Общественный смотр знаний по теме
реклама

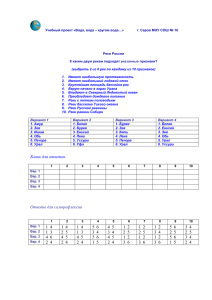
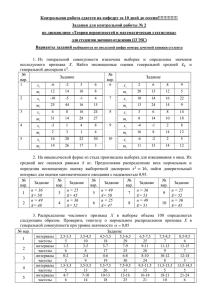
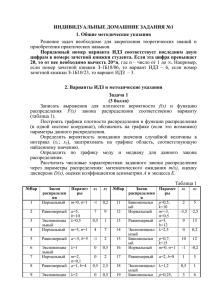
Урок по химии в 8 классе. «Общественный смотр знаний по теме «Первоначальные химические понятия». Цели урока: Обобщить первоначальные химические понятия: закрепить умение составлять химические формулы, уравнения реакций, умение решать задачи с использованием понятий «моль» и «молярная масса»; обобщить знания о веществе и химической реакции на основе атомномолекулярного учения. 2. Создать условия для развития: умения выделять главное, работы в парах и коллективно, отстаивать свою точку зрения, делать выводы. 3. Воспитывать самостоятельность, индивидуальность стиля познания и поведения. 1. На доске девиз урока: «Дорога к знанию? Ну что же, её легко понять. Ответить можно сразу: вы ошибаетесь и ошибаетесь, и ошибаетесь опять, но меньше, меньше, меньше с каждым разом». Химия - наука. И как всякая наука требует к себе самого серьезного, самого ответственного отношения. Сегодня проверка ваших знаний. I. Разминка (За правильный ответ-жетон, (красный- ответ полный, жёлтый - не совсем), жетоны подписать карандашом и сдать в конце урока.) 1. 2. 3. 4. 5. 6. 7. 8. 9. Что изучает химия? Дайте определение физических явлений (примеры ). Дайте определение химических явлений (примеры). Назовите признаки химических реакций. Какие вещества называют простыми? (примеры). Какие вещества называют сложными? (примеры). Что называют химическим элементом? Сформулируйте закон сохранения массы веществ. Кто открыл этот закон? Это был замечательный русский ученый М. В. Ломоносов, человек поистине энциклопедических знаний. Он сделал немало открытий не только в таких науках, как физика, химия, астрономия, но и с большим успехом работал в области литературы, риторики и др. Ломоносов писал о химии: В земное недро ты, Химия, Проникни взора остротой, И что содержит в нем Россия, Драги сокровища открой. Поистине сокровищами являются те знания, которые получает (накапливает) человек в течение всей своей жизни. II. Химический диктант. На каждом столе – маленькие листочки, на них пишем: калий, магний, алюминий, азот, цинк, медь, кислород, фосфор, сера, железо, углерод, водород, молекула кислорода, 3 молекулы воды, 5 молекул водорода. Обменялись листочками с соседом по парте и, глядя на доску, проверили написанные знаки. Поставили оценки друг другу. 2 ошибки- «4», от 2 до 6 ошибок-«3», более 6- «2». III. Знаешь ли ты валентность? Вопрос классу: Что такое валентность? 1. На доске AlS, CCl - составить формулы, к доске 1 человек по желанию. 2. На доске N2 O3 , P2 O5 - определить валентности элементов, к доске 1 человек по желанию. Письменная работа. На больших листочках, лежащих на столах пишут работу. 1 Задание: Составьте формулы по валентности: I вар. СаСl, РО, МgN II вар. SO, СаР, ВаСl III вар. СН, NO, КS 2 Задание: Найдите валентность элементов в соединениях: I вар. Fe2 O3 , СО, РH3 II вар. Сu2 O, СО2 , Al2 O3 III вар. Н2 S, СuO, Мn2 O7 IV. Исчезнувшие слова. На карточках предложения. Эти предложения написаны таинственными чернилами и лежали на солнце - некоторые слова выгорели, а теперь их надо восстановить. Вместо пропусков написать слова: «атом» или «молекула». 1. Молекула воды состоят из атомов кислорода и водорода. 2. Для дыхания животных необходимы молекулы кислорода. 3. В состав молекулы сахара кроме атомов кислорода и водорода входят атомы углерода. 4. При растворении сахара в воде молекулы сахара равномерно распределяются между молекулами воды. (Учащиеся обсуждают в парах исчезнувшие слова и вслух зачитывают.) V. Учись уравнивать. На доске в уравнениях расставить коэффициенты, по желанию ученик к доске: 2Аg2 O → 4Аg + О2 МnO2 + Н2 → Мn + Н2 О Письменная работа на листках. Задание - расставить коэффициенты: I вар. Р + О2 → Р2 О5 , Fe + НСl →FeCl2 + Н2 II вар. Fe + Сl2 → FeCl3 , Zn + НСl → ZnCl2 + Н2 III вар. N2 + H2 → NH3 , Mg + HCl → MgCl2 + H2 VI. К сияющим вершинам. Это задание по решению задач. Лишь только тот доберется до «вершины горы», кто сумеет быстро и правильно решит задачу. На парте у каждого – задачи. Решить задачи и сдать все листочки, жетоны. I вар. Определите количество вещества в 54 г воды. II вар. Вычислите массу, которую составляет 0,5 моль углекислого газа. III вар. Какова масса 3 моль сероводорода (Н2 S)? Этап рефлексии: Каждый для себя в тетради строит «график» по таким понятиям, как валентность, уравнения реакций, задачи. Ставим крестик, чем выше, тем ученик считает, что лучше разобрался в этом вопросе; если есть проблемы, крестик ставим ниже. В. Подводим итоги урока, выставляем оценки. Дома: готовиться к контрольной работе. Ур. З.