Лабораторная работа №2. 26 Определение отношения
реклама

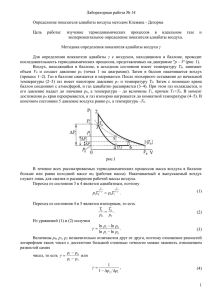
Лабораторная работа № 2. 26 Определение отношения удельных теплоемкостей газов методом адиабатного расширения Приборы и материалы:1) закрытый стеклянный баллон с краном; 3) манометр;4) поршневой насос. Цель работы: 1) ознакомление с газовыми процессами, 2) измерение отношения удельных теплоемкостей воздуха методом адиабатного расширения. Теоретическое введение Теплоемкость тела - это физическая величина, равная количеству теплоты, которое необходимо передать телу, чтобы изменить его температуру на один кельвин (градус): Q . CТ dT Теплоемкость зависит от количества вещества в теле. Удельной теплоемкостью с является теплоемкость в расчете на 1 кг вещества: с = СТ/m, а молярной теплоемкостью С – соответственно, на 1 моль вещества: С = СТ /ν = сМ , где ν = m/M – количество молей вещества в теле, М - масса моля. Теплоемкость зависит от условий, при которых происходит нагревание. Можно производить нагревание при постоянном объеме или при постоянном давлении. Обозначение теплоемкости при этом снабжается соответствующими индексами: СV, Cp. При этом Ср всегда больше СV. Это объясняется тем, что для нагревания газа с постоянным объемом все количество теплоты идет только на увеличение внутренней энергии газа; при нагревании же газа при постоянном давлении, кроме теплоты, идущей на повышение внутренней энергии газа, необходима еще теплота для работы на расширение газа. Отношение молярных зов сp cV Cp CV или, что то же, удельных теплоемкостей га- называется показателем адиабаты (или коэффициентом Пуассона) и входит в уравнения, связывающие параметры газа в адиабатном процессе: pV const , pT const . TV const , Адиабатным процессом называется такое изменение состояния газа, которое происходит без теплообмена с окружающей средой. Тогда первое начало термодинамики dQ = dU + dA для адиабатного процесса примет вид dU + dA = 0 или dA = – dU. 1 1 1 Следовательно, работа расширения будет совершаться за счет убыли внутренней энергии газа, и температура понизится. В случае адиабатного сжатия, когда работу совершают внешние силы, а работа газа отрицательна, температура газа будет повышаться. Если процесс изменения объема газа проводить достаточно быстро, то ввиду того, что теплопроводность газа невелика, его можно рассматривать, как близкий к адиабатному. Теория метода и описание установки. Главной частью установки (рис. 1) является большой стеклянный баллон Б, наполненный воздухом и соединенный резиновыми трубками с манометром М , а через кран К2 - с насосом Н. Кран К1 соединяет баллон с окружающим воздухом. Пусть первоначально в баллоне было атмосферное давление р0. С помощью насоса накачаем в баллон небольшое количество возРис. 1. духа и закроем кран К2. Давление в баллоне повысится. Избыток давления над атмосферным давлением можно определить по манометру. Обозначим через р1 давление сжатого воздуха внутри баллона, соответствующее показанию манометра h1. Ясно, что p1 = p0 + gh1. Здесь gh1 – давление столбика h1 манометрической жидкости, – плотность этой жидкости, g – ускорение свободного падения. Когда газ в баллоне, нагревшийся при сжатии, охладится и примет комнатную температуру, можно начинать опыт. За характером процессов в опыте удобно проследить с помощью pV – диаграммы (рис.2). Рис.2 2 Выделим в баллоне некоторый объем газа V0, доходящий, например, до уровня пунктирной прямой ab (рис. 3). Этот объем газа мы и будем рассматривать в дальнейшем. Пусть масса воздуха в объеме V0 равна m. Состояние этой массы газа m, соответствующее началу опыта, на диаграмме pV изображается точкой 1 с параметрами p1, V0, T0 (рис. 2). Рис. 3 T0 – температура окружающего воздуха, давление сжатого воздуха больше атмосферного, р1 > р0 . Если теперь быстро на короткое время (0,3 – 0,5 с) открыть кран К1, то воздух в объеме V0 , расширяясь при открытии крана, займет теперь весь объем баллона V. Масса Δm воздуха выходит из баллона. Воздух в сосуде будет расширяться, пока давление его не сделается равным атмосферному р0 Расширение воздуха происходит очень быстро, и за этот короткий промежуток времени теплообмена между газом и стенками баллона не происходит. По этой причине процесс расширения воздуха можно считать адиабатным. При этом воздух охладится до температуры Т1 и перейдет в новое состояние. Это будет второе состояние газа (на графике точка 2 с параметрами p0, V, T1). Затем охладившийся при расширении воздух в сосуде в результате теплообмена станет нагреваться, а давление внутри сосуда начнет медленно возрастать. Возрастание давления прекратится, когда температура воздуха в сосуде сравняется с комнатной температурой Т0. Это будет третье состояние газа (на графике точка 3 с параметрами p2, V, T0). Обозначим давление воздуха в сосуде в этот момент через р2 и соответствующее показание манометра – через h2. Ясно, что p2 = p0 + gh2 Так как переход из состояния 1 в состояние 2 произошел адиабатно, применим уравнение адиабаты, связывающее давление и температуру: pT 1 const . 3 Подставим значения параметров, соответствующих началу и концу расширения p1 T1 1 1 1 (1) p1T0 p0T1 или p0 T0 Переход из состояния 2 в состояние 3 является изохорным процессом. Для него справедливо уравнение p0 p2 T1 T0 p const . В наших обозначениях T T1 p0 или . T0 p2 (2) Подставим (2) в (1): p1 p0 1 . p0 p 2 (3) Логарифмируя, получим p p1 (4) ln 0 . p0 1 p2 Рассмотрим отдельно выражения p1 p0 gh1 gh1 . 1 p0 p0 p0 p0 p0 gh2 1 . 1 gh2 p 2 p0 gh2 p0 1 p0 Во второй дроби мы воспользовались формулой приближенных вычислений, а именно при малых х (х << 1) имеет место приближенное равенство 1 1 x . 1 x Действительно, в нашем случае величина х является малой по сравнению с единицей: ln x gh2 103 10 101 102 . p0 105 Перепишем уравнение (4): gh1 gh2 . ln 1 ln 1 p 1 p 0 0 Снова применим формулу приближенных вычислений. При малых х (х << 1) имеет место приближенное равенство ln 1 x x . Тогда gh1 gh2 , p0 1 p 0 откуда нетрудно получить 4 h1 h1 h2 Формула (5) и является расчетной для определения . (5) Порядок выполнения работы. 1. Открыв кран К2 (кран К1 закрыт), накачать в баллон воздух так, чтобы на манометре была значительная разность уровней жидкости (10 – 15 см). Закрыв кран К2 и выждав 2-3 минуты (до тех пор, пока нагретый от сжатия воздух не охладится и уровни в коленах манометра перестанут изменяться), отсчитать по шкале уровни левой и правой трубок манометра (отсчет ведут по нижнему краю мениска). Зафиксировать разность уровней h1. 2. Открыть и быстро закрыть кран (клапан) К1. Через 2-3 минуты зафиксировать разницу уровней h2. 3. По формуле (5) вычислить = Ср/СV для воздуха и сравнить с теоретическим значением, считая воздух двухатомным газом. 4. Опыт повторить не менее 10 раз при разных показаниях манометра. Полученные результаты занести в таблицу. Вычислить среднее значение и ошибки измерения по теории Стьюдента. № п/п 1. h1, мм h2, мм h1 – h2, мм i <> i i2 S<> tn E% 10. Контрольные вопросы. 1. Какой процесс называется изохорным? Адиабатным? 2. Почему ср всегда больше сV? 3. Почему манометр заполняют подкрашенной водой, а не ртутью? 4. Как влияет на результат опыта длительное открывание крана К1? 5. Почему в данном опыте удобно пользоваться уравнением адиабаты, 1 связывающим давление и температуру pT const , а не уравнением, связывающим давление и объем pV const , ? 6. Дайте объяснение значениям параметров воздуха в баллоне, приведенным на рис.3. 7. Как повлияет на результат опыта большая влажность воздуха в аудитории? 5