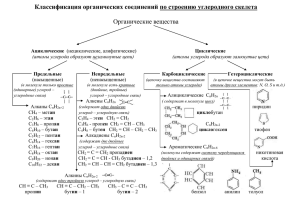
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
реклама
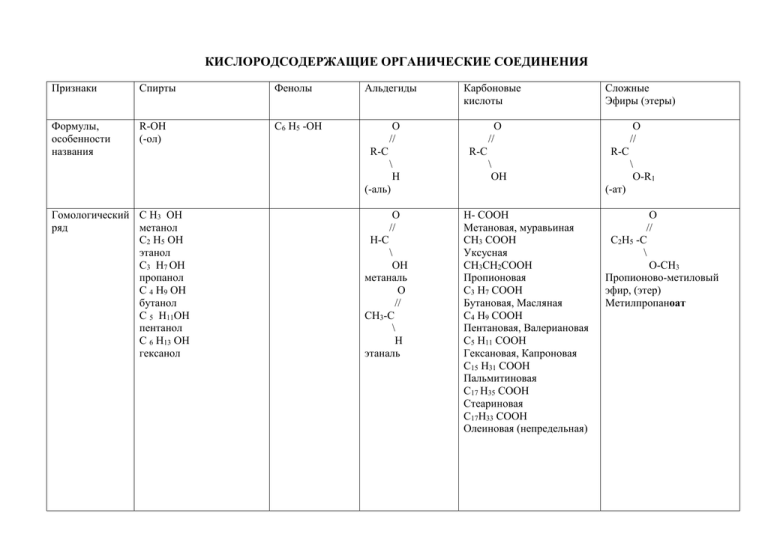
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Признаки Спирты Фенолы Формулы, особенности названия R-OH (-ол) С6 Н5 -ОН Альдегиды О // R-C О // Н-C \ ОН метаналь О // СН3-C \ Н этаналь Сложные Эфиры (этеры) О // R-C \ Н (-аль) Гомологический С Н3 ОН ряд метанол С2 Н5 ОН этанол С3 Н7 ОН пропанол С 4 Н9 ОН бутанол С 5 Н11ОН пентанол С 6 Н13 ОН гексанол Карбоновые кислоты О // R-C \ ОН \ О-R1 (-ат) Н- СООН Метановая, муравьиная СН3 СООН Уксусная СН3СН2СООН Пропионовая С3 Н7 СООН Бутановая, Масляная С4 Н9 СООН Пентановая, Валериановая С5 Н11 СООН Гексановая, Капроновая С15 Н31 СООН Пальмитиновая С17 Н35 СООН Стеариновая С17Н33 СООН Олеиновая (непредельная) О // С2Н5 -C \ О-СН3 Пропионово-метиловый эфир, (этер) Метилпропаноат Изомерия Физические свойства Химические свойства 1. Углеродного скелета (углеводородного радикала) Положения -ОН Спирты: Первичные Вторичные Третичные Межклассовая: Спирт-простой эфир (эстер) Жидкости по причине Твердое С1 газ наличия водородной вещество, С2- С11 жидкости связи растворимое С12 и больше …ОН…ОН…ОН в воде, на твердые вещества I I I воздухе R R R приобретает Cвыше 12 атомов розовый цветН-твердые в-ва окисляется ЯДЫ! Многоатомные спирты: СН2 –СН- СН2 | | | ОН ОН ОН Пропантриол, глицерин 1. Диссоциация 2. С металлами образуются алкоголяты 3. С НС1 4. Дегидратация ( - вода, обр. алкены) 5. Со спиртами обр. простые эфиры 6. Окисление оксидом меди с образованием альдегидов. 1.С металлами 2. Со щелочами. 3. С бромом. 4. С азотной кислотой. ( взаимное влияние атомов в молекуле) 5. С хлоридом трехвалентного железа образует фиолетовую 1.Окисление оксидом серебра, гидроксидом медикачественная реакция на альдегиды при нагревании. 2 .Восстановление водородом с образованием спиртов. Межклассовая со сложными эфирами Межклассовая с карбоновыми кислотами Жидкости, растворяются в воде. Свыше С9 - твердые вещества, не растворимые в воде. Летучие вещества, жидкости, имеют Запахи. Жиры С Н2 –О-СО-С15 Н31 | С Н –О-СО- С15 Н31 | 1.Диссоциация. 2. С металлами, оксидами, солями, щелочами. 3. Разложение, образование ангидридов. 4. Со спиртами образуют сложные эфиры. СН3- СООН + НО-СН3 → СН3 –СОО-СН3 + НОН Уксусно-метиловый эфир, метиловый эфир уксусной кислоты, метилэтаноат. С Н2- О- СО-С15 Н31 трипальмиат 1.Гидролиз (с водой) с образованием кислоты и спирта. Получение 7. Горение. 8. С карбоновыми кислотами обр. сл. эфиры. 9. Получение диеновых углеводородов. 10. Многоатомные спирты с гидроксидом меди образуют яркосиний раствор – качественная реакция . 1. СО + 2Н2 →СН3 ОН 2. СН2=СН2 + НОН→ СН3 СН2 ОН 3.Гидролиз крахмала 4. С 6Н12 О6→ 2 С2 Н5 ОН + СО2 5.С5 Н11 С1 + КОН С5 Н11 ОН + КС1 6.СН2 –С1+ НОН СН2- С1 + НОН СН2 –ОН СН2 –ОН Применение: 5. С галогенами по радикалу. окраскукачественная реакция. СН3-СООН +С12→ СН2–СООН + НС1 | С1 хлоруксусная кислота 1.бензол хлорбензол фенол 2. изопропилбензол+О2 фенол и ацетон 1.Из спиртов окислением оксидом меди. 2.Метан + О2 метаналь и вода 3. СН=СН +НОН уксусный альдегид 4.СН2 =СН2 + О этаналь 1. Из солей карбоновых 1.Реакция этерификации: кислот и неорганических Карбоновая кислота и кислот. спирт 2 .Окисление метана молекулярным кислородом. 3. Окислением спиртов молекулярным кислородом. 4. Окислением альдегидов атомарным кислородом.