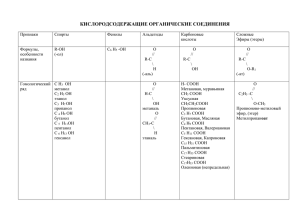
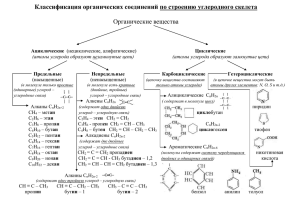
Биополимеры и их структурные компоненты
реклама

Самарский медицинский институт «Реавиз» Кафедра фармации Учебно-методическое пособие Биополимеры и их структурные компоненты Составитель: старший преподаватель кафедры фармации Журавская О.А. Самара 2007 УДК Составители О.А. Журавская . Биополимеры и их структурные компоненты. Учебное пособие для студентов, обучающихся по специальностям «Лечебное дело», «Стоматология» очной и очно-заочной форм обучения.- Самара :СМИ «Реавиз»,2007,59 страниц. Изучение биоорганической химии и смежных с ней специальных дисциплин в медицинских учебных заведениях связано с усвоением значительного объема материала, что не всегда позволяет студентам акцентировать внимание на ключевых моментах. Данное пособие поможет в изучении биополимеров и их структурных компонентов с учетом трудностей самостоятельного изучения предмета в заочной системе. Рекомендовано студентам, обучающимся по специальностям «Лечебное дело», «Стоматология» очной и очно-заочной форм обучения. Рецензенты: зав. кафедрой гуманитарных дисциплин, к.б.н.,доцент, Т.В. Шубина к.х.н.,доцент кафедры органической химии ГОУ ВПО Самарский государственный университет А.А. Данилин Утверждено учебно-методическим советом СМИ «Реавиз» СМИ «Реавиз»,2007 г. 2 Содержание Раздел 1. Аминокислоты и белки…………………………………………………….4 Раздел 2. Углеводы …………………………………………………………………..27 Раздел 3. Липиды……………………………………………………………………..45 Список литературы …………………………………………………………………..58 3 Раздел 1. Аминокислоты и белки Аминокислоты – гетерофункциональные соединения, в молекулах которых содержатся одновременно амино- и карбоксильные группы. В общем виде их строение выражается формулой: (Н2N)n- R – (СООН)m Число карбоксильных групп в молекулах аминокислот определяет их основность, наиболее важны одноосновные и двухосновные аминокислоты. В зависимости от числа аминогрупп различают моноаминокислоты и диаминокислоты. Существуют также α-, β-, γ и т.д. аминокислоты в зависимости от положения аминогруппы по отношению к карбоксилу. α-аминокислоты (протеиногенные аминокислоты) играют важную роль в процессах жизнедеятельности живых организмов, так как являются основой молекулы любого белка. В таблице 1 представлены аминокислоты, постоянно встречающиеся в белках. В некоторых белках встречаются редкие аминокислоты (оксопролин, γ-карбоксиглутаминовая кислота, гидроксилизин, 3,5-дийодтирозин и др.), которые являются производными тех же α-аминокислот. Во всех (кроме глицина) природных α-аминокислотах имеются асимметрические α-углеродные атомы: СООН Н2N Н СООН Н NН2 СН3 СН3 L (+)-аланин D (-)-аланин Таблица 1 Протеиногенные аминокислоты Формула Название Сокращенное обозначение Н2N – СН2 – СООН глицин гли Н3С – СН – СООН | NН2 аланин ала 4 Н3С \ СН – СН – СООН / | Н3С NН2 валин вал Н3С \ СН – СН2 – СН – СООН / | Н3С NН2 лейцин лей изолейцин иле аспарагиновая кислота асп аспарагин асн глутаминовая кислота глу глутамин глн НО – СН2 – СН – СООН | NН2 серин сер Н3С – СН – СН – СООН | | ОН NН2 треонин тре НS – СН2 – СН – СООН | NН2 цистеин цис метионин мет Н3С – СН2 – СН – СН – СООН | | CН3 NН2 НООС – СН2 – СН – СООН | NН2 О \\ C – СН2 – СН – СООН / | Н2N NН2 НООС – СН2 – СН2 – СН – СООН | NН2 О \\ C – СН2 – СН2 – СН – СООН / | NН2 Н2N Н3С – S – СН2 – СН2 – СН – СООН 5 | NН2 Н2N – С – СН2 – СН2 – СН2 – СН – СООН || | NH NH2 Н2N – СН2 – СН2 – СН2 – СН2 – СН – СООН | NH2 N – С – СН2 – СН – СООН || || | Н С СН NН2 \ / N | Н НN – СН – СООН / \ H2C CH2 \ / CН2 _____ / \ _ СН2 – СН – СООН \_____/ | NН2 _____ НО_ / \ _ СН2 – СН – СООН \_____/ | NН2 СН // \ НС С - С - СН2 - СН - СООН | || || | НС С СН NН2 \\ / \ / СН N | Н аргинин арг лизин лиз гистидин гис пролин про фенилаланин фен тирозин тир триптофан три 6 Буквы L- и D- обозначают принадлежность данной аминокислоты к L- и Dстереохимическому ряду, а знаки «+» и «-» указывают направление вращения. За исходное соединение, со строением которого принято сравнивать строение аминокислоты, условно принимают L- и D- молочные кислоты; конфигурации этих кислот в свою очередь установлены по L- и D- глицериновым альдегидам. Аминокислоты, входящие в состав белков и большинства природных соединений, относятся к L-ряду. D-формы аминокислот встречаются очень редко и входят в состав лишь некоторых антибиотиков (например, грамицидина - С). Интересно отметить различие в физиологическом действии аминокислот Lи D-рядов. Большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда - горькие или безвкусные. Как правило, D-аминокислоты не усваиваются животными организмами. Аминокислоты относятся к амфотерным соединениям и благодаря наличию карбоксильной группы они способны проявлять кислотные свойства, а благодаря наличию аминогруппы – присоединять протоны водорода и проявлять основные свойства. Кислотная и основная группы внутри молекулы аминокислоты взаимодействуют друг с другом и ион водорода карбоксильной группы присоединяется к атому азота аминогруппы: СН2 – СОО | + NН3 внутренняя соль глицина СН2 – СООН | | | NН2 ______| глицин Благодаря этому молекулы аминокислот представляют собой биполярные ионы, а так как противоположные и равные по величине заряды таких ионов нейтрализуют друг друга, аминокислоты являются внутренними солями. Поэтому водные растворы моноаминомонокарбоновых кислот нейтральны. Характер диссоциации аминокислот зависит от условий среды. В кислой среде при избытке ионов водорода (рН < 7) биполярные ионы аминокислот превращаются в их аммониевые катионы; в щелочной среде при избытке гидроксильных ионов (рН > 7) биполярные ионы приходят в анионы: Н+ СН2 – СООН | + NН3 катион глицина ОН- ОНСН2 - СОО | + NН3 биполярный ион глицина Н+ СН2 - СОО | + Н2О NН2 анион глицина По кислотно – основным свойствам аминокислоты делят в зависимости от физико-химических свойств бокового радикала на три группы: кислые, основные и нейтральные. 7 К кислым относятся аминокислоты с карбоксильными группами в боковом радикале: аспарагиновая и глутаминовая кислоты. К основным – аминокислоты лизин, аргинин и гистидин, имеющие в боковом радикале группировку с основными свойствами (аминогруппа, гуанидиновая и имидазольная группы). Все остальные аминокислоты – нейтральные, так как их боковой радикал не проявляет ни кислых, ни основных свойств. Следовательно, аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд, зависящий от рН-среды. Значение рН-среды, при котором заряд аминокислоты равен нулю, называется изоэлектрической точкой. По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые. Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. Это глицин, аланин, серин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин. Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей. Для организма человека такими аминокислотами являются аргинин и гистидин. Незаменимые аминокислоты в организме человека не синтезируются, поэтому должны поступать с пищей. Их восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан. Реакции аминокислот в живых организмах Аминокислоты, которые поступают в организм в количествах, превышающих потребности биосинтеза клеточных белков, не могут запасаться и подвергаются метаболическим превращениям. Основные реакции аминокислот в клетке – дезаминирование, переаминирование и декарбоксилирование. Примером реакции дезаминирования (то есть реакции, сопровождающейся отщеплением аммиака) может служить превращение аспарагиновой кислоты в фумаровую: фермент НООС – СН2 – СН – СООН НООС Н -| NH3 \ / С = С NН2 / \ Н СООН аспарагиновая фумаровая кислота кислота Такие реакции происходят в клетках печени и почек, что обеспечивает удаление из организма избытка аминокислот. Аммиак токсичен для центральной нервной системы, поэтому в организме существуют процессы, в которых происходят связывание (дезактивация) аммиака. Основным путем связывания аммиака в мозге является образование глутамина: фермент 8 НООС – СН2 – СН2 – СН – СООН + NН3 + АТФ | NH2 (глутаминовая кислота) Н2N – С – СН2 – СН2 – СН – СООН + АДФ + Н3РО4 || | О NН2 (глутамин) Глутамин может использоваться не только для синтеза белка, но и для других метаболических процессов, значит его можно рассматривать как хранилище аммиака. Так же происходят образование аспарагина. Реакция переаминирования представляет собой как бы перенос аминогруппы аминокислоты на молекулу другой кислоты, то есть фактически является примером биосинтеза аминокислоты в организме: СООН | СН2 | + СН – NН2 | СООН аспарагиновая кислота СООН СООН | | (СН2)2 СН2 | фермент | С =О С=О | | СООН СООН α-кетоглутаровая кислота кетоянтарная кислота СООН | (СН2)2 | СН – NН2 | СООН глутаминовая кислота Декарбоксилирование аминокислот (удаление карбоксильной группы) – важный метаболический процесс, в результате которого из аминокислот образуются биологически активные амины. Так, из 3,4–диоксифенилаланина при декарбоксилировании образуются дофамин – предшественник адреналина: фермент НО – - СН2 – СН – СООН НО - СН2 – СН2 + СО2 | | НО NH2 НО NH2 3,4 – диоксифенилаланин дофамин ГАМК (или γ-аминомасляная кислота) относится к нейромедиаторам – химическим соединениям, влияющим на передачу нервных импульсов, и образуется при декарбоксилировании глутаминовой кислоты. Декарбоксилирование гистидина приводит к образованию гистамина, который вызывает усиление деятельности желез внутренней секреции. Подводя итог, можно сказать, что конечными продуктами катаболизма аминокислот являются α-кетокислоты, амины, оксид углерода (IV), аммиак. При этом органические соединения вовлекаются в определенные метаболические процессы, оксид углерода (IV) беспрепятственно выводится из организма, а 9 аммиак связывается с образованием глутамина, аспарагина, аспартата и мочевины (орнитиновый цикл). Белки – это высокомолекулярные азотсодержащие вещества, состоящие из α-аминокислот, связанных между собой пептидными связями. Иначе белки называют протеинами – этот термин введен в 1838 году и образован от греческого слова proteos – первостепенный. Белки составляют значительную часть тканей живого организма: до 25% сырой и до 40-45% сухой массы. Они содержат 50-59% углерода, 6,5-7,3% водорода, 15-18% азота, 21-24% кислорода, до 2,5% серы. Для большинства белков характерна довольно постоянная доля азота (в среднем 16% от сухой массы) по сравнению с другими элементами. Этот показатель используют для расчета количественного содержания белка. В составе некоторых белков обнаруживают фосфор, цинк, медь и другие элементы. При нагревании с кислотами или щелочами, а также при обычных температурах под действием специальных ферментов (протеолитических) белки расщепляются, подвергаясь гидролизу. Главными продуктами полного гидролиза белков являются смеси αаминокислот, но процесс идет ступенчато. Вначале образуются более простые, но близкие по свойствам к белкам – пептоны, при дальнейшем гидролизе которых образуются еще более простые полипептиды, затем дипептиды и, наконец, αаминокислоты: Белок пептоны смесь α-аминокислот смесь полипептидов дипептиды Для понимания природы белков и их роли в процессе жизнедеятельности необходимо знание строения и уровней организации белковых молекул. Образование молекулы белка происходит за счет взаимодействия карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты, что можно выразить схемой: О // Н2N – СН – С | \ R ОН + О // Н2N – CН – С -Н2О | \ R ОН О О // // Н2N – СН – С – N – СН – С | | | \ R H R ОН пептидная связь Каждую аминокислоту, входящую в состав белка, называют аминокислотным остатком. Аминокислотные остатки в молекуле белка соединены пептидными связями. 10 Длина пептидной связи составляет 0,1325нм, представляя собой среднюю величину между длинами одинарной С-N связи (0,146 нм) и двойной С = N связи (0,127нм), то есть пептидная связь частично имеет характер двойной связи, что сказывается на свойствах пептидной группировки. Свойства пептидной группировки пептидная группировка имеет жесткую планарную структуру, то есть все атомы, входящие в нее, расположены в одной плоскости. атомы кислорода и водорода в пептидной группировке находятся в трансположении по отношению к пептидной С-N связи. пептидная группировка может существовать в двух резонансных формах (кето- и енольной): О || С / \ / N | Н (кето-форма) ОН | С / \\ / N (енольная форма) Эти свойства пептидной группировки определяют структуру полипептидной цепи. Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – боковых радикалов аминокислотных остатков. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец). Принят следующий способ наименования пептидов – их рассматривают как продукты замещения водорода в аминогруппе одной аминокислоты остатком другой. Остатки аминокислот без гидроксильной группы в карбоксиле (аминоацилы) называют, заменяя окончание –ин в тривиальном названии аминокислоты окончанием –ил. Так, пептид, формула которого О О || || Н2N – СН – С – N – СН – С – N – СН – СООН | | | | | СН3 Н СН2 Н СН2 | | SН N-концевая аминокислота С-концевая аминокислота | 11 ОН называется аланил – тирозил – цистеин. Подсчитано, что с цепью из 20 различных α-аминокислот (при условии, что каждая войдет в цепь только один раз) возможно гигантское число 2,3 * 1018 полипептидов. Если же учесть, что полипептидные цепи иногда содержат сотни аминокислотных остатков, причем одна и та же аминокислота может входить в цепь не один, а несколько раз, то можно получить безграничное количество полипептидных цепей белковых молекул. Из этого следует, что природа белка определяется не только тем, какие аминокислоты входят в его состав, но особенно и тем, в какой последовательности они соединяются друг с другом. Под первичной структурой белка понимают последовательность аминокислотных остатков в полипептидной цепи. Она строго специфична для белков каждого индивидуального организма. Не только замена одного или нескольких аминокислотных остатков другими, но даже их незначительный обмен местами в полипептидной цепи существенно изменяет биологические свойства белков, складывается на специфике их физиологических функций. Пептиды содержатся во всех видах организмов. Представителями самых маленьких пептидов являются содержащиеся в мышцах животных и человека карнозин и ансерин, в состав которых входит остаток β-аланина: Н2N – СН2 – СН2 – СО – NН – СН – СООН | СН2 | HN карнозин N (β-аланин- L - гистидин) Из наиболее распространенных представителей трипептидов – глутатион – содержится во всех растениях, животных и бактериях; участвует в ряде окислительно-восстановительных процессов: О О || || Н2N – СН – СН2 – СН2 – С – N – СН – С – N – СН2 – СООН | | | | СООН Н СН2SН Н γ-глутамил-цистеинил-глицин Глутатион выполняет функцию протектора белков, то есть предохраняет белки со свободными тиольными группами -SН от окисления с образованием дисульфидных связей -S – S-. Глутатион принимает на себя действие окислителя и «защищает» белок. 12 Большое значение имеет группа пептидов, проявляющих гормональное действие, то есть регулирующих химические реакции в организме. Так гормоны окситоцин и вазопрессин, выделяемые задней долей гипофиза, содержат по 9 аминокислотных остатка и являются нонапептидами. Оба гормона имеют сходные первичные структуры: вместо изолейцина (3) и лейцина (8) в окситоцине вазопрессин содержит остатки фенилаланина (3) и аргинина (8). Оба пептида содержат одну дисульфидную связь и на конце вместо свободной СООН- группы амидную СОNН2. Наибольшее различие в аминокислотной последовательности достаточно для разного биологического действия этих гормонов. Так окситоцин встречается только у женских особей и вызывает сокращение гладкой мускулатуры (особенно мускулатуры матки и применяется в гинекологии). Вазопрессин содержится и в женском, и в мужском организме, регулирует минеральный обмен и баланс жидкости. Установлено, что вазопрессин относится к числу мощных стимуляторов запоминания. Ответственный за контроль метаболизма углеводов, жиров и белков гормон инсулин вырабатывается поджелудочной железой. С недостатком инсулина в организме связаны серьезные нарушения углеводного обмена – сахарный диабет. Инсулин состоит из двух полипептидных цепей А и Б, причем цепь А содержит 21, а цепь Б – 30 аминокислотных остатков. Эти цепи соединены двумя дисульфидными мостиками: 1 7 19 30 фен----------------- цис ----------------- цис ---------------- ала | | S S | | S S 1 6 7| 11 | 20 21 гли ------ цис ----- цис ---- цис ------- цис --------------- асн | | S ------------------ S (Б) (А) Кроме того, в цепи А имеется дисульфидная связь, вызывающая образование петли. Пептидно-белковую природу имеют многие токсичные вещества, например токсины ядовитых грибов, пчел, змей, скорпионов. Так пептид апамин, состоящий из 18 аминокислотных остатков, является токсичным компонентом яда пчел и оказывает сильное действие на центральную нервную систему: арг ----- арг ----- цис ----- глн ----- глн ----- гис ----- NН2 | |______ ала S ----- S _____ | | | НООС – цис – асп – цис – лиз 13 цис _____ S ----- S _______| | | ала лей ----- ала ----- тре ----- глу ----- про ______| Изучение строения и физиологического действия токсинов представляет интерес не только с позиций поиска путей их обезвреживания, но и для выяснения принципов строения с целью моделирования аналоговых лекарственных средств. В настоящее время расшифрована структура около 1300 белков, отдельные содержат более 400 аминокислот. Первичная структура белка предопределяет следующие уровни организации белковой молекулы. Под вторичной структурой белка понимают способ укладки полипептидной цепи в упорядоченную структуру. По конфигурации выделяют следующие элементы вторичной структуры: αспираль и β-складчатый слой. Модель строения α-спирали была разработана О. Полингом и Р. Кори (19491951). Полипептидная цепь сворачивается в α-спираль таким образом, что витки спирали регулярны, поэтому спиральная конфигурация имеет винтовую симметрию (рисунок 1). На каждый виток α-спирали приходится 3,6 аминокислотных остатка. Расстояние между витками ил и шаг спирали составляет 0,54нм, угол подъема витка равен 260. Формирование и поддержание α-спирали происходит за счет водородных связей, образующихся между пептидными группами каждого n-го и (n+3)-го аминокислотных остатков. И хотя энергия водородных связей мала, большое количество их приводит к значительному энергетическому эффекту, в результате чего α-спираль довольна устойчива. В природных белках существуют только правозакрученные α-спирали. 14 β-складчатый слой – второй элемент вторичной структуры и имеет, в отличие от α-спирали, линейную форму. Такая линейная структура удерживается благодаря возникновению водородных связей между пептидными группировками, стоящими на разных участках полипептидной цепи. Эти участки оказываются сближенными на расстояние водородной связи между -С = О и НN- группами (0,272нм). Аминокислотные остатки в разной степени способны к образованию водородных связей, и это влияет на образование α-спирали и β-слоя. К спиралеобразующим аминокислотам относят аланин, глутаминовая кислота, глутамин, лейцин, лизин, метионин и гистидин. Если фрагмент белка состоит главным образом из перечисленных выше аминокислотных остатков, то на данном участке сформируется α-спираль. Валин, изолейцин, треонин, тирозин, фенилаланин – способствуют образованию β-слоев полипептидной цепи. Неупорядоченные структуры возникают на участках полипептидной цепи, где сконцентрированы такие аминокислотные остатки, как глицин, серин, аспарагиновая кислота, аспарагин, пролин. Во многих белках одновременно имеются и α-спирали, и β-слои. Доля спиральной конфигурации у разных белков различна. Так мышечный белок парамиозин практически на 100% спирализован, высока доля спиральной конфигурации у миоглобина и гемоглобина (75%). Напротив, у трипсина и рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей – кератин (белок волос), коллаген (белок кожи) – имеют β-конфигурацию. Коллаген – один из самых распространенных белков человеческого организма, на его долю приходится 30% от общего количества белка. Вместе с 15 другими компонентами он образует коллагеновые волокна, составляющие основную массу соединительной ткани организма. Полипептид, лежащий в основе коллагена, называется тропоколлагеном. Он на 1/3 состоит из глицина, 2022% из пролина, и небольшого количества лизина. Кроме того, в тропоколлагене присутствуют фрагменты глюкозы и галактозы, связанные α-1,2-гликозидной связью. Единичная полипептидная цепь включает примерно 1000 аминокислотных остатков и имеет форму сильно вытянутой спирали. Три параллельно вытянутые единичные спирали скручиваются в суперспираль, стабилизированную водородными связями. Боковые радикалы лизиновых остатков, находящихся на внешней стороне суперспирали, сначала окисляются в альдегиды, между которыми затем происходит альдольная конденсация, ведущая к «сшиванию» пептидных цепей. Нарушение в синтезе коллагена ведет к ослаблению костной и зубной тканей и соответственно вызывает некоторые заболевания (цинга), что связано с недостатком витамина С. Коллаген имеет большое значение в медицинской практике. На основе его разработаны новые пластические материалы – коллагеновые пленки, губки, предназначенные для закрытия кровоточащих поверхностей, донорских участков кожи, лечения трофических язв, ожогов, ран. Коллаген используется для получения биосовместимых материалов, которые выполнив функцию временного каркаса, замещаются затем собственными тканями организма. Третичная структура белка – это способ укладки полипептидной цепи в пространстве. Чтобы белок приобрел присущие ему функциональные свойства, полипептидная цепь должна определенным образом свернуться в пространстве, сформировав функционально активную структуру. Такая структура называется нативной. Стабилизируют третичную структуру белка взаимодействия, возникающие между боковыми радикалами аминокислотных остатков разных участков полипептидной цепи. Эти взаимодействия делят на сильные и слабые. К сильным взаимодействиям относят ковалентные связи между атомами серы остатков цистеина, стоящих в разных участках полипептидной цепи. Такие связи называют дисульфидными мостами, образование которых можно представить схемой: Н2N --------------- СООН | | SH SH Н2N -------------| S | S | НООС --------------- Кроме ковалентных связей третичная структура белковой молекулы поддерживается слабыми взаимодействиями – полярными и неполярными. 16 Полярные взаимодействия – это ионные и водородные связи. Ионные взаимодействия образуются при контакте положительно заряженных групп боковых радикалов лизина, аргинина, гистидина и отрицательно заряженной СООН-группы аспарагиновой и глутаминовой кислоты. Водородные связи возникают между функциональными группами боковых радикалов аминокислотных остатков. Неполярные или ван-дер-ваальсовы взаимодействия между углеводородными радикалами аминокислотных остатков способствуют формированию гидрофобного ядра («жирной капли») внутри белковой глобулы, так как углеводородные радикалы стремятся избежать соприкосновения с водой. Чем больше в составе белка неполярных аминокислот, тем большую роль в формировании его третичной структуры играют ван-дер-ваальсовы связи (рисунок 3). 1й фрагмент полипептидной цепи ---------------------------------------------------------------------------------------------------------| | | | | СН2 (СН2)4 СН2 СН2 СН | | | | / \ | ОН СН3 СН3 +NН3 S . | О О S | \ // | . | С ОН | | \ | | \ . | | О О ОН СН3 | | \\ / | | С СН2 Н2С СН3 | СН2 | | | | \ / СН2 | CH2 | СH | | | | | ---------------------------------------------------------------------------------------------------------А Б В Г Д 2й фрагмент полипептидной цепи Рисунок 3. Типы связей, поддерживающих третичную структуру белка: А – дисульфидный мостик; Б – ионная связь; В, Г – водородная связь; Д – ван-дер-ваальсовы связи. Третичная структура отдельно взятого белка уникальна, как уникальна и его первичная структура. Только правильная пространственная укладка белка делает его активным. Различные нарушения третичной структуры приводят к изменению свойств белка и потере биологической активности. 17 Структура, состоящая из определенного числа полипептидных цепей, занимающих строго фиксированное положение относительно друг друга, вследствие чего белок обладает той или иной активностью, называется четвертичной структурой белка. Белок, обладающий четвертичной структурой, называют эпимолекулой или мультимером, а составляющие его полипептидные цепи – субъединицами или протомерами. Характерным свойством белков с четвертичной структурой является то, что отдельная субъединица не обладает биологической активностью. Стабилизация четвертичной структуры белка происходит за счет полярных взаимодействий между боковыми радикалами аминокислотных остатков, локализованных на поверхности субъединиц. Такие взаимодействия прочно удерживают субъединицы в виде организованного комплекса. Участки субъединения, на которых происходят взаимодействия, называют контактными площадками. Классическим примером белка, имеющего четвертичную структуру, является гемоглобин. Молекула гемоглобина с молекулярной массой 68000Да состоит из четырех субъединиц двух разных типов – α и β. α – субъединица состоит из 141 аминокислотного остатка, а β – из 146. Третичная структура α- и β-субъединиц сходна, как и их молекулярная масса. Каждая субъединица содержит простетическую группу – гем, которая представляет собой сложную копланарную циклическую систему, состоящую из центрального атома железа (ст.ок.+2) и связанными с ним четырьмя остатками пиррола (рисунок 4). Рисунок 4. Структура гема гемоглобина Четыре субъединицы – две α и две β – соединяются в единую структуру таким образом, что α – субъединицы контактируют только с β – субъединицами и наоборот (рисунок 5). 18 Рисунок 5. Схематичное изображение четвертичной структуры гемоглобина Как видно из рисунка, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры α- и β-субъединиц гемоглобина и их взаимным расположением в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой. Так оксид углерода (II) – главное отравляющее вещество табачного дыма, легко связывается с гемоглобином, образуя карбоксигемоглобин. В результате этого гемоглобин теряет способность присоединять кислород и транспортировать его в органы и ткани, что приводит к кислородному голоданию – гипоксии. Поэтому у много и длительно курящих людей из-за постоянной нехватки кислорода в организме могут возникать тяжелые заболевания различных систем и органов, как например, облитерирующий эндартериит (сужение периферических кровеносных сосудов) нижних конечностей и другие заболевания. Кроме оксида углерода (II) в табачном дыме содержатся и другие действующие на гемоглобин вещества – метгемоглобинообразователи: нитраты, ароматические амины, толуидины и другие соединения. При соединении с этими веществами происходит окисление гемоглобина, при котором Fe2+ переходит в Fe3+. При образовании большого количества метгемоглобина (30-40%) возникает кислородное голодание тканей, что вызывает поражение центральной нервной системы. Расшифровка структуры гемоглобина позволило решить загадку с болезнью «серповидная анемия». Классификация белков Ввиду огромного количества белков, функционирующих в живых организмах, не существует единой их классификации. Поэтому на данный момент действует несколько классификаций, в основу каждой из них положен какой-либо признак, по которому белки объединяют в узкие или широкие группы. По степени сложности строения белки делят на простые и сложные. Простые или однокомпонентные белки состоят только из белковой части и при гидролизе дают аминокислоты. К сложным или двухкомпонентным относят белки, в состав которых входит протеин и добавочная группа небелковой природы – простетическая группа. В качестве такой группы могут выступать липиды, углеводы, нуклеиновые кислоты; соответственно сложные белки называют липопротеинами, гликопротеинами, нуклеопротеинами. По форме белковой молекулы белки разделяют на 2 группы: а) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму, к ним относят фиброин шелка, кератин шерсти; 19 б) глобулярные белки, молекулы которых имеют округлую форму, к ним относят альбумины, глобулины. Подавляющее большинство природных белков относятся к глобулярным и, имея более сложную конфигурацию, они выполняют более разнообразные, по сравнению с фибриллярными белками, функции. По отношению к условно выбранным растворителям выделяют альбумины и глобулины. альбумины хорошо растворяются в воде и концентрированных солевых растворах. Для них же характерна растворимость в водном растворе сульфата аммония (NН4)2 SО4 с концентрацией, превышающей 50% от насыщения белкового раствора. глобулины не растворяются в воде и растворах солей умеренной концентрации. При 50%-ной концентрации сульфата аммония в белковом растворе глобулины полностью выпадают в осадок. Функциональная классификация наиболее удовлетворительная, так как в основу ее положен не случайный признак, а выполняемая функция. • каталитически активные белки или ферменты – осуществляют катализ всех химических превращений в клетке • гормоны регулируют обмен веществ внутри клеток и интегрируют обмен в различных клетках организма в целом • белки-рецепторы избирательно связывают различные регуляторы на поверхности клеточных мембран • транспортные белки связывают и транспортируют вещества между тканями и через мембраны клеток • структурные белки участвуют в построении различных биологических мембран • белки-ингибиторы ферментов регулируют активность ферментов • сократительные белки обеспечивают механический процесс сокращения с использованием химической энергии • токсичные белки выделяются некоторыми организмами (змеями, пчелами, микроорганизмами) и являются ядовитыми для других живых организмов • защитные белки – антитела – белки, вырабатываемые животными в ответ на введение антигена. Антитела, взаимодействуя с антигенами, дезактивируют их и тем самым защищают организм от воздействия чужеродных соединений, вирусов, бактерий. Свойства белков Молекулярная масса белков колеблется в широких пределах – от десятков тысяч до миллионов единиц (104 - 107). Белки существуют в различных агрегатных состояниях: известны твердые аморфные или кристаллические, а также вазелино- или маслоподобного вида белки. 20 Все белки нерастворимы в безводном спирте и других органических растворителях. Многие белки растворяются в воде и разбавленных растворах солей, образуя при этом коллоидные растворы. Белковые растворы амфотерны. Различие в количестве кислотных и основных групп в молекуле белка и степени ионизации этих групп приводит к тому, что у белков преобладают кислотные или основные свойства. Белки, как и аминокислоты, имеют изоэлектрическую точку. Для белков характерно явление денатурации, то есть разрушение связей, обуславливающих вторичную, третичную и четвертичную структуры под влиянием различных воздействий. Незатронутой остается лишь первичная структура. Денатурация происходит при повышении температуры, изменении рН среды, облучении УФ-лучами, добавлении некоторых растворителей. В зависимости от степени разрушения структуры и от природы белка денатурация может быть обратимой (то есть после снятия воздействия структура восстанавливается) или необратимой. Наиболее характерными качественными реакциями на белки являются: 1) биуретовая реакция – появление фиолетового окрашивания при обработке солями меди в щелочной среде (ее дают все белки); 2) ксантопротеиновая реакция – появление при действии концентрированной азотной кислоты желтого окрашивания, переходящего при действии аммиака в оранжевое (ее дают белки, содержащие ароматические аминокислоты); 3) реакция Миллона – кипячение белка с раствором нитрата ртути в смеси азотной и азотистой кислот приводит к выпадению красно-коричневого осадка (реакция на тирозин); 4) нингидринная реакция – появление синего окрашивания при кипячении с водным раствором нингидрина (на все белки). Распад белков Белки – это основной строительный материал различных биологических структур клеток организма, поэтому обмен белков имеет первостепенную роль в их разрушении и новообразовании. У здорового человека за сутки обновляется 1-2% общего количества белков тела. Период полураспада белков в мышцах и коже – 80 дней, в мозгу – 180 дней, в сыворотке крови и печени – 10 дней, у некоторых белков – гормонов – часы и минуты. Главным путем распада белков в организме является ферментативный гидролиз – протеолиз. Протеолитические ферменты локализованы в лизосомах и в цитозоле клеток. Распад клеточных белков приводит к образованию аминокислот, которые используются в этой же клетке или выделяются из нее в кровь. В желудочно-кишечном тракте локализованы протеолитические ферменты различной специфичности. В желудочном соке находится пепсин, который быстро гидролизует в белках пептидные связи, образованные карбоксильными группами, прежде всего ароматических аминокислот (фенилаланина, тирозина, триптофана). 21 Протеолиз в кишечнике обеспечивают трипсин, химотрипсин, дипептидазы и другие, которые участвуют в более глубоком гидролизе белков по сравнению с гидролизом в желудке. Кроме того, слизистая кишечника содержит группу аминопептидаз, которые при действии на полипептидные цепи поочередно высвобождают N-концевые аминокислоты. На скорость гидролиза белков пищи указывает то, что через 15 минут после приема человеком белка, содержащего меченые по азоту (15N) аминокислоты, изотоп 15N обнаруживается в крови. Максимальная концентрация аминокислот достигается через 30-50 минут после приема белка с пищей. Всасывание аминокислот происходит в основном в тонком кишечнике, где функционируют специфические системы транспорта аминокислот. Кровотоком аминокислоты транспортируются во все ткани и органы. 22 Основные понятия и термины раздела Амфотерность – проявление двойственных свойств. Белки – высокомолекулярные азотсодержащие вещества, аминокислот, связанных между собой пептидными связями. состоящие из Вторичная структура белка – способ укладки полипептидной цепи в упорядоченную структуру. Дезаминирование – процесс отщепления аммиака. Декарбоксилирование – процесс отщепления оксида углерода (IV). Заменимые аминокислоты – аминокислоты, синтезируемые в организме в достаточном количестве. Изоэлектрическая точка аминокислоты (белка) – значение рН среды, при котором заряд аминокислоты (белка) равен нулю. Незаменимые аминокислоты – аминокислоты, не синтезируемые в ораганизме, а поступающие в него с пищей. Первичная структура белка – порядок чередования аминокислотных остатков в полипептидной цепи. Субъединица – единая полипептидная цепь в эпимолекуле. Третичная структура белка – способ укладки полипептидной цепи в пространстве. Четвертичная структура белка – структура, состоящая из определенного числа полипептидных цепей, занимающих строго фиксированное положение относительно друг друга, вследствие чего белок обладает определенной активностью. Эпимолекула (мультимер) – белок, обладающий четвертичной структурой. 23 Вопросы и задания 1. Какие органические вещества называются аминокислотами? химические свойства характерны для аминокислот? Какие 2. На примере аспарагиновой кислоты покажите амфотерность аминокислот. 3. Какие продукты образуются при дезаминировании аланина и аспарагиновой кислоты? 4. Какие диамины образуются в результате декарбоксилирования тирозина и гистидина? Напишите схемы реакций. 5. Пользуясь таблицей 1, выпишите формулы протеиногенных аминокислот: а) с углеводородными (гидрофобными) боковыми радикалами; б) с гидрофильными ионизирующимися боковыми радикалами. 6. В чем состоит отличие понятий «аминокислотный остаток» и «первчиная структура белка»? 7. Дипептид карнозин-β-аланилгистидин принимает участие в биохимических процессах, протекающих в мышечной ткани, а дипептид аспартам, обладающий в 200 раз более сладким вкусом, чем сахароза, состоит из остатков аспарагиновой кислоты и метилового эфира фенилаланина. Составьте структурные формулы этих дипептидов. 8. Напишите структурные формулы всех возможных трипептидов, в состав которых входят аланин, глутамин и тирозин. Назовите их. 9. Что понимают под вторичной структурой белка? 10.Что понимают под третичной структурой взаимодействий поддерживают эту структуру? белка? 11.Укажите тип взаимодействия между боковыми аминокислотных остатков: а) тир, глу; б) цис, цис; в) гис, асп. Какие типы радикалами 12.Укажите типы взаимодействий, возникающих между фрагментами полипептидной цепи при формировании третичной структуры: а) –цис-алатир-цис-иле-глн; б) –глу-асн-сер-лиз-тре-асп. 24 13.Какова специфичность действия протеоличитеских ферментов: химотрипсина, пепсина, трипсина? Как называются ферменты, ускоряющие гидролиз дипептидов? Проверьте себя (экспресс – тест) 1. Белки – биополимеры, мономерами которых являются: а) карбоновые кислоты б) амины в) β-аминокислоты г) α-аминокислоты д) амиды карбоновых кислот 2. В белках аминокислотные остатки связаны между собой: а) сложноэфирными связями б) водородными связями в) пептидными связями г) ангидридными связями д) гликозидными связями 3. К основным аминокислотам относят: а) аланин б) лизин г) глутамин д) триптофан в) тирозин 4. В изоэлектрической точке пептиды имеют: а) отрицательный заряд б) положительный заряд в) нулевой заряд 5. Заряд дипептида лизилпролина в кислой среде равен: а) 0 б) 2+ в) 1+ г) 2- д) 1- 6. Какое определение неправильно характеризует белки? а) это высокомолекулярные пептиды б) это бифункциональные полимеры в) это ферменты г) это полипептиды, образованные остатками α-аминокислот. 7. Первичная структура – это… а) последовательность аминокислот в белке б) аминокислотный состав белка в) молекулярная формула белка г) строение α-спирали белка 8. Какое взаимодействие не влияет на формирование третичной структуры? а) водородные связи между функциональными группами б) гидрофобное взаимодействие между углеводородными радикалами в) дисульфидная связь между цистеиновыми остатками г) пептидная связь 9. Денатурация белков приводит к разрушению ….. а) пептидных связей б) первичной структуры в) водородных связей г) вторичной и третичной структуры 25 10. Укажите общую качественную реакцию на белки и пептиды: а) ксантопротеиновая реакция б) биуретовая реакция в) реакция Льюиса г) реакция Милона 11. Какое из перечисленных веществ не относится к белкам? а) гемоглобин б) инсулин в) пенициллин г) рибонуклеаза 12. Укажите, важнейшую на ваш взгляд, биологическую функцию белков? а) катализ биохимических процессов б) транспорт белков в) регуляция иммунной системы живых организмов г) обеспечение строительного материала для тканей 26 Раздел 2. Углеводы Углеводы (сахара) наряду с белками являются одной из наиболее важных и распространенных групп природных органических соединений. Они составляют до 80% массы сухого вещества растений и около 2% сухого вещества животных организмов (в печени 5-10%; скелетные мышцы 1-3%; сердечная мышца – 0,5%; головной мозг – 0,2%). Важными природными источниками углеводов являются гликозиды – они широко распространены в природе и представляют собой соединения углеводов с другими классами соединений (фенолами, спиртами и др.) Животные организмы не способны синтезировать сахара и получают их с различными пищевыми продуктами растительного происхождения. В растениях углеводы образуются из оксида углерода (IV) и воды в процессе фотосинтеза, осуществляемого за счет солнечной энергии с участием зеленого пигмента растений – хлорофилла: hυ 6 СО2 + 6 Н2О С6Н12О6 + 6 О2 ↑ 2867 кДж/моль Классификация и строение Углеводы – полигидроксикарбонильные соединения и их производные. Свое название углеводы (гидраты углерода) получили потому, что соотношение водорода и кислорода в молекулах первых известных представителей было 2:1, вследствие чего их рассматривали как соединения углерода с водой: С6Н12О6 = 6 С * 6 Н2О С12Н22О11 = 12 С * 11 Н2О глюкоза сахароза По мере развития химии углеводов оказалось, что это представление ошибочно. Так, существуют углеводы (рамноза С6Н12О5, дезоксирибоза С5Н10О4 и др.), в которых соотношение водорода и кислорода иное. Но прежнее название сохранилось. Классификация углеводов основана на их способности к гидролизу и может быть представлена схемой (схема 1). 27 Сахара моносахариды монозы (простые сахара) альдозы полисахариды полиозы (сложные сахара) кетозы низкомолекулярные сахароподобные (олигосахариды) триозы тетрозы пентозы гексозы высокомолекулярные несахароподобные гомополисахариды восстанавливающие гетерополисахариды невосстанавливающие Простые углеводы или моносахариды – углеводы, не подвергающиеся гидролизу с образованием более простых соединений, являются основой олигосахаридов и полисахаридов. Олигосахариды – сложные углеводы, распадающиеся при гидролизе на несколько остатков моносахаридов (как правило, от двух до десяти остатков). Полисахариды – сложные углеводы, распадающиеся при гидролизе на множество остатков моносахаридов (от сотен до тысяч остатков) (схема 1) Моносахариды Моносахариды по химическому составу являются либо полигидроксиальдегидами, либо полигидроксикетонами. Моносахариды, в состав которых входит альдегидная группа (-СОН), называют альдозами, а кетонная ( >С = О) – кетозами. Для более быстрого и удобного написания конфигурации моноз Э. Фишер предложил изображать их проекционными формулами. Углеродная цепь изображается вертикальной линией, на концах которой пишут первую и последнюю функциональные группы (альдегидную группу всегда пишут вверху). Поэтому общие формулы альдоз и кетоз выглядят следующим образом: О // С 1 СН2ОН | 2 С=О 28 \ Н (СНОН)n | СН2ОН альдозы (n от 1 до 8) | (СНОН)n | СН2ОН кетозы (n от 1 до 7) В названии моноз учитывается не только наличие альдегидной или кетогруппы, но и число атомов углерода. Поэтому выделяют: О // С | Н * Н – С – ОН | СН2ОН альдотриоза СН2ОН | С=О | СН2ОН кетотриоза О // С | Н * Н – С – ОН | * Н – С – ОН | СН2ОН альдотетроза СН2ОН | С=О | * Н – С – ОН | СН2ОН кетотетроза О // С | Н * Н – С – ОН | * Н – С – ОН | * Н – С – ОН | СН2ОН альдопентоза СН2ОН | С=О | * Н – С – ОН | * Н – С – ОН | СН2ОН кетопентоза О // С | Н * Н – С – ОН | * Н – С – ОН | * Н – С – ОН | * Н – С – ОН | СН2ОН альдогексоза СН2ОН | С=О | * Н – С – ОН | * Н – С – ОН | * Н – С – ОН | СН2ОН кетогексоза Наиболее распространены в природе пентозы и гексозы. Выделенные звездочкой атомы углерода являются асимметрическими. Асимметрическим называется атом углерода, соединенный с четырьмя разными заместителями. Вещества, в составе которых есть асимметрические атомы углерода, обладают особым видом пространственной изомерии – стереоизомерией и оптической изомерией. Стереоизомеры отличаются пространственной конфигурацией атомов водорода и гидроксогруппы при 29 асимметрическом атоме углерода. Число стереоизомеров равно 2n, где n – число асимметрических атомов углерода. Например, альдогексоза общей формулой С6Н12О6 с четырьмя асимметрическими атомами углерода может быть представлена любым из 16 возможных стереоизомеров, восемь из которых относятся к D – ряду, а восемь – к L – ряду. Родоначальниками D- и L-рядов можно условно считать D- и Lглицериновые альдегиды. Принадлежность моносахарида к D- и L-ряду определяется положением водорода и гидроксила у наиболее удаленного от альдегидной или кетонной группы асимметрического углеродного атома: О // С | Н * Н – С – ОН | СН2ОН D – глицериновый альдегид О // С | Н * НО – С – Н | СН2ОН L – глицериновый альдегид Стереоизомеры отличаются физико-химическими свойствами биологической активностью. Наиболее важные моносахариды: Альдозы О О // // С С | Н | Н Н – С – ОН Н – С – ОН | | Н – С – ОН Н – С – ОН | | СН2ОН Н – С – ОН | D - эритроза СН2ОН D – рибоза О // С | Н Н – С – ОН | НО – С – Н | НО – С – Н | О // С | Н НО – С – Н | НО – С – Н | Н – С – ОН | и О // С | Н Н – С – ОН | НО – С – Н | Н – С – ОН | 30 СН2ОН D - галактоза СН2ОН | C=О | НО – С – Н | Н – С – ОН | СН2ОН D – ксилуоза Н – С – ОН | СН2ОН Н – С – ОН | СН2ОН D – манноза Кетозы D – глюкоза СН2ОН | С=О | Н – С – ОН | Н – С – ОН | СН2ОН D – рибулоза СН2ОН | С=О | НО – С – Н | Н – С – ОН | Н – С – ОН | СН2ОН D – фруктоза Альдозы, отличающиеся друг от друга конфигурацией лишь у асимметрического атома углерода, соседнего с карбонильной группой, называются эпимерами (например, D – глюкоза и D - манноза). Монозы с пятью и более атомами углерода могут осуществлять не только в линейной (цепной), но и в циклической (кольчатой) форме. Циклизация происходит за счет разрыва двойной связи в карбонильной группе, перемещения атома водорода к освободившейся валентности карбонильного кислорода и замыканию кольца углеродных атомов с образованием внутренних циклических α- или β-полуацеталей: СОН Н – С – ОН | НО – С – Н | Н – С – ОН | Н – С – ОН | Н – С – ОН НО – С – Н | | НО – С – Н О | НО – С – Н О | Н – С – ОН | Н – С – ОН | Н – С – ОН | Н – С – ОН | Н–С Н–С | | СН2ОН | СН2ОН СН2ОН α-D-глюкоза D-глюкоза β-D-глюкоза В циклических формах моноз на один асимметрический атом углерода больше, чем в открытых, поэтому у них в два раза большее число оптических изомеров (за счет α- или β-форм). Изомер, в изображении которого 31 полуацетальный гидроксил находится справа от С- цепи, называется α-формой, а слева – β-формой. Структурные формулы в проекции Фишера не способен дать всесторонний геометрический образ полуацетальной структуры, так как они не отражают реальных пространственных углов между химическими связями. В 1929 году Хеуорс предложил рассматривать полуацетальные формы моноз как производные гидрированных гетероциклов пирана и фурана: О фуран О тетрагидрофуран О пиран О тетрагидропиран Моносахариды, имеющие пятичленное кольцо, как у фурана, называют фуранозами, а имеющие шестичленное кольцо – относят к производным пирана и называют пиранозами. Пяти- и шестичленные циклические структуры изображаются при этом в виде плоских циклических систем, гидроксильные группы у каждого атома углерода ориентированы либо вверх, либо вниз. Для преобразовывания формул D–моноз в проекции Фишера в формулу Хеуорса надо придерживаться следующих правил: 1) Все группы, расположенные справа от углеродной цепи в формулах Фишера, в формулах Хеуорса занимают положение под плоскостью кольца (внизу). 2) Группы, расположенные в формулах Фишера слева от углеродной цепи, располагают над плоскостью кольца (вверху). 3) Атом кислорода всегда располагают в правом верхнем углу. 4) Концевую группу –СН2ОН в проекции Хеуорса направляют вверх. 32 В растворе линейные и циклические формы моносахаридов существуют одновременно и способны самопроизвольно превращаться друг в друга. Такие изомерные формы называют кольчато-цепными таутомерами. Преобладают, как правило, циклические изомеры моносахаридов; они используются организмами для построения олиго- и полисахаридов, мононуклеотидов и других молекул. Через линейную форму происходит переход α-формы в β-форму. Рентгеноструктурные исследования моносахаридов показали, что пиранозы существуют в виде кресловидной конформации (аналогично конформации «кресло» для циклогексана), причем такой, в которой максимально возможное число объемистых заместителей (четыре) расположено экваториально. Так, α-Dглюкопираноза имеет вид: НО--- НО--- СН2ОН | О | ОН --ОН где ----экваториальные заместители Свойства моносахаридов Моносахариды – полифункциональные соединения со смешанными функциями. Их химические свойства определяются наличием в молекуле карбонильной группы, спиртовых гидроксилов и полуацетального гидроксила. 33 1. Окисление а) при осторожном окислении альдоз бромной водой образуются одноосновные полиоксикислоты с тем же числом атомов углерода – альдоновые кислоты (глюкоза глюконовая кислота, манноза манноновая кислота и т.д.): О // Br2 СН2ОН - (СНОН)4 – С СН2ОН – (СНОН)4 - СООН \ Н б) при более сильном окислении концентрированной азотной кислотой образуются двухосновные оксикислоты – сахарные кислоты (глюкоза глюкосахарная кислота): О О // НNО3 // СН2ОН – (СНОН)4 – С СН2ОН – (СНОН)4 - С \ \ Н ОН 2. Восстановление При восстановлении моносахаридов они переходят в многоатомные спирты (D-глюкоза сорбит; D – ксилоза ксилит): О // Н2 СН2ОН – (СНОН)4 – С СН2ОН – (СНОН)4 – СН2ОН \ Н 3. Реакция со спиртами Среди реакций, которые обусловлены свойствами моносахаридов как циклических многоатомных спиртов, особую роль играет полуацетальный гидроксил. Так, при нагревании моносахаридов с низшими спиртами в присутствии НСl атом водорода в гликозидном гидроксиле замещается на алкильный радикал с образованием простого эфира – гликозида: СН2ОН О ОН СН2ОН О ОСН3 НСl Н Н + СН3ОН Н β - D- глюкопираноза + Н2О Н β -D- глюкопиранозид Остальные спиртовые гидроксилы в этих условиях во взаимодействие не вступают. 34 О – гликозиды широко распространены в растительном мире. В большинстве природных гликозидов в качестве сахарной компоненты выступает D – глюкоза и почти все они являются β-глюкозидами. Несахарная компонента называется агликоном и обладает сложным строением. Обычно гликозиды классифицируют по агликоновой компоненте. Важное значение имеют и азотсодержащие, так называемые N – гликозиды, в которых агликон связан с монозой через атом азота (в том числе нуклеозиды). В гликозидах отсутствует полуацетальный гидроксил, поэтому они не способны к таутомерии и не проявляют восстанавливающих свойств. 4. Брожение моносахаридов Брожение – это расщепление сахаров под влиянием биологических катализаторов – ферментов. Процессы брожения протекают сложными путями – через ряд промежуточных продуктов. Различные микроорганизмы вызывают определенные виды брожения. Например: а) спиртовое брожение С6Н12О6 2 С2Н5ОН + 2 СО2 ↑ этанол б) маслянокислое брожение СН3 – (СН2)2 – СООН + 2Н2 + 2 СО2 ↑ С6Н12О6 масляная кислота в) молочнокислое брожение С6Н12О6 2 СН3 – СН – СООН | ОН молочная кислота г) лимоннокислое брожение С6Н12О6 ОН | НООС – СН2 – С – СН2 – СООН + 2Н2О | СООН лимонная кислота Производные моносахаридов Большую группу производных моносахаридов составляют фосфорные эфиры, которые образуются в ходе превращений углеводов в тканях. Некоторые из них: 35 В природе широко распространены два аминопроизводных моносахарида: глюкозамин и галактозамин, которые существуют как в линейной, так и в циклической форме. Глюкозамин входит в состав многих полисахаридов, содержащихся в тканях животных и человека; галактозамин является компонентом гликопротеинов и гликолипидов: В состав полисахаридов входит глюкуроновая кислота. По химической природе аскорбиновая кислота близка к моносахаридам Lряда и является внутренним циклическим эфиром (лактоном) одной из альдоновых кислот: О // С | С – ОН L – аскорбиновая кислота || (витамин С) С – ОН О | Н–С | НО – С – Н 36 | СН2ОН Получают синтетически из D-глюкозы. Содержится в соке лимона, черной смородины, плодах шиповника, свежей капусте. Биологические функции моносахаридов пластическая – моносахариды и их производные участвуют в построении разнообразных молекул; энергетическая – моносахариды используются в качестве источников энергии в клетке. Олигосахариды Наиболее распространенными в природе олигосахаридами являются дисахариды, состоящие из остатков двух молекул моносахаридов. Связь между остатками моносахаридов осуществляется за счет двух гидроксильных групп – по одной от каждой молекулы. В зависимости от того, какие гидроксильные группы участвуют в образовании связи между остатками моносахаридов, все дисахариды делят на 2 группы: • если в образовании связи участвует гликозидный гидроксил одного моносахарида и негликозидный (спиртовой) гидроксил другого моносахарида, то такую связь называют гликозид-гликозной, а образовавшийся дисахарид относят к восстанавливающим дисахаридам (гликозил-гликозы); • если в образовании дисахарида участвуют гликозидные гидроксилы обоих моносахаридов, то это гликозид-гликозидная связь, а образовавшийся дисахарид относят к невосстанавливающим (гликозил-гликозиды). К восстанавливающим дисахаридам относят: а) мальтозу, которая образуется из полисахаридов, и состоит из двух остатков глюкозы, соединенных между собой α-1,4-гликозидной связью. 37 б) лактозу, содержащуюся в молоке животных и человека, молекулы которой состоят из остатков галактозы и глюкозы, связанных между собой β-1,4гликозидной связью. Представителем невосстанавливающих дисахарид является сахароза – наиболее важный дисахарид, встречающийся в растительном мире. Сахароза состоит из остатков α-D-глюкозы и β-D-фруктозы, связанных α, β-1,2гликозидной связью: Сахароза не проявляет восстанавливающих свойств, так как в молекуле отсутствует гликозидный гидроксил, циклические формы оказываются зафиксированными и ни одна из них не может таутомерно переходить в открытую форму. Полисахариды Полисахариды (или несахароподобные сложные углеводы) представляют собой биополимеры, мономерами которых служат моносахариды. Если в составе полисахарида содержатся остатки моносахарида одного вида, его называют гомополисахаридом, если разных – гетерополисахаридом. К физиологически важным гомополисахаридам относят крахмал и гликоген. К числу важнейших гетерополисахаридов – гиалуроновую кислоту, хондроитинсульфат и гепарин. Крахмал – гомополисахарид, состоящий из остатков α-D-глюкозы. Он является одним из наиболее распространенных запасных полисахаридов растений. Крахмал накапливается в семенах, клубнях (40-78%) и других частях растений (10-25%). Крахмал состоит из двух фракций, отличающихся строением и свойствами: амилозы (15-25%) и амилопектина (75-85%). Амилоза построена из остатков глюкозы, связанных кислородными «мостиками» (гликозидными связями) между первым атомом углерода одного остатка и четвертым углеродным атомом другого: 38 При этом глюкозные остатки образуют неразветвленную цепь, которая скручивается в пространстве в спираль, но в целом молекула имеет нитевидную форму. Амилопектин имеет разветвленное строение за счет связи между шестым атомом углерода одного остатка и первым углеродным атомом другого: Гликоген – резервное питательное вещество организма человека и животных. Иначе его называют «животным крахмалом». В организме человека он накапливается в печени (около 20%) и в мышцах (около 2%). Гликоген по структуре близок к амилопектину, но степень его разветвления больше, чем у амилопектина, поэтому молекула гликогена более компактна. Кроме того, молекулы гликогена неоднородны, и часть их находится в соединении с белками. 39 Целлюлоза – встречается в растительном мире в качестве структурного компонента клеточной стенки. Молекулы целлюлозы состоят из остатков βглюкозы, связанных между собой β-1,4-гликозидными связями. Структура целлюлозы хорошо отвечает ее биологической задаче. Отдельные молекулы целлюлозы связаны между собой водородными связями, что способствует образованию волокнистой и очень прочной структуры. В клеточных стенках растений волокна плотно упакованы в слои, которые дополнительно стабилизированы другими соединениями полисахаридной природы. Целлюлоза не имеет питательной ценности для высших животных и человека, так как пищеварительные секреты слюны и ферменты желудочнокишечного тракта не способны расщеплять 1,4-гликозидные связи до глюкозы. Гиалуроновая кислота – гетерополисахарид, имеющий важное значение для высших организмов. В соединительной ткани - это основной компонент внеклеточного желатинообразного вещества, заполняющего межклеточное пространство ткани. Она содержится в синовиальной жидкости суставов, стекловидном теле и пуповине новорожденных. 40 Гиалуроновая кислота – это линейный полисахарид, образованный дисахаридными повторяющимися звеньями, состоящими из остатков Dглюкороновой кислоты и N-ацетил-D-глюкозамина, соединенных β-1,3гликозидной связью. Повторяющиеся дисахаридные звенья связаны между собой β-1,4-гликозидной связью. Гиалуроновая кислота Хондроитинсульфат – составная часть костной ткани, хрящей, сухожилий, роговицы глаз, сердечных клапанов и других тканей. Повторяющееся дисахаридное звено в хондроитинсульфате состоит из глюкороновой кислоты и N-ацетилгалактозаминсульфата, звенья соединены друг с другом β-1,3- и β-1,4гликозидными связями: Гепарин – гетерополисахарид, препятствующий свертыванию крови у животных и человека. Он содержится в крови, печени, легких, селезенке, щитовидной железе и других тканях и органах. 41 Молекула гепарина из глюкуроновой кислоты и α-глюкозамина в виде двойного сульфопроизводного, соединенных между собой α-1,4-гликозидными связями: Биологические функции полисахаридов энергетическая – крахмал и гликоген составляют «депо» углеводов клетки и при необходимости быстро расщепляются на легко усваиваемый источник энергии – глюкозу; опорная – хондроитинсульфат выполняет опорную функцию в костной ткани; структурная – гиалуроновая кислота, хондроитинсульфат и гепарин структурные межклеточные вещества; гидроосмотическая и ионрегулирующая – гиалуроновая кислота благодаря высокой гидрофильности и отрицательному заряду связывает межклеточную воду и катионы, регулируя межклеточное асматическое давление. Катаболизм углеводов Обмен углеводов играет большую роль в жизнедеятельности организма. Катаболизм углеводов, с одной стороны, сопровождается освобождением энергии, которая может накапливаться в макроэргических связях АТФ и использоваться в дальнейшем для синтеза необходимых молекулярных компонентов клетки и совершения различных видов работ, с другой стороны, образующиеся метаболиты служат исходными веществами для образования биологически важных соединений, таких как аминокислоты, липиды, нуклеотиды. 42 Запасным полисахаридом в тканях человека является гликоген, процесс распада которого называют гликогенолизом. Этот процесс может осуществляться либо путем гидролиза, либо фосфоролиза: Гликоген фосфоролиз гидролиз Н3РО4 Н2О глюкозо-1-фосфат (катализируется ферментом гликогенфосфорилазой) глюкоза (катализируется ферментами амилазами) Дальнейшей распад глюкозы возможен двумя путями. Один из них заключается в распаде шестиугольной молекулы глюкозы на две трехугольные молекулы. Этот путь называется дихотомическим распадом глюкозы. При реализации второго пути происходит потеря молекулой глюкозы одного атома углерода, что приводит к образованию пентозы; этот путь носит название апотомического распада. Основные понятия и термины раздела Альдозы – моносахариды, в состав которых входит несколько гидроксильных и дона альдегидная группа. Брожение – расщепление молекул моносахаридов под влиянием ферментов. Восстанавливающие дисахариды – дисахариды, проявляющие свойств восстановителей, дающие реакции характерные для альдегидов (реакцию с реактивом Фелинга, реакцию «серебряного зеркала»). Гликозиды – производные моносахаридов, в которых водород в полуацетальном гидроксиле заменен на радикал. Гликозидный гидроксил (полуацетальный) – гидроксил, возникающий при образовании циклической формы моносахарида. Кетозы – моносахариды, в состав которых входит несколько гидроксильных и одна кето-группа. Моносахариды (простые углеводы, монозы) – углеводы, не подвергающиеся гидролизу. Невосстанавливающие дисахариды – дисахариды, не проявляющие свойств восстановителей (не реагируют с реактивом Фелинга и не дают реакцию «серебряного зеркала»). 43 Олигосахариды (сложные углеводы) – биополимеры, мономерами которых служат моносахариды. Таутомерия моносахаридов – явление взаимного перехода открытой и циклической форм моносахарида в растворе. Углеводы – полигидроксикарбонильные соединения и их производные. Вопросы и задания 1. Какие органические соединения называют углеводами? 2. Какие функциональные группы входят в состав альдогексоз? 3. Сколько оптических изомеров существует для открытой и циклической форм D-глюкозы? Что такое α- и β-циклические формы моносахаридов? 4. Составьте структурные иформулы: а) рибозо-5-фосфата; б) глюкозо-6-фосфата; в) галактозо-1-фосфата; г) фруктозо-1,6-дифосфата; д) этил-α-D-глюкопиранозида. 5. Объясните явление кольчато-цепной таутомерии моносахаридов. Напишите формулы таутомеров для альдогексозы и кетогексозы. 6. Напишите структурную формулу дисахарида, состоящего из двух остатков глюкозы, связанных между собой α-1,4-гликозидной связью. Как называется этот дисахарид? 44 7. Какие гомополи- и гетерополисахариды вы знаете? Каково их строение? Биологическая роль? Проверь себя (экспресс-тест) 1. К моносахаридам относятся: а) мальтоза б) фруктоза в) лактоза г) гепарин 2. На какие группы подразделяются углеводы по функциональным группам? а) альдозы и кетозы б) моносахариды и дисахариды в) глюкозы и фруктозы г) пентозы и гексозы 3. α-глюкоза и β-глюкоза - ……. а) оптические изомеры в) олигосахариды б) структурные изомеры г) цис-транс- изомеры 4. Оптическая изомерия углеводов связана с сущесьвованием в их молекуле… а) нескольких гидроксильных групп б) асимметрических атомов углерода в) карбонильной группы г) хиральных центров 5. Глюкоза в водном растворе представляет собой… а) альдегидоспирт б) шестичленный (пиранозный) цикл, содержащий атом кислорода в) пятичленный (фуранозный) цикл, содержащий атом кислорода г) смесь перечисленных структур 45 6. Образование полисахаридов из моносахаридов – это реакция… а) полимеризации б) поликонденсации в) этерификации г) гидролиза 7. В состав сахарозы входят: а) две молекулы глюкозы в) глюкоза и фруктоза б) две молекулы фруктозы г) галактоза и глюкоза 8. По какому признаку дисахариды подразделяют на восстанавливающие и невосстанавливающие? а) по реакции с водородом б) по реакции с азотной кислотой в) по реакции с раствором гидроксиддиаминсеребра г) по возможности взаимного превращения циклической и линейной форм 9. Продуктом фосфоролиза мальтозы является: а) глюкоза и галактоза б) глюкозо-1-фосфат и глюкоза в) глюкозо-6-фосфат и глюкоза г) глюкозо-1-фосфат и галактоза 10. Какой процесс с участием углеводов приводит к выделению наибольшего количества энергии? а) окисление кислородом воздуха б) восстановление в) брожение г) карбоксилирование Раздел 3. Липиды К липидам относят жиры и жироподобные вещества растительного и животного происхождения, нерастворимые в воде, но растворимые в неполярных растворителях (эфир, хлороформ, бензол и др.). В структурном отношении все липиды являются сложными эфирами жирных кислот и разнообразных спиртов. Жирные кислоты – это карбоновые кислоты с длинной алифатической цепью. Высшие жирные кислоты (ВЖК) являются основными гидрофобными компонентами липидов. Большинство ВЖК – это монокарбоновые кислоты с длинными линейными углеводородными цепями с четным числом атомов углерода (С12 – С20), встречаются ненасыщенные кислоты с одной или несколькими двойными связями (таблица 2). Таблица 2 Наиболее распространенные ВЖК Формула Название Насыщенные кислоты СН3 – (СН2)10 – СООН лауриновая СН3 – (СН2)12 – СООН миристиновая СН3 – (СН2)14 – СООН пальмитиновая СН3 – (СН2)16 – СООН стеариновая Число атомов С 12 14 16 18 46 СН3 – (СН2)22 – СООН лигноцериновая Ненасыщенные кислоты СН3 – (СН2)7 – СН = СН – (СН2)7 - СООН олеиновая СН3 – (СН2)3 – (СН2 – СН = СН)2 – (СН2)7 - СООН линоленовая СН3 – (СН2)4 – (СН = СН – СН2)4 – (СН2)2 - СООН арахидоновая СН3 – (СН2)7 – СН = СН – (СН2)13 - СООН нервоновая 24 18 18 20 24 Среди насыщенных ВЖК особенно распространены пальмитиновая и стеариновая кислоты, они найдены во всех тканях животных и человека используются организмом в целом как энергетический материал. Их больше всего в животных жирах, например: говяжьем и свином – по 25% пальмитиновой, соответственно 20 и 13% стеариновой кислоты. Эти кислоты могут частично синтезироваться в организме из углеводов (и даже из белков). Избыток насыщенных жирных кислот в питании часто приводит к нарушению обмена жиров, повышению уровня холестерина в крови. Ненасыщенные ВЖК подразделяются на мононенасыщенные и полиненасыщенные. К числу наиболее распространенных мононенасыщенных жирных кислот относят олеиновую кислоту, которой много в оливковом масле (65%), свином жире (43%), говяжьем жире (37%), сливочном масле (23%). Особое значение имеют полиненасыщенные жирные кислоты – линоленовая, линолевая, арахидоновая, которые входят в состав клеточных мембран и выполняют в организме ряд важных функций, в том числе обеспечивают нормальный рост и обмен веществ, эластичность сосудов и прочее. Такие полиненасыщенные жирные кислоты не могут синтезироваться в организме человека и поэтому являются незаменимыми (как некоторые аминокислоты и витамины). При полном отсутствии этих кислот в питании наблюдалось прекращение роста, некротические поражения кожи, изменение проницаемости капилляров. Линолевая кислота, которой особенно много в подсолнечном масле (60%) обладает достаточно высокой биологической активностью, 1/10 биологической активности линолевой кислоты обладает линоленовая кислота. Наибольшая биологическая активность свойственна арахидоновой кислоте, но ее содержание в пищевых продуктах очень мало: в мозгах – 0,5%, в яйцах – 0,1%, печени свиной – 0,3%. В организме линолевая кислота при участии витамина В6 переходит в арахидоновую, а эта, в свою очередь, превращается в очень важные внутриклеточные гормоны – простагландины. Полиненасыщенные жирные кислоты, в отличие от насыщенных, способствует удалению холестерина из организма. Классификация и функции липидов В зависимости от строения липиды разделяют на простые (двухкомпонентные) и сложные (многокомпонентные). В группе простых липидов выделяют жиры, воски и стериды. Сложные липиды подразделяются на фосфолипиды, гликолипиды, сфингофосфолипиды. К основным биологическим функциям липидов можно отнести следующие: 47 энергетическая – при окислении липидов в организме выделяется энергия (1г липидов – 39,1кДж); транспортная – участвуют в транспорте веществ через липидный слой биомембраны; механическая – липиды соединительной ткани, окружающей внутренние органы, и подкожного жирового слоя предохраняют органы от повреждений при внешних механических воздействиях; теплоизолирующая – благодаря своей низкой теплопроводности сохраняют тепло в организме. В последние годы выявлена крайне важная роль сложных липидов в функционировании клеточных мембран. Все клеточные мембраны, помимо белка и полисахаридов, содержат от 20 до 75% полярных и нейтральных липидов. Липиды образуют бимолекулярный слой толщиной около 5нм с полярными группами по обе стороны слоя, в который вкраплены белковые субчастицы и структурированная вода. Этот слой регулирует обмен веществ в клетках, определяя проницаемость мембран дл ионов, неэлектролитов и воды. Простые липиды (жиры) Жиры (триглицериды) – это сложные эфиры ВЖК и трехатомного спирта глицерина. Среди триглицеридов различают простые и смешанные. В состав первых входят три одинаковые ВЖК, например: СН2 – О – СО – С17Н35 | СН – О – СО – С17Н35 | СН2 – О – СО – С17Н35 тристеарин СН2 – О – СО – (СН2)7 – СН = СН – (СН2)7 – СН3 | СН – О – СО – (СН2)7 – СН = СН – (СН2)7 – СН3 | СН2 – О – СО – (СН2)7 – СН = СН – (СН2)7 – СН3 триолеин Смешанные триглицериды построены из остатков глицерина и разных ВЖК: СН2 – О – СО – (СН2)14 – СН3 | СН – О – СО – (СН2)16 – СН3 | СН2 – О – СО – (СН2)16 – СН3 пальмитодистеарин 48 Природные жиры представляют собой смесь разнообразных триглицеридов, в которых преобладают смешанные триглицериды. Стериды – это сложные эфиры ВЖК и полициклических спиртов (стеаролов). Свободные стеролы и родственные им соединения образуют большую фракцию природных соединений. В организме человека лишь 10% стеролов представлены стероидами, 90% находятся в свободном состоянии. Наиболее важен в функциональном отношении для организма человека стерол-холестерол (холестерин): Холестерин является нормальным структурным компонентом всех клеток и тканей, участвует в обмене желчных кислот, ряда гормонов, витамина D. Нормальное содержание холестерина в крови равно 150-220мг. При повышении этого показателя усиливается опасность возникновения и развития атеросклероза. Основная часть холестерина (около 70-80%) в организме образуется из жирных кислот (насыщенных) и углеводов. Частично человек получает его с пищей. Больше всего холестерина содержится в яйцах (0,57%), сырах (0,28-1,6%), сливочном масле (0,21%), субпродуктах (до 0,3%). При тепловой обработке холестерин относительно устойчив – теряется около 20% от исходного количества. Пожилым людям и тем, кто предрасположен к атеросклерозу, следует избегать избытка пищевого холестерина, не исключать полностью продукты, содержащие это вещество. Основное количество холестерина образуется в печени из других компонентов пищи. Чем больше холестерина поступает с пищей, тем меньше его синтезируется в печени, и наоборот. В обычном дневном рационе питания для профилактики атеросклероза может содержаться до 300мг холестерина. Почти суточную дозу (230мг) дает одно куриное яйцо, или 500г жирного мяса, или 50г голландского сыра, или 130г сливочного масла. В организме животных и человека стеролы окисляются с образованием производных, имеющих общее название – стероиды.К ним относятся холевые 49 кислоты (ингридиенты желчи, способствующие всасыванию жирных кислот в кишечнике) и стероидные гормоны. Из высших жирных кислот в составе стеридов обнаружены пальмитиновая, стеариновая и олеиновая кислоты. Стериды образуются в результате этерификации стеролов: Воски – это сложные эфиры высших насыщенных или ненасыщенных кислот с высшими одноатомными спиртами (С16 – С36). Воски подразделяются на растительные и животные. У растений воски играют роль слоем листья, плоды, стебли, восковой налет предохраняет растения от поражения вредителями и болезнями и от лишней потери воды. Из растительных восков следует отметить карнаубский воск – воск пальмовых листьев (Бразилия), воск стеблей льна, канделильский воск. К животным воскам относится спермацет, который получают из спермацетового масла, содержащегося в черепной полости кашалота. В спермацете преобладает цетиловый эфир пальмитиновой кислоты (С15Н31СООС16Н33). Пчелиный воск содержит спирты С24 – С34, этерифицированные высшими кислотами (например, мерициловый эфир пальмитиновой кислоты С15Н31СООС31Н63), углеводороды (до 17%), церотиновую кислоту С25Н51СООН. Воски находят широкое применение для приготовления кремов, мазей, в качестве добавок к мылам, пластырям, помадам и т.п. Свойства жиров Как правило, жиры не выдерживают перегонки и разлагаются, даже если их перегоняют при пониженном давлении. Температура плавления и консистенция жиров зависят от строения кислот, входящих в их состав. Твердые жиры, то есть жиры, плавящиеся при высокой температуре, состоят из глицеридов предельных кислот (стеариновая, пальмитиновая), а в маслах, плавящихся при более низкой температуре и представляющих собой пустые жидкости, содержатся значительные количества глицеридов непредельных кислот (олеиновая, линолевая, линоленовая). 50 Так как природные жиры представляют собой сложные смеси глицеридов, они плавятся не при определенной температуре, а в определенном температурном интервале, причем предварительно размягчаются. Для характеристики жиров применяется температура затвердевания, которая не совпадает с температурой плавления – она несколько ниже. Кроме того, температура затвердевания жира обусловлена характером составляющих его кислот: она тем выше, чем больше содержание предельных кислот. Жиры растворяются в эфире, сероуглероде, в ароматических углеводородах и бензине. Нерастворимы жиры в холодном спирте и воде, хотя могут образовывать эмульсии, которые стабилизируются в присутствии поверхностноактивных веществ, как белки, мыла. Природной эмульсией жира, стабилизированной белками, является молоко. Гидролиз жиров. Среди реакций жиров особое значение имеет гидролиз, который можно осуществить как кислотами, так и основаниями (щелочной гидролиз называют омылением): СН2 – О – ОС – R СН2 – ОН + | Н | СН – ОН + 3 R СООН CН – О – ОС – R + 3 Н2О | Н | СН2 – О – ОС – R СН2 – ОН С помощью этой реакции устанавливают строение липидов и получают ценные продукты. Гидролиз – первая стадия утилизации и метаболизма пищевых жиров в организме. Реакции присоединения. Двойные связи непредельных кислот, входящих в состав жира, могут быть прогидрированы каталитическим путем, они присоединяют бром и йод. В связи с тем, что твердых жиров не хватает для технического использования и пищевых целей, значение имеет превращение более дешевых жидких жиров в твердые. Это превращение идет путем каталитического гидрирования двойных связей кислот жидких жиров, при этом жидкие ненасыщенные жиры переходят в твердые насыщенные. В качестве сырья применяют жир морских млекопитающих и растительные масла (подсолнечное, хлопковое, соевое и др.): СН2 – О – СО – (СН2)7 – СН = СН – (СН2)7 СН3 | + Н2, Ni СН – О – СО – С17Н35 | СН2 – О – СО – С17Н35 олеодистеарин (жидкий жир) СН2 – О – СО – С17Н35 | СН – О – СО – С17Н35 | СН2 – О – СО – С17Н35 тристеарин (твердый жир) Так, искусственное масло, или маргарин, представляет собой эмульсию гидрогенизированного растительного жира в молоке; он имеет вид, консистенцию, запах и вкус сливочного масла. Запах и вкус придаются предварительным брожением молока с особыми видами молочных бактерий, 51 вызывающих частичное окисление и синтезирующих диацетил – основное душистое вещество сливочного масла. Для стабилизации эмульсии в маргарин вводят природные эмульгаторы, также как яичный желток или лецитин, выделенный из желтка или сои. Прогоркание. Многие жиры при стоянии на воздухе прогоркают – приобретают неприятный вкус и запах. Различают гидролитическое и окислительное прогоркание. Гидролитические изменения в жире происходят под действием ферментов или микроорганизмов, приводя к образованию свободных жирных кислот. Если эти кислоты обладают короткой цепью (масляная кислота), то жиры приобретают прогорклый вкус и запах. Этот тип характерен для коровьего молока. Окисление молекулы жира приводит к образованию ряда альдегидов и кетонов с короткой цепью, которые тоже имеют неприятный запах и вкус. Для этого процесса необходим кислород воздуха, а повышение температуры, свет и влажность ускоряют этот процесс. Сложные липиды К сложным липидам относят фосфолипиды, сфинголипиды и гликолипиды. Фосфолипидами называют липиды, дающие при гидролизе кроме глицерина и высших карбоновых кислот фосфорную кислоту и аминоспирты (или другие сложные эфиры). Фосфолипиды в зависимости от спирта, входящего в его состав, подразделяются на фосфатиды и сфингофосфодипиды. В состав фосфатидов входит глицерин, их рассматривают как производные фосфатидной кислоты: СН2 – О – СО – R | CН – О – СО – R | СН2 – О – Р = О / \ ОН ОН Они различаются высшими жирными кислотами и добавочными соединениями, входящими в состав. В зависимости от добавочного соединения среди фосфатидов различают фосфатидилхолин (лецитин), фосфатидилколамин (кефалин), фосфатидилсерин и т.д. СН2 – О – СО – R СН2 – О – СО – R | | СН – О – СО – R’ СН – О – СО – R’ | | + СН2 – О – Р – О – СН2 – СН2 СН2 – О – Р – О – СН2 – СН2 – N (СН3)3 // \ // \ | О О О ОН NН2 52 лецитин кефалин СН2 – О – СО – R | СН – О – СО – R’ | СН2 – О – Р – О – СН2 – СН – СООН // \ | О ОН NН2 фосфатидилсерин Наиболее распространены в природе лецитины – это глицериды, в которых две спиртовые группы глицерина этерифицированны двумя, чаще разными, жирным кислотами и содержат фосфохолиновую группировку, которая при гидролизе дает фосфат и четвертичное аммониевое основание – холин [НОСН2СН2 N+(СН3)3ОН-]. Лецитины впервые обнаружены в желтке яйца, откуда и произошло их название (греч. lekithos - желток). Кефалины – сложные эфиры глицерина, построенные по тому же принципу, что и лецитины, но в состав кефалинов вместо холина входит коламин (или этаноламин: НО – СН2 – СН2 – NН2). Кефалины (от греч. kephale - голова) впервые были выделены из тканей головного мозга. Фосфатидилсерины содержат в качестве основания аминокислоту серин НО – СН2 – СН – СООН | NН2 Сфинголипиды. Эти соединения представляют собой структурные аналоги фосфолипидов, где вместо глицерина входит сфигнозин. НОСН2 – СН – СН – СН = СН – (СН2)12 СН3 | | NН2 ОН В результате гидролиза сфинголипидов были получены 4 кислоты: пальмитиновая, стеариновая, лигноцериновая и нервоновая: СН3(СН2)7 – СН = СН – (СН2)13 СООН СН3 – (СН2)22 СООН лигноцериновая кислота нервоновая кислота Большое количество сфинголипидов содержится в нервной ткани и крови человека. В плазме крови содержится 8-15% сфинголипидов, в мембранах эритроцитов – 30-40% от общего содержания липидов. Гликолипиды. В состав гликолипидов входит сфигнозин, ВЖК, углеводный компонент (D-галактоза, D-глюкоза), глюкозамин, галактозамин и их ацетильные производные), но не входит фосфорная кислота. Известны следующие жирные кислоты, входящие в состав гликолипидов: лигноцериновая, цереброновая (α-оксилигноцериновая), нервоновая и αоксинервоновая кислоты. 53 Эти сложные липиды впервые выделены из серого вещества головного мозга. Обмен липидов В тканях организма происходит непрерывное обновление липидов. Основную массу липидов тела человека составляют триглицериды, которыми особенно богата жировая ткань. В виде включений триглицериды имеются в большинстве тканей и органов. Поскольку липиды выполняют энергетическую функцию, то процессы их обновления связаны с мобилизацией и депонированием их в процессе образования энергии. Обмен фосфодипидов недостаточно изучен, но есть мнение, что их обновление связано прежде всего с процессами восстановления структуры мембран. Обновление липидов тканей и органов организма требует предварительного внутриклеточного ферментативного гидролиза. Гидролиз триглицеридов (липолиз) проходит в два этапа. На первом этапе происходит гидролиз внешних сложноэфирных связей, ускоряет этот процесс фермент липаза: СН2 – ОН СН2 – О – СО – R | + 2Н2О | СН – О – СО – R’ липаза СН – О – СО – R’ + 2R – СООН | | СН2 – О – СО – R’’ СН2 – ОН ВЖК триглицерид β – моноглицерид β – моноглицерид на втором этапе далее гидролизуется неспецифической эстеразой до глицерина и ВЖК: СН2 ОН + Н2О СН2ОН | эстераза | СН – О – СО – R’ СНОН + R’ – СООН | | СН2ОН СН2ОН В результате гидролиза триглицеридов образуется глицерин и три молекулы ВЖК. Обмен глицерина может осуществляться несколькими путями. Значительная часть образовавшегося при гидролизе липидов глицерина используется для ресинтеза триглицеридов. Второй путь обмена глицерина – включение продукта его окисления в гликолиз или глюконеогенез. ВЖК в митохондриях подвергаются окислению, в ходе которого происходит уменьшение на два атома углерода с карбоксильного конца ВЖК. Механизм такого окисления был назван β – окислением ВЖК и он является одним из источников получения энергии для синтеза АТФ в животной клетке. 54 Нарушения в обмене жиров сопровождаются накоплением ацетоуксусной и β – гидроксимасляных кислот в крови. Ацетоуксусная кислота является продуктом окисления β – гидроксимасляной кислоты и может превращаться в ацетон по схеме: [О] СН3 – СН – СН2 – СООН | ОН β-гидроксимасляная кислота СН3 – С – СН2 – СООН СН3 – С – СН3 || - СО2 || О О ацетоуксусная ацетон кислота Ацетоуксусная β–гидроксимасляная кислота и ацетон получили название кетоновых тел. Усиленное образование их называют кетозом. Состояние организма, при котором происходит избыточное накопление кетоновых тел в крови, называют кетонемией, а выделение их с мочой – кетонурией. Среди многих причин патологического накопления кетоновых тел, особенно важными считают дефицит поступающих с пищей углеводов (относительно окисляющихся липидов) и нарушение обмена углеводов и жирных кислот при недостатке инсулина. Основные понятия и термины раздела Гликолипиды – сложные эфиры ВЖК и сфигнозина, в состав которых входит углеводная компонента. Жиры (триглицериды) – сложные эфиры ВЖК и трехатомного спирта глицерина. Кетонемия – состояние организма, при котором происходит избыточное накопление кетоновых тел. Кетонурия – состояние организма, при котором происходит выделение кетоновых тел с мочой. Липиды – природные неполярные соединения, нерастворимые в воде, но растворимые в неполярных растворителях. Липолиз – гидролитическое расщепление жиров. Стериды – сложные эфиры ВЖК и полициклических спиртов. 55 Сфинголипиды – сложные эфиры ВЖК сфингозида, содержащие остаток фосфорной кислоты и связанное с ней добавочное соединение. Фосфолипиды – сложные эфиры ВЖК и глицерина, содержащие остаток фосфорной кислоты и связанное с ней добавочное соединение. Вопросы и задания 1. Какие органические вещества называются липидами? 2. Напишите структурные формулы трипальмитина, пальмотодилаурила, пальтостеароолеина. Какие триглицериды входят в группу простых, а какие – смешанных тригоицеридов? 3. Приведите схему гидролиза триолеина. 4. Составьте уравнение гидрирования триолеина, назовите конечный продукт. 5. Какие химические компоненты входят в состав фосфатидов? Сфинголипидов? Гликолипидов? 6. Напишите структурную формулу лецитина и схему гидролиза его. 7. Из глицерина, пальмитиновой, стеариновой и олеиновой кислот проведите синтез триглицерида. 56 8. В комплексе с какими веществами липиды входят в состав биологических мембран? 9. Чем сопровождаются нарушения в обмене веществ? 10. Перечислите основные биологические функции липидов. Проверь себя (экспресс-тест) 1. Чем отличаются сложные эфиры от простых? а) сложные эфиры образуются из двух веществ, а простые из одного б) при образовании сложных эфиров вода выделяется, а простых – нет в) молекулы сложных эфиров содержат двойную связь С=О, а простые – нет г) простые эфиры могут иметь симметричное строение, а сложные – нет 2. Какой реагент нужно использовать для того, чтобы полностью этерифицировать все гидроксильные группы в молекуле многоатомного спирта? а) карбоновая кислота б) сложный эфир карбоновой кислоты и спирта в) метиламид карбоновой кислоты г) ангидрид карбоновой кислоты 3. Какое из перечисленных веществ относится к жирам? а) СН2 – ОН б) СН2 – О – СО – С17Н35 | | 57 СН – ОН | СН2 – О – СО – С17Н35 в) RСОО – СН2 | RСОО – СН О | || СН2 – О – Р – ОСН2 СН2 +NН3 | О- СН – О – СО – С17Н35 | СН2 – О – СО – С17Н35 г) СН2 – О – СО – С17Н35 | СН2 – О – СО – С17Н35 4. Сложные эфиры ВЖК с глицерином и полициклическими спиртами составляют группу: а) сложных липидов б) простых липидов в) фосфатидов г) диольных липидов 5. Какой азотистый ингредиент содержится в составе лецитина? а) холина б) серина в) треонина г) этаноламина д) этиламина 6. Липиды в виде комплексов с белками входят в состав: а) энзимных комплексов б) рибосом в) синтедаз ВЖК г) биологических мембран 7. Сложноэфирные связи в молекулах триглицеридов подвергаются гидролизу при участии: а) фосфалипазы б) ацетилхолинэстеразы в) липазы г) гликогенфосфорилазы 8. Высшие жирные кислоты в процессе их катаболизма разрушаются путем: а) процессов восстановления б) α-окисления в) β-окисления г) дикарбоксилирования г) гидролиза 58 Список литературы 1. Вивюрский В.Я. Вопросы, упражнения и задачи по органической химии с ответами и решениями. – М.: Гуманитарный издат. центр Владос, 1999. 2. Грандберг И.И. Органическая химия: учебник для студентов, обучающихся по агрономическим спецальностям. – М.: Дрофа, 2002. 3. Зеленин К.Н. Сдаем экзамен по химии. – СПб: Элби-СПб, 2001. 4. Оганесян Э.Т. Важнейшие понятия и термины химии: справочное пособие. – М.: Высшая школа, 1993. 5. Писаренко А.П. Курс органической химии. – М.: Высшая школа, 1985. 6. Проскурина И.К. Биохимия: учебное пособие для студентов высших учебных заведений. – М.: Изд-во Владос-Пресс, 2004. 7. Тюкавкина Н.А. Биоорганическая химия: учебник для вузов. – М.: Дрофа, 2005. 8. Швехгеймер М.-Г.А., Кобраков К.И. Органическая химия: учебник для нехимических специальных вузов. – М.: Высшая школа, 1994. 59 60