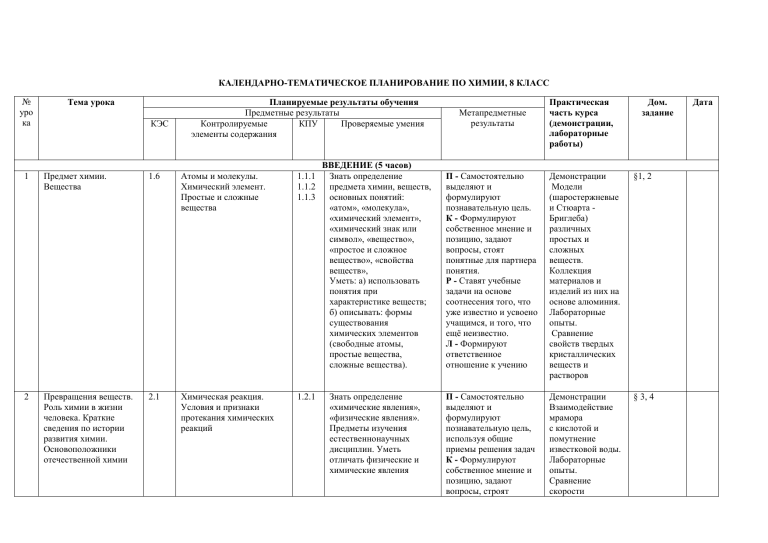
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ПО ХИМИИ, 8 КЛАСС № уро ка Тема урока КЭС Планируемые результаты обучения Предметные результаты Контролируемые КПУ Проверяемые умения элементы содержания 1 Предмет химии. Вещества 1.6 Атомы и молекулы. Химический элемент. Простые и сложные вещества 1.1.1 1.1.2 1.1.3 2 Превращения веществ. Роль химии в жизни человека. Краткие сведения по истории развития химии. Основоположники отечественной химии 2.1 Химическая реакция. Условия и признаки протекания химических реакций 1.2.1 ВВЕДЕНИЕ (5 часов) Знать определение предмета химии, веществ, основных понятий: «атом», «молекула», «химический элемент», «химический знак или символ», «вещество», «простое и сложное вещество», «свойства веществ», Уметь: а) использовать понятия при характеристике веществ; б) описывать: формы существования химических элементов (свободные атомы, простые вещества, сложные вещества). Знать определение «химические явления», «физические явления». Предметы изучения естественнонаучных дисциплин. Уметь отличать физические и химические явления Метапредметные результаты Практическая часть курса (демонстрации, лабораторные работы) Дом. задание П - Самостоятельно выделяют и формулируют познавательную цель. К - Формулируют собственное мнение и позицию, задают вопросы, стоят понятные для партнера понятия. Р - Ставят учебные задачи на основе соотнесения того, что уже известно и усвоено учащимся, и того, что ещё неизвестно. Л - Формируют ответственное отношение к учению Демонстрации Модели (шаростержневые и Стюарта Бриглеба) различных простых и сложных веществ. Коллекция материалов и изделий из них на основе алюминия. Лабораторные опыты. Сравнение свойств твердых кристаллических веществ и растворов §1, 2 П - Самостоятельно выделяют и формулируют познавательную цель, используя общие приемы решения задач К - Формулируют собственное мнение и позицию, задают вопросы, строят Демонстрации Взаимодействие мрамора с кислотой и помутнение известковой воды. Лабораторные опыты. Сравнение скорости § 3, 4 Дата 3 Знаки химических элементов. Таблица Д.И. Менделеева 1.2.1 2.1 Периодический закон и Периодическая система химических элементов Д.И. Менделеева Группы и периоды Периодической системы 1.1.1 1.1.3 2.1.1 Знать: химические символы, их названия и произношения, основные понятии П.С. Уметь: описывать форму ПСХЭ и положения химических элементов в таблице Д. И. Менделеева 4 Химические формулы. 1.6 Атомы и молекулы. 1.1.1 Знать определения понятные для партнера понятия Р - Принимают и сохраняют учебную задачу, учитывают выделенные учителем ориентиры действия в новом учебном материале в сотрудничестве с учителем. Л - Проявляют устойчивый учебно познавательный интерес к новым способам решения задач П - Ставят и формулируют цели и проблемы урока; КВладение монологической и диалогической формами речи Р - Принимают и сохраняют учебную задачу, учитывают выделенные учителем ориентиры действия в новом учебном материале в сотрудничестве с учителем. Л - Проявляют устойчивый учебно познавательный интерес к новым способам получения знаний П - Ставят и испарения воды, одеколона и этилового спирта с фильтровальной бумаги Демонстрации. Периодическая система химических элементов Д. И. Менделеева (различные формы) §5 §6 5 Относительная атомная и молекулярная массы. Массовая доля элемента в соединении 4.5.1 Химический элемент. Простые и сложные вещества. Вычисления массовой доли химического элемента в веществе 1.1.2 1.2.1 2.8.1 основных понятий. Уметь вычислять относительную молекулярную массу, массовую долю элементов в веществе, давать по плану описание вещества и выполнять расчеты по формуле Контрольная тестовая работа №1 1.6, 1.2, 1.2.1, 2.1, 4.5.1 Атомы и молекулы. Химический элемент. Простые и сложные вещества. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Группы и периоды Периодической системы. Вычисления массовой доли химического элемента в веществе 1.1.1 1.1.2 1.1.3 1.2.1 2.1.1 2.8.1 Знать определения основных понятий, химические символы, их названия и произношения, основные понятии П.С. Уметь: описывать форму ПСХЭ и положения химических элементов в таблице Д. И. Менделеева. Уметь вычислять относительную молекулярную массу, массовую долю элементов формулируют проблему урока, самостоятельно создают алгоритм деятельности при решении проблемы. К - Формулируют собственное мнение и позицию, задают вопросы, строят понятные для партнера понятия. Работают по плану. Р - Формируют ответственное отношение к учению, используя специально подобранные средства. Умеют оценить степень успеха или неуспеха своей деятельности. Л - Проявляют устойчивый учебнопознавательный интерес к новым способам решения задач П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Формулируют собственное мнение. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с в веществе 6 Основные сведения о строении атомов. Состав атомных ядер: протоны и нейтроны. Изотопы 1.2.1 7 Электроны. Строение электронных оболочек атомов элементов №1- 20 в таблице Д.И. Менделеева 1.1 1.2 1.2.1 поставленной задачей и условиями ее реализации Л-Выражают адекватное понимание причин успеха и неуспеха учебной деятельности Тема 1. АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (9 часов) Физический смысл 2.2.1 Знать определения П -Ставят и порядкового номера 2.2.2 основных понятий. формулируют химического элемента Уметь: использовать при проблему урока, характеристике атомов самостоятельно понятия: «протон», создают алгоритм «нейтрон», «электрон», деятельности при «химический элемент», решении проблемы. «массовое число», К - Отстаивать свою «изотоп» точку зрения, приводить аргументы, подтверждая их фактами. Различать в устной речи мнение, доказательства, гипотезы. Р - Формирование понятий о строении атома. Л - Формирование интереса к конкретному химическому элементу Строение атома. Строение 2.3.1 Знать определения П - Преобразовывать электронных оболочек 2.5.1 основных понятий. Уметь информацию из одного атомов первых 20 использовать при вида в другой, и элементов Периодической характеристике атомов выбирать для себя системы Д.И. Менделеева понятия: «электронный удобную форму Периодический закон и слой», «энергетический фиксации Периодическая система уровень». представления химических элементов Уметь характеризовать информации. Д.И. Менделеева Группы и химические элементы (от К - Договариваются о Демонстрации. Модели атомов химических элементов §7 §8 периоды Периодической системы. Физический смысл порядкового номера химического элемента 8 Металлические и неметаллические свойства элементов. Изменение свойств химических элементов по группам и периодам 1.2.2 Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева водорода до кальция) на основе их положения в Периодической системе химических элементов Д.И. Менделеева и особенностей строения их атомов 1.1.2 2.2.2 2.4.3 Знать определения основных понятий. Уметь использовать при характеристике атомов понятия: «элементыметаллы», «элементынеметаллы»; при характеристике веществ понятия «ионная связь», «ионы» совместной деятельности, приходят к общему решению, в том числе и столкновению интересов. Р - Учитывают правило в планировании и контроле способа решения, осуществляют пошаговый контроль Л - Определяют свою личную позицию; адекватную дифференцированную самооценку успехов в учебе своих партнеров П - Выбирать основания и критерии для классификации. К - Отстаивать свою точку зрения, приводить аргументы, подтверждая их фактами. Различать в устной речи мнение, доказательства, гипотезы, теории. РПринимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Проявляют устойчивый учебно- §9, 10 9 Ионная химическая связь 1.2.2 1.3 Строение веществ. Химическая связь-ионная Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева 1.1.2 2.2.2 2.4.3 Знать определения основных понятий. Уметь использовать при характеристике веществ понятия: «элементынеметаллы металлы», «ионы», «ионная связь» 10 Ковалентная неполярная химическая связь 1.2.2 1.3 Строение веществ. Химическая связьковалентная неполярная Закономерности изменения свойств элементов и их соединений в связи с положением в 1.1.2 2.2.2 2.4.3 Знать определения К.Н.С., механизм ее образования. Уметь определять И.С. и К.Н.С, связь в различных веществах, составлять схему образования молекул с различным видом связи познавательный интерес к новым способам получения знаний П - Самостоятельно создают алгоритм деятельности при решении проблем различного характера основных понятий. К - Отстаивать свою точку зрения, приводить аргументы, подтверждая их фактами. Различать в устной речи мнение, доказательства, гипотезы, теории. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Проявляют устойчивый учебнопознавательный интерес к новым способам получения знаний П - Самостоятельно создают алгоритм деятельности при решении проблем различного характера основных понятий. К - Отстаивать свою точку зрения, §10 §11 Периодической системе химических элементов Д.И. Менделеева 11 Электроотрицательность. Ковалентная полярная химическая связь 1.2.2 1.3 Строение веществ. Химическая связь: ковалентная полярная. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева 1.1.2 2.2.2 2.4.3 Знать определения «ковалентная полярная связь», «электроотрицательность», «валентность», механизм образования ковалентнополярной связи. Уметь определять виды химических связей, записывать схемы образования ковалентной полярной связи приводить аргументы, подтверждая их фактами. Различать в устной речи мнение, доказательства, гипотезы, теории. Р -Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Проявляют устойчивый учебнопознавательный интерес к новым способам получения знаний П - Самостоятельно создают алгоритм деятельности при решении проблем различного характера основных понятий. К - Отстаивать свою точку зрения, приводить аргументы, подтверждая их фактами. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации Л - Определяют Лабораторные опыты. Изготовление моделей молекул бинарных соединений §12 12 Металлическая химическая связь. 1.2.2 1.3 Строение веществ. Химическая связь: металлическая. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева 1.1.2 2.2.2 2.4.3 Знать определения металлической связи, механизм образования металлической связи. Уметь определять виды химических связей, записывать схемы образования МЕ-связи, устанавливать причинноследственные связи: состав вещества - вид химической связи 13 Обобщение и систематизация знаний по теме «Атомы химических элементов» 1.1 1.2 1.3 1.2.1 Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической 1.1.2 2.2.1 2.2.2 2.3.1 Знать электроннографические схемы строения атомов элементов 1-20 ПСХЭ. свою личную позицию; адекватную дифференцированную самооценку успехов в учебе своих партнеров П - Самостоятельно создают алгоритм деятельности при решении проблем различного характера основных понятий. Контролируют действия. К - Применяют необходимые коррективы после завершения действия на основе учета характера сделанных ошибок. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Определяют свою личную позицию; адекватную дифференцированную самооценку успехов в учебе своих партнеров П - Выбирают наиболее эффективные способы решения задач, контролируют и §13 § 7-13 1.2.2 14 Контрольная работа № 2 по теме «Атомы химических элементов» 1.1 1.3 1.2.1 1.2.2 системы Д.И. Менделеева Периодический закон и Периодическая система химических элементов Д.И. Менделеева Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева Периодический закон и Периодическая система химических элементов Д.И. Менделеева Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента Закономерности изменения свойств элементов и их соединений в связи с положением в 2.4.3 2.5.1 Уметь определять виды хим. связей, записывать схемы образования связи, устанавливать причинноследственные связи: состав вещества - вид химической связи оценивают процесс и результат. К - Формулируют собственное мнение. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации Л - Определяют свою личную позицию; адекватную дифференцированную самооценку успехов в учебе своих партнеров 1.1.2 2.2.1 2.2.2 2.3.1 2.4.3 2.5.1 Знать электроннографические схемы строения атомов элементов 1-20 ПСХЭ. Уметь определять виды хим. связей, записывать схемы образования связи, устанавливать причинноследственные связи: состав вещества - вид химической связи П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Формулируют собственное мнение. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации Л - Выражают адекватное понимание Периодической системе химических элементов Д.И. Менделеева Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая 15 Простые вещества – металлы 1.6 Атомы и молекулы. Химический элемент. Простые и сложные вещества 16 Простые вещества – неметаллы, их сравнение с металлами. Аллотропия 1.6 Атомы и молекулы. Химический элемент. Простые и сложные вещества причин успеха и неуспеха учебной деятельности Тема 2. ПРОСТЫЕ ВЕЩЕСТВА (6 часов) 2.4.4 Знать основные П - Умение работать с определения понятий. учебником, Уметь: использовать при дополнительной характеристике веществ литературой и понятия: «металлы», периодической «пластичность», «тепло- и системой. электропроводность» К - Умение сотрудничать с учителем в поиске и сборе информации, слушать его. Р - Формирование понятия о металлах, их свойствах Л - Овладение навыками для практической деятельности 2.4.4 Знать основные П - Умение работать с определения понятий. учебником, Уметь: использовать при дополнительной характеристике веществ литературой и понятия: «неметаллы», периодической «аллотропия», системой. «аллотропные К - Аргументируют видоизменения» свою позицию и координируют ее при помощи сотрудничества. Р - Формирование понятия о неметаллах, Лабораторные опыты. Ознакомление с коллекцией металлов §14 Демонстрации. Получение озона. Образцы белого и серого олова, белого и красного фосфора. Лабораторные опыты. 6. Ознакомление с коллекцией неметаллов §15 17 Количество вещества 1.6 4.5 Атомы и молекулы. Химический элемент. Простые и сложные вещества Проведение расчетов на основе формул 1.1.2 2.8.3 Знать основные определения понятий. Уметь проводить расчеты по формулам 18 Молярный объем газообразных веществ 1.6 4.5 Простые и сложные вещества Проведение расчетов на основе формул 1.1.2 2.8.3 Знать определения молярной массы. Уметь вычислять по формуле число моль по количеству структурных частиц аллотропии их свойствах Л - Овладение навыками для практической деятельности П - Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы. К - Аргументируют свою позицию и координируют ее при помощи сотрудничества. Р - Формирование понятия о количестве вещества. Л - Овладение навыками для практической деятельности П -Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения познавательных задач. Р - Формирование понятия о молярном Демонстрации. Некоторые металлы и неметаллы с количеством вещества 1 моль §16 Демонстрации. Молярный объем газообразных веществ §17 19 Решение задач с использованием понятий «количество вещества», «постоянная Авогадро», «молярный объем газов» 1.6 4.5 Простые и сложные вещества Проведение расчетов на основе формул 1.1.2 2.8.3 Знать определения. Уметь использовать при решении расчетных задач понятия: «количество вещества», «моль», «постоянная Авогадро», «молярная масса», «молярный объем газов», «Н.У» 20 Обобщение и систематизация знаний по теме «Простые вещества» 1.6 4.5 Простые и сложные вещества Проведение расчетов на основе формул 1.1.2 2.4.4 2.8.3 Знать определения. Уметь использовать при решении расчетных задач понятия: «количество вещества», «моль», «постоянная Авогадро», «молярная масса», «молярный объем газов», «Н.У» объеме газообразных веществ, о «нормальных условиях» Л - Овладение навыками для практической деятельности П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Оценивают правильность выполнения действия на уровне адекватной ретроспекивной оценки. Л - Овладение навыками для практической деятельности П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Формулируют собственное мнение. Задачи § 14-17 21 Степень окисления. Основы номенклатуры бинарных соединений 1.4 1.6 Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Определяют свою личную позицию; адекватную дифференцированную самооценку успехов в учебе своих партнеров Тема 3. СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (14 часов) Степень окисления 2.4.2 Знать определения П - Ставят и химических элементов 2.5.2 «степень окисления», формулируют Простые и сложные «валентность». Уметь проблему урока, вещества определять степень самостоятельно окисления по формуле и создают алгоритм составлять формулы по деятельности при степени окисления. Уметь решении проблемы. называть вещества К -Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Формирование §18 22 Важнейшие классы бинарных соединений: оксиды и летучие водородные соединения. 1.4 1.6 Степень окисления химических элементов Простые и сложные вещества 2.1.2 2.4.4 2.5.2 Знать определения оксидов. Уметь составлять формулы оксидов по валентности и степени окисления 23 Основания 1.4 1.6 4.2 Степень окисления химических элементов Простые и сложные вещества. Основные классы неорганических 2.1.2 2.4.4 2.5.2 2.7.4 Знать состав, определение оснований. Уметь составлять формулы оснований по валентности и степени готовности и способности к обучению и саморазвитию и самообразованию на основе мотивации к обучению и познанию П - Самостоятельно выделяют и формулируют познавательную цель, используя общие приемы решения задач. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формирование готовности и способности к обучению и саморазвитию и самообразованию на основе мотивации к обучению и познанию П - Самостоятельно выделяют и формулируют познавательную цель, используя общие Демонстрации. Образцы оксидов Лабораторные опыты. Ознакомление с коллекцией оксидов. Ознакомление со свойствами аммиака §19 Демонстрации. Образцы оснований Кислотнощелочные §20 веществ. Номенклатура неорганических соединений Определение характера среды раствора кислот и щелочей с помощью индикаторов 24 25 Кислоты 1.6 4.2 4.5 Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений Определение характера среды раствора кислот и щелочей с помощью индикаторов.. Проведение расчетов на основе формул окисления металлов, определять растворимые в воде основания с помощью индикаторов 1.1.2 2.1.2 2.4.4 2.5.2 2.7.4 Знать состав и определение кислот. Уметь составлять формулы кислот по валентности и степени окисления водорода, определять среду основания с помощью индикаторов. Производить расчеты, используя понятия-моль, молярная масса, молярный объем приемы решения задач по основаниям. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формирование готовности и способности к обучению и саморазвитию и самообразованию на основе мотивации к обучению и познанию П - Самостоятельно выделяют и формулируют познавательную цель, используя общие приемы решения задач по кислотам. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной индикаторы, изменение их окраски в различных средах. Универсальный индикатор и изменение его окраски в различных средах. Шкала pH. Лабораторные опыты. Качественная реакция на углекислый газ Демонстрации. Образцы кислот Кислотнощелочные индикаторы, изменение их окраски в различных средах. Универсальный индикатор и изменение его окраски в различных средах. Шкала pH. Лабораторные опыты. §21 26 27 Соли как производные кислот и оснований 1.4 1.6 4.5 Степень окисления химических элементов Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений Проведение расчетов на основе формул 1.1.2 2.1.2 2.4.4 2.5.2 Знать состав и определение солей. Уметь составлять формулы солей по степени окисления, определять среду солей с помощью индикаторов, давать название. Сравнивать по составу кислот и солей. Производить расчеты, используя понятия-моль, молярная масса, молярный объем задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формирование готовности и способности к обучению и саморазвитию и самообразованию на основе мотивации к обучению и познанию П - Самостоятельно выделяют и формулируют познавательную цель, используя общие приемы решения задач по солям. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формирование готовности и способности к обучению и саморазвитию и самообразованию на Определение pH растворов кислоты, щелочи и воды. Определение pH лимонного и яблочного соков на срезе плодов Демонстрации. Образцы солей Лабораторные опыты. Ознакомление с коллекцией солей §22 28 Аморфные и кристаллические вещества. 1.3 Строение веществ 2.3.2 2.4.3 Знать определения понятий «аморфные вещества», «кристаллические вещества», «кристаллические решетки», «ионная решетка», «атомная решетка», «молекулярная решетка», «металлическая решетка». Уметь давать характеристику атомных, молекулярных, ионных, металлических решеток. Определять типы кристаллических решеток по типу химической связей. описывать свойства 29 Чистые вещества и смеси. 1.5 4.1 4.5.2 Чистые вещества и смеси Разделение смесей и очистка веществ. Вычисления массовой доли растворенного вещества в растворе 2.8.2 Знать определение основных понятий, отличие чистого вещества от смеси. Уметь различать однородные и неоднородные смеси. Соблюдать правила по ТБ основе мотивации к обучению и познанию П - Выдвижение гипотез, их обоснование, доказательство. К -Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Формируют интерес к конкретному химическому веществу, поиск дополнительной информации о нем П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Планируют свои Демонстрации. Модели кристаллических решеток хлорида натрия, алмаза, оксида углерода (IV). Лабораторные опыты. Ознакомление с коллекцией веществ с разным типом кристаллической решетки. Изготовление моделей кристаллических решеток §23 Лабораторные опыты. Ознакомление с образцом горной породы §24 30 Массовая и объемная доли компонентов в смеси 1.5 4.1 4.5 4.5.2 Чистые вещества и смеси Разделение смесей и очистка веществ. Вычисления массовой доли растворенного вещества в растворе Проведение расчетов на основе формул 2.8.2 Знать определение основных понятий, отличие чистого вещества от смеси. Уметь различать однородные и неоднородные смеси. Соблюдать правила по ТБ 31 Расчеты, связанные с понятием «доля» 1.5 4.5 Чистые вещества и смеси Проведение расчетов на основе формул 2.8.2 Знать определение Растворимости, массовой доли растворенного вещества в растворе. Уметь вычислять массовую долю и массу в растворе. Используя основные понятия. «массовая доля действия в соответствии с поставленной задачей и условиями ее реализации. Л - Формируют умение использовать знания в быту П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Формируют умение использовать знания в быту П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат К - Участвуют в коллективном обсуждении проблем, §25 Задачи растворенного вещества», «объемная доля газообразного вещества» 32 Обобщение и систематизация знаний по теме «Соединения химических элементов» 1.3 1.4 1.5 1.6 4.1 4.2 4.5 4.5.2 Степень окисления химических элементов Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений Определение характера среды раствора кислот и щелочей с помощью индикаторов Строение веществ Чистые вещества и смеси Разделение смесей и очистка веществ. Вычисления массовой доли растворенного вещества в растворе Проведение расчетов на основе формул 1.1.2 2.1.2 2.5.2 2.3.2 2.4.3 2.4.4 2.7.4 2.8.2 Уметь выполнять задания по теме «Соединения химических элементов» проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Вносят необходимые коррективы после завершения действия на основе учета характера сделанных ошибок. Л - Вносят необходимые коррективы в действие после его завершения на основе его и учета характера сделанных ошибок П - Осуществляют поиск информации с использованием ресурсов библиотек и Интернета, создают модели и схемы для решения задач. К - Формулируют собственное мнение и позицию, аргументируют их, организуют и планируют учебное сотрудничество с учителем и сверстниками. Р - Ставят цель деятельности на основе поставленной проблемы и §§ 18-25 33 Контрольная работа № 3 по теме «Соединения химических элементов» 1.3 1.4 1.5 1.6 4.1 4.2 4.5 4.5.2 34 Физические явления. Разделение смесей 1.5 4.1 предлагают несколько способов её достижения. Л - Определяют свою личную позицию; адекватную дифференцированную самооценку успехов в учебе своих партнеров П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Формулируют собственное мнение. Р - Принимают и сохраняют учебную задачу, планируют свои действия в соответствии с поставленной задачей и условиями ее реализации. Л - Проявляют ответственность за результат Степень окисления 1.1.2 Представление химических элементов 2.1.2 информации по теме Простые и сложные 2.5.2 «Соединения химических вещества. Основные 2.3.2 элементов» в классы неорганических 2.4.3 виде выполнения веществ. Номенклатура 2.4.4 контрольного теста неорганических 2.7.4 соединений Определение 2.8.2 характера среды раствора кислот и щелочей с помощью индикаторов Строение веществ Чистые вещества и смеси Разделение смесей и очистка веществ. Вычисления массовой доли растворенного вещества в растворе Проведение расчетов на основе формул Тема 4. ИЗМЕНЕНИЯ, ПРОИСХОДЯЩИЕ С ВЕЩЕСТВАМИ (13 часов) Чистые вещества и смеси 1.2.1 Знать основные понятия. П - Выдвижение Разделение смесей и Уметь установление гипотез, их очистка веществ причинно-следственных обоснование, между физическими доказательство свойствами веществ и К - Участвуют в способом разделения коллективном смесей обсуждении проблем, проявляют активность во взаимодействии для Демонстрации. Примеры физических явлений: а) плавление парафина; б) возгонка иода; в) растворение окрашенных § 26 35 Химические явления. Условия и признаки протекания химических реакций 2.1 2.2 Химическая реакция. Условия и признаки протекания химических реакций Классификация химических реакций по различным признакам: поглощению и выделению энергии 2.4.5 Знать определения химических явлений, признаки химических реакций и условия их возникновения и течения. Уметь определять признаки химических реакций решения коммуникативных и познавательных задач. Р - Планируют свои действия в связи с поставленной задачей и условиями ее решения Л - Проявляют ответственность за результат П - Выдвижение гипотез, их обоснование, доказательство К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Планируют свои действия в связи с поставленной задачей и условиями ее решения. Л - Проявляют ответственность за результат солей; г) диффузия душистых веществ с горящей лампочки накаливания Демонстрации. Примеры химических явлений: а) горение магния, фосфора; б) взаимодействие соляной кислоты с мрамором или мелом; в) получение гидроксида меди(II); г) растворение полученного гидроксида в кислотах; д) взаимодействие оксида меди (II) с серной кислотой при нагревании; е) разложение перманганата калия; ж) разложение пероксида водорода с помощью диоксида марганца; з) взаимодействие § 27 разбавленных кислот с металлами 36 Закон сохранения массы веществ. Химические уравнения. 2.1 4.5 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях Проведение расчетов на основе формул и уравнений реакций 1.1.3 2.4.5 2.5.3 Знать определения закона сохранения массы веществ, химические уравнения. Уметь составлять уравнения химических реакций на основе закона сохранения массы веществ; производить расстановку коэффициентов 37 38 Расчеты по химическим уравнениям 4.5 4.5.3 Выполнение расчетов по химическим уравнениям. Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или 2.5.3 2.8.3 Уметь проводить расчеты по химическим уравнениям на нахождение количества, массы или объема продукта реакции по количеству, массе или объему исходного вещества; с П - Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формируют коммуникативный компонент в общении и сотрудничестве со сверстниками в процессе образовательной деятельности П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат. К - Участвуют в коллективном § 28 § 29 продуктов реакции 39 Реакция разложения. Понятие о скорости химической реакции и катализаторах 2.1 2.2 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях Классификация химических реакций по числу и составу исходных веществ использованием понятия «доля» 1.1.2 2.4.5 2.5.3 2.8.3 Знать определения реакций разложения, иметь понятие о скорости химической реакций. Уметь определять тип реакции. Составлять на основе текста схемы, в том числе с применением средств ИКТ обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формируют коммуникативный компонент в общении и сотрудничестве со сверстниками в процессе образовательной деятельности П - Ставят и формулируют цели и проблемы урока. К-Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формируют коммуникативный компонент в общении и § 30 40 Реакция соединения. Цепочки переходов 2.1 2.2 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях Классификация химических реакций по числу и составу исходных веществ 1.1.2 2.4.5 2.5.3 2.8.3 Знать определения понятий «реакции соединения», «каталитические реакции», «обратимые реакции» Уметь записывать, осуществлять «цепочку превращений», уметь проводить классификацию химических реакций по числу и составу исходных веществ и продуктов реакции; направлению протекания реакций; участию катализатора. Уметь проводить наблюдение и описание признаков и условий течения химических реакций, делать выводы на основании анализа наблюдений за экспериментом 41 Реакция замещения. Ряд активности металлов 2.1 2.2 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях Классификация химических реакций по числу и составу исходных 1.1.2 2.4.5 2.5.3 2.8.3 Знать определение понятия «реакция замещения», Уметь использовать электрохимический ряд напряжений (активности) написания химических уравнений реакций», уметь проводить классификацию сотрудничестве со сверстниками в процессе образовательной деятельности П - Ставят и формулируют цели и проблемы урока. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формируют коммуникативный компонент в общении и сотрудничестве со сверстниками в процессе образовательной деятельности П - Ставят и формулируют цели и проблемы урока. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и Лабораторные опыты. Прокаливание меди в пламени спиртовки § 31 Лабораторные опыты. Замещение меди в растворе хлорида меди (II) железом § 32 веществ 42 Реакция обмена 2.1 2.2 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях Классификация химических реакций по числу и составу исходных веществ химических реакций по числу и составу исходных веществ и продуктов реакции. Уметь проводить наблюдение и описание признаков и условий течения химических реакций, делать выводы на основании анализа наблюдений за экспериментом 1.1.2 2.4.5 2.5.3 2.8.3 Знать определения понятий «реакций обмена», «реакция нейтрализации». Уметь проводить классификацию химических реакций по числу и составу исходных веществ и продуктов реакции, использовать таблицу растворимости для определения возможности протекания реакций обмена Уметь проводить наблюдение и описание признаков и условий течения химических реакций, делать выводы на основании анализа наблюдений за экспериментом познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формируют коммуникативный компонент в общении и сотрудничестве со сверстниками в процессе образовательной деятельности П - Ставят и формулируют цели и проблемы урока. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Формируют коммуникативный компонент в общении и сотрудничестве со сверстниками в процессе образовательной деятельности § 33 43 Типы химических реакций на примере свойств воды. 2.1 2.2 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, поглощению и выделению энергии 1.1.2 2.4.5 2.5.3 2.8.3 Знать определения различных типов химических реакций, понятие «гидролиз». Уметь проводить классификацию химических реакций по числу и составу исходных веществ и продуктов реакции, поглощению и выделению энергии. Использовать таблицу растворимости 44 Обобщение и систематизация знаний по теме «Изменения, происходящие с веществами» 2.1 2.2 4.1 4.5 4.5.3 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, поглощению и выделению энергии. Проведение расчетов на основе формул и уравнений реакций. Вычисление количества 1.1.2 1.1.3 2.4.5 2.5.3 2.8.3 Знать определения различных типов химических реакций. Уметь проводить классификацию химических реакций по числу и составу исходных веществ и продуктов реакции, поглощению и выделению энергии. Использовать таблицу растворимости. Уметь вычислять количество вещества, объем или массу вещества по количеству вещества, объему или массе реагентов или продуктов П - Ставят и формулируют цели и проблемы урока. К - Участвуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач. Р - Постановка учебной задачи на основе соотнесения того, что известно и усвоено, и того, что еще неизвестно. Л - Выражают адекватное понимание причин успеха и неуспеха учебной деятельности П - Осуществляют поиск информации с использованием ресурсов библиотек и Интернета, создают модели и схемы для решения задач. К - Формулируют собственное мнение и позицию, аргументируют их, организуют и планируют учебное сотрудничество с учителем и сверстниками. Р - Ставят цель деятельности на основе § 34 § 26-34 вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции 45 Контрольная работа № 4 по теме «Изменения, происходящие с веществами» 2.1 2.2 4.1 4.5 4.5.3 46 Практическая работа №1 «Правила техники безопасности при работе 4.4.1 Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, поглощению и выделению энергии. Проведение расчетов на основе формул и уравнений реакций. Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции реакции Уметь представлять информацию по теме в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ поставленной проблемы и предлагают несколько способов её достижения. Л - Определяют свою личную позицию; адекватную, дифференцированную самооценку успехов в учебе своих партнеров П - Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процессии результат. К – Учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве. Р - Осуществляют итоговый и пошаговый контроль по результату. Л - Проявляют ответственность за результат Знать определения различных типов химических реакций. Уметь проводить классификацию химических реакций по числу и составу исходных веществ и продуктов реакции, поглощению и выделению энергии. Использовать таблицу растворимости. Уметь вычислять количество вещества, объем или массу вещества по количеству вещества, объему или массе реагентов или продуктов реакции Уметь представлять информацию по теме в виде таблиц, схем, опорного конспекта, в том числе с применением средств ИКТ Тема 5. ПРАКТИКУМ 1 «ПРОСТЕЙШИЕ ОПЕРАЦИИ С ВЕЩЕСТВАМИ» (3 часа) Правила техники 2.2.6 Уметь работать с П - Самостоятельно Практическая безопасности при работе в лабораторным выделяют и работа химическом кабинете. оборудованием и формулируют 1.1.2 1.1.3 2.4.5 2.5.3 2.8.3 Пр. работа №1 в химической лаборатории. Приёмы обращения с лабораторным оборудованием» Приемы обращения с лабораторным оборудованием и нагревательными приборами нагревательными приборами в соответствии с правилами техники безопасности. Уметь проводить наблюдения за свойствами веществ и явлений, происходящими с веществами. Описание химического эксперимента с помощью русского языка и языка химии. Составление выводов по результатам проведенного эксперимента 47 Практическая работа №2 «Признаки химической реакции» 4.4.1 Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами 2.2.6 Знать правила работы в химическом кабинете. Уметь наблюдать за свойствами веществ и явлениями, происходящими с веществами. Описание химического эксперимента с помощью русского языка и языка химии. Составление выводов по результатам проведенного эксперимента 48 Практическая работа № 3 «Приготовление раствора сахара и определение массовой доли его в растворе.» 4.4.1 4.5.2 Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным 2.2.6 2.8.2 Знать правила работы в химическом кабинете. Уметь наблюдать за свойствами веществ и явлениями, познавательную цель, используют общие приемы решения работы. К - Формирование умения работать индивидуально и в парах, сотрудничать с учителем. Р - Формирование навыков. Л - Формирование умения интегрировать и использовать знания о лабораторной посуде, приемов работы с нагревательными приборами в повседневной жизни П - Проводят сравнение и классификацию по заданным критериям. К - Договариваются о совместных действиях в различных ситуациях. Р - Выполнение простейших приемов обращения с лабораторным оборудованием Л - Овладение навыками практической деятельности П - Самостоятельно выделяют и формулируют познавательную цель, используют общие Практическая работа Пр. работа №4 Практическая работа Пр. работа №5 оборудованием и нагревательными приборами. Приготовление растворов Вычисления массовой доли растворенного вещества в растворе 49 Растворение как физикохимический процесс. Растворимость. Типы растворов. 50 Электролитическая диссоциация происходящими с веществами. Описание химического эксперимента с помощью русского языка и языка химии. Составление выводов по результатам проведенного эксперимента приемы решения работы. К - Формирование умения работать индивидуально и в парах, сотрудничать с учителем. Р - Формирование навыков. Л - Овладение навыками практической деятельности ТЕМА № 6 «РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ» (18 часов) 1.5 Чистые вещества и смеси 1.1.2 Знать определения П - Выдвижение 4.1 Приготовление растворов 2.8.2 понятий: раствор, гидрат, гипотез, их кристаллогидрат, обоснование, насыщенные, доказательство ненасыщенные, К - Формирование пересыщенные растворы, умения работать растворимость индивидуально и в Уметь парах, сотрудничать с Определять растворимость учителем. веществ с использованием Р - Планируют свои таблицы растворимости действия в соответствии с поставленной задачей и условиями ее реализации. Л - Овладение навыками практической деятельности. 2.3 Электролиты и 1.1.2 Знать основные понятия П - Ставят и Демонстрации. неэлектролиты. темы «Электролитическая формулируют цели и Испытание диссоциация» проблемы урока веществ и их Уметь: использовать при и условиями ее растворов на характеристике решения электропроводпревращений веществ К - Формирование ность понятия: «раствор», умения работать § 35 § 36 «электролитическая диссоциация», «электролиты», «неэлектролиты», «степень диссоциации», «сильные электролиты», «слабые электролиты» индивидуально и в парах, сотрудничать с учителем. Р - Различают способ и результат действия. Л - Овладение навыками практической деятельности П - Ставят и формулируют цели и проблемы урока и условиями ее решения. К - Адекватно используют речевые средства для эффективного решения коммуникативных задач. Р - Различают способ и результат действия. Л - Овладение навыками практической деятельности П - Владеют общим приемом решения задач. К - Адекватно используют речевые средства для эффективного решения коммуникативных задач. Р - Различают способ и результат действия. Л - Овладение навыками 51 Основные положения теории электролитической диссоциации. 2.3 2.4 Электролиты и неэлектролиты Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних) 1.1.2 2.2.3 Знать определения понятий: «ион», «катион», «анион», «кислота», «основание», «соль» в свете ТЭД. Уметь записывать уравнения диссоциации кислот, оснований, солей 52 Ионные уравнения 2.5 Реакции ионного обмена и условия их осуществления 2.2.3 2.4.5 2.4.6 2.5.3 Знать определение «реакции ионного обмена», условия, при которых реакции ионного обмена идут до конца. Уметь составлять, молекулярные, полные и сокращенные ионные, уравнения реакции, объяснять их сущность в свете ТЭД. Уметь выполнять Демонстрации. Зависимость электропроводнос ти уксусной кислоты от концентрации. Движение окрашенных ионов в электрическом поле § 37 Лабораторные опыты. Взаимодействие растворов хлорида натрия и нитрата серебра. Получение не растворимого гидроксида и взаимодействие его с кислотами § 38 53 54 Кислоты: классификация и свойства в свете ТЭД 1.6 2.5 3.2.3 Основные классы неорганических веществ. Номенклатура неорганических соединений Реакции ионного обмена и условия их осуществления. Химические свойства кислот 2.1.2 2.2.3 2.4.5 2.4.6 2.5.3 2.7.1 2.9.1 55 56 Основания: классификация и свойства в свете ТЭД. 1.6 2.5 3.2 Основные классы неорганических веществ. Номенклатура неорганических соединений Реакции ионного обмена и условия их осуществления. Химические свойства оснований 2.1.2 2.2.3 2.4.5 2.4.6 2.5.3 2.7.1 2.9.1 лабораторные опыты по проведению реакций ионного обмена Знать определение понятия «кислота». Уметь составлять характеристику общих химических свойств кислот с позиций ТЭД: составлять молекулярные, полные и сокращенные ионные уравнения с участием кислот. Уметь проводить наблюдение и описание реакций с участием кислот с помощью русского языка и языка химии. Уметь проводить опыты, подтверждающие химические свойства кислот, с соблюдением правил техники безопасности Знать определение «основания» в свете ТЭД, классификацию оснований. Уметь записывать уравнения реакций, отражающие химические свойства оснований. Составлять молекулярные, полные и сокращенные ионные уравнения реакций с участием оснований. Уметь проводить опыты, подтверждающие химические свойства щелочей и нерастворимых практической деятельности П - Владеют общим приемом решения задач. К - Адекватно используют речевые средства для эффективного решения коммуникативных задач. Р - Различают способ и результат действия. Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки Лабораторные опыты. Взаимодействие кислот с основаниями. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с металлами. Взаимодействие кислот с солями § 39 П - Владеют общим приемом решения задач. К - Адекватно используют речевые средства для эффективного решения коммуникативных задач. Р - Различают способ и результат действия. Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки Лабораторные опыты. Взаимодействие щелочей с кислотами. Взаимодействие щелочей с оксидами неметаллов. Взаимодействие щелочей с солями. Получение и свойства нерастворимых оснований. §40 57 58 Оксиды: классификация и свойства 1.6 2.5 3.2 Основные классы неорганических веществ. Номенклатура неорганических соединений Реакции ионного обмена и условия их осуществления. Химические свойства оксидов 2.1.2 2.2.3 2.4.5 2.4.6 2.5.3 2.7.1 59 60 Соли: классификация и свойства в свете ТЭД 1.6 2.5 3.2 4.4 Основные классы неорганических веществ. Номенклатура неорганических соединений Реакции ионного обмена и условия их осуществления. Химические свойства солей. Получение и изучение свойств изученных классов неорганических веществ 2.1.2 2.2.3 2.4.5 2.4.6 2.5.3 2.7.1 оснований с соблюдением правил техники безопасности Знать определения понятий «несолеобразующие оксиды», «солеобразующие оксиды», «основные оксиды», «кислотные оксиды». Уметь составлять характеристику общих химических свойств оксидов (основных и кислотных оксидов) с позиций ТЭД. Уметь составлять молекулярные, полные и сокращенные ионных уравнений с участием оксидов; проводить опыты, подтверждающие химические свойства оксидов, с соблюдением правил техники безопасности Знать определения понятий «средние соли», «кислые соли», «основные соли». Уметь составлять характеристику общих химических свойств солей с позиций ТЭД. Уметь составлять молекулярные, полные и сокращенные ионных уравнений с участием солей; проводить опыты, подтверждающие П - Владеют общим приемом решения задач. К - Адекватно используют речевые средства для эффективного решения коммуникативных задач. Р - Различают способ и результат действия. Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки Лабораторные опыты. Взаимодействие основных оксидов с кислотами. Взаимодействие основных оксидов с водой. Взаимодействие кислотных оксидов со щелочами. Взаимодействие кислотных оксидов с водой §41 П - Владеют общим приемом решения задач. К - Адекватно используют речевые средства для эффективного решения коммуникативных задач. Р - Различают способ и результат действия. Л - Имеют целостное мировоззрение, Лабораторные опыты. Взаимодействие солей с кислотами. Взаимодействие солей со щелочами. Взаимодействие солей с солями. Взаимодействие растворов солей с металлами. §42 61 Генетическая связь между классами неорганических веществ. 3.2 3.3 4.4 Химические свойства сложных веществ Взаимосвязь различных классов неорганических веществ Получение и изучение свойств изученных классов неорганических веществ 2.3.2 2.3.3 2.4.4 2.5.3 62 Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов» 2.3 2.4 2.5 3.2 3.2.3 3.3 4.4 Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних). Реакции ионного обмена и условия их осуществления. Химические свойства классов неорганических соединений. Взаимосвязь различных классов неорганических веществ Получение и изучение свойств изученных классов 1.1.2 1.2.1 2.2.3 2.3.2 2.3.3 2.4.6 2.5.2 2.5.3 2.8.2 2.8.3 химические свойства солей с соблюдением правил техники безопасности Знать определение понятия «генетический ряд». Иллюстрировать: а) примерами основных положений теории; б) генетическую взаимосвязь между веществами (простое вещество – оксид – гидроксид – соль). Уметь составлять молекулярные, полные и сокращенные ионные уравнения с участием электролитов; уравнений реакций, соответствующих последовательности превращений неорганических веществ различных классов. Уметь применять полученные знания, информацию и умения при характеристике состава и свойств кислот, оснований. солей в свете ТЭД соответствующее современному уровню развития науки П - Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы. К - Планируют свои действия в связи с поставленной задачей и условиями ее решения. Р - Различают способ и результат действия. Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки §43 П - Осуществляют поиск информации с использованием ресурсов библиотек и Интернета, создают модели и схемы для решения задач. К - Формулируют собственное мнение и позицию, аргументируют их, организуют и планируют учебное сотрудничество с учителем и сверстниками. Р - Ставят цель § 35-43 неорганических веществ 63 Контрольная работа №5 «Растворение. Растворы. Свойства растворов электролитов» 2.3 2.4 2.5 3.2 3.2.3 3.3 4.4 Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних). Реакции ионного обмена и условия их осуществления. Химические свойства классов неорганических соединений. Взаимосвязь различных классов неорганических веществ. Получение и изучение свойств изученных классов неорганических веществ 1.1.2 1.2.1 2.2.3 2.3.2 2.3.3 2.4.6 2.5.2 2.5.3 2.8.2 2.8.3 Уметь применять полученные знания, информацию и умения при характеристике состава и свойств кислот, оснований. солей в свете ТЭД деятельности на основе поставлен ной проблемы и предлагают несколько способов её достижения. Л - Определяют свою личную позицию; адекватную, дифференцированную самооценку успехов в учебе своих партнеров П - Осуществляют поиск информации с использованием ресурсов библиотек и Интернета, создают модели и схемы для решения задач. К - Формулируют собственное мнение и позицию, аргументируют их, организуют и планируют учебное сотрудничество с учителем и сверстниками. Р - Ставят цель деятельности на основе поставлен ной проблемы и предлагают несколько способов её достижения. Л - Определяют свою личную позицию; адекватную, дифференцированную самооценку успехов в 64 Окислительновосстановительные реакции 2.2 2.6 Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов Окислительновосстановительные реакции. Окислитель и восстановитель 1.1.2 2.4.2 2.4.5 2.5.3 Знать определения понятий «окислительновосстановительные реакции. Окислитель и восстановитель» «окисление», «восстановление». Классифицировать химические реакции по признаку изменения степени окисления элементов. Уметь определять окислитель, восстановитель, процессы окисления и восстановления. Уметь определять степень окисления элемента в соединении, составлять уравнения химических реакций и электронный баланс 65 Свойства изученных классов в свете окислительновосстановительных реакций 2.2 2.6 3.2 Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов Окислительновосстановительные реакции. Окислитель и восстановитель. Химические свойства сложных веществ 1.1.2 2.4.2 2.4.5 2.5.3 Уметь определять окислитель, восстановитель, процессы окисления и восстановления. Уметь определять степень окисления элемента в соединении, составлять уравнения химических реакций и электронный баланс учебе своих партнеров П - Самостоятельно выделяют и формулируют познавательную цель, используют общие приемы решения задач. К - Проявляют активность во взаимодействии для решения познавательных и коммуникативных задач (задают вопросы, формулируют свои затруднения, предлагают помощь в сотрудничестве. Р - Осуществляют пошаговый контроль по результату. Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки П - Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы. К - Планируют свои действия в связи с поставленной задачей и условиями ее решения. Р - Осуществляют пошаговый контроль по результату §44 Демонстрации. Взаимодействие цинка с серой, соляной кислотой, хлоридом меди (II). Горение магния §44 66 Обобщение и систематизация знаний по теме «Окислительновосстановительные реакции» 2.2 2.6 3.2 67 Решение экспериментальных задач 4.1 4.2 Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов. Окислительновосстановительные реакции. Окислитель и восстановитель. Химические свойства сложных веществ 1.1.2 2.4.2 2.4.5 2.5.3 Знать определения понятий «окислительновосстановительные реакции. Окислитель и восстановитель» «окисление», «восстановление». Классифицировать химические реакции по признаку изменения степени окисления элементов. Уметь определять окислитель, восстановитель, процессы окисления и восстановления. Уметь определять степень окисления элемента в соединении, составлять уравнения химических реакций и электронный баланс Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки П - Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы. К - Контролируют действия необходимые коррективы в действие после его завершения на основе его и учета характера сделанных ошибок Р - Осуществляют пошаговый контроль по результату Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки Тема 7. ПРАКТИКУМ 2 «СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ» (1 час) Правила безопасной 2.7.1 Уметь обращаться с П - Владеют общим работы в школьной 2.7.5 лабораторным приемом решения лаборатории. 2.9.1 оборудованием в задач. Лабораторная посуда и соответствии с правилами К - Аргументируют оборудование. техники безопасности; свою позицию и Определение характера Проводить опыты на координируют ее с среды раствора кислот и распознавание некоторых позиции партнеров в щелочей с помощью катионов и анионов; сотрудничестве. индикаторов. наблюдение свойств Р - Осуществляют Качественные реакции на веществ и происходящих с пошаговый контроль §44, записи Практическая работа Пр. работа №9 ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония) 68 Контрольная работа №6. Итоговая работа за год 1.1 1.3 1.4 1.5 1.6 2.1 2.2 2.4 2.5 3.2 3.3 4.5.3 Строение электронных оболочек атома первых 20 элементов Периодической системы Д. И. Менделеева. Строение веществ. Химическая связь. Валентность химических элементов, степень их окисления. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Атомы и молекулы. Простые и сложные вещества. Классификация химических реакций по различным признакам. Катионы и анионы. Химические свойства сложных веществ. Проведение расчетов на основе формул и уравнений реакций ними явлений; описание и формулирование вывода химического эксперимента с помощью русского языка и языка химии 1.1.2 1.2.1 2.2.3 2.3.2 2.3.3 2.4.6 2.5.2 2.5.3 2.8.2 2.8.3 Знать определения различных типов химических реакций. Уметь проводить классификацию химических реакций по числу и составу исходных веществ и продуктов реакции, поглощению и выделению энергии. Использовать таблицу. Уметь применять полученные знания, информацию и умения при характеристике состава и свойств кислот, оснований, солей в свете ТЭД по результату Л - Имеют целостное мировоззрение, соответствующее современному уровню развития науки П - Осуществляют поиск информации с использованием ресурсов библиотек и Интернета, создают модели и схемы для решения задач. К - Формулируют собственное мнение и позицию, аргументируют их, организуют и планируют учебное сотрудничество с учителем и сверстниками. Р - Ставят цель деятельности на основе поставлен ной проблемы и предлагают несколько способов её достижения. Л - Определяют свою личную позицию; адекватную, дифференцированную самооценку успехов в учебе своих партнеров