13x790
реклама

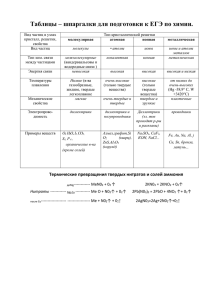
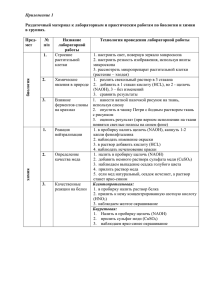
ГБОУ ВПО «Красноярский государственный медицинский университет имени профессора В.Ф.Войно-Ясенецкого» Фармацевтический колледж Творческое задание Команда "The Chemical Friends" Игровой номер 13x790 Красноярск 2013 Теоретическая часть В пронумерованных пробирках (1, 2, 3 и т.д.) находятся вещества набора Б: • сорбит • карбонат натрия • глюкоза • мочевина • сульфат аммония • янтарная кислота РЕАКТИВЫ: раствор NaOH (конц.), раствор HCl (разб.), раствор Pb(NO3)2, раствор CuSO4, раствор AgNO3, бромная вода, индикаторная бумага Таблица исследования Реактивы (из предложенных) № пробирок с неизвестными веществами Набор Б р-р NaOH (конц.) р-р CuSO4 р-р HCl (разб.) р-р индикаторная AgNO3 бумага Ярко-синее окрашивание Сорбит 1. 2. Вывод Выделение углекислого газа («вскипание») 1. C6H14O6 + Сu(OH)2 = C6H12O6(Cu) + 2H2O 2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 Карбонат натрия продолжение № пробирок с неизвестными веществами. Набор Б 3. Реактивы (из предложенных) р-р NaOH р-р (конц.) CuSO4 • Ярко-синий раствор (на холоду) • Кирпичнокрасный осадок ( при t0 ) р-р HCl (разб.) р-р AgNO3 индикаторная бумага Вывод «Серебряное зеркало» ( NH3,при t0 ) Фиолетовое окрашивание 4. Глюкоза Мочевина 3. C6H12O6 + Сu(OH)2 = C6H10O6(Cu) + 2H2O NH3 t0 C6H12O6 + Ag2O = C6H12O7 + 2Ag 4. NH2 – CO – NH2 + NH2 – CO – NH2 = NH2 – CO – NH – CO – NH2 + NH3 продолжение № пробирок с неизвестными веществами Реактивы (из предложенных) Набор Б Р-р NaOH (конц.) 5. Выделение аммиака (при t0 ) р-р р-р р-р индикатор CuSO4 HCl (разб.) AgNO3 ная бумага Вывод Сульфат аммония Красный цвет 6. t0 5. (NH4)2SO4 + 2NaOH = 2NH3 + 2H2O + Na2SO4 6. НООС-СН2-СН2-СООН ↔ -ООС-СН2-СН2-СОО- + 2Н+ Янтарная кислота А теперь приступаем к эксперименту…. Экспериментальная часть В пронумерованных пробирках (1, 2, 3) находятся вещества: глюкоза, щавелевая кислота, гидроксид натрия. РЕАКТИВЫ: раствор NaOH (конц.), раствор CaCl2, раствор CuSO4, индикаторная бумага. Эксперимент по определению веществ 1. Определение гидроксида натрия Универсальный индикатор стал синий, значит в пробирке №1 находится щелочь NaOH NaOH ↔ Na+ + OH- 2. Определение щавелевой кислоты H2C2O4 + CaCl2 = CaC2O4↓+ 2HCl При добавлении раствора хлорида кальция выпал белый осадок, значит в пробирке №2 - раствор щавелевой кислоты 3. Определение глюкозы В пробирке № 3 – раствор глюкозы → Таблица исследования № пробирок Набор Г 1. Реактивы Выводы Р-р NaOH индикаторная (конц.) Р-р CuSO4 Р-р CaCl2 бумага Ярко-синий раствор (на холоду) Кирпично-красный осадок (при нагревании) Щавелевая Кислота 2. Белый осадок 3. Глюкоза Синий цвет Гидроксид натрия Педагогическая часть ЗАДАНИЕ В пробирках под номерами находятся щавелевая кислота и салициловая кислота. Подберите необходимые реактивы для их распознавания. Проведите эксперимент по распознаванию кислот, напишите соответствующие уравнения химических реакций. РЕАКТИВЫ: раствор NaOH (конц.), раствор FeCl3, раствор CuSO4 №№ пробирки с Необходимые реактивы двумя известными веществами Р-р NaOH (не подписанные) (конц.) Р-р CuSO4 Р-р CaCl2 Ярко-синий раствор (название распознанного вещества в пробирке) Салициловая кислота 1. 2. Вывод Белый осадок Щавелевая кислота Мои студенты показали себя настоящими экспериментаторами! Знание качественных реакций на определение веществ для них очень важно, так как они готовятся к профессии фармацевта. Для определения ребята выбрали две органические кислоты: щавелевую и салициловую и предложили их для качественного анализа студентам 100/1 группы. На занятии ребята должны были изучить физические свойства кислот, их медико-биологическое значение и провести качественные реакции. Справились все – МОЛОДЦЫ! Преподаватель химии Ростовцева Лидия Вениаминовна