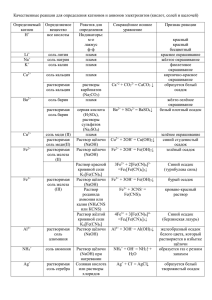
04 ЛС Ca, Mg, Ba, Zn, Hg, Ag, Cu, Fe
реклама

Лекция № 4 Тема: Неорганические лекарственные препараты Кальция, Магния, Бария, Цинка, Купрума, Аргентума, Меркурия, Феррума Доц. Яворская Л.П. План 1. Неорганические лекарственные препараты Кальция: кальция хлорид гексагидрат, кальция хлорид дигидрат. 2. Неорганические лекарственные средства Магния: магния оксид тяжелый, магния оксид легкий, магния карбонат тяжелый, магния карбонат легкий, магния сульфат гептагидрат, магния хлорид гексагидрат. 3. Неорганические препараты Бария: бария сульфат (бария сульфат для рентгеноскопии). 4. Неорганические лекарственные препараты Цинка: цинка оксид, цинка сульфат гептагидрат, цинка хлорид. 5. Неорганические лекарственные средства Купрума: купрума сульфат безводный, купрума сульфат пентагидрат. 6. Неорганические лекарственные препараты Меркурия: меркурия(ІІ) хлорид (ртути хлорид) , меркурия(ІІ) оксид (ртути окись желтая). 7. Неорганические препараты Аргентума: аргентума нитрат, протаргол, колларгол. 8. Неорганические препараты Феррума: феррума(ІІ) сульфат гептагидрат и Неорганические препараты Кальция Распространение в природе. В свободном виде Кальций не встречается из-за высокой химической активности. Соединения Кальция широко распространены в неживой и живой природе. 1. Минералы: а) карбонаты: СаСО3 – кальцит (залежи мела, известняка, мрамора); б) сульфаты: СаSО42Н2O – гипс, СаSО4 – ангидрит; в) фосфаты: 3Са3(РО4)2Са(ОН)2 – фосфориты, 3Са3(РО4)2СаF2 – фтораппатиты; г) флюориды: CaF2 – флюорид или плавиковый шпат. Чаще всего как источник для получения препаратов Кальция используют мрамор СаСО3 как самый чистый, свободный от примесей материал. 2. Живые организмы. Кальций относится к макроэлементам. В виде Са3(РО4)2 Кальций входит в состав костей, зубной ткани, мышц, нервной ткани, крови. Биологическое действие и медицинское 2+ применение. Ионы Кальция Са необходимы для формирования костной и зубной тканей; они усиливают жизнедеятельность клеток; способствуют сокращению скелетных мышц и мышц сердца; необходимы для улучшения свертывания крови. В качестве медицинских препаратов используют такие соединения Кальция. 1. Кальция оксид (жженная известь) (Calcii oxydum) CaO, используемый для приготовления известковой воды (Aqua calcis), которая применяется как легкое основание в разведении 1:700 (0,15–0,17% Са(ОН)2). В смеси с маслами применяют для смазывания ожогов. 2. Гипс медицинский (Calcii sulfas) 2СаSО4Н2O применяют в хирургической практике для наложения гипсовых повязок, в ортопедической стаматологии для снятия зубных отпечатков. 3. Кальция карбонат осажденный (Calcii carbonas praecipitatus) СаСО3 входит в состав зубных порошков, принимают орально при повышенной кислотности желудочного сока. 4. Кальция хлорид кристаллический – см. ниже. 5. Органические препараты Кальция (кальция лактат, кальция глюконат, кальция глицерофосфат) будут рассматриваться в дальнейшем. Кальция хлорид гексагидрат ГФУ, дополн. 1 Calcii chloridum hexahydricum CaCl26H2O М.м. = 219,08 г/моль CALCIUM CHLORIDE HEXAHYDRATE Calcium chloratum 97,0– 103,0% CaCl26H2O Химическое название: кальций хлорид гексагидрат Кальция хлорид дигидрат ГФУ, дополн. 1 Calcii chloridum dihydricum CaCl22H2O М.м. = 147,0 г/моль CALCIUM CHLORIDE DIHYDRATE Calcium chloratum 97,0– 103,0% CaCl22H2O Химическое название: кальций хлорид дигидрат Получение 1. Обработка мрамора CaCO3 хлоридной кислотой HCl: CaCO3 + 2HCl = CaCl2 + CO2 + H2O Полученный раствор концентрируют и очищают CaCl2 от примесей. Природный минерал мрамор CaCO3 может содержать примеси Fe2+ и Mg2+, которые под действием кислоты HCl превращаются в хлориды FeCl2 и MgCl2. С целью их устранения раствор насыщают хлором Cl2 (при этом FeCl2 окисляется в FeCl3), а затем осаждают образовавшиеся FeCl3 и MgCl2 гашенной известью Ca(OH)2: 2FeCl3 + 3Ca(OH)2 = Fe(OH)3 + 3CaCl2 MgCl2 + Ca(OH)2 = Mg(OH)2 + CaCl2 Раствор обогащается CaCl2, а осадки гидроксидов Fe(OH)3 и Mg(OH)2 отфильтровывают. Избыток Ca(OH)2 удаляют путем взаимодействия с хлоридной кислотой HCl: Ca(OH)2 + 2HCl = CaCl2 + 2H2O При этом выкристаллизовывается кальций хлорид гексагидрат CaCl26H2O. 2. Из растворов, которые образуются как отходы при получении соды по методу Сольве (CaCl2 – единственный побочный продукт в этом методе). Свойства Описание. CaCl26H2O. Кристаллическая масса белого цвета или бесцветные кристаллы. CaCl22H2O. Кристаллический порошок белого цвета. Гигроскопичен. ГФ Х (CaCl26H2O). Бесцветные прозрачные кристаллы без запаха, горько-соленого вкуса. Очень гигроскопичен, на воздухе отсыревает. При 34 С плавится в своей кристаллизационной воде. При температуре около 200 С теряет часть кристаллизационной воды и превращается в CaCl22H2O (пористые, очень легкие куски; применяется для высушивания газов). При 800 С теряет всю кристаллизационную воду и становится безводным. Безводный CaCl2 используется для высушивания жидкостей (кроме эфира и этанола, с которыми реагирует с образованием CaCl23С2Н5ОН). Плавится при температуре 772 С. С парами аммиака образует соединение CaCl28NH3. Растворимость. CaCl26H2O. Очень легко растворим в воде Р, легко растворим в 96% спирте Р. (Замерзает при температуре около 29 С). CaCl22H2O. Легко растворим в воде Р, растворим в 96% спирте Р. ГФ Х (CaCl26H2O). Очень легко растворим в воде, вызывая при этом сильное охлаждение; легко растворим в 95% спирте (отличие от многих неорганических солей). На воздухе поглощает влагу и расплывается. Водные растворы имеют нейтральную реакцию (соль, образованная катионом сильного основания и анионом сильной кислоты не гидролизирует). Из-за большой гигроскопичности в аптеках готовят 50%ный раствор (Calcium chloratum solutum 50%), и из этого концентрата готовят необходимые лекарства, содержащие кальция хлорид. Идентификация 1. Реакции на ионы Кальция Са2+ (см. хлорная известь, лекция № 1): а) ГФУ: взаимодействие со спиртовым раствором глиоксальгидроксианила в щелочной среде в присутствии хлороформа; хлороформный слой окрашивается в красный цвет за счет образования внутрикомплексного соединения с Кальцием, которое экстрагируется хлороформом: OH N CH CH N Ca O HO 2+ + Ca N CH O CH N + 2H+ б) ГФУ: взаимодействие раствора препарата в уксусной кислоте с калий гексацианоферратом(II) К4[Fe(CN)6] в присутствии аммоний хлорида NH4Cl; образуется белый кристаллический осадок аммоний-калий-кальций гексацианоферрата(II), нерастворимый в ацетатной кислоте СН3СООН: Ca2++ K+ + [Fe(CN)6]4– + NH4+ → KNH4Ca[Fe(CN)6]↓. в) ГФУ, N: реакция с аммоний оксалатом (NH4)2C2O4; образуется белый осадок, нерастворимый в разбавленной ацетатной кислоте СН3СООН и растворе аммиака Р, растворимый в разбавленных минеральных кислотах: Ca2+ + C2O42– → CaC2O4↓. г) ГФУ, N: Соль Кальция, смоченная хлоридной кислотой Р и внесенная в бесцветное пламя, окрашивает его в оранжево-красный цвет. Са2+ + h *Са2+ Са2+ + h1 2. Реакции на хлорид-ионы Cl– (cм. кислота хлоридная, лекция № 1) а) ГФУ: реакция с раствором аргентум нитрата в присутствии кислоты нитратной; образуется белый творожистый осадок, который нерастворим в нитратной кислоте, но легко растворим в разведенном растворе аммиака (допускается наличие нескольких крупных частиц, которые растворяются медленно): 3 2AgCl + Сa(NO ) СaCl2 + 2AgNO3 HNO 3 2 AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O При прибавлении HNO3 снова выпадает осадок аргентум хлорида AgCl: [Ag(NH3)2]Cl + HNO3 = AgCl↓ + 2NH4NO3 Только для AgCl характерна растворимость в аммоний карбонате (NH4)2CO3: AgCl + (NH4)2CO3 = [Ag(NH3)2]Cl + H2O + CO2 Все галогенидов аргентума (AgCl, AgBr, AgI) растворяются в растворе натрий тиосульфата: AgCl + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaCl б) действие окислителей (калий дихромата К2Cr2O7 (ГФУ), манган диоксида MnO2 и др.) в присутствии кислоты сульфатной; выделяется газ хлор Cl2 (нюхать нельзя – ядовитый газ!): 3СаCl2 + K2Cr2O7 + 7H2SO4 = 3Cl2 + Cr2(SO4)3 + 3СаSO4 + К2SO4 + 7H2O Cr2O72– + 14H+ + 6е 2Cr3+ + 7Н2О 2Cl– – 2е Cl2 Cr2O72– + 6Cl– + 14H+ 2Cr3+ + 3Cl2 + 7Н2О Для идентификации выделяющегося газа хлора Cl2 ГФУ предлагает поместить около отверстия пробирки кусочек фильтровальной бумаги, пропитанной раствором дифенилкарбазида Р. Пары газа хлора окисляют дифенилкарбазид (бесцветный) до дифенилкарбазона (оранжево-желтое окрашивание), а затем до дифенилкарбадиазона, вследствии чего индикаторная бумага окрашивается в фиолетово-красный цвет: NH O NH C NH NH C 6H5 + CL 2 C 6H5 -2 HCl дифенилкарбазон (бесцветный) красное N O C NH N C 6H5 + CL2 N O N дифенилкарбазид дифенилкарбадиазон (оранжево-желтое (фиолетовоNH C 6H5 -2 HCl N N окрашивание) окрашивание) C 6H5 C C 6H5 Испытания на чистоту Раствор S. Раствор субстанции в воде, свободной от СО2, должен быть прозрачным и иметь окрашивание не более интенсивное, чем соответствующий эталон. Кислотность или щелочность. К свежеприготовленному раствору S прибавляют 2–3 капли раствора фенолфталеина. Если раствор окрашивается в розовый цвет, он обесцвечивается при прибавлении не более 0,2 мл 0,01 М раствора кислоты хлоридной Р. Если раствор бесцветный, розовое окрашивание появляется при прибавлении не более 0,2 мл 0,0! М раствора натрий гидроксида. Алюминий (недопустимая примесь). К раствору S прибавляют раствор аммоний хлорида Р, раствор аммиака разбавленного Р1 и нагревают до кипения; раствор не должен мутнеть и не должен образовываться осадок: Al3+ + 3OH– Al(OH)3 Если субстанция предназначена для производства растворов для диализа, она должна выдерживать испытания на Алюминий (ГФУ, измеряют интенсивность флуоресценции продукта реакции с раствором гидроксихинолина в хлороформе), которого должно быть не более 1 ppm. Барий (недопустимая примесь). К раствору S прибавляют раствор кальций cульфата Р; опалесценция полученного раствора не должна превышать опалесценцию смеси раствора S и воды: Ва2+ + SO42– ВaSO4 Допустимые примеси в пределах эталонов: сульфаты (не более 200 ppm), Феррум (не более 1 ppm), Магний и щелочные металлы (не более 0,3%), тяжелые металлы (не более 15 ppm), N: Арсен (не более 1 ppm), Цинк (не более 50 ppm), Количественное определение 1. ГФУ. Комплексонометрия, прямое титрование исследуемого раствора кальция хлорида стандартным раствором Na-эдетата в среде концентрированого раствора NaOH с использованием индикаторной смеси кальконкарбоновой кислоты до изменения цвета от фиолетового до синего. Химизм процесса можно представить такими уравнениями. При прибавлении к исследуемому раствору кальция хлорида индикаторной смеси кальконкарбоновой кислоты H2Ind (синего цвета) образуется комплекс металл-индикатор CaInd (красно-фиолетового цвета): CaCl2 + H2Ind = CaInd + 2HCl синий цвет фиолетовый цвет При титровании такого раствора стандартным раствором Na-эдетата в среде концентрированого раствора натрий гидроксида NaOH образуется очень прочный бесцветный растворимый в воде комплекс ионов Са2+ с натрий эдетатом по схеме: 2+ Ca H2C N + CH2COONa CH2COOH CH2COOH C N CH2COONa H2 на трия э де та т H2C N C N H2 CH2COONa CH2COO CH2COO CH2COONa Ca + + 2H Избыточная капля Na-эдетата разрушает комплекс CaInd, образуя комплекс Са-эдетат и свободный индикатор H2Ind синего цвета. H2C N Ca Ind + CH2COONa CH2COOH CH2COOH C N CH2COONa H2 л ишня я ка пл я +H+ H2C N C N H2 Em (CaCl26H2O) = М.м. CH2COONa CH2COO CH2COO CH2COONa Ca Комплексонометрия (ГФУ) Титрант – Na–эдетат, Na2-ЭДТА Опреде -ление иона Bi3+ Ca2+ Mg2+ Условия проведения эксперимента Индикаторная смесь Изменение окрашивания Раствор NH3 конц. до появления Ксиленоловый помутнения, потом БледнорозовоHNO3 до оранжевый (1 часть фиолетовое в желтое исчезновения + 99частей KNO3) помутнения, t˚ = 70 C˚ Кальконкарбоновая Раствор NaOH конц. кислота (1 часть + Фиолетовое в синее 99частей NaCl) Протравной Аммиачный черный (эрихром буферный раствор Фиолетовое в синее черный) pH 10,0, t˚ = 40 C˚ (1 часть + 99частей NaCl) Pb2+ Zn2+ Al3+ Hg2+ Ксиленоловый Гексаметилентетрам оранжевый (1 ин (щелочная среда) часть + 99частей pH~7,8÷8,2 KNO3) Ксиленоловый Гексаметилентетрам оранжевый (1 ин (щелочная среда) часть + 99частей pH~7,8÷8,2 KNO3) Обратная Ксиленоловый комплексонометрия, оранжевый (1 избыток Na2-ЭДТА часть + 99частей титруют раствором KNO3) Pb(NO3)2 Обратная Протравной комплексонометрия, черный (эрихром избыток Na2-ЭДТА черный) титруют раствором (1 часть + ZnSO4 99частей NaCl) Фиолетово -розовое в желтое Фиолетово -розовое в желтое Бледнороз овофиолетово е 2. Аргентометрия по методу Мора. Прямое титрование исследуемого раствора препарата стандартным раствором аргентум нитрата AgNO3 в нейтральной среде в присутствии индикатора калий хромата K2CrO4. 1СаCl2 + 2AgNO3 = 2AgCl↓ + Сa(NO3)2 Избыточная капля титранта взаимодействует с индикатором с образованием осадка оранжево-красного цвета Ag2CrO4: 2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3 Em (CaCl26H2O) = М.м./2 3. Оксалатный метод. Он основан на осаждении ионов Кальция в виде малорастворимого кальций оксалата с последующим растворением осадка в разбавленной сульфатной кислоте и титровании выделившейся оксалатной кислоты стандартным раствором калий перманганата. Химизм этих процессов можно представить с помощью уравнений реакций: Са2+ + С2О42– СаС2О4 СаС2О4 + 2Н+ Са2+ + Н2С2О4 2KMnO4 + 5Н2С2О4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O MnO4– + 8H+ + 5 e Mn2+ + 4H2O | 5 | 2 H2С2O4 – 2e 2СO2 + 2H+ |2|5 5H2С2O4 + 2MnO4– + 6H+ 2Mn2+ + 10СO2 + 8H2O Еm(CaCl26H2O) = М.м./2 Хранение. У воздухонепроникном контейнере. Хранят в стеклянной посуде, пробки которых заливают парафином, в сухом месте, учитывая высокую гигроскопичность. Поэтому в аптеках готовят концентрат – 50%-ный раствор (Calcium chloratum solutum 50%), разведением которого получают растворы препарата необходимой концентрации. Применение Кальция хлорид широко применяется в медицинской практике: 1) в качестве кровоостанавливающего средства при легочных, носовых, желудочно-кишечных и маточных кровотечениях; 2) при алергических заболеваниях (бронхиальная астма, крапивница), при экземах, псориазе, различных формах туберкулеза и др.; 3) в хирургической практике для усиления свертываемости крови; стимулирует родовую деятельность и уменьшает проницаемость сосудов; 4) как антидот при отравлении солями Магния, флюоридами, кислотой оксалатной (щавелевой). Лекарственные препараты Магния Распространение в природе. Магний принадлежит к наиболее распространенным элементам в природе. В земной коре его содержание достигает 0,2%. Основные минералы: магнезит – MgCO3, доломит – CaCO3MgCO3, карналлит – KClMgCl26H2O, каинит – KClMgSO43H2O, кизерит – MgSO4H2O или MgSO47H2O, тальк – 3MgO4SiO2H2O. Залежи минералов Магния встречаются в основном в Сибири, на Кавказае, Кубани, водах Каспийского моря. Соли Магния являются спутниками каменной соли, содержатся в морской воде и многих минеральных источниках. Катионы Магния входят в состав хлорофилла, играющего важную роль в процессе фотосинтеза. В медицинской практике применяются такие лекарственные препараты Магния: ГФУ – магния оксид тяжелый, магния оксид легкий (магния оксид), ГФУ, дополн. 1 – магния карбонат тяжелый, магния карбонат легкий (магния карбонат основный), магния сульфат гептагидрат, магния хлорид гексагидрат. Магния оксид тяжелый ГФУ 98,0–100,5% Magnesii oxydum ponderosum MAGNESIUM OXYDE, HEAVY Магния оксид легкий ГФУ 98,0–100,5% Magnesii oxydum leve MAGNESIUM OXYDE, LIGHT Магния оксид М.м. = 40,32 г/моль Magnesii oxydum MgO Маgnesium oxydatum Маgnesia usta Жженная магнезия Получение 1. Термическая обработка основного карбоната магния: t 3MgCO3Mg(OH)23H2O 4MgO + 3CO2 + 4H2O Прокаливание ведут при температуре 250–300 С. Если этот процесс вести при более высокой температуре, то получают порошок, являющийся менее ценным лекарственным средством. 2. Из рассолов при переработке калийных солей, содержащих MgCl2. К рассолам прибавляют известковое молоко Ca(OH)2 и сульфатную кислоту H2SO4. При этом Ca(OH)2 осаждает примеси Fe2+ и Fe3+ в виде гидроксидов Fe(OH)2 и Fe(OH)3, а H2SO4 связывает катионы Кальция Ca2+: Fe2+ + 2ОН– Fe(OH)2 Fe2+ + 3ОН– Fe(OH)3 SO42– + Ca2+ CaSO4 Избыток известкового молока Ca(OH)2 связывает магний хлорид MgCl2 в виде магний гидроксида Mg(OH)2, который при прокаливании образует магния оксид MgO: MgCl2 + Ca(OH)2 = Mg(OH)2 + CaCl2 500 0 C MgO + H2O Mg(OH)2 t 3. Обработка магния хлорида перегретым водяным паром: MgCl2 + H2О = MgO + 2НCl Свойства Описание. Магния оксид тяжелый представляет собой мелкий порошок белого цвета. Магния оксид легкий – мелкий аморфный порошок белого цвета. Растворимость. Практически нерастворимы в воде Р, в которой проявляют щелочную реакцию по фенолфталеину. (Растворяются в разбавленных кислотах, в большинстве случаев со слабым выделением пузырьков газа). Идентификация Субстанцию растворяют в кислоте нитратной разбавленной Р HNO3 и нейтрализуют раствором натрий гидроксида разбавленным Р NaOH. Полученный раствор дает реакции на Магний Mg2+: MgO + 2HNO3 = Mg(NO3)2 + H2O Реакции на ионы Магния Mg2+: а) ГФУ. Реакция с натрий гидрогенфосфатом в присутствии аммиака и аммоний хлорида - образуется белый кристаллический осадок. Mg(NO3)2 + 2NH4OH = Mg(OH)2 + 2NH4NO3 Под действием натрий гидрогенфосфата Na2HPO4 в среде аммиака NH4OH и присутствии аммоний хлорида NH4Cl (аммиачного буферного раствора) образуется белый кристаллический осадок магний-аммоний фосфата NH4MgPO4 (кристаллы в форме шестилучевых звездочек): Cl 4 Mg2+ + HPO42– + NH4ОН NH NH4MgPO4 + Н2О Белый осадок б) Реакция с 8–оксихинолином в среде аммиачного буферного раствора; образуется желтозеленый кристаллический осадок магний 8оксихинолята: + 2 NH4OH MgCl2 N + NH4Cl OH N 2 HCl N O O Mg в) Реакция с хинализарина спиртовым раствором и щелочью (очень чувствительная реакция). В присутствии ионов Mg2+ образуется комплексное соединение васильково-синего цвета: Mg OH O OH OH OH OH O х ина л из а рин + HO HO -H2O Mg O OH O OH OH O ва сил ь ково-синее Количественное определение Навеску субстанции растворяют в кислоте хлоридной разбавленной, разбавляют водой и проводят количественное определение. 1. ГФУ. Комплексонометрия: прямое титрование подогретого до 40 С исследуемого раствора cоли Магния (MgCl2) стандартным раствором натрий эдетата в среде аммиачного буферного раствора (рН 10,00) и присутствии индикаторной смеси протравного черного (1 ч. протравного черного и 99 ч. NaCl) до перехода фиолетового окрашивания раствора в синее. Химизм процесса рассмотрен при изучении кальция хлорида (стр. 4). Em (MgO) = М.м. 2. Кислотно-основное титрование, обратное титрование. Навеску препарата магния оксида растворяют в избытке стандартного раствора хлоридной кислоты HCl и не прореагировавшую кислоту оттитровывают стандартным раствором натрий гидроксида NaOH в присутствии метилового оранжевого до перехода окрашивания от розового до желтого. MgO + 2HCl = MgCl2 + H2O HCl + NaOH = NaCl + H2O 1 моль MgO 2 моль (2 экв.) HCl 2 моль (2 экв.) NaOH Поэтому Еm(MgO ) = М.м./2 Хранение. В плотно закупоренном контейнере Применение. Антацидное средство. Препарат применяют при повышенной кислотности желудочного сока (при язвенной болезни), отравлении кислотами. Нейтрализуя хлоридную кислоту желудочного сока, превращается в магния хлорид, который проявляет слабительный эффект. Принимают через 1–3 часа после прийома пищи. Входит в состав препарата “Альмагель”, а также антидота при отравлении Арсеном. Магния карбонат тяжелый ГФУ, дополн. 1 Magnesii subcarbonas ponderosus MAGNESIUM CARBONATE, HEAVY Магния карбонат легкий ГФУ, дополн. 1 Magnesii subcarbonas levis MAGNESIUM CARBONATE, LIGHT Магния карбонат основный N Magnesii subcarbonas Magnesia alba M.м. = 365,36 г/моль Magnesium subcarbonicum 40,0–45,0% MgO 3MgCO3Mg(OH)23H2O (М.м.= 40,30 г/моль) Магния карбонат тяжелый (легкий) представляет собой гидратированный магния карбонат основный, содержание которого эквивалентно не менее 40,0% и не более 45% МgO (М.м. = 40,30 г/моль). Получение 1. Взаимодействие магния сульфата MgSO4 с содой Na2CO3 в водном растворе при температуре 70– 80 С: t 4MgSO4 + 4Na2CO3 + 4H2O 3MgCO3Mg(OH)23H2O + 4Na2SO4 + CO2 В зависимости лт условий осаждения (температуры, концентрации растворов) могут образовываться осадки различного состава с различными физическими свойствами. Поэтому формула препарата непостояная и может иметь состав 5MgCO32Mg(OH)27H2O. 2. Термическое разложение магний гидрогенкарбоната: t 4Mg(HCO3)2 3MgCO3Mg(OH)23H2O + 5CO2 Свойства Описание. Порошок белого цвета. Растворимость. Практически не растворим в воде Р. (Растворяется в разбавленных кислотах с бурным выделением пузырьков газа). 3MgCO3Mg(OH)23H2O + 5CO2 = 4Mg(HCO3)2 Этот процесс можно выразить таким упрощенным уравнением: MgCO3 + H2O + CO2 = Mg(HCO3)2 Поэтому магний гидрогенкарбонат является составной частью многих минеральных вод. Препарат трудно растворим в кислоте ацетатной при комнатной температуре, легко растворим в минеральных кислотах и растворе аммоний хлорида: 3MgCO3Mg(OH)23H2O + 8HCl = 4MgCl2 + 3CO2 + 8H2O При стоянии прозрачный раствор магний гидрогенкарбоната снова мутнеет вследствие реакии разложенияя: Mg(HCO3)2 MgCO3 + H2O + CO2 Идентификация 1. ГФУ, дополн. 1. Насыпной обьем. 15 г субстанции магния карбоната тяжелого занимает обьем около 30 мл. 15 г субстанции магния карбоната легкого занимает обьем около 180 мл. Испытание на подлинность магния карбоната основного проводят после предварительного растворения в разведенных кислотах: 3MgCO3Mg(OH)23H2O + 8HCl = 4MgCl2 + 3CO2 + 8H2O 2. Реакции на ионы Магния Mg2+ (см магния оксид): а) ГФУ, реакция с натрий гидрогенфосфатом в присутствии аммиака и аммоний хлорида; образуется белый кристаллический осадок; б) Реакция с 8–оксихинолином в среде аммиачного буферного раствора; образуется желто-зеленый кристаллический осадок; в) Реакция с хинализарина спиртовым раствором и 3. Реакции на карбонат-анионы СО32–: а) ГФУ, взаимодействие с минеральными кислотами. При растворении препарата в разбавленных кислотах бурно выделяется углекислый газ СО2 (см. выше растворение в HCl), который можно подтвердить помутнением известковой Са(ОН)2 или баритовой Ва(ОН)2 воды. Согласно методике, наведенной в ГФУ, исследуемую субстанцию суспендируют в воде, прибавляют раствор кислоты ацетатной разбавленной СН3СООН. Пробирку сразу закрывают притертой пробкой с изогнутой дважды под прямым углом стеклянной трубкой и образующийся газ (бесцветный, без запаха) пропускают сквозь раствор барий гироксида; образуется белый осадок, который растворяется в избытке хлоридной кислоты HCl. СО32– + 2СН3СООН = 2СН3СОО– + Н2О + СО2 СО2 + Ва(ОН)2 = ВаСО3 + Н2О ВаСО3 + 2HCl = BaCl2 + CO2 + Н2О б) ГФУ, N. Реакция с насыщенным раствором магний сульфата. К водному раствору субстанции, содержащей анионы СО32–, прибавляют насыщенный раствор магний сульфата MgSO4; образуется при обычной температуре белый осадок MgCO3 (в отличие от гидрогенкарбонатов, которые образуют осадок только при кипячении): CO32– + Mg2+ = MgCO3 Количественное определение. Навеску субстанции растворяют в кислоте хлоридной разбавленной, разбавляют водой и проводят количественное определение (MgCl2) аналогично магний оксиду (см. выше). 1. ГФУ. Комплексонометрическое титрование: прямое титрование раствором натрий эдетата в среде аммиачного буферного раствора с рН 10,00 и присутствии индикаторной смеси протравного черного до перехода окрашивания от фиолетового до синего. Химизм процессов – см. кальция хлорид (стр. 4). Поскольку состав препарата непостояныый, перерасчет делают на содержание магний оксида MgO. Em (MgO) = М.м. 2. Кислотно-основное титрование, обратное титрование (аналогично магния оксиду, см. стр. 7). Еm(MgO ) = М.м./2 3. Весовой метод. Навеску препарата магния карбоната основного 3MgCO3Mg(OH)23H2O высушивают, прокаливают до постоянной массы и взвешивают (весовая или гравиметрическая форма – MgO): 3MgCO3Mg(OH)23H2O 4MgO + 3СО2 + 4Н2О Расчитывают содержание чистого MgO в препарате по формуле: m(MgO) F % 100 % , m(3MgCO Mg(OH ) 3H O) 3 2 2 где F – гравиметрический расчитывают по формуле: фактор, который 4M(MgO) 1 . F M(3MgCO 3 Mg(OH ) 2 3H 2 O) Хранение. В плотно закупоренном контейнере. Применение. Антацидное средство. Применяют препарат внутрь при повышенной кислотности желудочного сока, а также как легкое слабительное средство. Взрослым назначают по 1–3 г 2–3 раза в день. Принимают до еды или в перерыве между прийомами пищи. Применяют наружно в виде присыпки. Формы выпуска: порошок и таблетки, содержащие магния карбонат основный и натрия гидрокарбонат по 0,5 г. Входит в состав таблеток “Викалин”, “Викаир”. Магния сульфат гептагидрат ГФУ, дополн. 1 Magnesii sulfas heptahydricus MAGNESIUM SULPHATE HEPTAHYDRATE Магния сульфат Magnesii sulfas MgSO47H2O Magnesium sulfuricum Sal amarum М.м. = 246,48 г/моль Горькаясоль 99,0–100,5% MgSO4 Английскаясоль (М.м. = 120,4 г/моль) Получение Впервые магния сульфат был получен в 1695 г. В качестве лекарственного препарата начали применять в конце XVII ст. в Англии, где его получали из вод Эпсомских минеральных источников (отсюда название – горькая или английская соль). 1. Растворение магнезита MgCO3 в избытке горячей разбавленной сульфатной кислоты H2SO4: MgCO3 + H2SO4 = MgSO4 + CO2 + H2O Избыток кислоты необходим для того, чтобы предупредить гидролиз MgSO4 и избежать образования основной соли (MgOH)2SO4 и магний гидроксида Mg(OH)2. Раствор фильтруют, упаривают до кристаллизации; при этом получают эпсомит – MgSO47H2O. Отфильтрованные кристаллы перекристаллизовывают из воды. Свойства Описание. Кристаллический порошок белого цвета или блестящие бесцветные кристаллы. Растворимость. Легко растворим в воде Р, очень легко растворим в кипящей воде Р, практически нерастворимый в 96% спирте Р. Идентификация 1. Реакции на ионы Магния Mg2+ (см. магния оксид): а) ГФУ. Реакция с натрий гидрогенфосфатом в присутствии аммиака и аммоний хлорида; образуется белый кристаллический осадок; б) Реакция с 8–оксихинолином в среде аммиачного буферного раствора; образуется желтозеленый кристаллический осадок; в) Реакция с хинализарина спиртовым раствором и щелочью; образуется раствор васильково- 2. Реакции на сульфат-анионы SO42– (см. натрия сульфат, лекция № 2): а) ГФУ. Реакция с раствором барий хлорида ВаCl2 в среде хлоридной кислоты HCl; образуется белый осадок ВаSO4: MgSO4 + BaCl2 = BaSO4 + MgCl2 SO42– + Ва2+ ВаSO4 Осадок нерастворим в минеральных кислотах и щелочах. б) ГФУ. К суспензии, полученной в реакции а), прибавляют раствор йода I2; желтое окрашивание не исчезает (отличие от сульфитов SO32– и дитионитов S2O32–), но обесцвечивается при прибавлении каплями раствора станум(ІІ) хлорида SnCl2 (отличие от йодатов IO3–). Смесь кипятят; осадок не обесцвечивается (отличие от селенатов и вольфраматов): MgSO4 + I2 (йод не обесцвечивается). I2 + SnCl2 + 4HCl = 2HI + H2[SnCl6] (йод обесцвечивается). Количественное определение. ГФУ. Комплексонометрическое титрование: прямое титрование исследуемого раствора препарата стандартным раствором натрий эдетата в среде аммиачного буферного раствора с рН 10,00 и присутствии индикатора протравного черного до перехода окрашивания от фиолетового до синего. Химизм процессов см. кальция хлорид (стр. 4). Em (MgSO47H2O) = М.м. Хранение. В герметически укупоренном контейнере, так как легко выветривается. Применение Магния сульфат имеет разностороннее влияние на организм. 1. При приеме внутрь плохо всасывается и применянтся в медицинской практике в качестве слабительного средства (по 15–30 г в день), оказывает желчегонное действие. 2. При парентеральном введении препарат оказывает успокаивающее действие на центральную нервную систему и в зависимости от дозы может наблюдаться седативный, снотворный (9–10 мг% в крови) или наркотический (при концентрации в крови 15–18 мг%) эффект. Однако большие концентрации могут вызвать угнетение дыхания (курареподобное действие). 3. В виде 25%-ного раствора вводят подкожно в качестве спазмолитического средства при гипертонической болезни, при свинцовых коликах. 4. Применяют для обезболивания родов, как противосудорожное средство внутримышечно по 5–20 мл 25%-ного раствора. В случае передозировки магния сульфата вводят внутривенно 10%-ный раствор кальция хлорида (антагонисты). Формы выпуска: порошок, 20% или 25% раствор в ампулах по 5, 10 или 20 мл. Магния хлорид гексагидрат ГФУ, дополн. 1 Magnesii chloridum hexahydricum MAGNESIUM CHLORIDE HEXAHYDRATE М.м. = 203,3 г/моль MgCl26H2O 99,0–100,5% Свойства Описание. Бесцветные кристаллы. Гигроскопичен. Растворимость. Очень легко растворим в воде Р, легко растворим в 96% спирте Р. Идентификация 1. Определение воды полумикрометодом (методом Фишера). Йодометрическое определение влаги. Содержание воды от 51,0% до 55,0%. Реактив Фишера – это раствор сульфур диоксида SO2, йода I2 и пиридина C5H5N в метаноле. В основе метода лежит окисление SO2 йодом I2 в присутствии воды: SO2 + I2 + 2Н2О H2SO4 + 2HI Для того, чтобы связать йодидную кислоту HI, а также уменьшить летучесть SO2, реакцию необходимо проводить в присутствии пиридина, который как слабое основание их связывает в нелетучие соединения: + I2 + SO2 + H2O 3 N I + 2 + + N N H O S O O - + CH3OH + + N O S O CH3SO4 N H O Конец титрования определяют визуально по изменению окрашивания от желтого до красноватокоричневого или потенциометрически. 2. Реакции на ионы Магния Mg2+ (см. магния оксид): а) ГФУ. Реакция с натрий гидрогенфосфатом в присутствии аммиака и аммоний хлорида; образуется белый кристаллический осадок; б) Реакция с 8–оксихинолином в среде аммиачного буферного раствора; образуется желтозеленый кристаллический осадок; в) Реакция с хинализарина спиртовым раствором и щелочью; образуется раствор васильковосинего цвета. 3. Реакции на хлорид-ионы Cl– (cм. кальция хлорид): а) ГФУ. Реакция с раствором аргентум нитрата в присутствии кислоты нитратной; образуется белый творожистый осадок, который нерастворим в нитратной кислоте, но легко растворим в разведенном растворе аммиака; б) ГФУ. Действие калий дихромата К2Cr2O7 в среде кислоты сульфатной; выделяется газ хлор Cl2, окрашивающий фильтровальную бумагу, смоченную дифенилкарбазидом, в фиолетово-красный цвет. Количественное определение. ГФУ. Комплексонометрическое титрование (см. магния сульфат). Em (MgCl26H2O) = М.м. Хранение У воздухонепроницаемом контейнере. Маркировка В необходимых случаях отмечают: – субстанция пригодна для производства растворов для перитонеального диализа, гемодиализа или гемофильтрации; – субстанция пригодна для производства лекарственных средств для парентерального применения. Неорганические препараты Бария Нахождение в природе. Барий – щелочноземельный металл и в природе в свободном виде не встречается, а только в виде минералов: витерит – BaСO3 и барит (тяжелый шпат) – BaSO4. Биологическая роль и медицинское применение. Все растворимые соли Бария (хлориды, бромиды, йодиды, нитраты, цианиды) очень ядовиты и поэтому в медицине не применяются. Ядовитыми также являются и те соли Бария, которые нерастворимы в воде (BaCO3, BaS), но растворимы в хлоридной кислоте HCl (желудочном соке) с образованием ядовитого BaCl2. Поэтому применяют в медицинской практике только бария сульфат BaSO4, который практически нерастворимый в воде, кислотах, щелочах и органических растворителях. Его применение в качестве рентгенконтрастного вещества основано на его непроницаемости для рентгеновских лучей. Принимают по 50–100 г в виде “бариевой кашицы”. Эта масса, наполняя желудок, непрозрачна для рентгеновских лучей. Получаются контрастные рентгеновские снимки. Через определенное время BaSO4 полностью выводится из организма. Бария сульфат ГФУ, дополн. 1 Barii sulfas Бария сульфат для рентгеноскопии Barii sulfas pro roentgeno BaSO4 BARIUM SULPHATE Barium sulfuricum pro roentgeno M.м. =233,40 г/моль Получение Получение бария сульфата состоит из нескольких стадий. 1. Прокаливание барита ВаSО4 с углем С с образованием барий сульфида ВаS: BaSO4 + 4С = ВаS + 4СО 2. Обработка хлоридной кислотой HCl полученного BaS или природного витерита BaСO3; образуется растворимая соль барий хлорид BaCl2: BaS + 2HCl = H2S + BaCl2 BaCO3 + 2HCl = H2O + CO2 + BaCl2 3. Осаждение BaSO4 под действием натрий сульфата Na2SO4, магний сульфата MgSO4 или сульфатной кислоты H2SO4: BaCl2 + Na2SO4 BaSO4 + 2NaCl Чтобы BaSO4 был высокодисперсным, растворы должны быть очень разбавленными, а кроме того, прибавляют защитный коллоид (льняное семя или отвар слизи) для замедления осаждения BaSO4. Осадок BaSO4 тщательно промивают водой (от недопустимых примесей хлоридов: растворимая соль BaCl2 – ядовита). При этом отмываются и примеси сульфатов SO42–. Свойства Описание. Порошок мелкий, тяжелый, белого цвета, свободный от крупных частиц.Плавится при температуре 1580 С. Растворимость. Практически не растворяется в воде Р (0,2 мг в 100 г воды) и органических растворителях. (Очень мало растворимый в кислотах и растворах гидроксидов щелочных металлов). Идентификация 2– 1. Реакция на сульфат-анионы SO4 : А. ГФУ. Реакция с барий хлоридом в среде хлоридной кислоты - образуется белый осадок. Химизм происходящих процессов можно представить в виде таких уравнений. BaSO4 + Na2CO3 BaCO3 + Na2SO4 карбонизация на фильтре В фильтрате имеется натрий сульфат Na2SO4 и избыток соды Na2CO3. При нейтрализации хлоридной кислотой HCl и прибавлении раствора BaCl2 происходят реакции: Na2CO3 + 2HCl = NaCl + H2O + CO2 Na2SO4 + BaCl2 = BaSO4 + 2NaCl Поэтому образуется белый осадок барий сульфата t 2. Реакции на катионы Бария Ba2+: а) ГФУ, прилож. 1. Реакция с сульфатной кислотой - образуется белый осадок, нерастворимый в растворе натрий гидроксида разбавленном Р: BaCO3 + 2HCl = BaCl2 + H2O + CO2 BaCl2+ H2SO4 = BaSO4 + 2HCl б) Окрашивание пламени. Летучие соли Бария (BaCl2) окрашивают бесцветное пламя в желтозеленый цвет. в) Реакция с раствором калий хромата K2CrO4 или калий дихромата K2Cr2O7; образуется желтый осадок BaCrO4: Ba2+ + CrO42– = BaCrO4 2Ba2+ + Cr2O72– + H2O = 2BaCrO4 + 2H+ Для связывания ионов H+ используют CH3COONa. Образуется ацетатная кислота: CH3СOO– + H+ = CH3COOH, в которой BaCrO4 нерастворим. г) Реакция с натрий родизонатом; образуется красно-бурый осадок барий родизоната, который (в отличие от солей Стронция) при взаимодействии с хлоридной кислотой HCl образует красный осадок барий гидрородизоната: O O O ONa O ONa + Ba2+ O O O O O Ba + 2 Na+ O ба рий родиз она т (кра с но-буры й ос а док) O O O Ba 2 O O O O O Ba + 2 HCl O O O OH O O HO O O O ба ри й гид рород и з она т (кра сны й оса д ок) + BaCl2 Количественное определение 1. ГФХ количественного определения бария сульфата не требует. 2. Ионообменная адсорбция. Нагревают BaSO4 в воде при 70–80 С с ионообменной смолой H-типа (катионитом) в течение 12 часов. При этом происходит катионный обмен: катионы Ba2+ адсорбируются на катионите, а в фильтрате появляется эквивалентное количество сульфатной кислоты H2SO4: BaSO4 + 2H-катионит Ba-катионит + H2SO4 Образующуюся в фильтрате кислоту H2SO4 титруют 0,1 М раствором натрий гидроксида NaOH в присутствии индикатора фенолфталеина до розового окрашивания. H2SO4 + 2NaOH = Na2SO4 + 2H2O Хранение Поступает в аптеку в оригинальной упаковке в плотно заклеенных двойных бумажных пакетах (внутренний – пергаментный) з написью pro Roentgeno. На наружную упаковку наносят данные о заводе изготовителе, дате выпуска и результатах контроля. Пакеты с бария сульфатом нельзя хранить вместе с карбонатами, во избежание попадания бария карбоната. Нельзя вскрывать, расфасовывать, а отпускать в оригинальной расфасовке. Применение. Рентгенконтрастное средство. Применяют в качестве контрастного средства при рентгенологическом обследовании желудка и кишечника. Препараты Бария известны под названиями: Colobarium, Citobarium, Barex, Shadoform, Kaylenema, Nov-Umberose. Имеется две формы отпуска: 1. Сульфобар (Sulfobar) – паста белого цвета, содержащая 50% BaSO4 для рентгеноскопии; она лучше, чем порошок обволакивает слизистую оболочку желудочно-кишечного тракта и обеспечивает высокое качество рентгеновского изображения. 2. Адсобар (Adsobar) (BaSO4) – применяют не для рентгеноскопии, а в качестве антидота. В отличии от препарата бария сульфата для рентгеноскопии, он представляет собой белый мелкокристаллический порошок без запаха и вкуса. Важным показателем его качества является степень адсорбции. Определяют его адсорбционную способность с азокрасителем хризофенином: C2H5O N N CH SO3Na CH N N OC2H5 Na3OS При взаимодействии с препаратом образуется комплексное соединение, которое при спектрофотометрии имеет иную оптическую плотность, чем сам хризофенин. C0 C x D0 Dx Неорганические препараты Цинка Цинк известен человеку с глубокой древности, а в Европе – с ХVI столетия. Распространение в природе. Основные минералы Цинка: цинковая обманка – ZnS; цинковый шпат (галмей) – ZnCO3; каламин – Zn4(Si2O7)(OH)2H2O. Биологическая роль и медицинское применение. Цинк – необходимый микроэлемент, играющий важную роль в жизнедеятельности организма. В организме взрослого человека содержится около 2 г Цинка. Он найден в мышечной, зубной и нервной таканях; входит в состав гормона поджелудочной железы – инсулина (0,52%); является синергетиком витаминов (способствует проявлению их действия). Цинкзависимыми являются также такие жизненно важные ферменты, как кортикотропин, соматотропин, гонадотропин. Дефицит Цинка наблюдается при заболеваниях желудочнокишечного тракта, почек, печени, болезнях крови, псориазе, новообразованиях. Он сопровождается ослаблением иммунитета, снижением обоняния, вкусовых ощущений и Соединения Цинка в больших дозах ядовиты, а при местном применении имеют вяжущее и прижигающее действие. При пероральном введении вызывают рвоту. Применение соединений Цинка базируется на том, что как и другие тяжелые металлы, Цинк связывает белки с образованием альбуминатов: растворимые альбуминаты проявляют действие от слабовяжущего до резко прижигающего; нерастворимые альбуминаты образуют пленку на поврежденной поверхности и поэтому проявляют подсушивающий эффект. В медицинской практике применяют такие неорганические препараты Цинка: ГФУ, дополн. 1 – цинка оксид ZnO, цинка сульфат гептагидрат ZnSO47H2O и цинка хлорид ZnCl2. Цинка оксид дополн. 1 Zinci oxydum ZnO ГФУ, ZINC OXIDE Zincumoxydatum М.м. = 81,38 г/моль FloresZinci 99,0– 100,5% ZnO Lana philosophica Получение 1. Прокаливание цинкового шпата ZnCO3: t ZnCO3 ZnO + CO2 2. Прокаливание свежеосажденного основного карбоната цинка 2ZnCO33Zn(OH)2, который получают при прибавлении раствора цинк сульфата ZnSO4 к кипящему раствору соды Na2CO3 так, чтобы раствор оставался слабощелочным: 5ZnSO4 + 5Na2CO3 + 3H2O 2ZnCO33Zn(OH)2 + 5Na2SO4 + 3CO2 Полученный белый осадок 2ZnCO33Zn(OH)2 промывают путем декантации, фильтруют и промывают на фильтре водой до исчезновения реакции на сульфат-анионы (с барий хлоридом BaCl2). После высушивания осадок прокаливают в фарфоровых чашках при 250–300 С: t 2ZnCO33Zn(OH)2 5ZnO + 2CO2 + 3H2O 3. Прокаливание цинк гидроксида Zn(OH)2, который получают прибавлением небольшого избытка раствора аммоний гидроксида NH4OH к 10%-ному раствору цинк нитрата Zn(NO3)2: Zn(NO3)2 + 2NH4OH = Zn(OH)2 + 2NH4NO3 Полученный белый осадок Zn(OH)2 промывают декантацией, фильтруют и промывают на фильтре водой до исчезновения реакции на катионы аммония NH4+ (с реактивом Несслера). После высушивания осадок прокаливают в фарфоровых чашках при температуре около 400 С: t Zn(OH)2 ZnO + H2O Свойства Описание. ГФУ, дополн.1. Мягкий аморфный порошок белого или слегка желтовато-белого цвета, свободный от песчаных частиц. Растворимость. Практически нерастворимый в воде Р и 96% спирте Р. (Растворяется в разбавленных минеральных кислотах). Идентификация 1. ГФУ, дополн. 1. Субстанция при сильном нагревании желтеет; желтое окрашивание исчезает при охлаждении. 2. Реакции на ионы Цинка Zn2+ (после предварительного растворения в HCl): а) ГФУ. Реакция с натрий гидроксидом NaOH и натрий сульфидом Na2S; образуется белый Происходящие процессы можно представить такими уравнениями реакций: ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl белый осадок Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] осадок растворяется Na2[Zn(OH)4] + 4NН4Cl = ZnCl2 + 2NaCl + 4NH4OH раствор остается прозрачным ZnCl2 + Na2S = ZnS + 4NaCl белый осадок б) ГФУ, N. Реакция с раствором калий ферроцианида (калий гексациано(П)ферратом) K4[Fe(CN)6]; образуется белый осадок, нерастворимый в кислоте хлоридной разбавленной: 3ZnCl2 + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2 + 6KCl белый осадок 2K+ + 3Zn2+ + 2[Fe(CN)6]4– K2Zn3[Fe(CN)6]2 в) Неофицинальная реакция. Получение зелени Ринмана. При прокаливании препарата ZnO с кобальт(ІІ) нитратом Co(NO3)2 образуется характерное зеленое окрашивание кобальт(ІІ) цинката (зелень Ринмана): 2Cо(NO3)2 2CоO + 4NO2 + O2 t ZnO + CoO CoZnO2 Количественное определение. ГФУ. Комплексонометрия (после растворения навески препарата в кислоте ацетатной разбавленной Р), прямое титрование раствором натрий эдетата в среде гексаметилентетрамина (рН = 7,8–8,2) и присутствии индикаторной смеси ксиленолового оранжевого (1 ч. ксиленолового оранжевого и 99 ч. KNO3) до перехода фиолетово-розового окрашивания в желтое. Химизм процессов см. кальция хлорид (стр. 4). В сокращенном виде эти процессы можно представить такими уравнениями: ZnO + 2CH3COOH = Zn(CН3СОО)2 + H2O Zn(CН3СОО)2 + H2Ind = ZnInd + 2CН3СООH фиолетово-розовое окрашивание Na2Н2-эдетат + ZnCl2 Na2Zn-эдетат + 2НCl Na2Н2-эдетат + ZnInd Na2Zn-эдетат + H2Ind желтое окрашивание Em (ZnO) = М.м. Хранение. В плотно закупоренном контейнере, защищающем от попадания углекислоты воздуха (см. выше). Применение. Вяжущее, дезинфицирующее средство. Цинка оксид применяют наружно в качестве вяжущего, дезинфицирующего средства при кожных заболеваниях (дерматиты, язвы, опрелости) в виде присыпок, мазей, паст, линиментов. Имеются сведения об эффективности препарата при лечении гнездной алопеции (облысения) у детей. В этом случае назначают цинка оксид внутрь по 0,02–0,05 г 2–3 раза в день (после еды) и наружно 2%-ную цинковую мазь (Unguentum Zinci). Входит в состав различных мазей (цинковой, цинконафталанной с анестезином); паст (цинковой, салицилово-цинковой – пасты Лассара, цинкоихтиоловой); присыпки детской, присыпки от потливости ног – гальманин; суппозиториев анестезол, нео-анузол; лейкопластыря; некоторых кремов против загара и др. Цинка сульфат гептагидрат ГФУ, дополн. 1 Zinci sulfas heptahydricus ZnSO47H2O М.м. = 287,56 г/моль ZINC SULPHATE HEPTAHYDRATE Zincum sulfuricum Цинковыйкупорос 99,5–104,0% ZnSO47H2O Применялся издавна в медицине под названием “белый купорос”, в отличие от окрашенных медного купороса CuSO45H2O и железного купороса FeSO47H2O. Химическое название: цинк сульфат гептагидрат Получение 1. Обжиг цинковой обманки ZnS с последующим растворением цинк оксида ZnO в сульфатной кислоте H2SO4: 2ZnS + 3O2 = 2ZnO + 2SO2 ZnO + H2SO4 = ZnSO4 + H2O Цинк сульфат получают в растворе, а примеси Cu, Cd, Pb не растворяются. Чтобы устранить примеси Fe2+, раствор обрабатывают гидроген пероксидом Н2О2. При этом образуются ионы Fe3+: 2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O Затем раствор кипятят с небольшим количеством чистого цинк оксида ZnO, который осаждает Fe(OH)3. Осадок отфильтровывают, а раствор сгущивают до кристаллизации. Кристаллы ZnSO47H2O фильтруют, промывают холодной водой и высушивают на воздухе. 2. Растворение металлического цинка Zn в разведенной сульфатной кислоте H2SO4: Zn + H2SO4 = ZnSO4 + H2 При этом примеси, содержащиеся в цинке, не растворяются. Свойства Описание. ГФУ, дополн. 1. Кристаллический порошок белого цвета или бесцветные прозрачние кристаллы. Выветривается на воздухе. Растворимость. Очень легко растворяется в воде Р, не растворяется в 96% спирте Р. Медленно растворяется в глицерине. Водные растворы имеют кислую реакцию на лакмус и нейтральную на метиловый оранжевый. Это обусловлено гидролизом соли по схеме: Zn2+ + HOH ZnOH+ + H+ (рН 7). Идентификация 1. Реакции на ионы Цинка Zn2+(см. цинка оксид). а) ГФУ. Реакция с натрий гидроксидом NaOH и натрий сульфидом Na2S; образуется белый хлопьевидный осадок ZnS. б) ГФУ, N. Реакция с раствором калий фероцианида (калий гексациано(П)ферратом) K4[Fe(CN)6]; образуется белый осадок K2Zn3[Fe(CN)6]2, нерастворимый в кислоте хлоридной разбавленной. 2. Реакции на сульфат-анионы SO42– (см. натрия сульфат, лекция № 2): а) ГФУ. Реакция с раствором барий хлорида ВаCl2 в среде хлоридной кислоты HCl; образуется белый осадок ВаSO4, нерастворимый в минеральных кислотах и щелочах: SO42– + Ва2+ ВаSO4 б) ГФУ. К суспензии, полученной в реакции а), прибавляют раствор йода I2; желтое окрашивание не 2– исчезает (отличие от сульфитов SO3 и дитионитов S2O32–), но обесцвечивается при прибавлении каплями раствора станум(ІІ) хлорида SnCl2 (отличие от йодатов IO3–). Смесь кипятят; осадок не обесцвечивается (отличие от селенатов и вольфраматов): ZnSO4 + I2 (йод не обесцвечивается). I2 + SnCl2 + 4HCl = 2HI + H2[SnCl6] (йод обесцвечивается). Количественное определение 1. ГФУ. Комплексонометрия, прямое титрование (см. цинка оксид). Em (ZnSO47H2O) = М.м. 2. Йодометрия, непрямое титрование (по заместителю). Метод основан на восстановлении калий гексациано(ІІІ)феррата K3[Fe(CN)6] с помощью калий йодида KI до калий гексациано(ІІ)феррата K4[Fe(CN)6]: 2K3[Fe(CN)6] + 2KI = 2K4[Fe(CN)6] + I2 K4[Fe(CN)6] реагирует с ионами Zn2+, образуя нерастворимую двойную комплексную соль K2Zn3[Fe(CN)6]2: 2K+ + 3Zn2+ + 2[Fe(CN)6]4– K2Zn3[Fe(CN)6]2 Выделившийся йод титруют стандартным раствором натрий тиосульфата в присутствии индикатора крахмала (прибавляют под конец титрования) до исчезновения синего окрашивания: I2 + 2Na2S2O3 = 2NaI + Na2S4O6 I2 + 2е 2I– 2S2O32– – 2е S4O62– Еm(ZnSO47H2O) = 3М.м./2 Еm(Na2S2O3) = М.м. Хранение. Список сильнодействующих веществ. В плотно закупоренном неметаллическом воздухонепроницаемом контейнере. Применение. Вяжущее и дезинфицирующее средство. Применяют наружно как вяжущее и дезинфицирующее средство при кожных заболеваниях. В малых концентрациях в виде 0,1, 0,25 и 0,5%-ных растворов применяют в глазной практике, часто вместе с борной кислотой. В урологической и гинекологической практике в виде 0,1–0,5%-ных растворов используют для спринцеваний. Редко применяют внутрь по 0,1–0,2 г как рвотное средство. Формы выпуска: порошок, глазные капли. В Польше выпускают таблетки, покрытые оболочкой, “Цинктераль”, содержащие 200 мг цинка сульфата, для лечения облысения, угрей, дерматозов. Включен в ряд поливитаминных препаратов: таблеток “Компливит”, ”Олиговит” и др. В.р.д. взрослым внутрь как рвотное – 1 г (однократно). Цинка хлорид Zinci chloridum ГФУ, дополн. 1 ZINC CHLORIDE ZnCl2 М.м. = 136,3 г/моль 95,0–100,5% ZnCl2 Свойства Описание. Кристаллический порошок белого цвета или литые белые палочки. Расплывается на воздухе. Растворимость. Очень легко растворим в воде Р, легко растворим в 96% спирте и глицерине Р. Идентификация 1. ГФУ, дополн. 1. Реакция на хлориды (а) после растворения субстанции в кислоте нитратной разбавленной: с раствором аргентум нитрата; образуется белый творожистый осадок, который быстро растворяется в растворе аммиака Р: AgNO3 + ZnCl2 = 2AgCl + Zn(NO3)2 AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O 2. ГФУ, дополн. 1. Реакция на ионы Цинка Zn2+ после растворения субстанции в воде, свободной от СО2, и прибавления по каплям кислоты хлоридной разбавленной до обесцвечивания раствора (см. цинка оксид). Количественное определение 1. ГФУ. Комплексонометрия, прямое титрование (см. цинка оксид). Em(ZnCl2) = М.м. 2. Йодометрия, непрямое титрование (по заместителю) (cм. цинка сульфат). Еm(ZnSO47H2O) = 3М.м./2 Еm(Na2S2O3) = М.м. Хранение В неметаллическом контейнере. Применение Входит в состав поливитаминных препаратов с микроэлементами. Соединения Купрума Нахождение в природе Поскольку медь – малоактивный металл, поэтому она встречается в природе в самородном виде. Кроме этого, Купрум входит в состав многих руд и минералов: медный блеск – Cu2S, CuFeS2 – халькопирит, Cu2O – красная медная руда, CuO – тенорит, (CuOH)2CO3 – малахит, 3Cu2SFe2O3 – пестрая медная руда. Основные залежи медных руд встречаются в Казахстане, Алтае, Армении и в Украине. Для получения лекарственных препаратов используют медь, которую получают из руд. Биологическая роль. Купрум относится к содержащимся в организме микроэлементам, играющим роль в процессах метаболизма. Он содержится в крови (в эритроцитах) и активирует Феррум при образовании гемоглобина. С лечебной целью используются только соединения Купрума(ІІ), в частности купрума сульфат. Купрума сульфат Cupri sulfas CuSO45H2O Cuprum sulfuricum М.м. = 249,69 г/моль Меди сульфат 98,0–101,0% Медный купорос Химическое название: купрум(ІІ) сульфат пентагидрат Получение 1. Взаимодействие гарячего раствора сульфатной кислоты с медными отходами металлообрабатывающей промышленности в присутствии кислорода воздуха: 2Сu + O2 = 2CuO CuO + H2SO4 = CuSO4 + H2O Полученную соль очищают путем перекристаллизации 2. Растворение чистой металлической меди в гарячей концентрированной сульфатной кислоте (для ускорения реакции прибавляют концентрированную нитратную кислоту HNO3): 3Cu + 3H2SO4 + 2HNO3 = 3CuSO4 + 2NO + 4H2O Полученный раствор выпаривают досуха (для удаления воды, избытка H2SO4 и HNO3), остаток растворяют в воде и из него выкристаллизовывается CuSO45H2O. Кристаллы центрифугируют и перекристаллизовывают из воды. Свойства. Описание. Синие кристаллы или синий кристаллический порошок без запаха, металлического вкуса. На воздухе и в сухом месте медленно выветривается и становится более светлого цвета. При нагревании до 110 С теряет 4 молекулы воды (CuSO4Н2О), до 150 С – становится безводным CuSO4 (бесцветные кристаллы), а при 653 С – разлагается: 2CuSO4 2CuO + 2SO2 + O2 Растворимость. Легко растворимый в воде (3 ч. холодной и 0,8 ч. горячей воды), глицерине, практически нерастворимый в 95% спирте. Водные растворы имеют слабокислую реакцию вследствие гиролиза, идущего по катиону: Cu2+ + HOH CuOH+ + H+ Идентификация 1. Реакции на ионы Купрума Cu2+. Для установления подлинности препарата используют свойства Купрума легко востанавливаться из соединений. а) Действие на раствор препарата металлического железа. Раствор купрум сульфата (1:20) покрывает железную проволоку красным налетом металлической меди: CuSO4 + Fe = FeSO4 + Cu C раствором бария хлорида образуется белый осадок бария сульфита: CuSO4 + BaCl2 = BaSO4 + CuCl2 б) Взаимодействие с раствором аммиака; образуется аммиачный комплекс Купрума темно-синего цвета. При прибавлении к раствору купрум сульфата по каплям раствор аммиака NH4OH вначале образуется голубой осадок (CuOH)2SO4, который растворяется в избытке реактива, образуя комплексное соединение [Cu(NH3)4]SO4 темносинего цвета: 2CuSO4 + 2NH4OH = (CuOH)2SO4 + (NH4)2SO4 (NH4)2SO4 + (CuOH)2SO4 + 6NH4OH = 2[Cu(NH3)4]SO4 + 8H2O в) Взаимодействие с сульфидами (Na2S или (NH4)2S); образуется черный осадок купрум сульфида CuS, растворимый в нитратной кислоте HNO3: Cu2+ + S2– CuS 3CuS + 14HNO3 = 3Cu(NO3)2 + 3H2SO4 + 8NO + 4H2O г) Реакция с калий гексациано(ІІ)ферратом K4[Fe(CN)6]; образуется осадок красно-коричневого (сливового) цвета купрум(ІІ) гексацианоферрата Cu2[Fe(CN)6]: 2Cu2+ + [Fe(CN)6]4– Cu2[Fe(CN)6] д) Реакция с раствором калий йодида KI; образуется белый осадок Cu2I2 и наблюдается появление желтого окрашивания (за счет I2): CuSO4 + 2KI = CuI2 + K2SO4 CuI2 Cu2I2 + I2 2CuSO4 + 4KI = Cu2I2 + I2 + 2K2SO4 е) Взаимодействие с многоатомными спиртами (напр., глицерол), амино- и оксикислотами (глюконовая кислота и др) в щелочной среде; образуется хелатное соединение темно-синего цвета: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Реактив Фелинга H2C HC H2C OH + HO OH HO Cu HO OH HO OH CH2 H2C OH CH HC OH CH2 H2C HO Cu O CH2 CH HO O CH2 те м но-сине е окра ш + 2 H2O 2. Реакции на сульфат-анионы SO42– (см. натрия сульфат, лекция № 2): а) ГФУ. Реакция с раствором барий хлорида ВаCl2 в среде хлоридной кислоты HCl; образуется белый осадок ВаSO4, нерастворимый в минеральных кислотах и щелочах: SO42– + Ва2+ ВаSO4 б) ГФУ. К суспензии, полученной в реакции а), прибавляют раствор йода I2; желтое окрашивание не исчезает (отличие от сульфитов SO32– и дитионитов S2O32–), но обесцвечивается при прибавлении каплями раствора станум(ІІ) хлорида SnCl2 (отличие от йодатов IO3–). Смесь кипятят; осадок не обесцвечивается (отличие от селенатов и вольфраматов): SO42– + I2 (желтое окрашивание не исчезает). I2 + SnCl2 + 4HCl = 2HI + H2[SnCl6] (йод обесцвечивается) Количественное определение. Йодометрия, непрямое титрование (по заместителю) 2CuSO4 + 4KI = Cu2I2 + I2 + 2K2SO4 2Cu2+ + 4I– = Cu2I2 + I2 I2 + 2Na2S2O3 = 2NaI + Na2S4O6 I2 + 2е 2I– 2S2O32– – 2е S4O62– Еm(CuSO45H2O) = М.м. Еm(Na2S2O3) = М.м. Хранение. В хорошо укупоренной таре, не допуская потери кристаллизационной воды. Список сильнодействующих веществ. Применение. Антисептическое, вяжущее, прижигающее средство. Наружно препарат применяют в качестве антисептического, вяжущего, прижигающего средства в виде 0,25% раствора в глазной практике (при коньюнктивитах), в урологии (при уретритах, вагинитах). При ожогах кожи Фосфором обильно смачивают обожженный участок 5% раствором препарата. Внутрь назначают при отравлении белым Фосфором, принятым внутрь, по 0,3–0,5 г купрум сульфата в полстакана теплой воды и промывание желудка 0,1% раствором, а также для усиления эритропоэза при анемиях по 5–10 капель 1% раствора 2–3 раза в день. Как необходимый микроэлемент входит в состав ряда комплексных поливитаминных препаратов: таблеток “Квадевит”, ”Олиговит”, Компливит”, ”Глутамевит” и др. В.р.д. внутрь 0,5 г (однократно, как рвотное). Лекарственные средства Аргентума Распространение в природе. Серебро относится к благородным металлам. В природе встречается как в самородном виде (обычно содержит вкрапления золота, меди, ртути и других металолов), так и в виде соединений: серебряный блеск – Ag2S, роговая обманка – AgCl, аргентум-стибиевая обманка (пираргирит) – Ag3SbS3, аргентум-арсеновая обманка – Ag3AsS3. Основные залежи этих руд находятся на Урале, в Грузии, Армении, на Алтае, в Читинской области и др. В соединениях Аргентум главным образом одновалентен. Разбавленные кислоты, кроме нитратной, его не растворяют. Биологическое действие и медицинское применение. Применение пррепаратов Аргентума основано на его бактерицидных свойствах. Это свойство использовалось еще в Древнем Египте, когда на поверхность ран накладывали серебряные пластинки. Вода, которая хранится в серебряных сосудах, долгое время не загнивает. Бактерицидное действие серебра проявляется уже при концентрации ионов Аргентума Ag+ всего 210–11 мг/л. Поэтому при соприкосновении воды с серебром (“серебряные шарики”) создается весьма малая, но достаточная концентрация ионов Ag+ и получаем ”серебряную воду” Aquargen – средство для обеззараживания и консервирования некоторых пищевых продуктов. “Серебряную марлю”, ”серебряную вату” можно использовать для лечения некоторых кожных заболеваний. Из соединений Аргентума в медицинской практике применяется только аргентум нитрат. Аргентум нитрат ГФУ, дополн. 1 Argenti nitras SILVER NITRATE Argentum nitricum AgNO3 М.м. = 169,89 г/моль Lapis infernalis 99,0–100,5% Ляпис Впервые получил AgNO3 арабский алхимик Гебер в VIII ст. н. э. Получение 1. Растворение металлического серебра в 25%ном растворе нитратной кислоты: 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O Свойства Описание. Кристаллический порошок белого цвета или прозрачные, бесцветные кристаллы Растворимость. Очень легко растворим в воде Р (в 0,6 ч. воды), растворим в 96% спирте Р (в 3 ч. спирта). Идентификация 1. Реакции на ионы Аргентума Ag+: а) ГФУ. Взаимодействие с хлоридной кислотой. К водному раствору субстанции прибавляют раствор хлоридной кислоты HCl; образуется белый творожистый осадок AgCl, который легко растворяется в растворе аммиака NH4OH. AgNO3 + HCl = AgCl + HNO3 AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O Кроме того, из всех нерастворимых галогенидов Аргентума только для AgCl характерно растворение в аммоний карбонате (NH4)2CO3 : AgCl + (NH4)2CO3 = [Ag(NH3)2]Cl + H2O + CO2 б) Реакция “серебряного зеркала”. При прибавлении к аммиачному раствору AgNO3 (реактиву Толленса) раствора формальдегида и нагревании через некоторое время на стенках сосуда образуется налет металлического серебра в виде зеркала: 2AgNO3 + 2NH4OH = [Ag(NH3)2]NO3 + 2H2O HCНO + 2[Ag(NH3)2]NO3 + H2O = 2Ag + HCOONH4 + NH3 + 2NH4NO3 в) Реакция с раствором калий хромата K2CrO4 (нефармакопейная реакция); образуется оранжевокрасный осадок Ag2CrO4, растворимый в HNO3 и NH4OH, трудно растворимый в CH3COOH: AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3 –1. Реакции на нитрат-анионы NO3 : а) ГФУ. Навеску субстанции прибавляют к смеси нитробензола и сульфатной кислоты и через 5 мин охлаждают в ледяной воде. Продолжая охлаждение, медленно при перемешивании прибавляют воды, раствор натрий гидроксида концентрированного, ацетона, встряхивают и отстаивают; верхний слой преобретает темно-фиолетовое окрашивание. б) ГФУ, N. Раствор субстанции, подкисленный сульфатной кислотой, не обесцвечивает раствор калий перманганата (отличие от нитритов). в) Реакция с дифениламином в кислой среде (конц. H2SO4) с образованием органического красителя ярко-синего цвета (аналогично нитрит–ионам, см. NaNO2): 2 NH H2SO4 + NO2 NH NH H2SO4 дифенилбензидин + N N HSO4 H сульфоимониевая соль дифенилбензидина (краситель синего цвета) г) Взаимодействие с раствором феррум(ІІ) сульфатом FeSO4 в среде концентрированной сульфатной кислоты H2SO4; образуктся бурое кольцо (FeSO4NO) (на часовом стекле): 2NaNO3 + 6FeSO4 + 4H2SO4 = 2NO + 3Fe2(SO4)3 + Na2SO4 + 4H2O NO + Fe2+ + SO42– [Fe(NO)]SO4 Эту реакцию можно провести в пробирке: к раствору препарата прибавляют концентрированной сульфатной кислоты H2SO4, а затем осторожно, по стенке, прибавляют раствор феррум(ІІ) сульфата FeSO4. На границе двух жидкостей образуется темно-бурое кольцо неустойчивого соединения FeSO4NO. Химизм этого процесса можно представить и так: 2AgNO3 + H2SO4 = Ag2SO4 + 2HNO3 HNO3 + 3H2SO4 + 6FeSO4 = 3Fe2(SO4)3 + 2NO + 4H2O Количественное определение. ГФ Х. Тиоцианатометрия, прямое титрование исследуемого раствора препарата в среде разбавленной нитратной кислоты HNO3 стандартным раствором аммоний тиоцианата NH4SCN в присутствии индикатора феррум(ІІІ) аммоний сульфата (железо-аммиачных квасцов) FeNH4(SO4)2 до красновато-желтого окрашивания (за счет образования Fe(SCN)3): AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + FeNH4(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Em (AgNO3) = M.м. Хранение Список ядовитых и наркотических веществ. В плотно закупоренном неметаллическом контейнере в защищенном от света месте, в банках с притертой пробкой с оранжевого стекла, чтобы на происходило разложение: 2AgNO3 2Ag + 2NO2 + O2 Карандаши ляписные хранят в пеналах из полиэтилена в hV Применение. Антисептическое и прижигающее средство. Наружно применяют в виде 1–10% растворов или 1–2% мазей при эрозиях, трещинах, язвах, острых коньюнктивитах. Для прижиганий ран и язв используют ляписные карандаши Stilus Argenti nitratis (содержат 0,18 г AgNO3). Ранее широко пользовались для профилактики бленнореи у новорожденных (2% глазные капли). Теперь с этой целью применяют 30% раствор натрия сульфацила. Механизм действия препарата состоит в том, что AgNO3 сворачивает белки (в том числе и микроорганизмов), превращая их в нерастворимые соединения. У небольших количествах проявляет вяжущее и противовоспалительное действие. Внутренне применяли ранее в виде 0,05–0,06% растворов при язвенной болезни желудка, суперацидном гастрите. В.р.д. для взрослых внутрь – 0,03 г В.с.д. для взрослых внутрь – 0,1 г. Коллоидные препараты Аргентума Протаргол Protargolum Argentum proteinicum Содержит 7,8-8,3% Ag (в неионизованом состоянии). Получение Выпаривание растворов белковых веществ (казеин, яичный белок, пептон та др.) с растворами AgNO3 в вакууме или в струе гарячого воздуха при температуре 30-50 C до небольшого обьема. При этом белки (Naлизальбинат, Na-протальбинат) восстанавливают серебро Ag, которое связывается в коллоидном виде с белками. С полученного раствора протаргол осаждают спиртом, причем серебро, которое не связалось с белками, остается в растворе. Можно также получить препарат, используя для его очищения натрий гидроксид NaOH с последующим диализом для выделения солей Na. Свойства Описание. Коричнево-желтый или коричневий легкий почти аморфный порошок без запаха, слабо горького и слегка вяжущего вкуса. Растворимость. Легко растворим в воде, нерастворим в спирте, эфире хлороформе. Идентификация 1. Поскольку Ag находится в неионогенном состоянии, то раствор препарата не дает сразу осадка с хлоридной кислотой HCl, а осадок AgCl випадает только через некоторое время. Общие реакции для протаргола и колларгола. 1. Сжигание препаратов; слышен запах жженного рога (наличие в препаратах белка). 2. Реакция с купрум сульфатом в щелочной среде; появляется фиолетовое окрашивание (биуретовая реакция на белок). 3. Обнаружение ионов Аргентума Ag+ в золе после сжигания препаратов. Остаток после сжигания (зола серовато-белого цвета) растворяют в нитратной кислоте HNO3, фильтруют и к фильтрату прибавляют хлоридной кислоты HCl; выпадает белый творожистый осадок AgCl, который растворим в разбавленном растворе аммиака NH3: Ag+ + Cl– AgCl AgCl + 2NH3 = [Ag(NH3)2]Cl Хранение. В хорошо укопоренных банках оранжевого цвета, в защищенном от света месте. Применение. Вяжущее, антисептическое и противовоспалительное средство. Применяют наружно (1–5% растворы) для смазывання слизистых оболочек верхних дыхательных путей; для промывания мочеиспускательного канала и мочевого пузыря при гонорейном хроническом уретрите (1–3% раствор); в очной практике при коньюнкивите, блефарите, бленнорее (очные капли 1– 3% раствор). Растворы отпускают и хранят в посуде из темного стекла. Форма выпуска: порошок. В связи с наличием других современных антибактериальных препаратов (сульфаниламидов, антибиотиков и др.) препараты Аргентума широкого применения в настоящее время не имеют. Колларгол Collargolum Argentum colloidale Серебро коллоидное Содержит 70–75% серебра Ag и 25% Na-солей лизальбиновой и протальбиновой кислот. Впервые коларгол введен в медицинскую практику в 1897 году врачом Креде. Получение Получение препарата состоит из таких стадий. 1. Получение аргентум оксида путем взаимодействия раствора аргентум нитрата AgNO3 со щелочью NaOH: 2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O 2. Восстановление аргентум оксида до серебра белковыми веществами. Свежеполученный и промытый осадок Ag2O обрабатывают восстановительной смесью Na-солей лизальбиновой и протальбиновой кислот, которые получают при щелочном гидролизе яичного белка. Они восстанавливают Ag2O до серебра Ag, которое остается в растворе в виде коллоида. Полученный препарат очищают в диализаторе и выпаривают в вакууме. Свойства Описание. Зеленовато-черные или синеваточерные мелкие пластинки с металлическим блеском. Растворимость. Растворим в воде с образованием коллоидного раствора желтоватого или красно-бурого оттенка. Идентификация Общие реакции идентификации протаргола и колларгола см. выше. В отличие от протаргола, при прибавлении к раствору колларгола раствора НCІ выпадает темнобурый осадок Ag-лизальбината, который легко растворяется в щелочах. Количественное определение (проводят только после “сухого” озоления или “мокрого” окисления, т.е минерализации). 1. При “сухом” озолении препарат сжигают в присутствии натрий гидрокарбоната NaHCO3. Зольний остаток, содержащий Ag, Na2CO3 и зольные элементы белковых веществ, растворяют в нитратной кислоте HNO3: Ag + 2HNO3 AgNO3 + NO2 + H2O Образовавшийся аргентум нитрат AgNO3 определяют количественно методом тиоцианатометрии (см. аргентум нитрат). Em (AgNO3) = M.м. 2. При “мокром” окислении на раствор препарата действуют сильными окислителями (HNO3, KМnO4 в среде H2SO4, H2O2 в среде H2SO4) в колбе Кьельдаля. Органические вещества окисляются, а Аргентум переходит в состав солей (AgNO3, Ag2SO4), которые также определяют методом тиоцианатометрии. Хранение. В хорошо укопоренных банках оранжевого цвета, в защищенном от света месте. Список сильнодействующих веществ. Применение. Сильное бактерицидноей средство. Применяют наружно для промывания гнойных ран (0,2– 1% раствор); для промывания мочевого пузыря при хронических циститах, уретритах (1–2% растворы); для лечения гнойных коньюнктивитов и бленнореи в виде 2–3– 5% очных капель. При рожистых воспалениях, лимфангите, мягком шанкре назначают иногда втирания 15% мази – взрослым – 3 г, детям – 1 г 4 раза в день Форма выпуска: порошок. Неорганические препараты Меркурия Ртуть известна с глубокой древности. При обычной температуре – это жидкий металл (температура кипения 357 С, температура замерзания –39 С), напоминающий по блеску серебро . Поэтому греки называли ее “серебрянной водой” – хюдраргирон (от греч. “хюдор” – вода и ”аргюрон” – серебро). Отсюда и латинское название элемента Hydrargyrum и химический знак (символ) Hg. Алхимики называли ее Mercurius (Меркурий) из-за чрезвычайной подвижности капель ртути (иногда ртуть поэтому называют “живое серебро”). Распространение в природе. Ртуть сравнительно мало распространена в природе. Иногда встречается в свободном состоянии (самородная ртуть, вкрапленная в горные породы), а в основном – в виде минерала киноварь HgS, встречающегося на Урале, Донбассе, Туркменистане, Фергане и др. Получение ртути Обжиг киновари в специальных печах в струе воздуха при температуре 360 С: HgS + О2 = Hg + SО2 Химические свойства Ртуть – малоактивный металл, Она легко растворяет в себе металлы, образуя амальгаммы. С хлоридной кислотой HCl и сульфатной Н2SО4 на холоду не реагирует. Горячая концентрированная сульфатная кислота реагирует с ртутью с выделением сернистого газа SО2 : Hg + 2Н2SО4 = HgSО4 + SО2 + 2Н2О Реагирует ртуть также с галогенами и с разбавленной нитратной кислотой HNO3: 3Hg + 8НNО3 = 3Hg(NО3)2 + 2NО + 4Н2О Пары ртути очень ядовиты! Меркурий образует два типа соединений: меркуросоединения (Hg2+) и меркурисоединения (Hg22+). Основные соединения Hg2+: меркурий(ІІ) оксид HgО (основание Hg(ОН)2 не существует, ибо сразу разлагается), сулема HgCl2, меркурий(ІІ) нитрат Hg(NО3)2 и др. Соединения Hg(І) (Hg22+) только формально являются одновалентными, поскольку связаны между собой попарно с образованием групп – Hg–Hg– . Основные соединения: меркурий(І) оксид Hg2О (основание HgОН также не существует, ибо сразу разлагается), каломель Hg2Cl2 , меркурий(І) нитрат Hg2(NО3)2 и др. Фармакологическое действие и медицинское применение. Соли Меркурия проявляют разностороннее фармакологическое действие: а) антисептическое (способны осаждать белки, в т.ч. микроорганизмов); б) мочегонное (выводятся почками и раздражают эпителий почек, что способствует мочевыделению; в) слабительное (раздражают кишечник). В медицинской практике применяются теперь меркурия дихлорид HgCl2 (был первым ртутным препаратом, нашедшим применение в качестве антисептического и дезинфицирующего средства) и меркурия оксид HgО (ртути оксид желтый). Раньше неорганические препараты Меркурия применялись очень широко. В частности, ртуть очищенная Hg в виде серой ртутной мази (для лечения сифилиса и кожных паразитарных болезней); меркурия монохлорид Hg2Cl2 (слабительное и желчегонное средство), меркурия йодид HgI2 (для лечения сифилиса в виде микстуры с калия йодидом), меркурия амидохлорид HgNH2Cl (белая ртутная мазь, в дерматологии), меркурия цианид Hg(CN)2 (для полосканий и спринцеваний 1:1000, 1:2000), меркурия оксицианид Hg(CN)2HgO (дезинфицирующее средство 1:5000, 1:10000 при гонорее, бленнорее, циститах) теперь практически не применяются. Первая помощь при отравлении препаратами Меркурия Все соединения Меркурия ядовиты и их токсичность тем выше, чем лучше они растворяются в воде и больше диссоциированы. Наиболее опасными являются хронические отравления. При отравлении ртутью чувствуется металлический привкус во рту и боли в животе; появляется рвота, ослабление кишечника, угнетение сердечной деятельности. Особенно чувствительны до ртутных препаратов люди с больными почками. Первая помощь при отравлении ртутью – антидот от металлов Antidotum metallorum (cм. отравления Арсеном, лекция № 3) либо суспензия угля активированного. Одновременнно необходимо пить молоко, белковую воду, слизистые отвары, суспензию жженной магнезии (MgO). Нельзя употреблять натрия хлорид NaCl, так как может образоваться растворимая сулема HgCl2. Как противоядие применяют унитиол, дикаптол (см. отравление Арсеном, лекция № 3), а также тетацин-кальций. Тетацин-кальций Na2Ca-ЭДТА H2C N CH2COONa CH2COO Ca H2C N * 7 H2O CH2COO CH2COONa Химическое название: динатриево-кальциевая соль этилендиаминотетраацетатной кислоты. Свойства Тетацин-кальций – белый еристаллический порошок, растворимый в воде. При прокаливании в тигле образует смесь натрий карбоната Na2CO3 и кальций карбоната СаСО3. Применение Прнцип его действия как антидота состоит в том, что это вещество способно замещать ионы Са2+ на ионы тяжелых металлов с образованием малотоксичных труднорастворимых комплексов, которые бысто выводятся из организма из мочой. Вводят внутривенно по 20 мл 10%-ного раствора капельным путем 2 раза в день. Ртути хлорид ГФУ, дополн. 1 Меркурия дихлорид Hydrargyri dichloridum HgCl2 MERCURIC CHLORIDE Hydrargyrum dichloratum М.м. = 271,50 г/моль Hydrargyrum bichloratum 99,5–100,5% HgCl2 Сулема Получение 1. Растворение металлической ртути в сульфатной кислоте и нагревание в присутствии большого количества нитратной кислоты Hg = 2H2SO4 = HgSO4 + SO2 + 2H2O Раствор выпаривают досуха, а остаток смешивают с натрий хлоридом, небольшим количеством манган(IV) оксида (катализатор) и нагревают. При этом меркурий хлорид сублимирует HgCl2, а натрий сульфат Na2SO4 остается в виде сухой соли: HgSO + 2NaCl = HgCl + Na SO Cвойства Описание. Кристаллический порошок белого цвета или белые или бесцветные кристаллы, или тяжелая кристаллическая масса. Растворимость. Растворим в воде Р, эфире Р и глицерине Р, легко растворим в 96% спирте Р. Идентификация Раствор субстанции в воде, свободной от СО2, дает реакции на Меркурий. 1. Реакции на катионы Меркурия Hg2+. а) ГФУ. Реакция с очищенной медной фольгою - образуется темно-серое пятно (Hg) HgCl2 + Cu = CuCl2 + Hg б) ГФУ. Взаимодействие с раствором натрий гидроксида разбавленным образуется густой осадок желтого цвета (HgO): HgCl2 + 2NaOH = HgO + 2NaCl + H2O в) ГФУ, N. Реакция с раствором калий иодида - образуется красный осадок (HgI2), растворимый в избытке реактива с образованием комплексной соли калий тетраиодомеркурата K2[HgI4]: HgCl2 + 2KI = HgI2 + 2KCl HgI2 + 2KI = K2[HgI4] г) ГФ Х. Реакция с раствором натрий сульфида - образуется коричнево-черный осадок HgS, нерастворимый в нитратной кислоте, но растворимый в “царской воде”, смеси гидроген пероксида и хлоридной кислоты и др. HgCl2 + Na2S = HgS + 2NaCl 2. Реакции на хлорид-ионы Cl– (cм. кальция хлорид). а) ГФУ. Реакция с раствором аргентум нитрата в присутствии нитратной кислоты; образуется белый творожистый осадок 3 2AgCl + Hg(NO ) HgCl2 + 2AgNO3 HNO 3 2 AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O При прибавлении HNO3 снова выпадает осадок аргентум хлорида AgCl: [Ag(NH3)2]Cl + HNO3 = AgCl↓ + 2NH4NO3 б) ГФУ. Действие калий дихромата К2Cr2O7 в присутствии кислоты сульфатной H2SO4 ; выделяется газ хлор Cl2, который окрашивает индикаторную бумажку, смоченную дифеникарбазидом, в фиолетовокрасный цвет. 3HgCl2 + K2Cr2O7 + 7H2SO4 = 3Cl2 + Cr2(SO4)3 + 3HgSO4 + К2SO4 + 7H2O Cr2O72– + 14H+ + 6е 2Cr3+ + 7Н2О 2Cl– – 2е Cl2 Cr2O72– + 6Cl– + 14H+ 2Cr3+ + 3Cl2 + 7Н2О Количественное определение 1. ГФУ, дополн. 1. Комплексонометрия, обратное титрование. Химизм происходящих процессов можно представить с помощью таких уравнений: 1). HgCl2 + Na2H2-ЭДТА Na2Hg-ЭДТА + 2HCl (связывают буферным раствором рН 10,9) избыток 2). Na2H2-ЭДТА + ZnSO4 Na2Zn-ЭДТА + H2SO4 (связывают буферным раствором рН 10,9) не прореаг. титрант H2Ind + ZnSO4 ZnInd + H2SO4 (связывают буферным раствором рН 10,9) лишняя капля пурпурное окраш. 3). Na2Hg-ЭДТА + 4KI Na2K2-ЭДТА + K2[HgI4] Константа стойкости комплекса K2[HgI4] значительно больше, чем константа стойкости комплекса Na2Hg-ЭДТА. Поэтому комплекс Na2HgЭДТА разрушается и все катионы Меркурия, содержащиеся в исследуемой субстанции HgCl2, связываются избытком KI в комплекс K2[HgI4]. 4). Na2K2-ЭДТА + ZnSO4 Na2Zn-ЭДТА + К2SO4 H2Ind + ZnSO4 ZnInd + H2SO4 (связывают буферным раствором рН 10,9) лишняя капля пурпурное окраш. Еm(HgCl2) = М.м. HgCl2 1 моль Na2Hg-ЭДТА Na2K2-ЭДТА 1 моль 1 моль ZnSO4 1 моль 2. Иодометрия, обратное титрование после предварительного восстановления препарата раствором формальдегида HCHO в щелочной среде KOH до свободной ртути Hg: HgCl2 + HCHO + 3KOH = Hg + HCOOK + 2KCl + 2H2O Полученную ртуть окисляют избытком раствора йода I2 в присутствии калий йодида KI до комплексной соли калий тетрайодомеркурата K2[HgI4]: 2KI + Hg + I2 = K2[HgI4] Не прореагировавший йод I2 титруют стандартным раствором натрий тиосульфата Na2S2O3 в присутствии крахмала (до исчезновения синего окрашивания): I2 + 2Na2S2O3 = 2NaI + Na2S4O6 I2 + 2е 2I– 2S2O32– – 2е S4O62– Еm(HgCl2) = М.м./2 Еm(Na2S2O3) = М.м. 3. Аргентометрия по методу Фольгарда. К водному раствору сулемы HgCl2 прибавляют соответствующее количество цинковой пыли Zn и нагревают: HgCl2 + Zn = Hg + ZnCl2 После охлаждения раствор фильтруют. Содержащийся в фильтрате цинк хлорид ZnCl2 в количестве, эквивалентном до HgCl2, определяют аргентометрически по методу Фольгарда. С этой целью прибавляют избыток стандартного раствора аргентум нитрата AgNO3 : ZnCl2 + 2AgNO3 = 2AgCl + Zn(NO3)2 Не прореагировавший AgNO3 титруют стандартным раствором аммоний тиоцианата NH4SCN в присутствии феррум-аммониевых квасцов FeNH4(SO4)2 до появления розового окрашивания, обусловленного Fe(SCN)3: AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + FeNH4(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Em (HgCl2) = М.м./2 4. Алкалиметрия, обратное титрование (метод разработан в Румынии). Раствор сулемы осаждают с помощью калий йодида KI, а затем растворяют в избытке реактива до K2[HgI4]: 2HgCl2 + 4KI = 4KCl + 2K2[HgI4] При действии цинка Zn образуется эквивалентное количество цинк йодида ZnI2, на который действуют при нагревании избытком натрий гидроксида NaOH до получения осадка цинк гидроксида Zn(OH)2: K2[HgI4] + Zn = ZnI2 + Hg + 2KI ZnI2 + 2NaOH = Zn(OH)2 + 2NaI Не прореагировавший NaOH титруют стандартным раствором хлоридной кислоты HCl в присутствии метилового оранжевого до появления розового окрашивания: NaOH + HCl = NaCl + H2O Хранение. В защищенном от света месте. Список ядовитых и наркотических веществ. (под замком), в темном защищенном от света месте, у плотно закупоренном контейнере. Растворы сулемы подкрашивают эозином, на посуду наклеивают соответствующие этикетки для предупреждения о ядовитости. Измельчение проводят в присутствии спирта с целью предохранения от распыления, вызывающего токсическое действие. Применение. Дезинфицирующее средство. Применяют сулему только наружно для дезинфекции белья, одежды, мытья стен и предметов ухода за больными в разведении 1:1000, 2:1000. Не допускать попадания на слизистые оболочки и кожу: сулема является сильным ядом и может всасываться через слизистую оболочку и кожу рук, вызывая отравление (работать следует в резиновых перчатках). Формы выпуска: порошок; таблетки (по 0,5 и 1 г), состоящие из равных частей HgCl2 и NaCl, таблетки окрашены 1% раствором эозина в розовый или красно-розовый цвет, дают опалесцирующий раствор такого же цвета. Таблетки предназначены только для наружного применения (для приготовления растворов). Ртути окись желтая ГФ Х Hydrargyri oxydum flavum HgO Hydrargyrumoxydatumflavum М.м. = 216,59 г/моль Hydrargyrum praecipitatum flavum не менее 99,0% Ртуть осадочная желтая Химическое название: меркурий(ІІ) оксид Получение 1. Взаимодействие растворимых солей Меркурия(II) (HgCl2 или Hg(NO3)2) c натрий гидроксидом: HgCl2 + 2NaOH = HgO + 2NaCl + H2O Для получения препарата, не содержащего посторонних примесей, концентрированный раствор меркурий дихлорида HgCl2 прибавляют к раствору натрий гидроксида NaOH. Если прибавлять раствор щелочи до сулемы, образуется основная соль HgOHCl, от которой трудно избавиться. Осадок HgO фильтруют, промывают водой и сушат. Все операции необходимо проводить в темноте, иначе может образоваться меркурий(І) оксид Hg2O черного цвета. 2. Прокаливание меркурий(ІІ) нитрата: Hg(NO3)2 2HgO + 4NO2 + O2 Однако в этом случае образуется крупнодисперсный HgO красного цвета, который в медицине не применяется (высокодисперсный HgO имеет желтый цвет). Свойства Описание. Желтый или оранжево-желтый тяжелый, мелкодисперсный, аморфный порошок без запаха. Растворимость. Не растворяется в воде, спирте, легко растворяется в кислотах (HCl, СН3СООН и HNO3) с образованием соответствующих солей Меркурия. Это свидетельствует об основных свойствах HgO: HgO + 2HCl = HgCl2 + H2O Идентификация 1. Реакции на катионы Меркурия Hg2+ (после растворения препарата в хлоридной кислоте HCl)(cм. меркурия дихлорид): а) ГФУ. Реакция с очищенной медной фольгой; образуется темно-серое пятно (Hg), которое при натирании становится блестящим. б) ГФУ. Взаимодействие с раствором натрий гидроксида разбавленным; образуется густой осадок желтого цвета (HgO). в) ГФУ, N. Реакция с раствором калий йодида; образуется красный осадок (HgI2), растворимый в избытке реактива с образованием комплексной соли калий тетрайодомеркурата K2[HgI4]. г) ГФ Х. Реакция с раствором натрий сульфида; образуется коричнево-черный осадок HgS, нерастворимый в нитратной кислоте. Количественное определение 1. ГФ Х. Ацидиметрия, непрямое титрование (по заместителю). HgO + 4KI + H2O = K2[HgI4] + 2KOH KOH + HCl = KCl + H2O Em (HgО) = М.м./2 2. Тиоцианатометрия. Навеску препарата растворяют в нитратной кислоте HNO3 и полученную соль Hg(NO3)2 титруют стандартным раствором аммоний тиоцианата NH4SCN в присутствии индикатора феррум-аммиачных квасцов FeNH4(SO4)2 до розового окрашивания (Fe(SCN)3): HgO + 2HNO3 = Hg(NO3)2 + H2O Hg(NO3)2 + 2NH4SCN = Hg(SCN)2 + 2NH4NO3 3NH4SCN + FeNH4(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Em (HgO) = М.м./2 Хранение. Список сильнодействующих веществ. В плотно закупоренных банках оранжевого стекла, в защищенном от света месте. На свету может образоваться Hg2O, вызывающий потемнение лекарственной субстанции. Применение. Антисептическое средство. Применяют как антисептическое средство в виде 2% мази (Unguentum Hydrargyri oxydi flavi) в очной практике (при блефаритах, кератитах, конъюктивитах). При кожных заболеваниях (сикоз, себорея) применяют в виде желтой ртутной мази вместе с ихтиолом, цинка оксидом или серой. Мазь готовят ex tempore. Отпускают в таре, предохраняющей от действия света. Препараты Феррума Распространение в природе. Феррум обычно в природе находится в виде железных руд: магнитный железняк (магнезит) – Fe3O4; красный железняк (гематит ) – Fe2O3; бурый железняк (лимонит) Fe2O3nH2O; железный шпат (сидерит) – FeСО3; железный колчедан (пирит) – FeS2; халькопирит – CuFeS2. Основные залежи этих руд в Украине имеются в Кривом Роге, в России – на Урале, Курская магнитная аномалия и др. Феррум – d-элемент VIII группы периодической системы элементов. В соединениях он проявляет переменную валентность: ІІ, ІІІ и VI. Соединения Fe(II) обычно белого или слегка зеленоватого цвета; они неустойчивы и кислородом воздуха окисляются до Fe(III) – соединений красно-бурого цвета. Биологическая роль и медицинское применение. Феррум играет важную роль в жизнедеятельности живых организмов. Он входит в состав гемоглобина крови, миоглобина мышц, берет участие в процессах газообмена, стимулирует функцию кровотворных органов. Соли Феррума проявляют вяжущее и прижигающее действие в зависимости от концентрации. Применяют препараты Феррума при малокровии, гипохромных анемиях и как кровоостанавливающие средства. В качестве препаратов используют: 1. Железо восстановленное Ferrum reductum. 2. Феррума(ІІ) сульфат Ferri sulfas. 3. Феррума(ІІ) лактат Ferri lactas. 4. Комплексные препараты Феррума (вместе с витаминами). Феррума(II) сульфат гептагидрат ГФУ, дополн. 1 Ferrosi sulfas heptahydricus FeSO47Н2О FERROUS SULPHATE HEPTAHYDRATE Ferri(II) sulfas Ferrum sulfuricum oxydulatum М.м. = 278,03 г/моль Железный купорос 98,0–105,0% Химическое название: феррум(ІІ) сульфат гептагидрат Имеется еще феррума(ІІ) сульфат высушенный Ferri(ІІ) sulfas exsiccatus FeSO4Н2О, содержащий не меньше 82,0% препарата. Его получают высушиванием FeSO47Н2О на водяном нагревателе до потери в масее 35%. Получение 1. Растворение восстановленного железа в 25– 30% растворе H2SO4 при температуре 80 С: Fe + H2SO4 = FeSO4 + H2 Железо берут в избытке, так как неизмененное железо вытесняет менее активные (тяжелые ) металлы с их соединений (примесей) и препарат получают более чистым. Чтобы не образовались основные соли (вследствие гидролиза FeSO4), выпаривание ведут в присутствии спирта или избытка сульфатной кислоты H2SO4. Выделившиеся кристаллы отфильтровывают и высушивают при температуре 30 С, а при 64 С вещество плавится в собственной кристаллизационной воде. Свойства Описание. Кристаллический порошок светлозеленого цвета или голубовато-зеленые кристаллы. На воздухе выветривается. При 100 С тратит 6 молекул воды (FeSO4Н2О), а при 250–300 С становится безводным (FeSO4). Растворимость. Легко растворимый в воде Р, очень легко растворимый в кипящей воде Р, практически нерастворимый в 96% спирте Р. (Феррума(ІІ) сульфат окисляется во влажном воздухе, окрашиваясь в коричневый цвет). Идентификация 1. Реакции на ионы Феррума Fe2+: а) ГФУ. Реакция с калий феррицианидом (калий гексациано(ІІІ) ферратом) K3[Fe(CN)6]. К испытуемому раствору прибавляют раствор калий феррицианида Р; образуется синий осадок (берлинская лазурь KFe[Fe(CN)6] или Fe3[Fe(CN)6]2), нерастворимый при прибавлении кислоты хлоридной разбавленной Р. FeSO4 + K3[Fe(CN)6] KFe[Fe(CN)6] + K2SO4 или 3FeSO4 + 2K3[Fe(CN)6] Fe3[Fe(CN)6]2 + K2SO4 Осадок разрушается щелочами: Fe3[Fe(CN)6]2 + 6KОН = Fe(OН)3 + 2K3[Fe(CN)6] б) Реакция с аммоний сульфидом (NH4)2S; образуется черный осадок FeS, растворимый в разбавленных минеральных кислотах: 3FeSO4 + (NH4)2S = FeS + (NH4)2SO4 в) Взаимодействие с раствором щелочи NaOH или аммиака NH4OH; образуется осадок светло-зеленого цвета Fe(OH)2, который на воздухе постепенно буреет (вследствие окисления до Fe(OH)3): FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 г) Реакция с диметилглиоксимом (реактивом Чугаева) в среде аммиака; образуется раствор красного цвета (образуется хелатное соединение Fe2+ с диметилглиоксимом): H3C H3C C N OH + C Fe2+ + 2 NH3 N OH H3C C H3C C N O HO N C Fe N OH O N C CH3 + 2 NH4+ CH3 д) Реакция с 2,2-дипиридилом (офенантролином) в кислой среде; образуется комплекс темно-красного цвета: N FeSO4 + N Fe N SO4 N 2. Реакции на сульфат-анионы SO42– (см. купрума сульфат и натрия сульфат (лекция № 2): а) ГФУ. Реакция с раствором барий хлорида ВаCl2 в среде хлоридной кислоты HCl; образуется белый осадок ВаSO4, нерастворимый в минеральных кислотах и щелочах. б) ГФУ. К суспензии, полученной в реакции а), прибавляют раствор йода I2; желтое окрашивание не исчезает (отличие от сульфитов SO32– и дитионитов S2O32–), но обесцвечивается при прибавлении каплями раствора станум(ІІ) хлорида SnCl2 (отличие от йодатов IO3–). Смесь кипятят; осадок не обесцвечивается (отличие от селенатов и вольфраматов): SO42– + I2 (йод не обесцвечивается). I2 + SnCl2 + 4HCl = 2HI + H2[SnCl6] (йод обесцвечивается) Количественное определение 1. ГФУ, дополн. 1. Цериметрическое титрование. 2 FeSO4 + 2 (NH4)2Ce(NO3)6 + 2 H2SO4 Fe2(SO4)3 + 2 Ce(NO3)3 + (NH4)2SO4 + 2 NH4NO3 + 4 HNO3 Индикатор – ферроин (красное окрашивание) получают растворением о-фенантро-лина в растворе феррума (II) сульфата. В точке эквивалентности Се4+ окисляет Fe2+ в Fe3+, который с о-фенантролином образует комплекс синего цвета. Титруют до появления зеленого окрашивания (синий цвет комплекса с желтым раствором титранта образует зеленое окрашивание): 2+ 3+ N 4+ + Ce же л т о е о кр а ш . Fe N N + Fe N 3 ф е рроин (кр а с н о е о кр а ш и ва н и е ) 3 с и н е е о кр а ш и в а н и е Em (FeSO47Н2О) = М.м. 3+ Ce 2. Перманганатометрия, прямое титрование исследуемого раствора, подкисленного сульфатной кислотой H2SO4, стандартным раствором калий пермнганата KMnO4 до бледно-розового окрашивания: 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O MnO4– + 8H+ + 5e Mn2+ + 4H2O | 5 | 2 2Fe2+ – 2e 2Fe3+ |2|5 MnO4– + 5Fe2+ + 8H+ Mn2+ + 5Fe3+ + 4H2O Em (FeSO47Н2О) = М.м. Хранение. У воздухонепроникном контейнере (для предупреждения окисления и выветривания). Применение Применяют препараты Ферума(II) в комплексной терапии гипохромных (феррумдефицитных) анемий в качестве стимулирующего средства для кроветворных органов. Чистый FeSO47Н2О применяют редко. Дозы для взрослых: 0,3–0,5 г 3–4 раза в день. В частности, в Югославии разработан препарат “Ферро-градумент” – таблетки, в которых феррума(ІІ) сульфат находится в специальной полимерной губкообразной масе, что обеспечивает постепенное выделение Феррума в течение нескольких часов после приема таблеток внутрь. Феррума(ІІ) сульфат входит в состав комбинированных поливитаминных таблеток (“Глутамевит”, ”Компливит”, ”Олиговит”, “Фефолвит”, а также феррумсодержащих комплексных препаратов. 1. Феррокаль (Ferrocalum) – таблетки, покрытые оболочкой, в состав которыъ входит феррума(ІІ) сульфат, кальция фруктозодифосфат, церебролецитин. 2. Ферроплекс (Ferroplex) – драже белого цвета, содержащие феррума(II) сульфат и кислоту аскорбиновую (Венгрия). 3. Конферон (Conferon) – капсулы, содержащие феррума(ІІ) сульфат и натрия диоктилсульфосукцинат (Венгрия). 4. Тардиферон (Tardiferon) – депо-препарат феррума(II) сульфата. Для детей младшего и грудного возраста выпускают драже ”Бебе-тардиферон”) (Венгрия). 4. Ферро-фолик (Ferro-folik) – таблетки, покрытые оболочкой, содержащие феррума(ІІ) сульфат, фолиевую кислоту, аскорбиновую кислоту. Спасибо за внимание !