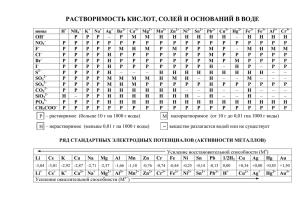
21. Вычислить значение электродного потенциала процесса Pb2+ → Pb4+, если концентрация [Pb2+] = 0,01, [Pb4+] = 10-2 моль/л. Решение: Pb4+ + 2e→Pb2+ E0(Pb2+/Pb4+) = +1,694 В согласно уравнению Нернста, при [Red]=[Pb2+]=0,01моль/л =[Ox]=[Pb4+]=10-2 моль/л, z=2 (число электронов, принимающих участие в процессе), электродный потенциал рассматриваемого процесса равен E(Pb2+/Pb4+)=E0(Pb2+/Pb4+) + (0,059/z)lg([Pb4+]/[Pb2+]) = = 1,694 + (0,059/2)lg([10-2]/[0,01]) = 1,694 В 32. Напишите уравнения электродных реакций и вычислите ЭДС гальванического элемента, образованного сочетанием кадмиевого электрода в растворе CdCl2, [Cd2+] = 0,01 моль/л и цинкового электрода в растворе ZnCl2, [Zn2+] = 2∙10-2 моль/л. Решение: Катодом (т.е. электродом, на котором протекает процесс восстановления) в гальваническом элементе будет электрод, имеющий большее значение стандартного электродного потенциала. E0(Cd2+/Cd) = -0,403 В E0(Zn2+/Zn) = -0,763 В В данной паре катодом является кадмий. Анодом – цинк. Схема гальванического элемента: (-) А Zn/ ZnCl2 // CdCl2 / Cd К (+) (-) А: Zn – 2e = Zn2+ (+) K: Cd2+ + 2e = Cd ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС =EК – ЕА По уравнению Нернста рассчитываем значение электродного потенциала анода. E(Zn2+/Zn) = E0(Zn2+/Zn) + 0,059/2lg[Zn2+] = -0,763 + 0,0295lg(2∙10-2) = -0,813 В E(Cd2+/Cd) = E0(Cd2+/Cd) + 0,059/2lg[Cd2+] = -0,403 + 0,0295lg(0,01) = -0,489 В 1 ЭДС =EК – ЕА = -0,489 – (-0,813) = 0,324 В Ответ: 0,324 В 70. В какой последовательности будут восстанавливаться катионы из растворов солей, содержащий катионы: Zn2+, Ag+, Pt2+, Pb2+? Решение: E0(Zn2+/Zn) = -0,763 В E0(Ag+/Ag) = +0,7991 В E0(Pt2+/Pt) = +1,2 В E0(Pb2+/Pb) = -0,126 В Окислитель тем сильнее, чем больше его потенциал. На катоде в первую очередь будут восстанавливаться частицы с большим потенциалом. Следовательно, последовательность разряда ионов на катоде будет следующая: Pt2+ Ag+ Pb2+ Zn2+ 2