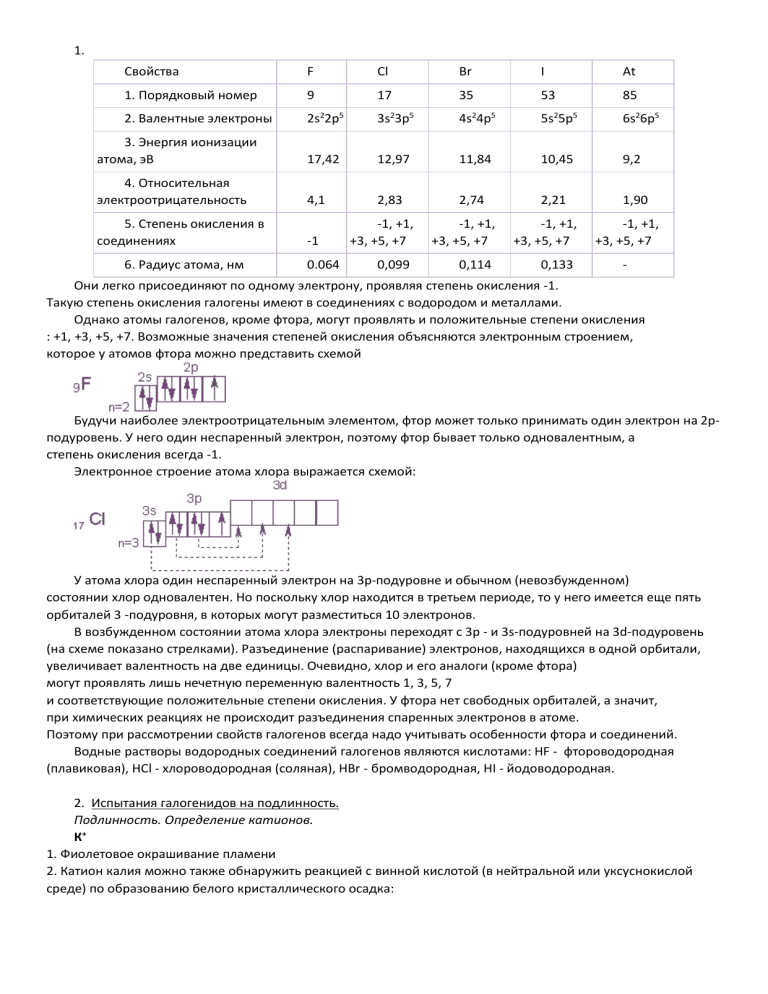
1. Свойства F Cl Br I At 1. Порядковый номер 9 17 35 53 85 2. Валентные электроны 2s22p5 3s23p5 4s24p5 5s25p5 6s26p5 3. Энергия ионизации атома, эВ 17,42 12,97 11,84 10,45 9,2 4. Относительная электроотрицательность 4,1 2,83 2,74 2,21 1,90 5. Степень окисления в соединениях -1 6. Радиус атома, нм 0.064 -1, +1, +3, +5, +7 -1, +1, +3, +5, +7 -1, +1, +3, +5, +7 0,099 0,114 0,133 -1, +1, +3, +5, +7 - Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представить схемой Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2рподуровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1. Электронное строение атома хлора выражается схемой: У атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3 -подуровня, в которых могут разместиться 10 электронов. В возбужденном состоянии атома хлора электроны переходят с 3p - и 3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений. Водные растворы водородных соединений галогенов являются кислотами: НF - фтороводородная (плавиковая), НСl - хлороводородная (соляная), НВr - бромводородная, НI - йодоводородная. 2. Испытания галогенидов на подлинность. Подлинность. Определение катионов. К+ 1. Фиолетовое окрашивание пламени 2. Катион калия можно также обнаружить реакцией с винной кислотой (в нейтральной или уксуснокислой среде) по образованию белого кристаллического осадка: 3. Соли калия в уксусно-кислой среде образуют с гексанитрокобальтатом (III) натрия желтый кристаллический осадок: К+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6] ↓ + Na+ Na+ 1. Окрашивание пламени в желтый цвет. 2. Na++Zn[(UO2)3(CH3COO)8] + CH3COOH + H2O → Na Zn[(UO2)3CH3COO)9]· 9H2O↓ 3. Na+ + K[Sb(OH)6] → Na[Sb(OH)6]↓ + K+ 4. Тринитрофенол также образует нерастворимую соль натрия: Определение анионов 1. Групповая реакция с AgNO3 – все галогениды под действием раствора AgNO3 в присутствии HNO3 дают творожистый осадок. Галогениды серебра отличаются друг от друга по цвету и по растворимости в растворе аммиака. Галогениды Цвет осадка AgCl Белый AgBr AgI Произведение растворимости Растворимость в растворе аммиака 1,7.10-10 Растворим Светложелтый 5,3.10-13 Мало растворим Желтый 8,5.10-17 Нерастворим 2. Бромиды можно также обнаружить по реакции с раствором сульфата меди и концентрированной серной кислоты. Появляется черный осадок, который обесцвечивается от нескольких капель воды (катализатор – серная кислота): 2Br– + CuSO4 → CuBr2↓ + SO42 черно-фиолетовая взвесь, исчезающая при добавлении воды 3. Йодиды под действием концентрированной серной кислоты выделяют фиолетовые пары йода. Из растворов йодидов при добавлении ацетата свинца выпадает осадок йодида свинца желтого цвета: 2I– + Pb(CH3COO)2 → PbI2↓ + 2CH3COO– желто-красный осадок Окислительно-восстановительные реакции Галогениды являются восстановителями. Легче всего отдает электрон I–, т.е. в сравнении Вr–, Сl–. Стандартный потенциал Е 2Сl -/Сl2 Е 2Вr-/Вr2 Е 2I-/I2 1. Легче всего окисляется йодид-анион до элементарного йода под действием хлорного железа: 2 I– + FeCl3 → I2 + FeCl2 + Сl– 2. Более жестких окислителей требует окисление бромид-аниона до элементарного брома. Для этого используют смесь воды и хлороформа ( несмешивающаяся двухфазная система), а в качестве окислителя используют хлорамин в присутствии соляной кислоты: реакцию наблюдают по окрашиванию хлороформного слоя. 3. Для окисления хлорид-аниона требуется сильный окислитель, такой как перманганат калия в серной кислоте. В этой реакции хлорид-анион восстанавливается до элементарного хлора: 10 NaCl + 2KMnO4 + 8H2SO4 → 5Cl2↑ + 2MnSO4 + 8H2O + 6NaSO4 Определение галогенидов при совместном присутствии 1. Дифференциация по различной растворимости НаlАg в растворах NH4OH и (NH4)2CO3 2. При совместном обнаружении галогенидов (Cl–, Br–, I–) используют их способность окисляться до свободных галогенов. Поскольку у них разные величины окислительно-восстановительных потенциалов, окисление идет поэтапно. В качестве окислителя используют раствор КМnО4, который в сернокислой среде в первую очередь вступает в реакцию с I– и окисляет его до свободного I2. окрашивающего хлороформ в фиолетовый цвет. При дальнейшем прибавлении КМnО4 идет более глубокое окисление до образования бесцветного соединения и в реакцию вступает Вr– – хлороформный слой окрашивается в желто-бурый цвет. Cl– как более слабый восстановитель не взаимодействует в этих условиях и может быть обнаружен в водном слое по реакции с AgNO3 ( после обесцвечивания водного слоя). 2KMnO4 +5 H2O + 3 H2SO4 → 2 MnSO4 +5 O2 + K2SO4 + 8 H2O Cl– + AgNO3 → AgCl↓ + NO3– 4. Классификация методов количественного определения галогенидов 1. Химические (титриметрические) 2. Физико-химические (инструментальные) Физико-химические методы: 1. Метод рефрактометрический; 2. Метод ионообменной хроматографии: для NaCl, KCl, NaBr, KBr, но не применим для I–, т.к. НI не устойчива (при определении на катионитах), I– окисляет анионит. Kat [R-SO3]H + NaCl → [R-SO3]Na + HCl HCl + NaOH → NaCl + H2O [An] OH + NaCl → [An]Cl + NaOH NaOH + HCl → NaCl + H2O Химические методы: 1. Осадительные 2. Окислительно-восстановительные. Осадительные: а) аргентометрия б) меркуриметрия (Нg+2) в) меркурометрия (Нg+1) Окислительно-восстановительные: а) галогенометрическое определение б) перманганатометрическое определение Аргентометрическое титрование Метод основан на реакциях осаждения галогенидов (Сl–, Вr–, I–) стандартным раствором АgNО3. Аргентометрическое титрование в зависимости от химических свойств вещества может быть выполнено прямым и обратным способами. К способам прямого титрования относятся: метод Гей-Люсака (безиндикаторный). Метод Мора. Метод применяется для анализа Сl–, Вr–, имеющих в титруемых растворах рН в пределах от 6,5 до 10. В качестве индикатора используют К2СrО4 NaCl + AgNO3 → AgCl↓ + NaNO3 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3 f=1 В присутствии галогенид-ионов осадок Ag2CrO4 не образуется, т.к. его растворимость (1·10-4 моль/дм3) больше растворимости АgCl (1,25·10-5 моль/дм3) и AgBr (7,94·10-7 моль/дм3). Поэтому из растворов при титровании прежде всего выпадают осадки галогенидов Аg+, и лишь только после полного осаждения Сl– и Вr– , начинает образовываться осадок Ag2CrO4. Титрование методом Мора проводят при рН 6,8-10,3. в кислой среде равновесие: смещено вправо, и чувствительность индикатора резко понижается, так как дихромат-ионы не обладают индикаторными свойствами вследствие высокой растворимости дихромата серебра. В сильнощелочной среде образуется нестойкий гидроксид серебра (AgOH), разлагающийся до оксида серебра (Ag2О) и воды. Гидроксид и оксид серебра могут выпадать в осадок раньше хромата серебра. Титрование иодид-ионов не дает удовлетворительного результата, так как осадок йодида серебра адсорбирует хромат-ионы и точка конца титрования фиксируется неточно. Метод Фаянса. Применяется для титрования йодидов и бромидов. Прямое титрование в слабокислой среде (СН3СООН) в присутствии адсорбционных индикаторов. Бромфеноловый синий и флюоресцеин применяют при титровании Сl– и Вr–; эозинат Nа применяют при титровании I–. Адсорбционные индикаторы представляют собой кислоты НInd, распадающиеся при диссоциации на ионы: НInd↔ Н+ + Ind– Эозин нельзя применять при титровании хлоридов. Он представляет собой более сильную кислоту, чем флюоресцеин, адсорбируется на АgС1 раньше С1–, и осадок с начала титрования приобретает розовый цвет. В интервале рН 6,5-10,3 анионы флуоресцеина способны давать с ионами серебра. Адсорбированными на поверхности осадка, окрашенные адсорбционные соединения: При этом поверхность осадка окрашивается в розовый цвет, а см осадок коагулирует на дно колбы, в которой проводится титрование. 3. Примеси в препаратах галогенидов Барий, кальций и броматы определяют за одно испытание, прибавляя 1 млH2SO4, раствор должен быть прозрачным и не должен окрашиваться в желтый цвет в течении 5 минут. Ba2++ H2SO4кBaSO4 Ca2++ H2SO4кCaSO4 5Br-+ BrO3-+ 3H2SO43Br2+ SO42-+ 3H2O Примесь йодатов, тиосульфатов и сульфитов. Приб. несколько капель крахмала и разв.H2SO4. Жидкость не должна приобретать в течение 30 секунд заметного синего окрашивания. 5KI + KIO3+ 3H2SO43I2+ K2SO4+ 3H2O Синее окрашивание должно появиться при прибавлении не более одной капли 0,1 М I2. 2Na2S2O3+ I22NaI + Na2S4O6 Na2SO3+ I2+ H2ONa2SO4+ 2HI Примесь цианидов определяют, добавляяFeSO4,FeCl3. Подщелачивают, слегка нагревают, после подкисления раствор не должен окрашиваться в синий цвет (берлинская лазурь). 2CN-+ FeSO4Fe(CN)2+ SO424CN-+ Fe(CN)2[Fe(CN)6]4K4[Fe(CN)6] + FeCl3KFe[Fe(CN)6]-+ 3KCl Примесь йодидов определяют, добавляя 3 каплиFeCl3и несколько капель крахмала. В течение 10 мин. не должно быть синего окрашивания. 2I- + 2FeCl3 I2 + 2FeCl2 + 2ClПримесь нитратовопределяют, добавляяNaOHи цинковые или железные опилки. Нагревают. Влажная красная лакмусовая бумажка в парах жидкости не должна синеть. Zn + NaOH Na2ZnO2+ H2 NaNO3+ H2NH3+ NaOH + 2H2O Препараты: Natrii chloridum Натрия хлорид, NaCl, М. в. 58,44 Описание. Белые кубические кристаллы или белый кр. порошок без запаха, соленого вкуса Растворимость. Растворим в 3 ч. воды, мало растворим в спирте. Чистота: Кислотность и щелочность. К 50 мл того же раствора прибавляют 5 капель раствора бромтимолового синего и 0,1 мл 0,02 н. раствора едкого натра; должно появиться голубое окрашивание. К другим 50 мл того же раствора прибавляют 5 капель раствора того же индикатора и 0,1 мл 0,02 н. раствора соляной кислоты; должно появиться желтое окрашивание. Недопустимые примеси:Калий, Кальций, Барий +Допустимые примеси:Соли аммония, Магний, Железо, Тяжелые металлы, Сульфаты, Мышьяк. 5-6 Для определения подлинности лекарственных веществ чаще всего используется химический метод, т. к. он не требует эталонирования, а сводится к визуальному фиксированию результатов. Кроме того, он не требует дорогостоящего оборудования. В основе химического метода лежит аналитическая реакция, т. е. реакция, идущая с аналитическим эффектом (образование осадка, изменение окраски, появления запаха, выделение газа). К реакциям, используемым для доказательства подлинности вещества, предъявляются следующие требования: 1. Реакция должна быть по возможности специфичной. Специфические реакции – это реакции, которые позволяют получить с данным реагентом характерный аналитический эффект, свойственный только для данного вещества. Однако аналитическая практика располагает небольшим числом специфических реакций. 2. Чаще всего реакция является избирательной или селективной. Это реакции, которые, являясь групповыми, при выполнении определенных условий становятся избирательными к тому или иному веществу или структурной части. Следовательно, при поведении селективных реакций для создания условий, делающих реакцию таковой, предполагается использование одного или нескольких вспомогательных реагентов. 3. Реакция должна быть чувствительной. Под этим термином понимается наименьшее количество определяемого вещества, которое может быть обнаружено данным реактивом с учетом разведения. Этот термин близок по смыслу к понятию «предел обнаружения», который обозначает наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью. 4. Реакция должна идти быстро и сопровождаться обязательно отчетливым аналитическим эффектом. 10 Так как специфических реакций мало, а избирательные реакции позволяют определить, как правило, определенную структурную часть, поэтому для определения подлинности вещества используют обычно не одну, а несколько реакций, позволяющих обнаружить все структурные части лекарственного вещества, с которыми связано его фармакотерапевтическое действие. Кроме того, комплекс реакций чаще всего дает возможность получить информацию не только о природе структурных частей, но и о порядке их взаимодействия. При анализе лекарственных веществ неорганической природы, практически проводится элементный анализ, основанный на обнаружении ионов. Это связано с тем, что атомы элементов у веществ неорганической природы связаны чаще всего ионной связью. Для получения ионов, достаточно растворения вещества в воде, являющейся полярным растворителем и способствующей диссоциации вещества на ионы. При этом в растворе легко обнаружить каждый ион. В некоторых веществах атомы элементов связаны ковалентной связью, в этом случае для перевода вещества в ионогенное состояние необходима предварительная обработка. Примером могут служить оксиды ZnO, MgO и восстановленное железо. Их предварительно растворяют в кислотах. ZnO + 2HCl → ZnCl2 + H2O MgO + 2HCl → MgCl2 + H2O Fe + 2HCl → FeCl2 + H2↑ При этом образуется соль, которая в растворе легко диссоциирует на ионы, которые затем можно обнаружить 7 . Существует несколько различных методов аргентометрии, отличающиеся используемыми индикаторами (или их отсутствием) в процессе анализа[2]: метод равного помутнения (без индикатора); метод Мора (индикатор — хромат калия); метод Фольгарда (индикатор — тиоцианатные комплексы железа (III)); метод Фаянса (адсорбционные индикаторы). Наиболее широко в промышленности используется метод Фольгарда, с помощью которого проводят анализ на содержание галогенидов, арсенатов, оксалатов и других анионов, образующих малорастворимые соединения с катионами серебра, в кислой среде. Метод Мора применяется менее часто, анализируя вещества только в нейтральной среде 8