УРОК- ПРЕЗЕНТАЦИЯ ПО ХИМИИ (9 класс) по теме «Галогены»
реклама

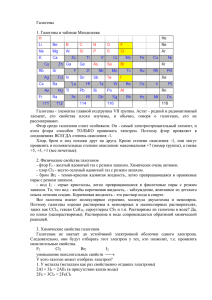
УРОК- ПРЕЗЕНТАЦИЯ ПО ХИМИИ (9 класс) по теме «Галогены» Подготовила: Гриднева М.Ф. учитель химии МОУ СОШ № 2 г. Миллерово Цели урока: проконтролировать знания учащихся, а также их практические навыки, умение решать экспериментальные задачи по теме «Галогены»; развивать у учащихся мышление, речь, умение работать с таблицами, используя информационные технологии; воспитывать аккуратность при работе с реактивами, формирование умений безопасного обращения с веществами. Методические рекомендации: Данную разработку урока можно использовать при изучении темы «Галогены» в разделе «Неметаллы» на уроке обобщения и систематизации, а также слайды можно изучать и в течении всей темы на уроке. Физические свойства Вещество Агрегатное состояние при обычных условиях Цвет Запах t t плавления кипения,C С Фтор F2 Газ не сжижается при обычной температуре под давлением Светло желтый Резкий раздражаю щий -220 -180 Хлор Cl2 Газ, сжижающийся при обычной температуре под давлением Жёлтозелёный Резкий удушливый -101 -34 Бром Br2 Жидкость Буровато коричневый Резкий зловонный -7 +58 Йод I2 Твёрдое вещество Чёрно фиолетовый с металлическим блеском резкий +114 +186 Открытие галогенов Получен в1866 г. французским химиком Анри Муассаном (от греческого «фторос»-разрушающий). Открыт известным химиком К.Шееле в 1774г. (от греческого «хлорос» – желто-зелёный). Открыт в 1826 г. французским химиком А.Баларом • (от греческого «бромос» – зловонный). Открыт в 1811г . французом Б.Куртуа (от греческого «йодес»-фиолетовый). Биологическое значение галогенов Нервные клетки железы( обмен веществ) F Зубная эмаль кости мышцы поступает в организм с солью рост волос пищеварение ( желудочный сок) обмен веществ CL Придает бодрость, силу плазма крови мускульное возбуждение Пищеварение аппет ит биение сердца гормоны J щит овидная железа работ а мозга т емперамент •Поступает в организм: • Хлеб, яйца, молоко, вода, морская капуста, морской воздух при дыхании, лекарства. ЦНС(возбуждение и торможение) Br Содержится в: морских водорослях ,при дыхании морским воздухом ,лекарства . Определение галогенов Определяемый Ион Ион, используемый для определения Результат F Ca2+ CaF2 осадок Cl Ag+ Br Ag I Ag AgCl осадок белый творожный AgBr осадок светло желтый AgI осадок желтый Галогены в природе Сильвин Cl 0,19% От массы • KCl Земной коры • галит сильвинит • NaCL KCL* Na CL • • • • • • 0,03% F Флюорит (плавиковый шпат CaF2) Br и I – рассеянные элементы в виде минералов нет Вода морей и океанов Воды буровых скважин Водоросли морские Химическая эстафета NaBr Br2 HBr AgBr CuBr2 2NaBr+Cl2=2NaCl+Br2 HBr+AgNO3=AgBr +HNO3 Br2+H2=2HBr Br2+Cu=CuBr2 HCl Cl2 Cl2+H2=2HCl NaCl+ AgNO3=AgCl +HNO3 HCl+AgNO3=AgCl +HNO3 NaCl AgCl Cl2+2Na=2NaCl + NaCl + + + CuCl2 + NaHSO4 + H2O Na2SO4 KOH + KClO + + + + CaCl2 AgCl + H2O Br2 + NaOH + NaCl + HBrO + + AgBr + HNO3 MnO2 + + Cl2 + H2O + HClO + NaOH + NaCl + Конкурс химиков - аналитиков Распознать растворы: сульфата натрия, хлорида калия, иодида калия. Ответ: AgNO3 KCl BaCl2 Na2SO4 AgNO3 NaBr Распознать растворы: хлорида калия, бромной и йодной воды. раствор крахмала I2 BaCl2 Na2SO4 Br2