ГАЛОГЕНЫ Разработано учителем химии МОБУ «Лицей №5» г. Оренбурга Павловой Е.С
реклама

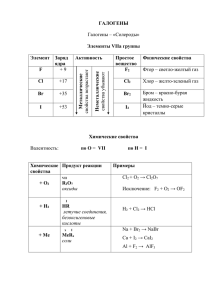
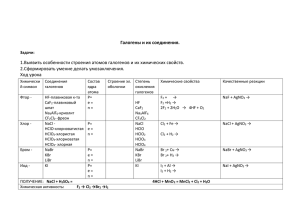
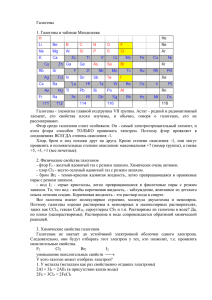
ГАЛОГЕНЫ Разработано учителем химии МОБУ «Лицей №5» г. Оренбурга Павловой Е.С Историческая справка Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиус галогены (греч. hals – соль, gen – рождаю) 1886 – открыт фтор (Анри Муассан, фр. химик, Нобелевская премия) Фтор (греч. phtoros – разрушение) 1774 – открыт хлор (Карл Шееле, шведский химик) 1826 – открыт бром (Антуан Балар, фр. химик) 1811 – открыт йод (Бернар Куртуа, фр. химик) Бром (греч. bromos – зловонный) Иод (греч. iodes – фиолетовый) 1940 – открыт астат (Д. Корсон, К. Р. Маккензи, Э. Сегре, калифорнийский университет в Беркли) 2009—2010 – открыт элемент №117 (унунсептий) (Объединённый институт ядерных исследований в Дубне, Россия) Астат (греч. astatos – неустойчивый) Унунсептий (лат. – сто семнадцатый) Хлор (греч. khloros – бледно-зеленый) Распространенность в природе флюорит CaF2 галит NaCl сильвин KCl сильвинит KCl•NaCl Строение атома 35 Количество валентных электронов Количество энергетических уровней Радиус атома Восстановительные свойства Металлические свойства Электроотрицательность Как изменяются свойства? Строение молекулы F2 Cl2 Br2 I2 F-F Cl-Cl Br-Br I-I Связь ковалентная неполярная, одинарная, кристаллическая решетка молекулярная. Физические свойства , способно к возгонке Химические свойства 1) Взаимодействие с металлами: Cu + Cl2 = Fe + Cl2 = 2) Взаимодействие с неметаллами (галогены не взаимодействует с кислородом и азотом): H2 + F2 = 2HF (со взрывом) H2 + Cl2 = 2HCl (на свету) H2 + Br2 = 2HBr (при нагревании) H2 + I2 = 2HI (при нагревании, обратимая реакция) Химические свойства 3) Взаимодействие с водой: 2F2 + 2H2O = 4HF + O2 H2O + Cl2 HCl + HClO (хлорная вода) 4) Вытеснение менее активных галогенов из галогенидов : Cl2>Br2>I2 Cl2 + NaI = I2 + NaCl = Химические свойства 5) Взаимодействие со щелочами на холоду: 2NaOH + Cl2 = NaCl + гипохлорит NaClO + H2O натрия при нагревании: t 6NaOH + 3Cl2 = 5NaCl + NaClO + 3H2O хлорат 3 натрия Составить электронный баланс и расставить коэффициенты Получение F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: эл.ток 2Na + Cl 2NaCl 2 расплав ток H 2NaCl + 2H2O эл. 2 + Cl2+ H2O Cl2 в лаборатории получают: MnO2 + 4HCl = MnCl2 + Cl2 + H2O Закрепление В периодической системе галогены находятся в: А) главной подгруппе VIII группы; Б) побочной подгруппе VII группы; В) главной подгруппе VII группы; Г) главной подгруппе VI группы. Закрепление Для галогенов характерна степень окисления: А) -2; Б) -1 и -2; В) -2 и -3; Г) -1. Зкрепление Галогены могут проявлять положительную степень окисления в соединениях с: А) водородом; Б) кислородом; В) с металлами; Г) ни с одним из этих веществ. Закрепление Как меняется химическая активность галогенов в ряду: F, Cl, Br, I? А) увеличивается; Б) меняется беспорядочно; В) уменьшается; Г) не меняется. Закрепление При обычных условиях бром - это: А) газ; Б) жидкость; В) кристаллическое в-во; Г) жидкость или кристаллическое в-во. Закрепление Свободных орбиталей нет у: А) хлора; Б) брома; В) йода; Г) фтора. Закрепление Галогены в твердом состоянии имеют: А) атомную кристаллическую решетку; Б) молекулярную кристаллическую решетку; В) А и Б; Г) имеют особое строение. Домашнее задание §18, 20 Составить электронный баланс для реакций хлора со щелочами.