концентрация растворов музафарова О. Н
реклама

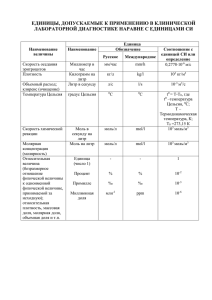
Профессиональный конкурс работников образования ВСЕРОССИЙСКИЙ ИНТЕРНЕТ-КОНКУРС ПЕДАГОГИЧЕСКОГО ТВОРЧЕСТВА (2012/13 учебный год) МИНИСТЕРСТВО ТРУДА, ЗАНЯТОСТИ И СОЦИАЛЬНОЙ ЗАЩИТЫ ГОСУДАСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «НИЖНЕКАМСКИЙ НЕФТЕХИМИЧЕСКИЙ КОЛЛЕДЖ» Номинация конкурса: Педагогические идеи и технологии: профессиональное образование Презентация на тему: «Концентрация растворов» Автор: Музафарова Ольга Николаевна, преподаватель ГБОУ СПО «Нижнекамский нефтехимический колледж», высшей категории Место выполнения работы: ГБОУ СПО «Нижнекамский нефтехимический колледж», Республика Татарстан, г. Нижнекамск, ул. Химиков д. 45 2013 ПРЕЗЕНТАЦИЯ по дисциплине «АНАЛИТИЧЕСКАЯ темы ХИМИЯ» «КОНЦЕНТРАЦИЯ РАСТВОРОВ» преподавателя Музафаровой О.Н. А-234 Лаборатория аналитической химии Т Е О Р И Я + П Р А К Т И К А Т Е О Р И Я + П Р А К Т И К А ВОПРОСЫ МАССОВАЯ ДОЛЯ МОЛЯРНАЯ ЭКВИВАЛЕНТНАЯ МАССА ВЕЩЕСТВА МОЛЯРНАЯ КОНЦЕНТРАЦИЯ ВЕЩЕСТВА МОЛЯРНАЯ КОНЦЕНТРАЦИЯ ЭКВИВАЛЕНТА ВЕЩЕСТВА ТЕХНИКА БЕЗОПАСНОСТИ Техника безопасности • При приготовлении растворов кислот • надо кислоту лить в воду ! ! ! • • • • • МАССОВАЯ ДОЛЯ –ω - показывает,сколько грамм вещества содержится в ста граммах раствора. Пример: 12%раствор NaCL 12 г соли NaCL + 88г растворителя(H2O) 100 г раствора соли Молярная концентрация эквивалента вещества показывает, сколько моль эквивалента вещества содержится в 1л раствора. Расчет ведут через молярную эквивалентную массу вещества М(fэХ). 2н (моль/л) – двунормальный раствор, 0,3н (моль/л) – тридецинормальный раствор, 0,05н (моль/л) – пятисантинормальный раствор. Молярная концентрация вещества показывает, сколько моль вещества содержится в 1л раствора. Расчет ведут через молярную массу вещества М(х). 2М (моль/л) – двумолярный раствор, 0,3М (моль/л) – тридецимолярный раствор, 0,05М (моль/л) – пятисантимолярный раствор. Спасибо за внимание! ВСЕМ – ЗДОРОВЬЯ !!!