«Загадка»
реклама

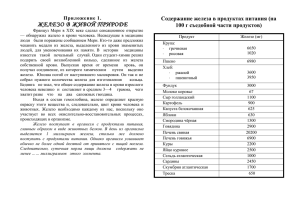
«Загадка» Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до нашей эры. А за блеск, мерцавший холодом, Люди там платили золотом! Я давно в названии века, В организме человека. Называют мной характер, Из меня почти весь трактор. Очень в яблоке полезно, И зовут меня … Железо Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества. А. Е. Ферсман. Решите анаграммы и исключите лишнее Леруогд Иксолодр Ддрооов Золеже Решите анаграммы и исключите лишнее Углерод Кислород Водород Железо Строение атома железа. Задание: прочитайте текст учебника стр. 76 и охарактеризует положение химического элемента железа в ПСХЭ Д. И. Менделеева и особенности строения атома данного элемента, укажите возможные степени окисления элемента. Fe (железо) Порядковый номер: 26 Период: IV Группа: VIII Подгруппа: В Электронное строение атома: … 4S23d6 Степень окисления 0, +2, +3 Запомни! Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня. Физические свойства 1. Цвет 2. Блеск 3. Пластичность 4. Магнитные свойства 5.Температура плавления, 6. Твердость 1. Серебристо-серый 2. Имеет блеск 3. Ковкий, пластичный 4. При температуре ниже 770 С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается». 5.Температура плавления – 1535 С Температура кипения около 2800 С 6. Сравнительно мягкий Химические свойства железа Fe +2 S, Cu2+, p-рHCI, р-р H2SO4 +2, +3 O2, H2O +3 CI2,HNO3р-р, H2SO4к гор Химические свойства железа 1. Железо реагирует с неметаллами: Fe + O2 = FeO*Fe2O3 (Fe3O4) При нагревании до 200-250 0С реагирует с хлором Fe+Cl2=FeCl3 Задание: Расставьте коэффициенты в уравнении реакции методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления Fe0 - 3e = Fe+3 Cl02+2e=2Cl-1 Проверь себя ! 2 3 – восстановитель, процесс окисления – окислитель, процесс восстановления Химические свойства железа 2. Железо реагирует с кислотами Fe+H2SO4=FeSO4+H2 В концентрированных азотной и серной кислотах железо не растворяется, так как на поверхности металла возникает пленка, препятствующая реакции металла с кислотой ( происходит пассивация металла) Задание: Расставьте коэффициенты в уравнении реакции Fe + HCl FeCl2 + H2 методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления Железо реагирует с кислотами при нагревании 2Fe0 + 6H2SO4(k)=Fe+32(SO4)3 +3SO2+6H2O Fe0 + HNO3 (p) = Fe +2(NO3 )2 + N20 + H2 O Fe0 + HNO3(р) = Fe+3 (NO3)3 + N+2 O + H20 Fe0 + HNO3(р) = Fe+2(NO3)2 + N-3H4 N+5O3+ H2O Химические свойства железа. 3. Реагирует с растворами солей металла согласно электрохимическому ряду напряжений металлов. Fe + CuSO4 = Fe SO4 + Cu Задание: Расставьте коэффициенты в уравнении реакции методом электронного баланса, укажите окислитель, восстановитель, процессы окисления и восстановления Химические свойства 4. Реагирует с водой (прочитайте текст учебника, составьте уравнения реакций) Fe+H2О Fe+ O2+H2О Сделайте вывод о химической активности простого вещества – железа. Вывод: Железо – средний по химической активности металл. Какие из реакций соответствуют схеме Fe+2 Fe+3 1. 2. 3. FeCI2 + CI2 = FeCI3 FeCI3 + NaOH = Fe(OH)3 + 3NaCI Fe(OH)2 + O2 + H2O = Fe(OH)3 Нахождение в природе. Пирит Халькопирит с включениями кварца Приморский край Нахождение в природе. Бурый железняк Лимонит 2 Fe2O3•3H2O (чугуна и стали) Магнитный железняк магнетит Fe3O4 (чугуна и стали) Красный железняк гематит Fe2O3 (чугуна и стали) Железный или серный колчедан (пирит) FeS2 (серной кислоты) Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина крови, соединения железа применяют для лечения малокровия, истощении, упадке сил. Основным источником железа для человека является пища. Его много в зеленых овощах, мясе, сухофруктах, шоколаде. Из предложенных формул соединений составьте генетический ряд Fe+2 (для первого варианта) и генетический ряд Fe+3 (для второго варианта). Fe(OH)3 , Fe, Fe(OH)2 , FeCI3 , Fe2O3 , FeCI2 , FeO. 1)Fe FeCI2 Fe(OH)2 FeO 2)Fe FeCI3 Fe(OH)3 Fe2O3 Качественная реакция на ион Fe+2 Реактив – красная кровяная соль K3[Fe(CN)6] Результат воздействия – синий осадок (турнбулевой сини) K3[Fe(CN)6] + FeCI2 = 2KCI + KFe[Fe(CN)6] 3K+ + Fe²+ + 2CI¯ + [Fe(CN)6]³- → KFe[Fe(CN)6] + 2K+ + 2CI¯ K+ + Fe²+ + [Fe(CN)6]³- → KFe[Fe(CN)6] Качественная реакция на ион Fe+3 1) Реактив – желтая кровяная соль K4[Fe(CN)6] Результат воздействия – синий осадок (берлинской лазури) K4[Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6] 4K+ + Fe³+ + 3CI¯ + [Fe(CN)6]4- → KFe[Fe(CN)6] + 3K+ + 3CIK+ + Fe³+ + [Fe(CN)6]4-→ KFe[Fe(CN)6] 2) Реактив – роданид натрия NaCNS(аммония) (NH4CNS) Результат воздействия – интенсивно- красный цвет. FeCI3 + NaNCS = [FeNCS]CI2 + NaCI Fe³+ + NCS¯ = FeNCS²+ Ответы на тест 1 вариант 1Б 2 А,В 3 Б,Г 4 А,Г 5В 2 вариант 1 Б,В 2 А,В 3 А,В 4Б 5 1А, 2Б Если интересно… www.catalogmineralov.ru – сайт содержит каталог минералов, большую коллекцию фотографий и описание минералов. http://.elementy.ru – сайт « Элементы большой науки», содержит каталоги и статьи наунопопулярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др. http://www.ovitanah.com - сайт посвящен витаминам и микроэлементам, содержит интересную информацию. http://alhimik.ru – сайт «Алхимик» содержит самую разнообразную информацию по химии. Проверь себя 0 +5 5Fe + 12 HN O = 5Fe +3(NO 3 (p) вос-ль Fe0 +4 0 +6 H O ) + N 3 2 2 2 окис-ль Fe0 - 2e = Fe+2 10 1 2N+5 + 10e = N20 2 5 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + Fe0 - 3e = Fe+3 3 1 N+5 + 3e = N+2 3 1 2H20 Fe0 – восстановитель HNO3 – окислитель 4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O вос-ль окис-ль Fe0 - 2e = Fe+2 N+5 + 8e = N-3 8 2 4 1