ЖЕЛЕЗО ИЕГО СВОЙСТВА
реклама

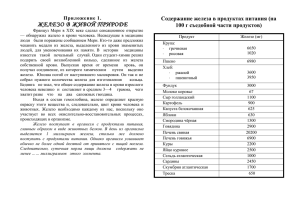
ЖЕЛЕЗО И ЕГО СВОЙСТВА химия 9 класс ВЫПОЛНИЛА УЧИТЕЛЬ :Лис С.Н. МОУ СОШ с. Котиково 2006г. Учебная цель Дать общее представление о железе, как о простом веществе и о химическом элементе. Повторить химические свойства металла. Формировать навыки логического мышления, делать выводы. Общая характеристика элемента 1s2 +26 Fe 2s2 2p6 3s2 3p6 4s2 3d 6 Для элементов побочных подгрупп характерна общая особенность: электроны заполняются в их атомах не внешний, а предвнешний подуровень энергетического уровня. Например в атомах железа после заполнения 4 s - подуровня очередной электрон помещается Не на внешний 4p - подуровень - четвертый энергетический уровень электронной оболочки, а на третий - предвнешний, на свободную d - орбиталь На внешнем уровне у d – элементов, как правило сохраняется 2 s –электрона. Все d – элементы проявляют металлические свойства. Валентность в их атомах являются энергетически близкие s - и p – орбитали внешнего и d – орбитали предвнешнего энергетических уровней. Особенности В периодической системе d- элементы располагаются между s- и pэлементами, являясь элементами побочных групп. d- Элементы проявляют металлические свойства, а образуемые ими простые вещества – металлы. Большинство d – элементов проявляет переменные степени окисления и образует несколько рядов соединений, различных по кислотно – основным свойствам . В побочных подгруппах химическая активность металлов уменьшается с увеличением порядкового номера. С увеличением значения степени окисления металла происходит ослабление основных и усиления кислотных свойств образуемых ими оксидов и гидроксидов. Физические свойства Блестящий ,сребристо – белый. Легко намагничивается Пластичен Легко куется как в холодном так и в нагретом состоянии. Поддается волочению, прокатке и штамповке Температура плавления -15390С. Температура кипения 32000С. Содержание в земной коре 4,65% по массе. Электроотрицательность 1,8 Химические свойства Fe0+ слабый окислитель (H+,S,Men+)→Fe2+ Fe0+S0→FeS Fe0+2HCL→FeCL2+H2o Fe0+ сильный окислитель (О2,HAI2 и др.)→Fe+3 3Fe0+2O20→Fe3O4 (или Fe+2O•Fe2O3) 2Fe+3CL2→2FeCL3 Fe+2H+→Fe2++H20 2Fe0+3F2→2FeF3 Fe+Cu2+CL2→FeCL2+Cu0 Fe0+Cu2+→Fe2++Cu0 Как видно из приведенных примеров, степень окисления железа в продуктах реакций зависит от силы окислителя, с которым он вступает во взаимодействие. Железо не реагирует с холодными концентрированными с серной и азотной кислотами. Оно пассивируется вследствие образования на поверхности металла защитных оксидных пленок. Поэтому безводную серную кислоту можно хранить и перевозить в стальной таре. Разбавленная азотная кислота взаимодействует с железом с образованием солей железа (lll), восстанавливаясь до NH3 ИЛИ NO2 И N2 При высокой температуре(700-9000С) железо реагирует с парами воды: 3Fe+4H2O=Fe3O4+4H2 Эту реакцию иногда используют для получения водорода на промышленных предприятиях. В ходе данной работы вы узнали Особенность строения атома железа. Его физические свойства Химические свойства А как вы думаете, железо обладает ещё другими свойствами? Литература Н.Е. Кузнецова, И.М. Титова и др. Химия учебник для учащихся 9класа.2005. Химия: Энциклопедия химических элементов/ А.М.Смолеговского: Дрофа,2000.432стр