Baeshov
реклама

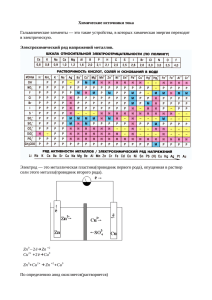
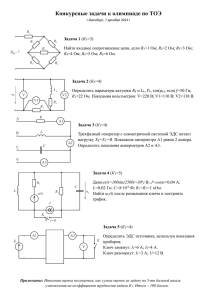
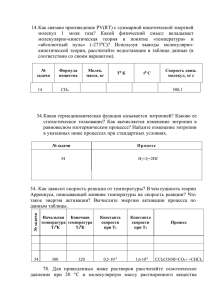
АО Институт органического катализа и электрохимии им. Д.В. Сокольского ЭЛЕКТРОХИМИЧЕСКОЕ ПРЕОБРАЗОВАНИЕ ТЕПЛОВОЙ ЭНЕРГИИ В ЭЛЕКТРИЧЕСКУЮ Академик Национальной академии естественных наук РК, д.х.н., профессор А.Б. Баешов Алматы 2012 Объект исследования: Исследование изменения потенциала электрода и электродвижущей силы (ЭДС) электрохимической системы в водных растворах, содержащих переменновалентные окислительно-восстановительные системы в зависимости от разности температуры электролита в электродных пространствах электролизера. Цель: Установить закономерности изменения величин электродного потенциала и электродвижущей силы между твердыми электродами в водных растворах от разности температур раствора в электродных пространствах. На основе полученных экспериментальных данных разработать принципиально новый электрохимический способ преобразования тепловой солнечной энергии (тепло, полученное от Солнца) и энергии гидротермальных вод в электрическую. Методы исследования: Измерение потенциала электрода, снятие потенциодинамических поляризационных кривых, а также измерение величины ЭДС и тока короткого замыкания между электродами в случае разделенных межэлектродных пространств, имеющих различную температуру. Основные результаты: Разработан принципиально новый электрохимический метод преобразования тепловой энергии в электрическую с применением графитовых электродов и раствора, содержащего переменновалентные ионы. Область применения: Вся деятельность человечества связана с электрической энергией. Кроме того, наиболее универсальная форма энергии – электричество. Работа направлена на получение электрической энергии от тепловой энергии. Практическое применение: Полученный электрический ток используется во всех отраслях производства, и в народном хозяйстве, и в быту. Таблица 1 - Электродвижущая сила (ЭДС), возникающая при разности температур (0°С 100°С) в случае применения различных металлов (Ме) в паре с платиной (Ме−Рt) Металл U, мВ Железо 1,9 Молибден 1,2 Кадмий 0,9 Вольфрам 0,8 Медь 0,76 Цинк 0,75 Платина 0,0 Родий 0,64 Никель 1,64 Константан 3,4 E E0 a RT ln Ox nF aRe d 1 – термостатируемый электролизер; 2 - нетермостатируемый электролизер; 3 – мостик для соединения электродных пространств, 4 – графитовые (железные) электроды Рисунок 1 - Принципиальная схема установки для проведения исследований по преобразованию тепловой энергии в электрическую t=25 0С, V=25 mV/s, С H2SO4=0,5М Рисунок 2 – Циклическая анодно-катодная поляризационная кривая железного электрода в сернокислом растворе t=25 0С, V=25 mV/s, С H2SO4=0,5М Рисунок 3 – Циклическая катодно-анодная поляризационная кривая железного электрода в сернокислом раствореф t=25 0С, V=25 mV/s, С Fe(II)=0,5М, С H2SO4=0,5М Рисунок 4 – Циклическая анодно-катодная поляризационная кривая на графитовом электроде t=25 0С, V=25 mV/s, С Fe(II)=0,5М, С H2SO4=0,5М Рисунок 5 – Циклическая катодно-анодная поляризационная кривая на графитовом электроде t=25 0С, V=25 mV/s, С Fe(III)=0,5М, С H2SO4=0,5М Рисунок 6 – Циклическая катодно-анодная поляризационная кривая на графитовом электроде t=25 0С, V=25 mV/s, С Fe(III)=0,5М, С H2SO4=0,5М Рисунок 7 – Циклическая анодно-катодная поляризационная кривая на графитовом электроде 1 – 20 0C; 2 – 40 0C; 3 – 60 0C V=25 mV/s, С Fe(II)=0,5М,С Fe(III)=0,5М, С H2SO4=0,5М Рисунок 8 – Катодно-анодные (а) и анодно-катодные (б) поляризационные кривые графитового электрода при разных температурах Таблица 2 – Влияние различных параметров на потенциал графитового электрода t, 0C 20 30 40 50 60 E, мВ 461,7 470,5 480,1 489,6 498,2 C H2SO4, М 0,1 0,5 1,0 2,0 3,0 E, мВ 475,3 470,6 456,4 444,2 435,7 С Fe(II), М 0,01 0,03 0,05 0,07 0,09 E, мВ 512,7 482,5 469,6 459,4 453,2 С Fe(III), М 0,01 0,03 0,05 0,07 0,09 E, мВ 441,3 467,8 480,5 483,8 488,6 Таблица 3 - Влияние температуры в левом термостатированном пространстве электролизера на величину ЭДС и ТКЗ между железными электродами t, °C 20 30 40 50 60 70 80 Е, мВ 0,0 0,1 2,0 2,0 2,0 3,0 3,0 I, мА 0,0 0,01 0,012 0,012 0,011 0,011 0,012 Примечание: H2SO4 -100 г/л, tх=20 °C Таблица 4 - Влияние температуры в левом термостатированном пространстве электролизера на величину ЭДС и ТКЗ между железными электродами t, °C 20 30 40 50 60 70 80 Е, мВ 0,0 0,12 2,0 6,0 6,0 6,0 6,0 I, мА 0,0 0,005 0,010 0,011 0,037 0,035 0,040 Примечание: Fe (III) -1,0 г/л, Fe(II) -1,0 г/л, H2SO4 -100 г/л, t = 25 °C Таблица 5 - Влияние продолжительности опыта на величину ЭДС и ТКЗ между железными электродами в левом термостатированном пространстве электролизера τ, мин 0 10 20 30 40 50 60 Е, мВ 12,0 12,1 12,2 13,0 13,4 13,8 14,4 I, мА 0,068 0,069 0,075 0,077 0,085 0,084 0,084 Примечание: Fe(III) -10 г/л, Fe(II) -10 г/л, H2SO4 -100 г/л, t = 60 °C, t = 25 °C Рисунок 9 - Изменение величины ЭДС и ТКЗ между железными электродами от температуры в солянокислом растворе (50 г/л) в присутствии 10 г/л Fe(III) и 10 г/л Fe(II) Таблица 6 - Влияние температуры в левом термостатированном пространстве электролизера на величину ЭДС и ТКЗ между графитовыми электродами в сернокислом растворе железа t, ºC 25 30 40 50 60 70 80 90 E, мВ 0 3,2 2,1 21,4 31,5 40,4 50,1 59,2 I, мА 0 0,025 0,050 0,090 0,128 0,164 0,206 0,240 Примечание: H2SO4 – 100 г/л, Fe(II) – 30 г/л, Fe(III) – 30 г/л, tx = 25 ºC Таблица 7 - Влияние температуры в левом термостатированном пространстве электролизера на величину ЭДС и ТКЗ между графитовыми электродами t, ºC 20 30 40 50 60 70 80 90 E, мВ 0 8,8 15,1 28,2 34,3 36,4 42,4 45,0 I, мА 0 0,04 0,09 0,12 0,14 0,15 0,18 0,19 Примечание: состав электролита - 100 г/л NaCl, 10 г/л K3[Fe(CN)6] и 10 г/л K4[Fe(CN)6] Таблица 8 - Влияние температуры на величину ЭДС и ТКЗ между графитовыми электродами в растворе t, ºC 20 30 40 50 60 70 80 90 E, мВ 0 18,4 26,0 32,1 36,2 40,4 52,3 55,1 I, мА 0 0,09 0,11 0,11 0,14 0,15 0,18 0,19 Примечание: 200 г/л NaCl, 10 г/л K3[Fe(CN)6] и 10 г/л K4[Fe(CN)6] Таблица 9 – Влияние продолжительности опыта на величину ЭДС и ТКЗ между электродами при температуре раствора в термостатированном пространстве электролизера, равной 60 ºС, (а холодного 20 ºС) τ, мин 0 15 20 30 45 60 Е, мВ 34,1 34,0 33,1 33,0 34,0 33,0 I, мА 0,14 0,14 0,13 0,13 0,14 0,13 Примечание: 100 г/л NaCl, 10 г/л K3[Fe(CN)6] и 10 г/л K4[Fe(CN)6] Рисунок 10 – Принципиальная схема электрохимической установки для непосредственного превращения тепловой энергии в электрическую: 1- корпус электролизера (I-верхний блок II-нижний блок), 2-трубки, разделяющие верхний и нижний блоки, 3-электролит, 4-графитовые электроды, 5-короба для нагрева раствора верхнего блока электролизера от тепла солнечной энергии или от тепла электрического нагревателя, 6- ключ для измерения величины тока короткого замыкания. ЗАКЛЮЧЕНИЕ 1. Патент РК № 24466. Преобразователь тепловой энергии в электрическую // Баешов А.Б., Баешова С.А., Баешова А.К. – Опубл. 15.08.2011, бюл. № 8. 2. Инновационный патент РК № 24923. Преобразование тепловой энергии в электрическую // Баешов А.Б., Абижанова Д.А., Даулетбаева А.С., Баешова А.К. Конурбаев А.Е. – Опубл. 15.11.2011, бюл. № 11. БЛАГОДАРЮ ЗА ВНИМАНИЕ