Альдегиды. Гомологический ряд предельных альдегидов
реклама

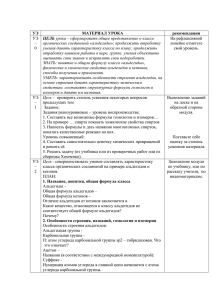
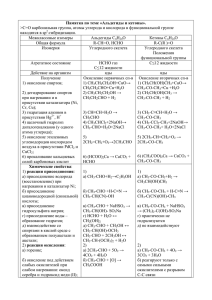
Альдегиды. Гомологический ряд предельных альдегидов. молекулярная формула структурная формула СH2O О Н–С Н C2H4O О Н3С – С Н О C3H6O Н3С2 – С названия t° кипения муравьиный альдегид, формальдегид, метаналь – 21,2 t° уксусный альдегид, ацетальдегид, этаналь +20,2 t° пропионовый альдегид, пропиональ +48,8 t° масляный альдегид, бутаналь +73 t° валериановый альдегид, пентаналь +103 t° Н C4H8O О Н7С3 – С Н О C5H10O Н9С4 – С Н О Общая формула членов ряда R–С Н О –С Н функциональная группа Альдегидами называются сложные вещества, состоящие из углеводородного радикала и функциональной группы О –С Н Строение и особенности альдегидов. В альдегидной группе между атомами углерода и кислорода имеются две связи, одна из них σ, другая – π связь, подобная той, что образуется у алкенов. Двойная связь способна разрываться. Альдегидам присуща изометрия углеродного скелета. О Например, H3C – CH – C О Н H3C – CH2 – CH2 – C CH3 Н бутаналь 2 – метилпропаналь Важнейшими представителями альдегидов являются формальдегид и ацетальдегид. Формальдегид – газ с резким запахом, единственный газообразный представитель альдегидов. Хорошо растворяется в воде. Водный раствор его называют формалином. Но! Формалин опасен для здоровья. Он способен вызывать раздражение слизистых тканей и действует на нервную систему. Ацетальдегид – жидкость с характерным запахом зеленой листвы. Хорошо растворяется в воде. Но! Очень токсичен. Он способен соединяться с белками и подавлять дыхательные процессы в клетках. Химические свойства альдегидов. 1. Реакции присоединения. Присоединение происходит за счет разрыва двойной связи между атомом кислорода и углерода. Эта реакция идет в присутствии катализатора и приводит к превращению альдегидов в спирты. О R–С + Н Н2 R – CH2 – OH спирт 2. Реакция окисления. Реакция окисления осуществляется по функциональной группе. В результате альдегиды способны превращаться в соответствующие органические кислоты. Окислителями служат KMnO4, K2Cr2O7, оксиды и гидроксиды меди и серебра. а) окисление формальдегида аммиачным раствором оксида серебра. О Н–С О t° Н–С + Ag2O Н + 2Ag ↓ OН аммиачный раствор муравьиная кислота О t° Н–С CO2 + H2O + 2Ar ↓ + Ar2O OН Эта реакция называется “реакция серебряного зеркала” б) окисление ацетальдегида гидроксидом меди (II) О t° СН3 – С + 2Cu(OH)2 Н голубой уксусный альдегид О СН3 – С + 2CuOH ↓ + 2H2O OН желтый уксусная кислота t° 2СuOH Cu2O ↓ + H2O красно – оранжевый 3. Реакция поликонденсации между фенолом и формальдегидом. OH OH О + Н–С CH2OH Н промежуточный продукт фенол OH OH CH2 OH Н + OH OH СН2 Фенол + Н2О Так выглядит фрагмент молекулы полимера – фенолформальдегидная смола. Реакция, при которой получают фенолформальдегидную смолу, относится к реакциям поликонденсации. Поликонденсация – это такие реакции, при которых наряду с высокомолекулярным веществом получается и низкомолекулярное, например вода. Получение альдегидов. 1. Окисление спиртов Спирты альдегиды H О катализатор, t° R C OH + R–С O H спирт Н альдегид 2. Ацетальдегид получают гидратацией ацетилена (реакция М.Г. Кучерова) HC ≡ CH + ацетилен О Hg2+ H2O Н3С – С Н уксусный альдегид 3. Окисление этилена катализатор 2 Н3С – С 2H2C = CH2 + О2 этилен О Н уксусный альдегид Этот способ на сегодняшний день является наиболее дешевым и поэтому именно так получают альдегиды в промышленности.