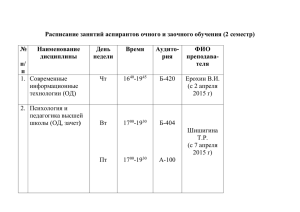
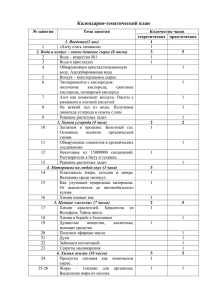
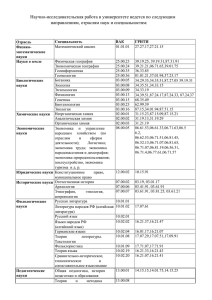
Преподаватель Афанасьева Е.А.
реклама

ГБПОУ МО «Пушкинский лесотехнический техникум» Структурное подразделение (ПТУ) Преподаватель Афанасьева Е.А. 03.02.2016 г. Учебная дисциплина: ХИМИЯ Группа: 2 МЦ ЗАНЯТИЕ № 21 (1 час) Тема: Карбоновые кислоты. Сложные эфиры. Жиры. Знать: состав, строение, свойства, получения, применение карбоновых кислот, сложных эфиров, жиров. Уметь: составлять структурные формулы, уравнения реакций, характеризующие свойства и способы получения. Задание: Записать в тетрадь определения, ответить на вопросы. 1. Что такое карбоновые кислоты? 2. Какую функциональную группу содержат? 3. Составьте гомологический ряд для 10 представителей предельных одноосновных карбоновых кислот, общая формула которых: Сn H2n+1 COOH 4. Назовите по международной номенклатуре 10 представителей: к названию алкана добавьте окончание -овая Пример: Н-СООН метановая кислота 5. Перечислите физические свойства карбоновых кислот. Как образуется водородная связь в молекулах карбоновых кислот? 6. Напишите уравнения реакций взаимодействия этановой кислоты с: магнием, оксидом магния, гидроксидом натрия, карбонатом натрия, этиловым спиртом. 7. Что называется сложными эфирами? Примеры. 8. Как называется реакция получения сложных эфиров? 9. Применение карбоновых кислот, сложных эфиров. Домашнее задание: 1. Прочитайте – стр. 383-391, учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 2. Выполните упр. №2,3,4,5 стр. 390. 3. Подготовьте презентацию по теме «Жиры. Мыла» ГБПОУ МО «Пушкинский лесотехнический техникум» Структурное подразделение (ПТУ) Преподаватель Афанасьева Е.А. 03.02.2016 г. Учебная дисциплина: ХИМИЯ Группа: 2 АВТ ЗАНЯТИЕ № 17 (1 час) Тема: Сложные эфиры. Жиры. Знать: состав, строение, свойства, получения, применение, сложных эфиров, жиров. Уметь: составлять структурные формулы, уравнения реакций, характеризующие свойства и способы получения. Задание: Записать в тетрадь определения, ответить на вопросы. 1. 2. 3. 4. 5. 6. 7. 8. 9. Что называется сложными эфирами? Примеры. Как называется реакция получения сложных эфиров? Номенклатура сложных эфиров. Физические и химические свойства сложных эфиров. Применение сложных эфиров. Определение жиров, общая формула. Классификация жиров, примеры. Химические свойства: гидролиз жиров, гидрирование. Применение и биологическое значение жиров. Домашнее задание: 1. Прочитайте – стр. 391-395, учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 2. Выполните упр. №2,3,4,5 стр. 396. 3. Подготовьте презентацию или конспект по теме «Мыла» ГБПОУ МО «Пушкинский лесотехнический техникум» Структурное подразделение (ПТУ) Преподаватель Афанасьева Е.А. 03.02.2016 г. Учебная дисциплина: ХИМИЯ Группа: 2 ПК ЗАНЯТИЕ № 39 (1 час) Тема: Классификация связей по способу перекрывания. Знать: типы орбиталей атома углерода, перекрывание орбиталей вдоль линии, соединяющей центры ядер 2 атомов (образование «сигма» связи), перекрывание орбиталей в двух плоскостях (образование «пи» связи) Уметь: писать схемы образования «сигмы» и «пи» связей, определять типы образования связи. Задание: Записать в тетрадь определения, ответить на вопросы. 1. Как образуется ковалентная связь? 2. Как образуется «сигма» связь7 3. Запишите схемы образования «сигмы» связи в молекулах водорода, хлора, хлороводорода. 4. Как образуется «пи» связь? 5. Напишите схемы образования «пи» связи в молекулах кислорода, азота. Домашнее задание: 1. Прочитайте – стр. 70-73, учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 2. Выполните упр. №2,3,5 стр. 76. 3. Подготовьте презентацию или конспект по теме «Ковалентная связь» ГБПОУ МО «Пушкинский лесотехнический техникум» Структурное подразделение (ПТУ) Преподаватель Афанасьева Е.А. 03.02.2016 г. Учебная дисциплина: ХИМИЯ Группа: 2 ПК ЗАНЯТИЕ № 40 (1 час) Тема: Виды разрыва ковалентной связи. Знать: радикальный и ионный виды разрыва ковалентной связи. Уметь: уметь определять виды разрыва ковалентной связи при написании уравнений реакций Задание: Записать в тетрадь определения, ответить на вопросы. 1. Радикальный – образуются радикалы. Радикалы – это частицы, имеющие неспаренный электрон. Пример: А : В = А . + . В А:В – вещество, А . и . В – радикалы 2. Ионный разрыв ковалентной связи – образуются ионы. Ионы – это положительно или отрицательно заряженные частицы. Пример: А : В = А + + : В – Вопросы: Напишите электронную формулу метана. Как происходит радикальный разрыв ковалентной связи С – Н в молекуле метана. Домашнее задание: 1. Прочитайте – стр. 73 - 75, учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 2. Выполните упр. № 6 стр. 76. 3. Подготовьте презентацию или конспект по теме «Образование радикалов» ГБПОУ МО «Пушкинский лесотехнический техникум» Структурное подразделение (ПТУ) Преподаватель Афанасьева Е.А. 03.02.2016 г. 1 курс 1 МЦ Учебная дисциплина: ХИМИЯ Группа: 1 МЦ ЗАНЯТИЕ № 19, 20 (2 часа) Тема: Растворы. Концентрация растворов. Решение задач. Знать: основные положения теории растворения, виды растворов, классификацию веществ в зависимости от растворимости, растворимость газа, качественную характеристику растворов (понятие концентрация растворов) Уметь: определять растворимые или не растворимые вещества, рассчитывать концентрацию растворов, растворимость веществ. Задание: Записать в тетрадь определения, ответить на вопросы. 10.Что такое растворы? Приведите примеры. 11.Что называется растворителем и растворенным веществом? 12.Какие представления о процессе растворения развил Д.И. Менделеев? 13.Какие соединения называются сольватами, гидратами? 14.Что такое диффузия? 15.Какие растворы называются насыщенными, ненасыщенными, пересыщенными? 16.Как классифицируются вещества в зависимости от растворимости? 17.Что называется концентрацией раствора? 18.Определение доли растворенного вещества: w =mB /mР, где w-массовая доля растворенного вещества, mР – масса раствора, mВ – масса растворенного вещества. Массовую долю растворенного вещества выражают в процентах: w=mB /mР × 100%. Решите задачу. Определите массовую долю (%) растворенного хлорида натрия, если в 250 г воды растворено 50 г вещества хлорида натрия. Алгоритм решения: Дано: mВ=50 г Решение:1. Найдите массу раствора mводы=250 г (mР= mВ+ mводы) Найти: w раствора. 2.Запишите формулу w=mB /mР×100%. 3. Запишите числовые значения в формулу 10. Как определяется молярная концентрация? Запишите формулу. 11. Что такое эквивалент? 12. Как определяется нормальная концентрация? Запишите формулу. 13. Решите задачи, используя данные формулы: упр. №2,3,7 стр. 120 учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» Домашнее задание: 4. Прочитайте – стр. 112-118, учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 5. Напишите сообщение, доклад о «Применение растворов» 6. Подготовьте презентацию по теме «Растворы» ГБПОУ МО «Пушкинский лесотехнический техникум» Структурное подразделение (ПТУ) Преподаватель Афанасьева Е.А. 03.02.2016 г. 1курс ПК Учебная дисциплина: ХИМИЯ Группа: 1 ПК ЗАНЯТИЕ № 51, 52 (2 часа) Тема: Растворы. Концентрация растворов. Решение задач. Знать: основные положения теории растворения, виды растворов, классификацию веществ в зависимости от растворимости, растворимость газа, качественную характеристику растворов (понятие концентрация растворов) Уметь: определять растворимые или не растворимые вещества, рассчитывать концентрацию растворов, растворимость веществ. Задание: Записать в тетрадь определения, ответить на вопросы. Что такое растворы? Приведите примеры. Что называется растворителем и растворенным веществом? Какие представления о процессе растворения развил Д.И. Менделеев? Какие соединения называются сольватами, гидратами? Что такое диффузия? Какие растворы называются насыщенными, ненасыщенными, пересыщенными? 7. Как классифицируются вещества в зависимости от растворимости? 8. Что называется концентрацией раствора? 9. Определение доли растворенного вещества: w =mB /mР, где w-массовая доля растворенного вещества, mР – масса раствора, mВ – масса растворенного вещества. Массовую долю растворенного вещества выражают в процентах: w=mB /mР × 100%. Решите задачу. Определите массовую долю (%) растворенного хлорида натрия, если в 250 г воды растворено 50 г вещества хлорида натрия. Алгоритм решения: Дано: mВ=50 г Решение:1. Найдите массу раствора mводы=250 г (mР= mВ+ mводы) Найти: w раствора. 2.Запишите формулу w=mB /mР×100%. 1. 2. 3. 4. 5. 6. 3. Запишите числовые значения в формулу 10. Как определяется молярная концентрация? Запишите формулу. 11. Что такое эквивалент? 12. Как определяется нормальная концентрация? Запишите формулу. 13. Решите задачи, используя данные формулы: упр. №2,7 стр. 120 учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» Домашнее задание: 1. Прочитайте – стр. 112-118, учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 2. Выполните упражнения № 3,4,6 стр. 120 учебник Ю.М. Ерохин, И.Б. Ковалева «ХИМИЯ» 3. Напишите сообщение, доклад о «Применение растворов», «Растворы в вашей профессии»