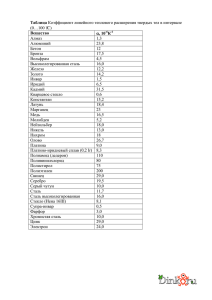
Коллекция текстовых сопроводительных материалов для учащихся к уроку по теме:
реклама

Коллекция текстовых сопроводительных материалов для учащихся к уроку по теме: «Минералы и сплавы в оформлении станции “Маяковская” Московского метрополитена» Железо. Сталь Земная кора очень богата железом (4,1%), но, по-видимому, его еще больше в ядре земли. Железо содержится более чем в 30 минералах, часть из которых образует крупные месторождения: Fe2O3 – магнетит, магнитный железняк – черные кристаллы; Fe2O3 – гематит, красный железняк – темно-красные кристаллы; Fe2O3·H2O – лимонит – вещество желтого цвета; FeS2 – пирит, железный колчедан – кубические кристаллы латунного цвета. Железо добывают путем соответствующей химической обработки его соединений, входящих в состав горных пород (руд). Руды разделяются на отдельные группы в зависимости от окислителя, с которым связан металл в виде соединения. По этому признаку различают оксидные, сульфидные, карбонатные, фосфатные и др. руды. В промышленности большую часть производимого железа получают восстановлением оксидных руд углеродом в доменных печах. Дальнейшая переработка железа (чугуна) заключается в выжигании в нем растворенного углерода путем продувки через жидкий чугун воздуха или кислорода. Это делают в специальных устройствах – конверторах. Одновременно для получения заданных марок стали вносят легирующие добавки других металлов. Чугун – не поддается ковке и включает в себя более 2 % углерода и примеси кремния, марганца, фосфора и серы. Сталь – ковкий сплав железа с углеродом, в котором массовая доля углерода менее 2 %. В сталях, как правило, присутствуют примеси, влияющие на физико-химические особенности сплава. А специальные легирующие добавки (хром, молибден, кремний, ванадий и др.) позволяют получать сплавы с определенными, необходимыми для разных целей свойствами. Сталь является материальной основой практически всех отраслей промышленности. Используют ее и в искусстве. Производство стали Для получения стали из чугуна необходимо окислить содержащийся в нем лишний углерод и примеси. С этой целью жидкий чугун загружают в конвертор и продувают кислородом под давлением. За счет самой реакции температура развивается до 2000 °С. Кроме основного процесса окисления углерода С + 1⁄2О2 = СО, происходит окисление примесей. На границе «металл–шлак» сначала окисляется железо в шлаке: 2Fe + O2 = 2FeO Образующийся оксид железа (II) FeO расходуется на окисление примесей: Si + 2FeO = SiO2 + 2Fe, Mn + FeO = MnO + Fe, C + FeO = CO + Fe Легированной называют сталь, содержащую один или несколько легирующих элементов, изменяющих свойства этой стали. Основной легирующий элемент нержавеющей стали – хром Cr (12– 20 %). Легированные стали маркируют по буквенно-цифровой системе. Легирующие элементы обозначают русскими буквами, например, А – азот, Б – ниобий, В – вольфрам, Г – марганец, Д – медь, Е – селен, К – кобальт, Л – бериллий, М – молибден, Н – никель, П – фосфор, Р – бор, С – кремний, Т – титан, Ф – ванадий, Х – хром, Ц – цирконий, Ю – алюминий, Ш – магний. Первые цифры в марках стали указывают на содержание углерода в сотых долях процента, а цифры, стоящие за буквой, – на содержание легирующих элементов. Нержавеющие стали марок 1X13, 2X13, 3X13, 4X13 обладают высокой стойкостью против атмосферной коррозии. Из них изготовляют турбинные лопатки, хирургический инструмент, клапаны гидравлических насосов, предметы домашнего обихода и т. д. В прошлые времена при упоминании железа, которое нужно ковать, пока оно «горячо», имели в виду не чистый металл, а сталь с низким содержанием углерода – низкоуглеродистую сталь. Именно ее, а не чистое железо ковали кузнецы. Знаменитые булат и дамасская сталь – изделия из литой стали. Рецепты их приготовления хранили в строжайшем секрете. Одним из наиболее известных шедевров старинного русского кузнечного производства является «Золотая решетка» Теремного дворца Московского Кремля. Она была выкована из низкоуглеродистой стали в 1670 г. В XX в. сталь использовали для декорирования интерьеров. Стальные барельефы и светильники украсили станции метро, залы вокзалов, фойе театров. Для расширения декоративных возможностей стали были разработаны новые приемы ее отделки, в частности окрашивание. Мозаика Мозаика – (от лат. музивум, буквально – «посвящение музам») – разновидность монументальной живописи, представляющая собой изображение или узор, выполненный из однородных или различных по материалу частиц: каменной гальки, специально нарезанных разноцветных каменных или стеклянных кубиков, керамической плитки и т. п. История мозаичного искусства уходит вглубь веков. Расцвет византийского стеклоделия обеспечил совершенно новое «звучание» мозаичному искусству. Мастера Византии использовали десятки химических соединений и готовили смальты всевозможных оттенков. В разных странах использовали разные красители для стекла. Великий русский просветитель Михаил Васильевич Ломоносов, «теоретик науки о цвете», автор письма «О пользе стекла», заинтересовался мозаиками еще в 1740-е гг. и приступил к проведению опытов по окрашиванию стекла (в те времена цветное стекло доставляли в Россию из-за границы). Используя оксиды меди и иных металлов, М. В. Ломоносов получал стекла различных оттенков, например, «превосходное зеленое, травяного цвета, весьма похожее на изумруд», «приближающееся по цвету к аквамарину», «красное берилловое», «хрустальное синеватое». Им с учениками были созданы великолепные мозаичные картины: портрет М. И. Воронцова, мозаика «Полтавская баталия» и другие. В настоящее время для приготовления золоченых смальт применяется известная из древности технология. На стеклянные листы наклеивали тончайшие листочки золота и сверху прижимали еще одним листом прозрачного стекла. Полученный «пакет» на железном лотке задвигали в печь и нагревали до покраснения стекла так, чтобы верхний и нижний слои спаялись. После охлаждения заготовку нарезали на кубики.1 Окраска стекла зависит от введения в него как самих металлов так их оксидов: Металлы, оксиды металлов Au Ag Se CoO CuO 1 Цвет стекла красный желтый розовый голубой зеленый Титова И. М. Химия и искусство: 10-11 классы: учебное пособие для учащихся общеобразовательных учреждений. – М.: Вентана-Граф, 2007.