Тема: Цели. Кристаллические решетки
реклама

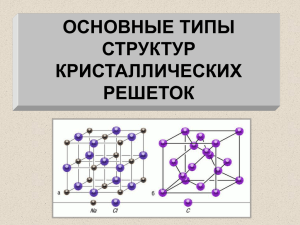
Тема: Цели. Кристаллические решетки Дать понятие о кристаллическом и аморфном состоянии твердых веществ; познакомиться с типами кристаллических решеток, их взаимосвязью с видами химической связи и влиянием на физические свойства веществ; дать представление о законе постоянства состава веществ. Развивать логическое мышление, умения наблюдать и делать выводы. Формировать эстетический вкус и коллективизм, расширять кругозор. Оборудование и реактивы. Модели кристаллических решеток; пластилин, жевательная резинка, смолы, воск, поваренная соль NaCl, графит, сахар, вода; раздаточный материал. Тип урока: усвоение нового материала Форма организации работы. фронтальная, групповая. Методы и приемы. объяснительно-иллюстративный, проблемный, демонстрационный опыт, лабораторная работа. ХОД УРОКА I. Орг. момент (отметить отсутствующих) II. Усвоение нового материала Сегодня я хочу начать урок со слов поэта Леонида Мартынова: «В мире этом – я знаю – нет счета сокровищам, Но весьма поучительно для очей заглянуть повнимательнее в нутро вещам, прямо в нутро вещей». Тема урока: Кристаллические решетки Цель нашего урока – понять, что такое кристаллическое и аморфное состояние твердых веществ, познакомиться с типами кристаллических решеток, получить представление о законе постоянства состава веществ. Вам представлены вещества: алмаз, медный купорос, аметист, графит, алюминий, оксид углерода (IV), ртуть, каменная соль. В конце урока вы должны ответить на вопрос: Что общего у этих веществ? Вспомните: Какие агрегатные состояния веществ известны? (Ответ): Твердое, жидкое и газообразное. Следовательно: вещества по агрегатному состоянию делят на газы, жидкости и твердые тела. Не забываем записывать схемы в тетрадь. Приведите примеры веществ. Для нас важны все три агрегатных состояния, так как любое вещество может быть газом, жидкостью или твердым веществом. Приведите примеры такого перехода: лед ↔ вода ↔ пар; твердый натрий легко плавится и может испарятся, т.е. быть газообразным. Газ кислород при низких температурах сначала превращается в жидкость, а при еще более низких – затвердевает в синие кристаллы. Сегодня мы рассмотрим твердое состояние вещества. (Л.О.) Посмотрите на вещества на ваших столах и распределите их на две группы (по своему усмотрению). (Только разделить, ничего пока не записывать) (На доске) Пластилин, жевательная резинка, смола, воск, соль NaCl, графит, сахар. (Ответ учащихся) Пластилин, жевательная резинка, смола, воск – это аморфные вещества. У них часто нет постоянной температуры плавления, наблюдается текучесть, нет упорядоченного строения. Напротив, соль NaCl, графит и сахар – кристаллические вещества. Для них характерны четкие температуры плавления, правильные геометрические формы, симметрия, упорядоченное строение. (на доске вещества одной группы подчеркнуть) Исходя из вашего ответа следует вывод, что все твердые вещества делятся на аморфные и кристаллические (их характеристика) Записали в тетради. Что бы выяснить отличие аморфных и кристаллических веществ мы заглянем внутрь этих веществ. Кристаллические вещества характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов. Эти частицы расположены в строго определенных точках пространства – называемых узлами. Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка. В соответствии с видом частиц можно выделить четыре типа кристаллических решеток. Установим взаимосвязь между типом решетки, видом химической связи и свойствами веществ одновременно заполняя таблицу, (которая вам дана). 1 кристаллическая решетка – ИОННАЯ. Виды частиц в узлах решетки? (ионы) – вписали в таблицу. Вид связи между частицами – ионная, прочная. Какие вещества могут иметь ионную кристаллическую решетку? – соли, оксиды и гидроксиды типичных металлов (I – III групп) Какими физ. свойствами будут обладать такие вещества? – твердые, прочные, нелетучие, тугоплавкие. Следующий тип кристаллической решетки – АТОМНАЯ Виды частиц в узлах решетки – атомы Вид связи между частицами? –( атомная или) ковалентная Примеры – графит (его крист. решетка показана на слайде), кварц, алмаз. Физические свойства веществ – такие же что и у веществ с ионной кристаллической решеткой – твердые, прочные, нелетучие, тугоплавкие, не растворимы в воде. У графита в крист. решетке У алмаза крист. решетка по структуре отличается от решетки графита. Посмотрите в папочках (на парте) есть кристаллическая решетка алмаза. Она имеет тетраэдрическое строение. Из за такого своего строения алмаз – твердое, очень прочное вещество. 3 тип крист. решетки – МОЛЕКУЛЯРНАЯ. В узлах такой решетки находятся – молекулы. Между молекулами – слабые силы межмолекулярного притяжения, а внутри молекул – прочная ковалентная связь. Примеры веществ –твердые при особых условиях вещества, которые при обычных условиях газы, жидкости; сера, иод, уксусная кислота. Характерные физ .свойства таких веществ – непрочные, летучие, легкоплавкие, имеющие малую твердость. На таблице приведена крист. решетка углекислого газа – оксида углерода (IV). В узлах находится молекула состоящая из атома углерода и двух атомов кислород. В кристаллических решетках простых веществ, например иода (посмотрите в папочках) – в узлах находятся двухатомные молекулы иода. И последняя крист. решетка – МЕТАЛЛИЧЕСКАЯ В узлах находятся – атом – ионы (металлов) Связь – металлическая, осуществляемая свободными обобществленными электронами (которые двигаются между атом – ионами). Посмотрите в папках приведена кристаллическая решетка металлов, где показано что между ионами металлов находятся свободные электроны. Примеры – метали и сплавы. Какими физ. свойствами будут обладать такие вещества? – ковкие, пластичные, электро – и теплопроводны, имеют мет. блеск ( все свойства металлов). Рассмотрев типы кристаллических решеток мы с вами установили взаимосвязь между строением атома, химическими связями, кристаллическими решетками и свойствами веществ Строение атома химическая связь кристаллическая решетка свойства вещества. Строение Строение Состав Свойства Откройте учебник на стр. 80, табл. 6 и обратите внимание на типы кристаллических решеток простых веществ в зависимости от их положения в периодической системе. Какой тип решетки не встречается в простых веществах? Ответ учеников. У простых веществ не бывает ионных решеток. Для веществ с молекулярной решеткой характерно явление возгонки (сублимации). Демонстрационный опыт. Возгонка иода. (Возгонка – это превращение (при нагревании) твердого вещества в газ, минуя жидкую фазу, а затем снова кристаллизация в виде инея.) Остался еще один момент урока – закон постоянства состава вещества, которому подчиняются вещества с молекулярным строением. Этот закон открыт французским химиком Ж.Л.Прустом. Его формулировка такова: вещества молекулярного строения имеют постоянный состав независимо от способа их получения. Н-р: вода – не зависимо от того как ее получают, в каком агрегатном состоянии она находится, состав ее не меняется – Н2О Для веществ с ионным строением закон Пруста не всегда выполняется. ИТОГ: Мы заглянули в нутро вещей. Рассмотрели кристаллические решетки А теперь отвечаем на вопрос, который был задан в начале урока. Что общего у этих веществ? (алмаз, медный купорос, аметист, графит, алюминий, оксид углерода (IV), ртуть, каменная соль.) III. Закрепление материала Какие кристаллические решетки у О2, Н2О, NaCl, С? (НА ДОСКЕ) Ответ учеников. О2 и Н2О – молекулярные кристаллические решетки, NaCl – ионная решетка, С – атомная решетка. • Кремний имеет атомную кристаллическую решетку. Каковы его физические свойства? • Оксид СО2 имеет низкую tпл, а кварц SiO2 – очень высокую (кварц плавится при 1725°С). Какие кристаллические решетки они должны иметь? Я на бумаге оставляю Конечно, очень жирный след. И рисовать вам помогаю Уже я много – много лет! Не прочен я, не как гранит! А называюсь я ... (графит) Какое строение (крист. решетку) имеет это вещество? Какими свойствами он обладает? Горжусь своим я блеском И тем, что очень твёрд. Разрежу я железку На тысячи кусков. Я – камень драгоценный, Чужих боюсь я глаз! Надеюсь, догадались: Меня зовут... (алмаз) Какое строение (крист. решетку) имеет это вещество? Какими свойствами он обладает? Самостоятельная работа (Задания на доске) Определить тип кристаллической решетки для веществ: 1 вариант: Н2, Са, КСl, Si, Н2S 2 вариант: Сl2, NaNO3, Mg, Н2SO4, С IV. Домашнее задание ( с комментариями) § 22, упр. 6