lekciya_13_funkcii_membran
реклама

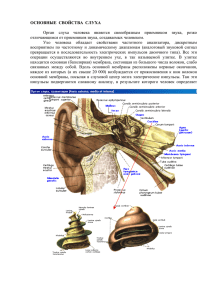
Лекция № 12 ФУНКЦИИ БИОЛОГИЧЕСКИХ МЕМБРАН. СОВРЕМЕННЫЕ МОДЕЛИ БИОМЕМБРАН Физические, химические и физико-химические свойства БМ обеспечивают выполнение ими определенных функций, без которых невозможна жизнедеятельность организма. В самом общем виде и применительно к мембранам всех типов многообразие этих функций можно свести к трем основным: механической, барьерной и матричной. Механическая функция заключается в поддержании морфологической целостности и относительной автономности как клетки в целом, так и внутриклеточных органоидов. Она основана прежде всего на механических свойствах мембранных структур. Под барьерной функцией понимают создание биомембраной препятствий для свободного переноса веществ через нее. Выше говорилось о том, что для одних агентов БМ является непреодолимым препятствием, другие легко проходят сквозь нее, причем, как правило, только в определенном направлении, как того требуют векторные свойства мембраны. Скорости мембранного транспорта разных веществ далеко не одинаковы. Следовательно, с барьерной функцией БМ непосредственно связана ее избирательная (селективная) проницаемость. Мембраны не только отделяют клетки друг от друга, но также разделяют цитоплазму на ряд замкнутых отсеков (компартментов), каждый из которых выполняет свою специфическую задачу. В такой трактовке клеточные органоиды рассматриваются в качестве компартментов. Принцип компартментализации (разбиения цитоплазмы на компартменты) признан сейчас одним из важнейших в организации биологических систем. Благодаря компартментализации в клетке пространственно разобщены и изолированы друг от друга биохимические процессы, совместное течение которых невозможно. Например, синтез жирных кислот происходит в цитоплазме, а окисление − в митохондриях; синтез белка − на рибосомах, а деградация − в лизосомах. Между содержимым органоидов и цитозоля имеются существенные различия в химическом составе, чем обусловлены высокие концентрационные градиенты на внутриклеточных мембранах. На плазмолемме также поддерживаются значительные физико-химические градиенты. Они служат главной движущей силой трансмембранного переноса веществ. Преимущества компартментализации связаны не только с барьерной, но и с матричной функцией клеточных мембран. БМ служит матрицей для белков-рецепторов, ферментов и других физиологически активных веществ, обеспечивая пространственную организацию рецепторных взаимодействий, метаболических реакций, переноса энергии и других мембранных процессов. Так, биомембраны объединяют встроенные в них ферменты в единый конвейер, где каждый из них действует строго согласованно с остальными. Среди мембранных ферментов выделяют так называемые векторные, которые пронизывают БМ и 1 принимают субстраты на ее одной стороне, чтобы выделить продукты реакции на противоположной. Реакции, катализируемые такими ферментами, имеют векторный характер. Мембранным ферментам присуще явление аллопии, заключающееся в том, что при отделении от БМ они полностью или частично утрачивают свою активность. Различные клеточные мембраны, выполняя механическую, барьерную и матричную функции, осуществляют также ряд специфических функций, присущих не всем, а только определенным мембранам. В мембранах эндоплазматической сети идет синтез белков, фосфолипидов и других соединений. На внутренней митохондриальной мембране происходит клеточное дыхание, представляющее собой многоэтапный ферментативный процесс. Все специфические функции органоидов неразрывно связаны с их мембранами. Обращаясь к характерным функциям плазмолеммы, следует назвать и механическую защиту клетки, и обеспечение межклеточных взаимодействий, и электрическую изоляцию, и экранировку клеток от внешних электромагнитных полей, и биоэлектрогенез. На их основе в плазматических мембранах клеток разных типов формируются еще более специфические и сложные функции, обеспечивающие определенные физиологические свойства: в нейронах − генерацию нервных импульсов и их проведение по нервным волокнам, в рецепторах органов чувств − преобразование разнообразных раздражителей в нервную импульсацию, в мышечных волокнах − генерацию мышечных электрических импульсов и сокращение, в кишечных эпителиоцитах − переваривание пищи и всасывание ее компонентов. Модели биологических мембран. Существует несколько гипотез о структурной организации клеточных мембран. Их принято называть моделями биомембран. В основу первой модели были положены экспериментальные исследования плазмолеммы эритроцита. Мембраны гемолизированных клеток крови получили название теней (или привидений) эритроцитов. В конце 1920-х гг. И. Гортер и А. Грендел экстрагировали липиды из теней эритроцитов и в специальном приборе (ванне Лэнгмюра) измерили площадь, образованную ими на поверхности ванны. Она оказалась примерно вдвое больше площади, которую образовывали липиды, находясь в эритроцитарной мембране. Последовал вывод о бислойной организации липидов в БМ. Позднее результаты измерений И. Гортера и А. Грендела были уточнены: площадь липидного бислоя составляла не 100%, а только 75% поверхности эритроцита. Тогда предположили, что мембрана построена не из одних липидов. В 1931 г. Н. Девсон и Р. Даниелли предложили модель сэндвича (бутерброда), согласно которой среднюю часть БМ образует бимолекулярный липидный слой, а на его обеих поверхностях расположены белки (рис. 47). Поперечное расположение осей липидных молекул к мембранной поверхности было установлено в 1936 г. Р.О. Шмиттом при исследовании поляризации и дифракции рентгеновых лучей на мембранах зрительного нерва. 2 Рис. 47. Бутербродная модель биомембраны: 1 − белковые компоненты; 2 − бимолекулярный фосфолипидный слой Другая модель БМ называется мозаичной или жидкостно-мозаичной (рис. 48). Она предложена в 1972 г. С. Синджером и Г. Николсоном, которые предположили, что с белками взаимодействуют не отдельные липидные молекулы, а их комплексы − мицеллы и что только около 30% липидных молекул вступают в непосредственные связи с белками. Рис. 48. Мозаичная модель биомембраны: 1 − белковые глобулы; 2 − липидное «озеро» Интересные факты в подтверждение основной идеи мозаичной модели получены посредством метода «замораживания-травления» (или «замораживания-скалывания»). Изучаемые ткани очень быстро охлаждают в жидком азоте, благодаря чему внутриклеточная вода не кристаллизуется, а переходит в стекловидное состояние, не разрушая клетки. Замороженные таким образом клетки под действием ультрамикротомного ножа не разрезаются, а раскалываются. Линия скола нередко проходит вдоль зоны расположения углеводородных цепей липидного бислоя. Скол мембраны при низкой температуре помещают в вакуум. По мере того как вода возгоняется из стекловидной формы, поверхность разлома «протравливается», и на ней рельефно выделяются крупные молекулы и их комплексы. На «протравленную» поверхность напыляют покрытие из платины и углерода, формируя реплику 3 (своеобразный слепок) исследуемого скола. При помещении ткани в дистиллированную воду комнатной температуры реплика всплывает. Она служит препаратом для электронной микроскопии. На электронограмме получается изображение внутренней структуры клеточной мембраны. На нем хорошо видны как отдельные частицы (крупные молекулы и их комплексы), так и вмятины от них. Если сделать реплики с обеих половин одного скола, то на одной из них можно увидеть выступающие частицы, а на другой − точно соответствующие им вмятины. Метод «замораживания-травления» позволил установить, что в плазматической мембране бактериальной клетки между соседними белковыми глобулами, пронизывающими ее насквозь, расположено примерно 300 липидных молекул. При изучении обеих половин скола эритроцитарной мембраны рассмотрели 4200 белковых частиц на 1 мкм2 поверхности, что соответствует 6 · 105 таких частиц во всей плазмолемме эритроцита. Следовательно, белки занимают около 25% поверхности эритроцитарной мембраны, «плавая» в липидах. Плазмолемма эритроцита в высшей степени асимметрична, что проявляется прежде всего в различном составе молекулярных компонентов ее наружной и внутренней сторон, а также в их неодинаковой толщине. Общая площадь мембраны эритроцита достигает 140 − 150 мкм2, а масса − (1,1 − 1,2) · 10-12 г. В эритроцитарной мембране − 50% белков, 40% липидов, 10% углеводов. Среди липидов − 42% холестерина, 17% фосфатидилхолина (лецитина), 15% фосфатидилэтаноламина, 13% сфингомиелина, 8% фосфатидилсерина и фосфатидилинозита, 3 − 5% нейтральных липидов. Из белков эритроцитарной мембраны) хорошо изучены спектрин и гликофорин. Первый из них относится к периферическим белкам, причем расположен на цитоплазматической стороне плазмолеммы, образуя там сеть, выстилающую мембрану изнутри (рис. 49). Спектрин обеспечивает жесткость и прочность эритроцитарной мембраны, благодаря чему эритроцит при движении по кровеносным сосудам может испытывать значительную деформацию, не разрушаясь при этом. Молекула спектрина состоит из двух полипептидных цепей (с молекулярными массами около 220 и 240 кДа). Они образуют длинные гибкие стержни длиной от 100 до 200 нм. На 1 эритроцит приходится примерно 216 тыс. молекул спектрина. Решетка из них образует каркас, на который «натянута» остальная часть плазмолеммы. Со спектрином связаны актиновые нити (микрофиламенты), входящие в состав цитоскелета. 4 Рис. 49. Схема расположения сети спектрина, обеспечивающей структурную жесткость мембраны; 1 − гликофорин; 2 − спектрин (тектин А), образующий сеть под внутренней поверхностью мембраны. Кроме того, в спектринном каркасе фиксированы некоторые интегральные белки, внедряющиеся в мембрану и пронизывающие ее насквозь. Одним из интегральных белков эритроцитарной мембраны является гликофотин. Он представляет собой гликопротеид с молекулярной массой около 55 кДа. Плазмолемму одной клетки пронизывает около полумиллиона его молекул. Каждая из них образована полипептидной цепью, включающей до 200 аминокислотных остатков. К ней прикреплено множество олигосахаридных цепочек (как коротких − из 4 моносахаридов, так и длинных − из 8 − 12 моносахаридов), на долю которых приходится около 60% всей молекулы. Большая часть таких цепочек («сахарных кустиков») увенчана остатками сиаловой кислоты, присоединенной к галактозе. Сиаловая кислота придает поверхности эритроцита отрицательный заряд, предохраняющий клетки от слипания. Эритроцит живет в среднем 120 суток, в течение которых содержание сиаловой кислоты в гликофорине постепенно уменьшается, что приводит к обнажению галактозных остатков. С ними взаимодействуют белки-рецепторы, сосредоточенные на плазматических мембранах клеток печени и селезенки, входящих в ретикулоэндотелиальную систему. В результате такого взаимодействия состарившиеся эритроциты разрушаются и выводятся из кровеносного русла. Гликопротеиды эритроцитарной плазмолеммы определяют также групповую принадлежность крови, обеспечивают рецепцию некоторых вирусов (в том числе вируса гриппа), фитогемагглютининов, гормонов и других физиологически активных веществ. 5