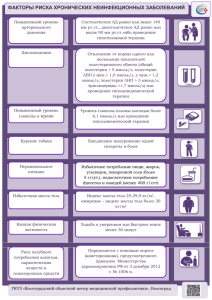
КАРДИОЛОГИЯ НЕВРОЛОГИЯ ХИРУРГИЯ ПЕДИАТРИЯ
реклама

12 № тÓÏ 10, 2012 КАРДИОЛОГИЯ НЕВРОЛОГИЯ ХИРУРГИЯ ПЕДИАТРИЯ ОНКОЛОГИЯ Главный редактор д.м.н. И.С.Явелов Редакционная коллегия Профессор, д.м.н. В.П. Авдошин Профессор, д.м.н. Г.Е. Гендлин Профессор, д.м.н. П.Р.Камчатнов Академик РАМН, д.м.н. А.И.Кириенко Профессор, д.м.н. И.В.Кузнецова Д.м.н. Л.В.Недосугова Профессор, д.м.н. А.И.Парфенов К.м.н. Н.В.Стуров Профессор, д.м.н. С.Н.Терещенко Профессор, д.м.н. Н.А.Шостак Содержание КАРДИОЛОГИЯ Роль дигидропиридиновых антагонистов кальция в лечении артериальной гипертонии Г.А.Барышникова, И.И.Степанова, Н.В.Чупрова, С.А.Чорбинская 4 Изолированная систолическая гипертензия – удел пожилого гипертоника О.М.Драпкина 10 Особенности течения ишемической болезни сердца у женщин. Клинические наблюдения Е.Е.Матвиенко, И.В.Родионова, Т.А.Кузнецова 14 Редакционный совет Акушерство и гинекология Е.Н. Андреева, А.П. Никонов, В.Н. Серов, А.Л. Тихомиров Аллергология Н.И. Ильина, М.Н. Клевцова, В.А. Ревякина, Е.С. Феденко Венерология и дерматология В.И. Кисина, М.А. Соловьев, И.А. Чистякова Гастроэнтерология Ю.В. Васильев, О.Н. Минушкин Иммунология Н.И. Ильина, М.Н. Клевцова, А.Е. Шульженко Кардиология Д.М. Аронов, Ю.А. Бунин, И.В. Жиров, С.Г. Козлов, О.Д. Остроумова, Б.А. Сидоренко, Г.И. Сторожаков Неврология А.Н. Бойко, Т.Г. Вознесенская, Н.Н. Яхно Неотложные состояния А.Л. Верткин Отоларингология А.И. Крюков, Л.А. Лучихин Педиатрия А.Г. Румянцев, Г.А. Самсыгина, И.Н. Захарова, Ю.Г. Мухина Проктология В.Г. Румянцев Психиатрия А.Б. Смулевич Пульмонология Л.И. Дворецкий, Н.П. Княжеская, В.Е. Ноников Урология Л.М. Гориловский, К.И. Забиров Хирургия С.З. Бурневич, В.С. Савельев, М.И. Филимонов Эндокринология В.В. Фадеев НЕВРОЛОГИЯ Асимптомные» стенозы магистральных артерий головы и их влияние на биоэлектрическую активность головного мозга С.А.Гуляев, А.В.Овчинников, И.В.Архипенко 18 Случай шейно-черепного синдрома с вегетативными респираторными кризами в неврологической практике М.Н.Дадашева, Л.А.Подрезова, Е.К.Романенко 21 ХИРУРГИЯ Использование бемипарина в качестве средства профилактики венозных тромбозов в общей хирургии и оперативной онкологии Н.В.Стуров, Д.А.Медянцева 24 ПЕДИАТРИЯ Клинические трудности диагностики синдрома Прадера-Вилли В.И.Гузева, Л.Б.Бессонова, К.А.Насеко 30 ОНКОЛОГИЯ Случай множественной миеломы, выявленной в стадии терминальной почечной недостаточности И.Т.Муркамилов, Р.Р.Калиев 32 CARDIOLOGY Dihydropyridine calcium antagonists in the treatment of hypertension G.A.Baryshnikova, I.I.Stepanova, N.V.Chuprova, S.A.Chorbinskaya 4 Isolated systolic hypertension as a destiny of elderly hypertensive patients O.M.Drapkina 10 Features of IHD in women. Case reports E.E.Matvienko, I.V.Rodionova, T.A.Kuznetsova 14 18 The case of cervicocranial syndrome with vegetative respiratory crises in neurological practice M.N.Dadasheva, L.A.Podrezova, E.K.Romanenko 21 Редакция журнала генеральный директор зав. редакцией директор по маркетингу дизайн, верстка Сафронова Н.В. Смирнова Л.Б., к.б.н. Бриль Ю.А. Антонова Д.А. Тираж: 50 000 экз. Редакция не несет ответственности за содержание рекламных материалов В статьях представлена точка зрения авторов, которая может не совпадать с мнением редакции журнала. В статьях могут быть указаны коммерческие названия лекарственных препаратов. SURGERY Bemiparin for venous thrombosis prevention in general surgery and surgical oncology N.V.Sturov, D.A.Medyantceva 24 PEDIATRY Difficulties of Prader-Willi syndrome diagnostics V.I.Guzeva, L.B.Bessonova, K.A.Naseko 30 ONCOLOGY The case of multiple myeloma diagnosed at the stage of severe renal failure I.T.Murkamilov, R.R.Kaliev Трудный пациент № 12, ТОМ 10, 2012 Тираж сертифицирован Национальной тиражной службой журнал «ТРУДНЫЙ ПАЦИЕНТ» Том 10, №12, 2012 Свидетельство о регистрации СМИ: ПИ № 77-14893 Издательский дом «Академиздат» 127055, Москва, а/я 91 e-mail: info@t-pacient.ru, Телефон: (495) 500-61-96 NEVROLOGY «Asymptomatic» stenosis of major cerebral arteries and its impact on the brain bioelectric activity S.A.Gulyaev, A.V.Ovchinnikov, I.V.Arkhipenko 32 Научное производственно-практическое издание. Согласно рекомендациям Роскомнадзора выпуск и распространение данного производственно-практического издания допускается без размещения знака информационной продукции. 3 КЛИНИЧЕСКИЙ СЛУЧАЙ Роль дигидропиридиновых антагонистов кальция в лечении артериальной гипертензии Г.А.Барышникова, И.И.Степанова, Н.В.Чупрова, С.А.Чорбинская Учебно-научный медицинский центр УД Президента РФ В статье обсуждаются фармакологические свойства и клиническая эффективность нового блокатора кальциевых каналов лерканидипина в лечении пациентов с артериальной гипертензией. Ключевые слова: лерканидипин, артериальная гипертензия, лечение. Dihydropyridine calcium antagonists in the treatment of hypertension G.A.Baryshnikova, I.I.Stepanova, N.V.Chuprova, S.A.Chorbinskaya Educational-scientific medical centre of the Administration of the President of the Russian Federation, Moscow Трудный пациент № 12, ТОМ 10, 2012 The article discusses pharmacological features and clinical effectiveness of the new generation calcium antagonist called lercanidipine in the treatment of hypertension. Keywords: lercanidipine, hypertension, treatment. 4 Артериальная гипертензия (АГ) остается одной из наиболее актуальных проблем здравоохранения, что обусловлено ее высокой распространенностью (в России АГ страдают около 40% лиц старше 18 лет), способностью АГ вызывать поражение органов-мишеней (сердце, почки, сосуды), и увеличивать частоту развития таких тяжелых осложнений, как инфаркт миокарда, инсульт, хроническая сердечная недостаточность, ухудшение функции почек вплоть до развития терминальной почечной недостаточности. При эффективном лечении АГ достоверно снижается риск сердечно-сосудистых осложнений и сердечно-сосудистая смертность, то есть достигается основная цель лечения АГ. Европейские и Российские ре- комендации по диагностике и лечению АГ [1] выделяют пять основных классов противогипертензивных препаратов: диуретики, b-адреноблокаторы, антагонисты кальция, ингибиторы ангиотензинпревращающего фермента и блокаторы ангиотензиновых рецепторов. При выборе тактики ведения больного необходимо учитывать уровень АД, наличие и характер имеющихся факторов риска, органов-мишеней, ассоциированных с АГ заболеваний (ишемическая болезнь, сахарный диабет, заболевания почек) и состояний. Разумеется, выбирая стратегию лечения АГ, следует учитывать опыт применения различных препаратов у пациента (как эффективность, так и переносимость). Другими словами, выбор препарата должен быть индивидуализирован. Дигидропиридиновые антагонисты кальция (АК) на протяжении многих лет были и остаются препаратами первого ряда, особенно у пациентов с изолированной систолической гипертонией (ИСАГ), с сопутствующей ИБС, атеросклерозом сонных и коронарных артерий. К их несомненным достоинствам относится метаболическая нейтральность, сохранение эффективности при одновременном приеме нестероидных противовоспалительных препаратов, отсутствие синдрома отмены и влияния на сексуальную функцию у мужчин. Кроме классификации АК по химическому строению, их разделяют также на I (короткодействующие), II и III поколения (пролонгированного действия) (таблица). Поскольку многочисленными исследованиями доказано, что короткодействующие АК способны повысить риск развития ишемии миокарда (из-за повышения активности симпатико-адреналовой системы в ответ на быстрое и мощное сосудорасширяющее действие), их применение ограничено неотложными состояниями, например, короткодействующий нифедипин применяется для купирования гипертонического криза. Напротив, АК пролонгированного действия способны снижать риск развития сердечно-сосудистых осложнений, а по способности снижать риск инсульта даже являются лидерами среди прочих антигипертензивных препаратов (исследования ALLHAT, VALUE). Одним из самых серьезных доказательств эффективности современных АК явились результаты метаанализа 13 крупных исследований (около 104 тыс пациентов, страдающих АГ), согласно которому при терапии дигидропиридиновыми АК достоверно снижался риск развития инсульта, причем это снижение не было напрямую связано с влиянием на уровень АД [2]. Поэтому только АК II–III поколений могут применяться для длительного непрерывного лечения АК. Наряду с амлодипином и лацидипином к АК III поколения относится лерканидипин, обладающий рядом преимуществ перед прочими АК. Прежде всего, следует подчеркнуть более высокую сосудистую селективность лерканидипина по сравнению с амлодипином, фелодипином, лацидипином (рис. 1) [3], что объясняет отсутствие отрицательного инотропного действия в отличие от других антагонистов кальция дигидропиридинового ряда. Лерканидипин, как и другие АК дигидропиридинового ряда, обратимо связывается с кальциевыми Сведения об авторах: Барышникова Галина Анатольевна – д.м.н., профессор кафедры семейной медицины ФГБУ «Учебно-научный медицинский центр» УД Президента РФ Степанова Ирина Ираклиевна – к.м.н., доцент кафедры семейной медицины ФГБУ «Учебно-научный медицинский центр» УД Президента РФ Чупрова Наталья Владимировна – врач Центральной клинической больницы Главного Медицинского управления УД Президента РФ Чорбинская Светлана Алексеевна – д.м.н., профессор, зав кафедрой семейной медицины ФГБУ «Учебно-научный медицинский центр» УД Президента РФ каналами L-типа гладкомышечных клеток сосудов, что сопровождается вазодилатацией, снижением периферического сосудистого сопротивления и снижением АД без существенного повышения частоты сердечных сокращений (ЧСС). Благодаря высокой липофильности и, соответственно, высокому мембранному коэффициенту распределения (мембранная фармакокинетика), лерканидипин депонируется внутри двойного липидного слоя мембран гладкомышечных клеток сосудов. Способность лерканидипина накапливаться в мембране обеспечивает продолжительную блокаду кальциевых каналов при относительно недолгом периоде циркуляции препарата в крови (2–5 ч). В результате сосудорасширяющее и, соответственно, антигипертензивное действие препарата зависит именно от концентрации его в клеточной мембране, а не в плазме крови, как у других АК (с плазменной фармакокинетикой). Антигипертензивный эффект лерканидипина развивается постепенно и сохраняется длительно (коэффициент Т/Р превышает 83%). В исследовании ELYPSE изучали антигипертензивную эффективность лерканидипина в дозе 10 мг/сут у 9059 пациентов с АГ I–II степени [4]. Уже через месяц отмечено снижение систолического АД на 13,5±11,5 мм рт. ст., диастолического АД – на 9,4±7,7 мм рт. ст. (рис. 2). Через 3 мес отмечено нарастание антигипертензивного эффекта и, что очень важно, незначительное, но достоверное (р<0,01) уменьшение ЧСС по сравнению с исходными показателями (как известно, увеличение ЧСС сопровождается увеличением риска сердечно-сосудистых осложнений). У лиц с мягкой и умеренной АГ монотерапия лерканидипином в дозе 10 мг/сут на протяжении 4 нед приводила к нормализации АД в 72–89% случаев [5], увеличение дозы лерканидипина до 20 мг/сут достоверно усиливало его антигипертензивный эффект [6]. Двойные слепые перекрестные исследования показали, что у пациентов с мягкой и умеренной АГ прием лерканидипина в течение 2–16 нед в суточной дозе 10–20 мг дает такой же антигипертензивный эффект, как и нифедипин замедленного высвобождения в дозе 20–40 мг 2 раза в сутки, нифедипин GITS в дозе 30–60 мг 1 раз в сутки, амлодипин в дозе 10 мг/сут, фелодипин в дозе 10–20 мг/сут и верапамил-SR в дозе 240 мг/сут [7, 8]. У больных с тяжелой АГ при назначении лерканидипина 20 мг/сут через месяц диастолическое АД снизилось в среднем на 22 мм рт. ст. При изолированной систолической АГ у пожилых пациентов применение лерканидипина в суточной дозе 10– 20 мг в течение 8 нед по сравнению с плацебо позволило достичь значительного снижения систолического АД – в среднем на 32 мм рт. ст. [9]. В многоцентровом рандомизированном исследовании COHORT сравнили эффективность и переносимость лерканидипина (в дозе 10–20 мг/сут), амлодипина и лацидипина у 828 лиц старше 60 лет. Во всех трех группах достигнуто сопоставимое снижение АД – на 20/10 мм рт. ст. через 4 нед и на 30/14 мм рт. ст. – через 6 мес терапии [10]. Периферические отеки значительно чаще развивались в группе амлодипина (19%) и чаще приводили к отмене препарата (8,5%) по сравнению с лерканидипином (соответственно 9,0% и 2,1%). Частота других побочных эффектов в группах амлодипина и лерканидипина не отличалась. Лерканидипин обладает органопротективным действием: по способности обеспечить регресс гипертрофии миокарда левого желудочка у лиц с АГ КЛИНИЧЕСКИЙ СЛУЧАЙ Рис. 1. Тропность к мембранам сосудов различных дигидропиридиновых антагонистов кальция лерканидипин превосходит блокатор рецепторов ангиотензина II лозартан (рис. 3), сопоставим с ингибитором АПФ эналаприлом [11, 12]. Подобно другим АК лерканидипин улучшает эндотелий-зависимую вазодилатацию, обладает антиатерогенным действием, не связанным с его антигипертензивной эффективностью. Доказано, что лерканидипин обладает нефропротективными свойствами. По данным M.Sabbatini и соавт. [13], в отличие от большинства антагонистов кальция, лерканидипин расширяет не только приносящие, но и выносящие артериолы, предупреждая повреждение клубочков и собирательных трубочек у крыс со спонтанной гипертензией. По мнению авторов, нефропротективное действие лерканидипина не связано с его влиянием на АД. В рандомизированном двойном слепом контролируемом исследовании DIAL [14] сравнивали лерканидипин (10 мг/сут) и рамиприл (5 мг/сут) по способности снижать уровень экскреции альбумина и АД у больных с СД 2 типа и персистирующей микроальбуминурией. 180 больных были рандомизированы в группу лерканидипина (91 больной) и рамиприла (89 больных). Лерканидипин вызывал значительное снижение уровня экскреции альбумина по сравнению с исходным уровнем, причем статистически значимых различий по сравнению с рамиприлом не отмечалось (рис. 4). Трудный пациент № 12, ТОМ 10, 2012 Информация о препарате 6 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА Фармакодинамика. Лерканидипин – селективный блокатор кальциевых каналов дигидропиридиновой группы, подавляющий трансмембранный ток кальция в клетки сердца и гладких мышц. Механизм его гипотензивного действия обусловлен прямым релаксирующим влиянием на гладкие мышцы сосудов, за счет чего снижается ОПСС. Несмотря на короткий период полувыведения (Т1/2) из плазмы крови, лерканидипин оказывает длительное антигипертензивное действие за счет высокого коэффициента мембранного распределения; не обладает отрицательным инотропным эффектом за счет высокой сосудистой селективности. Редко отмечают коллаптоидные реакции с рефлекторной тахикардией ввиду постепенного развития вазодилатации. Фармакокинетика. Лерканидипин полностью всасывается после приема внутрь. Cmax в плазме крови достигается приблизительно через 1,5–3 ч; степень связывания с белками плазмы крови – >98%. Вследствие интенсивного метаболизма при первичном прохождении через печень абсолютная биодоступность лерканидипина, принятого после еды, составляет около 10%, при этом она снижается до 1/3 этого значения, если препарат применяют у здоровых добровольцев натощак. Т1/2 составляет 8–10 ч, а терапевтическое действие продолжается на протяжении 24 ч вследствие высокой степени связывания с липидной мембраной. При повторном применении кумуляция не отмечена. Биодоступность лерканидипи- Рис. 2. Влияние лерканидипина на систолическое (САД) и диастолическое АД (ДАД), ЧСС в исследовании ELYPSE Рис. 3. Сравнительная антигипертензивная эффективность и влияние на гипертрофию левого желудочка лозартана и лерканидипина ММЛЖ – масса миокарда левого желудочка. В исследование ZAFRA [15] были включены 175 пациентов с хронической почечной недостаточностью различной этиологии, получавшие ингибиторы АПФ или блокаторы рецепторов ангиотензина II, у которых сохранялись повышение АД и протеинурия. Через 6 мес после присоединения лерканидипина в дозе 10 мг/сут увеличилось число больных с целевым уровнем АД, снизилась протеинурия, улучшилась функция почек (рис. 5). Леркамен® (Берлин-Хеми АГ/Менарини Групп) Лерканидипин Таблетки п.о., 10 мг, 20 мг на после перорального применения значительно повышается после приема пищи (в 4 раза), поэтому препарат принимают натощак. При пероральном применении лерканидипина его концентрация в плазме крови непрямо пропорциональна принятой дозе (нелинейная кинетика). После приема 10; 20 и 40 мг Cmax в плазме крови имели соотношение 1:3:8, а AUC, соответственно, 1:4:18, что указывает на постепенное насыщение метаболизма при первом прохождении. Таким образом, биодоступность лерканидипина увеличивается с повышением дозы. Фармакокинетика лерканидипина у лиц пожилого возраста и у пациентов с дисфункцией почек или печени легкой и средней тяжести мало отличается от таковой в общей популяции. При тяжелой дисфункции почек или у пациентов, находящихся на гемодиализе, концентрация препарата в плазме крови повышается (около 70%). При средней или тяжелой дисфункции печени системная биодоступность лерканидипина, вероятно, повышается, поскольку он метаболизируется главным образом в печени. ПОКАЗАНИЯ Эссенциальная артериальная гипертензия легкой или средней тяжести. Разделы: Применение, Противопоказания, Побочные эффекты, Особые указания, Взаимодействие, Передозировка, – см. в инструкции по применению препарата. I поколение III поколение IIa IIb исрадипин нимодипин нисолдипин Дигидропиридины нифедипин нифедипин SR/GITS фелодипин ER исрадипин SR Фенилкиламины верапамил верапамил SR Бензотиазепины дилтизем дилтизем SR амлодипин лацидипин лерканидипин Рис. 4. Влияние лерканидипина и рамиприла на скорость экскреции альбумина – СЭА (исследование DIAL) Рис. 6. Влияние на кровоток в общих сонных артериях лерканидипина и нимодипина Рис. 5. Влияние лерканидипина на функцию почек и протеинурию у больных ХПН в исследовании ZAFRA Рис. 7. Переносимость лерканидипина в сравнении с другими дигидропиридиновыми антагонистами кальция (амлодипин, нифедипин GITS, фелодипин) У больных пожилого возраста лерканидипин выглядит особенно привлекательным, поскольку, снижая АД, улучшает мозговой кровоток (рис. 6) [16]; в этом отношении лерканидипин подобен нимодипину, назначаемому неврологами при субарахноидальных кровоизлияниях. А по способности уменьшать отношение толщины стенки церебральной артерии к ее просвету лерканидипин в экспериментальном исследовании на крысах со спонтанной гипертензией превзошел такие антигипертензивные препараты как гидралазин, манидипин, нимодипин [17]. Важна еще и очень хорошая переносимость лерканидипина у пожилых пациентов. Во всяком случае, частота побочных эффектов у пожилых (5,4%) и более молодых пациентов (6,6%) не отличалась [18]. Лерканидипин не ухудшает липидный и углеводный виды обмена, более того в исследовании M.Caffiero с соавт. [19] при назначении лерканидипина в дозе 10–20 мг 355 больным с умеренной АГ через 12 мес число больных с отклонением от нормы уровней глюкозы, общего холестерина и креатинина достоверно уменьшилось (рис. 8). Лерканидипин хорошо переносился. Только у 5,6% больных препарат был отменен из-за развития побочных эффектов. Через 12 мес более 80% больных оказались приверженными проводимой терапии. Очень хорошая переносимость лерканидипина была продемонстрирована в иследовании C.Borghi с соавт. [20], когда перевод пациентов, получавших такие АК, как амлодипин, нифедипин GITS, фелодипин, на терапию лерканидипином в дозе 10–20 мг/сут привел через 4 нед к достоверному снижению частоты головных болей, приливов и отеков голеней. При возврате предыдущей терапии увеличивалась частота ранее выявляемых побочных эффектов (рис. 9), что, несомненно, свидетельствует о лучшей переносимости лерканидипина по сравнению с вышеперечисленными АК. При недостаточной эффективности атенолола, эналаприла или гидрохлоротиазида с амилоридом назначение в дополнение к этим препаратам лерканидипина в дозе 10 мг/сут уже через 4 нед позволило достичь целевого уровня диастолического АД у 76% больных; через 12 нед число больных, достигших целевого уровня диастолического АД, увеличилось до 92% [21]. Лерканидипин может быть добавлен по сути дела к любому другому антигипертензивному препарату с целью достижения целевого АД. Комбинация лерканидипина с ингибиторами АПФ относится к рациональной, согласно национальным рекомендациям по диагностике и лечению АГ (4-й пересмотр, 2010), так как в этом случае помимо повышения эф- Трудный пациент № 12, ТОМ 10, 2012 II поколение Химическая структура КАРДИОЛОГИЯ Классификация антагонистов кальция (T.Toyo-Oka, W.G.Nayler, 1996) 7 КЛИНИЧЕСКИЙ СЛУЧАЙ Трудный пациент № 12, ТОМ 10, 2012 8 Рис 8. Уменьшение доли пациентов с отклонением от нормы креатинина, глюкозы и холестерина крови через 12 мес терапии лерканидипином фективности противогипертензивной терапии можно рассчитывать на уменьшение выраженности возможных нежелательных эффектов. Лерканидипин способен уменьшить выраженность сухого кашля благодаря снижению гиперреактивности бронхов, а ингибитор АПФ позволяет уменьшить отеки стоп и голеней, которые могут появляться при использовании любого антагониста кальция из-за присущего им артериолярного вазодилатирующего эффекта (хотя при использовании лерканидипина достоверно реже) за счет вазодилатации посткапиллярных венул, снижая гидростатическое давление в капиллярах. За рубежом несколько лет назад появилась и с успехом применяется официнальная комбинация лерканидипина и эналаприла. Высокая антигипертензивная эффективность лерканидипина, возможность комбинации его с любым другим антигипертензивным препаратом, хорошая переносимость и метаболическая нейтральность послужили основанием к его применению в описываемой ниже клинической ситуации. Клинический случай. Пациентка, 62 года, страдает АГ с 30-летнего возраста, поначалу регулярной терапии не получала, АД не превышало 150/100 мм рт. ст. Наследственность отягощена (оба родителя страдали АГ). Стала регулярно принимать антигипертензивные препараты после того, как дважды была госпитализирована с гипертоническим кризом. Последние 10 лет принимала индапамид ретард и Небилет® 5 мг/сут, с хорошим эффектом. Однако 2 года назад пациентка попала в автокатастрофу (перелом ноги с последующим неудачным остеосинтезом и ушиб мозга). После этого АД, несмотря на продолжающийся прием вышеуказанных препаратов, стало повышаться до 180–190/100–110 мм рт. ст. К терапии были добавлены эналаприл 10 мг 2 раза в сутки и фелодипин 5 мг/сут, однако появились мучительный сухой кашель и выраженные отеки голеней, заставившие пациентку отказаться от их применения. Были назначены% бисопролол 2,5 мг/сут, валсартан 160 мг/сут, индапамид ретард 1,5 мг утром и моксонидин 0,4 мг вечером. Помимо этого больная принимает ацетилсалициловую кислоту 100 мг и аторвастатин 10 мг (оба препарата вечером). Несмотря на четкое выполнение рекомендаций по приему препаратов, сохраняется повышение АД до 180/100 мм рт. ст., которое одинаково часто может регистрироваться как утром, так и вечером. Больная обратилась для коррекции терапии, так как плохо переносит повышенные цифры АД (тяжесть в затылке, слабость, головокружение). Больная страдает ожирением (индекс массы тела 32 кг/м2). При обследовании: отрицательная динамика ЭКГ в виде сглаженного зубца Т в III, AVF (предыдущая ЭКГ была снята около 2-х лет назад), ритм синусовый, 58 ударов в 1 мин), хотя болей в области сердца не отмечает. ЭхоКГ: умеренная гипертрофия левого желудочка (тол- Рис. 9. Влияние 4-летнего приема лерканидипина и других дигидропиридиновых АК на общую смертность щина задней стенки и межжелудочковой перегородки 1,2 мм), дилатации полостей сердца не отмечено, нарушения сократительной функции сердца не выявлено (фракция выброса 63%), нарушение диастолической функции I тип. Общий анализ крови и мочи без особенностей. Обнаружена микроальбуминурия (180 мг/сут). При УЗИ почек обнаружены несколько кист в левой почке диаметром до 1,5 см (рекомендовано наблюдение). Креатинин – 89 мкмоль/л, мочевина – 6,9 ммоль/л, калий плазмы – 4,05 ммоль/л. К проводимой терапии был добавлен лерканидипин (Леркамен®) 10 мг/сут вечером. Через 10 дней доза препарата была увеличена до 20 мг/сут. Еще через 2 нед АД снизилось до 150/90–95 мм рт. ст. Больная чувствует себя лучше, головные боли не беспокоят, претибиальных отеков нет. Рекомендовано ограничить потребление поваренной соли и калорийность рациона с целью снижения избыточной массы тела; на повышение физической активности рассчитывать трудно (после автокатастрофы очень долго восстанавливалась, ходит с трудом, пользуется тростью). Данное наблюдение подтвердило данные о способности лерканидипина в составе комбинированной терапии снижать АД у больных, резистентных к терапии другими антигипертензивными препаратами. Выбор препарата для пациентки, столкнувшейся с проблемой переносимости ингибиторов АПФ и АК амлодипина, не случаен. Как уже говорилось, лерканидипин хорошо переносится. По данным метаанализа 20 клинических плацебо-контролируемых исследований, включавших около 1800 больных АГ, нежелательные явления встречались у 11,8% больных, получавших лерканидипин (10–20 мг/сут, n=1317) и у 7% больных на плацебо (n=227), причем доля больных, отказавшихся от продолжения терапии, в обеих группах не отличалась. Причем, если стартовой дозой лерканидипина избирается доза 20 мг, частота побочных эффектов оказывается выше, а если стартовая доза составляет 10 мг, и лишь спустя какое-то время увеличивается до 20 мг – частота побочных эффектов была значительно ниже. Еще более впечатляющими оказались данные о переносимости лерканидипина в суточной дозе 10 мг по завершении многоцентрового 6-недельного исследования, включавшего 32 345 больных мягкой и умеренной АГ с сопутствующими ИБС, сахарным диабетом, хронической сердечной недостаточностью, дислипидемией: частота побочных реакций оказалась крайне низкой (покраснение лица – 0,3%, периферические отеки – 0,14%, сердцебиение – 0,06%) [22]. А в отношении небольшой вероятности появления отеков голеней и стоп (явившихся причиной отказа нашей пациентки от амлодипина), при применении лерканидипина мы ориентировались еще и на результаты исследования R.Fogari и соавт. [23]. Авторы Литература 1. Рекомендации РМОАГ/ВНОК по диагностике и лечению артериальной гипертонии (IV пересмотр), 2010. 2. Angeli F. et al. Calcium channel blockade to prevent stroke in hypertension: a meta-analysis of 13 studies with 103,793 subjects. Am J Hypertens. 2004 Sep; 17 (9): 817–22. 3. Angelico P., Guarneri L., Leonardi A. et al. Vascular-selective effect of lercanidipine and other 1,4-dihydropyridines in isolated rabbit tissues. J. Pharmacol. 1999; 51: 709–714. КАРДИОЛОГИЯ 4. Barrios V., Navarro A., Esteras A. et al. Antihypertensive efficacy and tolerability of lercanidipine in daily clinical practice. The ELYPSE study. Blood Press. 2002; 11 (2): 95–100. 5. Bang L.M., Chapman T.M., Goa K.L. 2003. Lercanidipine: a review of its efficacy in the management of hypertension. Drugs. 63: 2449–72. 6. Paterna S., Licata A., Arnone S. et al. Lercanidipine in two different dosage regimens as a sole treatment for severe essential hypertension. J. Cardiovasc. Pharmacol. 1997; 29 (Suppl. 2): S50–53. 7. Policicchio D., Magliocca R., Malliani A. Efficacy and tolerability of lercanidipine in patients with mild to moderate essential hypertension: a comparative study with slow-release nifedipine. J. Cardiovasc. Pharmacol. 1997; 29 (Suppl. 2): S31–35. 8. Romito R., Pansini M.I., Perticone F. et al. Comparative effect of lercanidipine, felodipine, and nifedipine GITS on blood pressure and heart rate in patients with mild to moderate arterial hypertension: the Lercanidipine in Adults (LEAD) Study. J Clin Hypertens (Greenwich). 5: 249–53. 9. Barbagallo M., Barbagallo S.G. Efficacy and tolerability of lercanidipine in monotherapy in elderly patients with isolated systolic hypertension. Aging Clin. Exp. Res. 2000; 12 (5): 375–379. 10. Zanchetti A. Emerging data on calcium-channel blockers: the COHORT study. Clin Cardiol. 2003; 26 (Suppl. 2): II: 17–20. 11. Fogari R., Mugellini A., Corradi L. et al. Efficacy of lercanidipine vs losartan on left ventricular hypertrophy in hypertensive type 2 diabetic patients [abstract no. P1.191]. J. Hypertens. 2000; 18 (Suppl. 2): S65. 12. Sanchez A., Sayans R., Alvarez J.L. et al. Left ventricular hypertrophy regression after a short antihypertensive treatment with lercanidipine vs. enalapril [abstract no. 12]. Fourth European Meeting on Calcium Antagonists. 1999, Oct 27–29; Amsterdam. 13. Sabbatini M., Leonardi A., Testa R. et al. Effect of calcium antagonists on glomerular arteriolesin spontaneously hypertensive rats. Hypertension. 2000; 35 (3): 775–9. 14. Dalla Vestra M., Pozza G., Mosca A. et al. Effect of lercanidipine compared with ramipril on albumin excretion rate in hypertensive Type 2 diabetic patients with microalbuminuria: DIAL study (diabete, ipertensione, albuminuria, lercanidipina). Diabetes Nutr Metab. 2004; 17 (5): 259–66. 15. Robles N.R., Ocon J., Gomez C.F. et al. Lercanidipine in Patients with Chronic Renal Failure: The ZAFRA study. Ren Fail. 2005; 27 (1): 73–80. 16. Sironi G., Colombo D., Greto L et al. Regional vasodilating effects of lercanipine in dogs// ISHR XVI World Congress, 1998. 17. Sabbatini M., Tomassoni D., Amenta F. Influence of treatment with Ca2+ antagonistis on cerebral vasculature of spontaneously hypertensive rats. Mechanisms of Ageing and Development. 2001; 122: 795–809. 18. Leonetti G. The safety profile of antihypertensive drugs as the key factor for the achievement of blood pressure control: current experience with lercanidipine. High Blood Press. 8: 92–101. 19. Cafiero M., Giasi M. Long-term (12-month) treatment with lercanidipine in patients with mild to moderate hypertension. J Cardiovasc Pharmacol. 1997; 29: Suppl 2: S45–49. 20. Borghi C., Prandin M.G., Dormi A. The use of lercanidipine can improve the individual tolerability to dihydropyridine calcium blockers in hypertensive patients [abstract]. J Hypertens. 2000; 18: Suppl 2: S155. 21. Rengo F., Romis L. Activity of lercanidipine in double-blind comparison with nitrendipine in combination treatment of resistant essential hypertension. J. Cardiovasc. Pharmacol. 1997; 29: Suppl. 2: S54–58. 22. Marx A., Lichtenthal A., Milbredt C. et al. 2004. Effect of anthypertensive therapy with a new third generation calcium antagonist lercanidipine on patients with concomitant diseases. J Hypertens. 22: Suppl 2: S236. 23. Fogari R., Malamani G.D., Zoppi A. et al. Comparative effect of lercanidipine and nifedipine gastrointestinal therapeutic system on ankle volume and subcutaneous interstitial pressure in hypertensive patients: a doubleblind, randomized, parallel-group study. Curr Ther Res. 2000; 61 (12): 850–62. 24. Lund-Johansen P., Stranden E., Helberg S. et al. Quantification of leg oedema in postmenopausal hypertensive patients treated with lercanidipine or amlodipine. J. Hypertens. 2003; 21: 1003–1010. 25. Ortiz M., Calcino G. Inferred Mortality Differences between Dihydropyridine Antihypertensives. Hypertension. 2009; 53: 1116. 26. Isla S. Mackenzie, Carmel M., McEniery et al. Comparison of the Effects of Antihypertension Agents on Central Blood pressure and Arterial Stiffness in Isilated Systolic Hypertension. Hypertension. 2009; 54: 409–413. Трудный пациент № 12, ТОМ 10, 2012 в своем исследовании использовали известный закон: тело, погруженное в воду, вытесняет объем жидкости, равный объему погруженного тела, то есть был исключен субъективизм в оценке выраженности претибиальных отеков. Оказалось, что при погружении в воду ног больных, получавших лерканидипин, объем вытесненной воды гораздо меньше по сравнению с больными, получавшими нифедипин GITS. В другом исследовании были получены сходные результаты: при оценке выраженности отеков голеней у больных АГ женщин, находящихся в постменопаузе, получавших лерканидипин и амлодипин (в группе лерканидипина выраженность отеков была в 11,4 раза меньше) [24]. В Австралии была ретроспективно изучена общая смертность у больных АГ, получавших дигидропиридиновые АК (амлодипин, фелодипин, нифедипин и лерканидипин) в виде моно- или комбинированной терапии [25] . Через 4 года общая смертность в группах нифедипина, амлодипина и фелодипина оказалась на 75% выше по сравнению с лерканидипином (рис. 9). Следует отметить, что больные, получавшие лерканидипин, значительно реже отказывались от продолжения терапии. Одной из возможных причин лучшего влияния лерканидипина на прогноз может быть влияние на центральное пульсовое давление. S.Isla и соавт. при назначении в течение 10 нед пациентам старше 60 лет с изолированной систолической АГ периндоприла, атенолола, лерканидипина или тиазидного диуретика бендрофлуазида обнаружили снижение центрального пульсового давления в группе периндоприла, лерканидипина и диуретика, в то время как атенолол на центральное пульсовое давление влияния не оказывал. Причем, лерканидипин снижал индекс аугментации (повышение индекса означает увеличение жесткости аорты), в то время как атенолол его повышал [26]. На основании вышесказанного можно сделать вывод, что антагонист кальция третьего поколения лерканидипин является высокоэффективным, длительно действующим антигипертензивным препаратом для лечения АГ любой стадии и степени тяжести. Он обладает органопротекторными свойствами и может успешно применяться как в качестве монотерапии, так и в комбинации с любыми другими (кроме дигидропиридиновых антагонистов кальция) антигипертензивными препаратами. В России лерканидипин представлен под торговым названием Леркамен® (компания «Берлин-Хеми АГ/Менарини Групп»). Леркамен® выпускается в таблетках по 10 и 20 мг по 28 или 60 штук в упаковке (таблетки делимые). Рекомендуемая доза, согласно официальной инструкции, составляет 10 мг 1 раз в сутки, при необходимости дозу следует увеличить до 20 мг 1 раз в сутки. Леркамен® не только эффективно снижает АД, но и обладает лучшей среди всех антагонистов кальция дигидропиридинового ряда переносимостью, что с учетом удобства применения (соответствие девизу «Один день – одна таблетка») позволяет рассчитывать на более высокий уровень приверженности пациентов назначенной терапии. 9 ТЕРАПИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ Изолированная систолическая гипертензия – удел пожилого гипертоника О.М.Драпкина Первый Московский Государственный Университет им И.М.Сеченова Клиника пропедевтики внутренних болезней, Москва Изолированная систолическая артериальная гипертензия наиболее часто наблюдается у лиц пожилого возраста и трудно поддается фармакотерапии. В статье приводится случай успешной фармакотерапии ИСАГ с использованием антагонистов кальция и олмесартана. Ключевые слова: ИСАГ, пожилые лица, лечение, олмесартан. Isolated systolic hypertension as a destiny of elderly hypertensive patients O.M.Drapkina Internal Medicine Propaedeutic Clinics, I.M.Sechenov FMSMU Трудный пациент № 12, ТОМ 10, 2012 Isolated systolic hypertension (ISH) is mostly common in elderly patients and is known to be difficult to treat. The article describes the case of ISH successfully treated with calcium antagonists and olmesartan. Keywords: ISH, elderly patients, treatment, olmesartan. 10 Артериальная гипертензия (АГ) – одно из самых распространенных сердечно-сосудистых заболеваний (ССЗ), которое представляет собой огромную угрозу здоровью и жизни населения. В РФ АГ широко распространена и наблюдается у 41,1% женщин [1, 4] Частота АГ в популяции зависит от возраста и пола. При этом отмечается следующая закономерность: в возрастном диапазоне от 30 до 50–60 лет распространенность АГ выше среди мужчин, после 50–60 лет – среди женщин. Проблема артериальной гипертензии (АГ) у пожилых женщин приобретает все большую актуальность, так как у более чем половины женщин старше 60 лет фиксируется стойкое повышение артериального давления (АД). При этом эффективность антигипертензивной терапии у женщин с возрастом уменьшается (с 20 до 8% после 50 лет), у мужчин же она остается практически неизменной (4–7%) на протяжении всей жизни [3]. Повышенное нормальное артериальное давление по сравнению с оптимальным увеличивает риск ишемической болезни сердца у женщин в 4 раза, хорошо корректируемая артериальная гипертензия – в 8 раз, плохо леченная артериальная гипертензия – в 19 раз [4]. Женщины в 2 раза чаще умирают от инсультов, чем мужчины (16 и 8%, соответственно) при равной распространенности церебральных сосудистых катастроф у представителей обоих полов, что связывают с большей продолжительностью жизни и более высоким уровнем систолического АД у женщин [2]. Наиболее часто у женщин диагностируется изолированная систолическая форма АГ (ИСАГ), т.е. повышение уровня систолического АД до 140 мм рт. ст. и выше при диастолическом АД менее 90 мм рт. ст. В настоящее время ИСАГ рассматривают как один из вариантов эссенциальной (или первичной) АГ, т.е. в рамках гипертонической болезни [5]. Распространенность ИСАГ увеличивается с возрастом, превышая 40% у больных старше 60 лет. Гораздо чаще встречается ИСАГ 1-й степени (по сравнению с ИСАГ 2-й или 3-й степени): 1-я cтепень ИСАГ, например, встречается у 1/3 американцев старше 70 лет. Различают первичную и вторичную ИСАГ. Вторичная ИСАГ обусловлена увеличением минутного объема сердца (например, при тиреотоксикозе или анемии) или наличием выраженного атеросклероза аорты. В случае отсутствия указанных причин для повышения САД говорят о наличии первичной ИСАГ, то есть гипертонической болезни. Гемодинамические механизмы первичной ИСАГ у пожилых лиц окончательно не установлены. Абсолютное большинство исследователей считают основным механизмом ее формирования снижение растяжимости аорты и крупных артерий, поэтому выброс крови из левого желудочка осуществляется в более ригидную и менее эластичную аорту, что и обусловливает увеличение САД. Под растяжимостью понимают способность сосуда к изменению объема под влиянием меняющегося давления. Ригидная аорта также способствует формированию гипертрофии миокарда левого желудочка. Снижение растяжимости тесно связано с процессом старения (потеря эластичности волокон стенки артерий и отложения в ней коллагена, эластина, гликозаминогликанов и кальция). Важность выделения проблемы ИСАГ связана с тем, что повышение САД, в том числе изолированное повышение САД (при нормальном диастолическом АД), является важным фактором риска развития сердечно-сосудистых осложнений. Поэтому расценивать повышение САД как проявление возрастной нормы, как это было около десяти лет назад, является серьезной ошибкой, которая может иметь для больного самые серьезные последствия. Установлено, что ИСАГ увеличивает смертность от сердечно-сосудистой патологии в 2–5 раз и общую смертность на 51% по сравнению с таковой у лиц, имеющих нормальные показатели АД. Более Сведения об авторе Драпкина Оксана Михайловна – д-р мед. наук, проф. кафедры пропедевтики внутренних болезней Лечебного факультета Первого Московского государственного медицинского университета им. И.М.Сеченова, зав. отделением кардиологии Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х.Василенко, Москва того, во многих случаях повышение систолического АД играет даже большую роль в развитии сердечно-сосудистых осложнений: у лиц всех возрастных групп риск развития всех сердечно-сосудистых осложнений АГ (ишемическая болезнь сердца, в том числе инфаркт миокарда, инсульт, сердечная недостаточность, атеросклероз периферических артерий) сильнее коррелировал с уровнем систолического, а не диастолического АД. В России эта проблема крайне актуальна, поскольку наша страна, к сожалению, занимает первое место в мире по смертности от сердечно-сосудистых заболеваний (ССЗ). Отмечено, что при росте САД относительный риск смерти от ССЗ увеличивается больше, чем при возрастании ДАД, и при максимальных значениях АД (для систолического – более 150 мм рт. ст., для диастолического – более 98 мм рт. ст.) в 2 раза превышает риск, обусловленный ростом диастолического АД. У женщин относительный риск развития ССЗ составляет 1,3 для изолированной диастолической (САД менее 160 мм рт. ст.) АГ, 3,2 – для систолодиастолической АГ и 4,1 – для ИСАГ. Для мужчин аналогичные показатели составляют 1,4, 2,3, 2,9 для изолированной диастолической, систолодиастолической и ИСАГ соответственно. Следовательно, самый высокий риск развития ССЗ зафиксирован у пациентов с ИСАГ. У женщин гормональная перестройка репродуктивной системы с возрастом вызывает ряд изменений в различных органах и системах, предрасполагающих к развитию артериальной гипертензии. Выключение репродуктивной функции приводит к нейроэндокринным нарушениям, которые предопределяют некоторые особенности течения АГ в пери- и постменопаузе [5, 6]: • дебют стойкого повышения АД приходится, как правило, на перименопаузу; • отмечается повышенная чувствительность к хлориду натрия и существенный прирост общего периферического сосудистого сопротивления; • повышенная реактивность сосудов на норадреналин вызывает чрезмерный рост АД в ответ на психоэмоциональный стресс, а нарушение регуляции выброса катехоламинов определяет высокую вариабельность АД в течение суток; • АГ потенцирует клинику климактерического синдрома; • зачастую АГ сопровождается менопаузальным метаболическим синдромом; • к характеристикам АГ в постменопаузе также относят быстрое развитие поражения органов-мишеней и большую частоту осложнений. Возраст женщины увеличивается, а следовательно, возрастает дефицит эстрогенов. В основе патогенеза АГ, возникающей в перименопаузе лежит гипоэстрогения, которая приводит к развитию менопаузального метаболического синдрома [11]. В многочисленных исследованиях продемонстрирована целая серия положительных эффектов эстрогенов на сердечно-сосудистую систему. Наиболее доказано их благоприятное влияние на вазоактивные нейрогуморальные факторы (снижение активности симпатической нервной системы и чувствительности b-адренорецепторов, стимуляция выработки эндотелием оксида азота и простациклина, уменьшение образования ангиотензина II и экспрессии рецепторов 1 типа к нему, снижение уровня эндотелина-1 и активности ангиотензинпревращающего фермента). Эстрогены также положительно воздействуют на показатели гемостаза (снижение агрегационной ак- ТЕРАПИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ тивности тромбоцитов, уменьшение уровней ингибитора активатора плазминогена-1, фактора Виллебранда, плазминогена, антитромбина III и фибриногена). Кроме того, доказана эффективность их влияния на показатели липидного обмена – выраженное антиатерогенное действие (снижение уровней атерогенных липопротеидов и повышение антиатерогенных); на диурез (увеличение натрийуреза). Интересны результаты исследований, свидетельствующие о прямом вазодилатационном действии эстрогенов на артериальные сосуды, в том числе, на коронарные артерии. При этом имеются данные о том, что механизмы вазодилатационного действия эстрогенов различаются в зависимости от дозы: прямое действие через гладкомышечные клетки сосудов обнаруживается при применении высоких доз, а при низких дозах вазодилатация опосредуется, прежде всего, за счет изменения активности эндотелиальных факторов – повышения образования оксида азота, простациклина, снижения синтеза эндотелина-1 и тромбоксана В-2. В последние годы накоплены данные о положительном влиянии эстрогенов на компоненты сосудистой стенки: торможение процессов фиброзирования сосудистой стенки (снижение синтеза коллагена и эластина в гладкомышечных клетках), уменьшение миграции и пролиферации гладкомышечных клеток и экспрессии адгезивных молекул, способствующих прикреплению моноцитов к клеткам эндотелия, и уровня хемокинов, участвующих в миграции моноцитов в субэндотелиальный слой, снижение факторов воспаления (С-реактивный протеин, фактор некроза опухоли-a), торможение апоптоза эндотелиальных клеток. Еще одним важным аспектом действия эстрогенов является их влияние на показатели углеводного обмена – на улучшение чувствительности тканей к инсулину и снижение продукции самого инсулина. Данные сдвиги происходят параллельно с улучшением параметров липидного спектра крови и снижением уровня гомоцистеина. Вместе с тем, для эстрогенов описан ряд эффектов, которые направлены на задержку натрия и Трудный пациент № 12, ТОМ 10, 2012 Информация о препарате 12 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА Фармакодинамика. Олмесартана медоксомил – сильнодействующий, селективный антагонист рецепторов ангиотензина II (тип АТ1), который тормозит эффекты ангиотензина II, опосредствованные рецепторами АТ1, независимо от источника и пути синтеза ангиотензина II. Селективный антагонизм рецепторов АТ1 ангиотензина II приводит к повышению концентрации ренина, ангиотензина I и II в плазме крови, а также к некоторому снижению концентрации альдостерона. При АГ олмесартана медоксомил вызывает дозозависимое, продолжительное снижение АД. Нет данных относительно развития артериальной гипотензии после приема первой дозы препарата, тахифилаксии при продолжительном лечении и синдрома отмены. Дозирование олмесартана медоксомила 1 раз в сутки обеспечивает эффективное и мягкое снижения АД на протяжении 24 ч. Максимальный антигипертензивный эффект достигается через 8 нед от начала терапии, хотя значительный эффект снижения АД отмечают через 2 нед лечения. Фармакокинетика. Олмесартана медоксомил является пролекарством. Он быстро превращается в фармакологически активный метаболит олмесартан под действием эстераз в слизистой оболочке кишечника и в крови портальной вены во время абсорбции в пищеварительном тракте. В плазме крови или в выделениях нераспавшийся олмесартана медоксо- жидкости в организме (рост уровня ангиотензиногена в печени с повышением образования количества ангиотензина I и II и индукции синтеза альдостерона) и могут приводить не только к задержке жидкости и отекам, но и к появлению избыточной массы тела и ожирения (прежде всего по гиноидному типу) у женщин в доменопаузальном периоде. Однако в физиологических условиях у здоровых женщин в детородном периоде указанным эффектам противодействует антиминералокортикоидная активность прогестерона. Кроме того, описанное выше положительное влияние эстрогенов на сосудистые и метаболические параметры даже в случае ожирения тормозит развитие АГ, атеросклероза и нарушений углеводного обмена. С учетом вышеизложенного, основным патогенетическим механизмом АГ у женщин в постменопаузе являются возникающий в этот период дефицит эстрогенов (прежде всего снижение концентрации 17-В-эстрадиола) и связанное с этим исчезновение защитного действия данных гормонов на сердечно-сосудистую систему [7, 8] К прямым последствиям дефицита эстрогенов, которые имеют первостепенное значение для развития АГ, относятся: снижение выработки мощных вазодилатационных и антиагрегантных факторов (оксида азота и простациклина), активация местной (тканевой) ренин-ангиотензиновой и симпатической нервной системы, задержка хлорида натрия, формирование инсулинорезистентности и обусловленной ею гиперинсулинемии. Гиперинсулинемия способствует развитию АГ, вызывая увеличение реабсорбции натрия в почках, задержку внутриклеточной жидкости, повышение концентрации натрия и кальция в гладкомышечных клетках артериол, их чувствительности к прессорным субстанциям, активацию пролиферации гладкомышечных клеток сердца и сосудов с формированием их патологических изменений или ремоделирования. Значимыми факторами прогрессирования АГ являются: повышение агрегации тромбоцитов, активизация факторов свертывающей системы крови, повышение в крови уровня гомоцистеина в условиях дефицита эстрогенов [9]. Появляющиеся в по- Кардосал® (Берлин-Хеми/А.Менарини, Германия) Олмесартана медоксомил Таблетки п.о., 10 мг, 20 мг, 40 мг мил или неизмененную боковую цепь медоксомильной группы не определяли. Среднее значение абсолютной биодоступности олмесартана при применении в таблетированной лекарственной форме составляет 25,6%. Cmax олмесартана в плазме крови в среднем достигается приблизительно через 2 ч после приема препарата внутрь и возрастает почти линейно с повышением принимаемой однократно пероральной дозы до 80 мг. Одновременный прием пищи практически не влияет на биодоступность олмесартана. Связывание олмесартана с белками плазмы крови составляет 99,7%, однако потенциал для клинически значимого сдвига величины связывания с белками при взаимодействии олмесартана с другими лекарственными средствами, имеющими высокую степень связывания с белками, низкий (это подтверждается отсутствием клинически значимого взаимодействия между олмесартаном и варфарином). Олмесартан выводится с мочой (приблизительно 40%) и желчью (приблизительно 60%), его Т½ составляет 10–15 ч. Кумуляции олмесартана не отмечали. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ Эссенциальная АГ. Разделы: Противопоказания, Способ применения и дозы, Побочное действие, Особые указания, Взаимодействие с другими лекарственными средствами – см. в инструкции по применению препарата. Приводим клиническое наблюдение. Пациентка 67 лет поступила в отделение кардиологии УКБ №2 Первого МГМУ им. И.М.Сеченова с жалобами на повышение АД до 170 и 80 мм рт. ст., головную боль, слабость. Из анамнеза жизни известно, что в течение последних 10 лет отмечает повышение АД, принимала блокаторы кальциевых каналов (БКК) с положительным эффектом. Однако в течение последнего времени антигипертензивная терапия стала неэффективной. Пациентка пыталась принимать ингибиторы ангитензинпревращающего фермента (иАПФ), на которые отмечала появление кашля; затем антагонисты рецепторов к ангиотензину – АРА (лозартан). Однако отчетливого эффекта от проводимой терапии не наблюдалось. Для коррекции терапии поступила в клинику. При осмотре: повышенного питания, пастозность голеней. Над легкими дыхание везикулярное, хрипы не выслушиваются. Тоны сердца ритмичны, 1 тон ослаблен, акцент 2 тона над аортой, систолический шум во втором межреберье справа от грудины. АД – 180 и 80 мм рт. ст., ЧСС – 72 уд/мин. Печень у края реберной дуги. Почки не пальпируются. Симптом Пастернацкого отрицательный с обеих сторон. Данные анмнеза, объективного обследования свидетельствовали в пользу наличия у больной изолированной систолической гипертензии, которая является частым спутником пожилого гипертоника. Согласно рекомендациям по лечению ИСАГ, препаратами выбора служат диуретики, БКК, агенты, блокирующие ренин-ангиотензиновую систему (РААС) – иАПФ или АРА. На основании данных объективного обследования и анамнеза был поставлен диагноз артериальной гипертензии 3-й степени, II ст. очень высокого риска, атеросклероза коронарных и мозговых артерий. Пациентка относилась к группе высокого сердечно-сосудистого риска, что требовало назначения комбинированной антигипертензивной терапии. Для рационального выбора необходимо было иметь информацию о состоянии почек, гликемического профиля, липидного спектра пациентки, а также поражения органов-мишеней. Согласно оценке скорости клубочковой фильтрации, у больной имелась 3-я степень хронической болезни почек, липидный спектр характеризовался повышением уровня общего холестерина до 6,5 ммоль/л и липопротеидов низкой плотности (ЛПНП) до 4 ммоль/л. Учитывая вышеописанный клинический профиль пациентки, в качестве антигипертензивной комбинации были назначены БКК и АРА. Поскольку в анамнезе имелись указания на недостаточную эффективность лозартана, встал вопрос о выборе другого препарата из этой группы. Доказательная база Литература 1. Артериальная гипертония у женщин в постменопаузе. Круглый стол. Кардиология. 2003; 4: 88–95. 2. В.И. Подзолков , Можарова Л.Г, Хомицкая Ю.В. Артериальная гипертензия у женщин с климактерическим синдромом. www.cardiosite.ru/articles/article.asp?id=4375 3. Первый Доклад экспертов научного общества по изучению Артериальной Гипертонии, Всероссийского научного общества кардиологов и Межведомственного совета по сердечно-сосудистым заболеваниям. Профилактика, диагностика и лечение первичной артериальной гипертонии в Российской Федерации. Клиническая фармакология и терапия. 2000; 9: 3: 5–30. 4. Nanchahal К., Ashton W.D., Wood D.A. Association between blood pressure, the treatment of hypertension, and cardiovascular risc factots in women. J Hypertens. 2000; 18: 833–841. 5.Остроумова О.Д. Изолированная систолическая артериальная гипертензия. www.consilium-medicum.com 6. Сметник В.П. Защитное влияние эстрогенов на сердечно-сосудистую систему. Сonsilium medicum. Экстравыпуск. 2002; 3–6. 7. Савельева Г.М., Бреусенко В.Г., Крюченкова М.Е., Грацианский Н.А., Аверков О.В. Заместительная гормонотерапия при ишемической болезни сердца. Практическая гинекология. 1999; 1: 12–20. 8. Samaan S.A., Crawford M.H. Estrogen and cardiovascular function after menopause. JACC 1995; 26 (1465): 1403–10. 9. Кудряшова О.Ю., Затейщиков Д.А., Сидоренко Б.А. Возможная роль эстрогенов в профилактике и лечении атеросклероза у женщин после наступления менопаузы. Кардиология. 1998; 4: 51–58. 10. Бритов А.Н., Быстрова М.М. Заместительная гормональная терапия в профилактике сердечно-сосудистых заболеваний у женщин с артериальной гипертонией и ишемической болезнью сердца. Сonsilium medicum. Экстравыпуск. 2002; 7–10. 11. Руководство по климактерию. Под ред. В.П. Сметник, В.И. Кулакова. М: Медицинское информационное агентство. 2001; 685. 12. Прохорович Е.А., Ткачева О.Н., Адаменко А.Н. Особенности клинического течения и лечения артериальной гипертонии у женщин. Трудный пациент. 2006; 8: 13–17. www.t-pacient.ru/archive/n82006/n8-2006_156.html КАРДИОЛОГИЯ по АРА на сегодняшний день обширна. Одно из интересных исследований, ESPORT, которое проводилось в 102 центрах Италии, ставило задачу оценить эффективность рамиприла и олмесартана у пациентов в возрасте 65–89 лет с ИСАГ. Продолжительность исследования составила 12 нед. Снижение АД было достигнуто в обеих группах, однако в группе олмесартана доля пациентов, ответивших на лечение, составила 59% против 53% в группе рамиприла, а терапевтический эффект в группе АРА развился через 2 нед. Напомним, что наша пациентка имела изолированную систолическую гипертензию в пожилом возрасте, что дало нам основания для предположения эффективности олмесартана у конкретной больной. Кроме того, наличие микроальбуминурии заставило вспомнить результаты исследования ROADMAP, которое доказало, что применение олмесартана задерживает время возникновения МАУ на 23%. Таким образом, была подобрана комбинированная терапия: БКК пролонгированного действия и олмесартан 20 мг (препарат Кардосал® 20) 1 раз в сутки. Кроме того, пациентке были назначены статины под контролем АЛТ, АСТ, гамма ГТ до нормализации уровня ЛПНП. Данное клиническое наблюдение демонстрирует, что ИСАГ остается уделом пожилых полиморбидных гипертоников, требует пристального внимания в связи с большой вероятностью осложнений и диктует необходимость комбинированной антигипертензивной терапии. Трудный пациент № 12, ТОМ 10, 2012 стменопаузе нарушения в системе гемостаза существенно повышают риск развития тромбозов [10]. Достаточно часто описанные выше метаболические сдвиги ассоциируются с нарушением пуринового обмена и возникновением гиперурикемии, что может быть также дополнительным фактором в патогенезе АГ у пожилых женщин. В механизмы повышения АД у женщин климактерического, в том числе, постменопаузального периода вовлечены и такие факторы, как нарушение социально-психологической адаптации с развитием депрессии, появлением или усугублением привычки к курению, повышением потребления алкоголя [11, 10]. 13 СЛОЖНОСТИ ДИАГНОСТИКИ Особенности течения ишемической болезни сердца у женщин. Клинические наблюдения Е.Е.Матвиенко, И.В.Родионова, Т.А.Кузнецова БУЗ ВО «Воронежская областная клиническая больница №2» В статье демонстрируются случаи сложности диагностики стенокардии у женщин в перименопаузе из-за неоднозначности клинической картины, результатов дополнительных методов исследования, в том числе коронароангиографии. Ключевые слова: стенокардия, перименопауза, диагностика. нередко происходит недооценка врачами состояния пациентки в связи с психоневрологическими особенностями или перименопаузальным периодом. Точность неинвазивных тестов у женщин ниже, чем у мужчин. Чувствительность нагрузочной ЭКГ у женщин более низкая, высока встречаемость ложноположительных депрессий сегмента ST при проведении теста с физической нагрузкой, особенно у пациенток с нетипичным болевым синдромом. Возможно, это связано с особенностями функционирования вегетативной нервной системы и желез внутренней секреции, меньшим диаметром коронарных артерий и склонностью к вазоспазму, детренированностью женщин [4, 5]. В женской популяции часто встречается синдром Х, связанный с микрососудистой эндотелиальной дисфункцией [3]. На практике женщины значительно реже, чем мужчины подвергаются коронароангиографии (КАГ), а в случае хирургических вмешательств имеют высокую степень технических трудностей, большую частоту осложнений и летальности, что часто служит поводом для отказа от реваскуляризации [3]. На сегодняшний день накоплено достаточно данных, позволяющих считать, что диагностика ИБС у женщин традиционными методами является более сложной, чем у мужчин. Представляем несколько клинических случаев из собственной практики. Клинические наблюдения Features of IHD in women. Case reports E.E.Matvienko, I.V.Rodionova, T.A.Kuznetsova Voronezh Regional Hospital №2 The article describes difficulties in diagnostics of angina in perimenopausal women due to controversial symptoms and data of additional examination including coronary angiography. Keywords: angina, perimenopause, diagnostics. Трудный пациент № 12, ТОМ 10, 2012 Введение 14 Частота сердечно-сосудистой патологии у женщин увеличивается в перименопаузе [1]. Первые проявления ишемической болезни сердца (ИБС) у женщин отмечаются в основном на 10–20 лет позже, чем у мужчин, однако темпы роста заболевания более высокие, что подтверждает необходимость особого внимания к женской популяции [2]. В ряде исследований установлены гендерные различия в течении ИБС. Известно, что у женщин чаще встречается нетипичная клиника стенокардии, в том числе в виде слабости, дискомфорта, одышки, тошноты или рвоты, боли в груди в покое, во сне или во время психологического стресса, которые зачастую не расцениваются как кардиогенные даже в случае острого инфаркта миокарда [3]. Из-за нетипичности симптомов и лучшей переносимости физического дискомфорта женщины более склонны длительное время не обращаться к врачу. В случае обращения Пациентка К., 47 лет, обратилась к кардиологу в сентябре 2010 г. с жалобами на приступы учащенного сердцебиения, сопровождающиеся общей слабостью, потемнением в глазах; боли в области сердца давящего характера, возникающие преимущественно при ускоренной ходьбе и купируемые самостоятельно, головные боли, головокружение. В анамнезе: с 2005 г. отмечалось повышение АД до 150/90 мм рт. ст., гипотензивные препараты не принимала; страдает остеохондрозом шейного отдела позвоночника. Менструальный цикл сохранен. При осмотре: рост 165 см, масса тела 62 кг, индекс массы тела (ИМТ) 23 кг/м2; АД – 120/70 мм рт. ст., ЧСС – 88 уд/мин. Тоны сердца ритмичные, слегка приглушены. В легких везикулярное дыхание, хрипов нет. На ЭКГ – синусовая тахикардия (90 уд/мин), умеренные изменения миокарда задней стенки и боковых отделов левого желудочка. В биохимическом анализе крови: общий холестерин (ХС) – 4,87 ммоль/л, триглицериды (ТГ) – 0,74 ммоль/л, глюкоза – 3,7 ммоль/л. При эхокардиографии (ЭхоКГ) выявлено наличие незначительного пролабирования передней створки митрального клапана, аномально расположенной хорды левого желудочка; фракция выброса левого желудочка (ФВ) – 64%, гипертрофии миокарда нет. При суточном мониторировании ЭКГ: выраженная тахикардия в течение всего наблюдения (средняя ЧСС днем – 108 уд/мин, ночью – 90 уд/мин), редкая одиночная желудочковая экстрасистолия (менее 2/ч); эпизоды выраженной депрессии сегмента ST во время двух из трех физических нагрузок, субъективно сопровождающиеся чувством нехватки воздуха и слабостью (общее время эпизодов – 6 мин). Данные велоэргометрии (ВЭМ): реакция на нагрузку неадекватная – избыточная пульсовая (до Сведения об авторах: Матвиенко Екатерина Евгеньевна – к.м.н., врач-кардиолог поликлиники №1 БУЗ ВО «Воронежская областная клиническая больница № 2» (БУЗ ВО ВОКБ № 2) Родионова Ирина Викторовна – зав. терапевтическим отделением БУЗ ВО ВОКБ № 2 Кузнецова Татьяна Андреевна – зам. главного врача по лечебной работе БУЗ ВО ВОКБ № 2, врач-кардиоло КАРДИОЛОГИЯ фрагмальные и боковые отделы левого желудочка. В апреле 2011 г. в условиях ВОКБ №1 проведена КАГ: стенозов коронарных артерий нет, выявлено наличие мышечных мостиков в средних сегментах передней нисходящей и огибающей артерий. Выписана с диагнозом: «ИБС, вазоспастическая стенокардия»; в терапии рекомендован дилтиазем 90 мг/сут. Осмотрена кардиологом в августе 2012 г. Сохраняются жалобы на приступы учащенного сердцебиения, перебои в работе сердца, боли в области сердца и нехватку воздуха без четкой связи с нагрузкой. АД преимущественно нормальное, редко – повышение до 140/90 мм рт ст. В крови: ХС – 5,79 ммоль/л, ЛПВП – 1,7 ммоль/л, ЛПНП – 3,28 ммоль/л, ТГ – 2,2 ммоль/л. При суточном мониторировании ЭКГ: ишемических изменений не выявлено, редкая одиночная наджелудочковая экстрасистолия. Рекомендован прием дилтиазема, дезагрегантов, цитопротекторов, статинов, анксиолитики. Пациентка О., 60 лет, постменопауза 9 лет. Данные профилактического осмотра за 2008–2010 гг.: АД – в норме, ЭКГ – без особенностей. Обратилась к терапевту в апреле 2011 г. с жалобами на общую слабость, боли в области сердца давящего характера, возникающие как при физической нагрузке, так и в покое, нехватку воздуха; ухудшение самочувствия в течение месяца. Объективно: рост – 162 см, масса тела – 85 кг, ИМТ – 32 кг/м2; АД – 110/70 мм рт. ст., ЧСС – 62 уд/мин, ХС – 5,7 ммоль/л, ЛПВП – 1,56 ммоль/л, ЛПНП – 3,4 ммоль/л. На ЭКГ от 25.04.2011 впервые выявлена полная блокада левой ножки пучка Гиса (ПБЛНПГ). Данные ЭхоКГ: зон гипокинезии, гипертрофии миокарда и снижения сократимости нет. Тропониновый тест – отрицательный. Госпитализирована в ВОКБ №1 для проведения КАГ. Заключение КАГ: передняя нисходящая артерия – без стенозов, извита, с мышечным мостиком; огибающая артерия – без стенозов, извита, правая коронарная артерия – без стенозов. Диагноз при выписке: «ИБС, вазоспастическая стенокардия, ПБЛНПГ». В августе 2012 г. пациентка обратилась к терапевту с жалобами на ухудшение состояния в течение месяца: резкую слабость, потливость, головокружение, чувства тяжести в области сердца и нехватки воздуха. При осмотре: АД – 110/70 мм рт. ст., ЧСС – 42 уд/мин. На ЭКГ от 16.08.12 выявлено наличие полной поперечной АВ-блокады с частотой сокращения желудочков 42 уд/мин. Была госпитализирована по скорой помощи в кардиохирургическое отделение ВОКБ №1, где имплантирован ЭКС в режиме DDDR. В послеоперационном периоде сохранялись жалобы на боли в области сердца, не связанные с физическими нагрузками, чувство нехватки воздуха. Рекомендован прием дезагрегантов, триметазидина, препаратов калия и магния, анксиолитика. Пациентка М., 62 лет, постменопауза 10 лет. Из анамнеза: повышение АД в течение 4 лет до 160/90 мм рт. ст.; антигипертензивные препараты регулярно не принимала. Сопутствующие заболевания: хронический гастродуоденит, аутоиммунный тиреоидит, эутиреоз, остеохондроз шейного отдела позвоночника, хроническая дисомния. Из результатов профилактического осмотра за 2011 г.: ХС – 6,18 ммоль/л, ЛПВП – 2,33 ммоль/л, ЛПНП – 3,65 ммоль/л, глюкоза – 5,36 ммоль/л. ЭКГ за 2011 г., февраль – апрель 2012 г. – без патологии. В июле 2012 г. обратилась к терапевту с жалобами на нарушение сна, боли в правом локтевом суставе. На ЭКГ выявлены очаговые изменения переднеперегородочно-верхушечной области и боковой стенки левого желудочка (рисунок). Трудный пациент № 12, ТОМ 10, 2012 153 уд/мин на пятой минуте нагрузки), проба отрицательная, толерантность к физической нагрузке низкая. ЧПЭС по ишемической программе: стресстест положительный, при стимуляции зарегистрирована горизонтальная депрессия сегмента ST до 2,8 мм, максимально выраженная в отведении V5. По результатам амбулаторного обследования был выставлен диагноз: «ИБС, стабильная стенокардия напряжения, ФК 2»; рекомендовано проведение коронарная ангиография (КАГ), от которой пациентка отказалась. Назначены b-блокаторы, а в дальнейшем, в связи с сохранением учащенного сердцебиения, в том числе пароксизмального характера, соталол 40 мг 2 раза в день и кораксан 5 мг 2 раза в день. Пациентка вновь обратилась к кардиологу в апреле 2011 г. с жалобами на боли в сердце, возникающие преимущественно при нагрузке, нехватку воздуха, учащенное сердцебиение. При осмотре: АД – 120/75 мм рт. ст., ЧСС – 74 уд/мин. При суточном мониторировании ЭКГ (на фоне приема соталола и кораксана): ЧСС средняя днем – 71 уд/мин, ночью – 60 уд/мин, одиночная наджелудочковая экстрасистолия, ишемических изменений не выявлено. ХС – 6,78 ммоль/л, ЛПВП – 1,32 ммоль/л, ЛПНП – 4,72 ммоль/л. 28.04.2011 г., в условиях Воронежской областной клинической больницы № 1 (ВОКБ № 1), проведена КАГ, не выявившая наличие стенозов коронарных артерий. При выписке из стационара поставлен диагноз: «ИБС, вазоспастическая стенокардия», рекомендован прием дезагрегантов, антагонистов кальциевых каналов, статинов. Пациентка Д., 46 лет, обратилась к кардиологу в 2009 г. с жалобами на перебои в работе сердца, учащенное сердцебиение, чувство тяжести в области сердца, нехватку воздуха без связи с физической нагрузкой, быструю утомляемость. АГ ранее не диагностирована. Сопутствующие заболевания: язвенная болезнь двенадцатиперстной кишки, хронический гастрит, хронический пиелонефрит. На момент первого обращения (2009 г.) менструальный цикл не нарушен. При осмотре: рост – 160 см, масса тела – 53 кг, ИМТ – 21 кг/м2; АД – 120/80 мм рт. ст., ЧСС – 74 уд/мин. Тоны сердца ритмичные, приглушенные; в легких везикулярное дыхание, хрипов нет. На ЭКГ – умеренные изменения миокарда задней стенки. ХС крови – 6,3 ммоль/л. Данные ЭхоКГ: незначительное пролабирование передней створки митрального клапана, митральная регургитация 1-й степени, в остальном без особенностей. При суточном мониторировании ЭКГ: ЧСС в пределах нормы, желудочковая экстрасистолия 3 градации (менее 1/ч), эпизод депрессии сегмента ST во время физической нагрузки (подъем на 6 этаж) при ЧСС 149 уд/мин. ВЭМ: проба отрицательная, но с особенностями – в ходе нагрузки отмечалось смещение ST во всех отведениях на 1 мм, расцененное как изменение реполяризации адаптационно-метаболического генеза. Амбулаторно поставлен диагноз: «ИБС, стабильная стенокардия напряжения, ФК 2»; в лечении рекомендованы малые дозы b-блокаторов, дезагреганты, кардиоцитопротекторы. В 2011 г. пациентка повторно обратилась к кардиологу с жалобами на сердцебиение, усилившиеся боли в области сердца без четкой связи с физической нагрузкой, одышку. С 2010 г. – нарушение менструального цикла. При осмотре: АД – 120/80 мм рт ст, ЧСС – 88 уд/мин. ХС – 5,07 ммоль/л, ЛПВП – 1,28 ммоль/л, ЛПНП – 3,11 ммоль/л. При суточном мониторировании ЭКГ (март 2011 г.): во время одной физической нагрузки выявлена депрессия ST по типу безболевой ишемии миокарда в отведениях, характеризующих переднюю стенку, нижне-диа- 15 Трудный пациент № 12, ТОМ 10, 2012 СЛОЖНОСТИ ДИАГНОСТИКИ ЭКГ пациентки М. от 17.07.12 16 Была госпитализирована в больницу скорой помощи с предварительным диагнозом: «ИБС, острый интрамуральный инфаркт миокарда переднеперегородочно-верхушечной области с распространением на боковые отделы левого желудочка». За время пребывания в палате интенсивной терапии болей в сердце не отмечала, гемодинамика устойчивая, тропониновый тест отрицательный. Данные ЭхоКГ: общая и регионарная сократимость не нарушена, ФВ – 60%, гипертрофия миокарда левого желудочка концентрического типа 1,2 см. Суточное мониторирование ЭКГ: синусовая брадикардия – до 46–50 уд/мин, редкая желудочковая и наджелудочковая экстрасистолия, эпизод наджелудочкового ускоренного ритма с абберацией желудочковых комплексов; на фоне исходных изменений ЭКГ диагностически значимого смещения сегмента ST не выявлено. Была переведена в ВОКБ №1 для проведения КАГ. Заключение КАГ: гемодинамически значимого поражения коронарного русла не выявлено; в передней нисходящей артерии стеноз проксимального отдела 30%, огибающая и правая коронарные артерии – без стенозов. Выписана с диагнозом: «ИБС, вазоспастическая стенокардия». Осмотрена кардиологом через 2 нед: болей в сердце или их эквивалентов не отмечает; физически активна, работает на даче, занимается йогой. АД – 130/70 мм рт. ст., ЧСС – 68 уд/мин. ХС – 4,03 ммоль/л, ЛПВП – 1,34 ммоль/л, ЛПНП – 2,41 ммоль/л. На ЭКГ – без динамики, сохраняются выраженные изменения переднесептальной области, верхушки и боковой стенки. Рекомендовано динамическое наблюдение терапевта, кардиолога, прием ингибитора АПФ, дезагреганта, цитопротектора, статина. Заключение Представленные клинические наблюдения подтверждают, что течение ИБС у женщин имеет особенности, которые должны учитываться практическим врачом в постановке диагноза, профилактике и лечении заболевания. Отсутствие в большинстве случаев типичной клинической картины стенокардии, неоднозначные результаты нагрузочных тестов затрудняют диагностику и определение тактики ведения пациенток. Во всех приведенных случаях отсутствовали гемодинамически значимые стенозы коронарного русла, у двух пациенток были выявлены мышечные мостики, у одной – патологическая извитость коронарных артерий. Представляется также дискутабельным вопрос о возможности постановки диагноза «ИБС, вазоспастическая стенокардия» как шаблона при отрицательном результате КАГ, в том числе при отсутствии преходящей элевации сегмента ST на ЭКГ как традиционного критерия диагностики вазоспазма. Очевидно, что именно у женщин в перименопаузе и ранней постменопаузе необходимо более широкое использование современных неинвазивных методов диагностики скрытой коронарной недостаточности, в частности стресс-ЭхоКГ. В связи с вышеизложенным чрезвычайно актуальным представляется проведение дальнейших специальных исследований, направленных на изучение патогенетических и клинических особенностей ИБС у женщин, разработку наиболее адекватных профилактических и лечебных мероприятий. Литература 1. Терещенко С.Н., Ускач Т.М., Косицина И.В. и др. Особенности сердечно-сосудистых заболеваний и их лечение у женщин. Кардиология. 2006; 1: 98–102. 2. Методология комплексной оценки факторов риска ИБС у женщин. Сердце. 2006; 5 (7): 336–339. 3. Архипова Л.В., Гуревич М.А. Особенности ишемической болезни сердца в женской популяции. Актуальные вопросы болезни сердца и сосудов. 2011; 1: 55–57. 4. Диагностика и лечение стабильной стенокардии. Российские рекомендации (второй пересмотр). Кардиоваскулярная терапия и профилактика. (Прил. 4). 2008; 6. 5. Беленков Ю.Н., Терновой С.К. Функциональная диагностика сердечно-сосудистых заболеваний. М.: ГЭОТАР-Медиа. 2007. Календарный план мероприятий непрерывного повышения квалификации медицинских работников на 2013 год Главное медицинское управление Управления делами Президента Российской Федерации I полугодие 2013 Ежегодная конференция «Фармакотерапия болезней уха, горла, носа с позиций доказательной медицины» 14 марта Руководители: Профессор А.С.Лопатин, заведующий кафедрой болезней уха, горла и носа ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М.Сеченова» МЗ РФ; профессор В.С.Козлов, заведующий кафедрой оториноларингологии ФГБУ «Учебно-научный медицинский центр» УД Президента РФ Место проведения: Центральный дом ученых, Москва, Пречистенка д.16. Российский мастер-класс с международным участием «Современная функциональная ринохирургия» 15–18 апреля Руководитель: Профессор А.С.Лопатин, заведующий кафедрой болезней уха, горла и носа ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М.Сеченова» МЗ РФ Место проведения: Первый МГМУ им. И.М.Сеченова, Первая университетская больница №1, Москва, ул. Большая Пироговская, д.6/1 Российская научно-практическая конференция с международным участием «Клиническая дерматология как междисциплинарная проблема» 23–24 апреля Научно-консультативный комитет: Е.Л.Ноников, В.Ф.Казаков, Е.В.Липова, С.И.Роговская, А.М.Соловьева, А.И.Неробеев Место проведения: Центральный дом ученых, Москва, Пречистенка д.16. Ежегодная конференция «Фармакотерапия аллергических заболеваний с позиций доказательной медицины» 24 апреля Руководитель: Профессор Л.А.Горячкина, главный аллерголог Главного медицинского управления УД Президента РФ, заведующая кафедрой клинической аллергологии ГБОУ ДПО «Российская медицинская академия последипломного образования» МЗ РФ Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 Офтальмология 5 июня Руководитель: Чл.-корр. РАМН С.Э.Аветисов, главный специалист по офтальмологии Главного медицинского управления УД Президента РФ, директор ГУ «Научно-исследовательский институт глазных болезней» РАМН Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 X Конгресс Российского общества ринологов, приуроченный к 20-летию образования общества 27–29 июня Руководитель: Профессор А.С.Лопатин, заведующий кафедрой болезней уха, горла и носа ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М.Сеченова» МЗ РФ Место проведения: Комплекс «Измайлово», корпус Альфа, Москва, Измайловское ш.71, корп.1A II полугодие 2013 Ежегодная конференция «Фармакотерапия заболеваний органов пищеварения с позиций доказательной медицины» 11 сентября Руководитель: Профессор О.Н.Минушкин, главный гастроэнтеролог Главного медицинского управления УД Президента РФ, заведующий кафедрой гастроэнтерологии ФГБУ «Учебно-научный медицинский центр» УД Президента РФ Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 Ежегодная конференция «Актуальные проблемы репродуктивного здоровья женщин» 9 октября Руководитель: Профессор В.Н.Прилепская, заместитель директора по научной работе, руководитель научно-поликлинического отделения ФГБУ «Научный центр акушерства, гинекологии и перинатологии им.акад.В.И.Кулакова» МЗ РФ Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 Ежегодная конференция «Сахарный диабет II типа и метаболический синдром» 7 ноября Руководитель: Профессор А.М.Мкртумян, заведующий кафедрой эндокринологии и диабетологии ЛФ ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И.Евдокимова» МЗ РФ Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 Ежегодная конференция «Профилактика и лечение гриппа и других острых респираторных вирусных инфекций» 26 ноября Руководитель: академик РАМН В.И.Покровский, главный инфекционист Главного медицинского управления УД Президента РФ, директор ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора, профессор А.В.Девяткин, главный врач инфекционного корпуса ФГБУ «Центральная клиническая больница с поликлиникой» УД Президента Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 Ежегодная конференция «Диагностика и лечение заболеваний сердечно-сосудистой системы. Проблемы и решения» 17 декабря Руководители: Профессор Б.А.Сидоренко, заместитель главного кардиолога Главного медицинского управления УД Президента РФ, заведующий кафедрой кардиологии и общей терапии ФГБУ «Учебно-научный медицинский центр» УД Президента РФ; профессор С.Н.Терещенко, руководитель отдела заболеваний миокарда и сердечной недостаточности Института клинической кардиологии им. А.Л.Мясникова ФГБУ «Российский кардиологический научно-производственный комплекс» МЗ РФ Место проведения: Здание Правительства Москвы, ул.Новый Арбат, д.36/9 ЦЕРЕБРОВАСКУЛЯРНЫЕ ЗАБОЛЕВАНИЯ «Асимптомные» стенозы магистральных артерий головы и их влияние на биоэлектрическую активность головного мозга С.А.Гуляев1, А.В.Овчинников2, И.В.Архипенко3 1 Институт детской неврологии им. Святителя Луки 2 Владивостокский Государственный медицинский университет 3 Медицинский центр на Миля В статье приводятся результаты обследования 45 больных в возрасте от 60 лет и старше, страдающих атеросклеротическим поражением магистральных артерий головы умеренной степени (до 50%) с отсутствием в анамнезе указаний на эпизоды ТИА и ОНМК, а так же объективно выявляемой очаговой неврологической симптоматики. Ключевые слова: электроэнцефалограмма, атеросклероз, артерии головного мозга. «Asymptomatic» stenosis of major cerebral arteries and its impact on the brain bioelectric activity Трудный пациент № 12, ТОМ 10, 2012 S.A.Gulyaev1, A.V.Ovchinnikov2, I.V.Arkhipenko3 1 St. Luke Institute for Pediatric Neurology 2 Vladivostok State Medicine University 3 Medicine Center «Na Milya» 18 The article presents study results obtained from 45 patients aged 60 and older with major cerebral arteries atherosclerosis of mild grade (up to 50%), no history of transient ischemic attack or stroke, as well as without focal neurological symptoms. Keywords: EEG, atherosclerosis, cerebral arteries. Введение Исследование биоэлектрической активности головного мозга в клинической практике чрезвычайно важно для врача-невролога. Одним из наиболее информативных, безопасных и доступных методов, позволяющих исследовать изменение биоэлектрических характеристик мозговой ткани, является электроэнцефалография (ЭЭГ). Этот метод обладает выраженной чувствительностью и позволяет выявлять различные функциональные нарушения на самых ранних этапах развития патологии. У лиц старшего возраста одной из ведущих причин развития заболеваний центральной нервной системы являются различные цереброваскулярные заболевания, которые занимают третье место среди причин смерти после кардиальных и онкологических причин. В большинстве случаев в основе их этиопатогенеза лежит стенозирующий просвет сосуда атеросклеротический процесс, вызывающий локальное нарушение гемодинамики и формирование общей недостаточности кровоснабжения целевого сосудистого бассейна, что в конечном итоге приводит к развитию острого нарушения мозгового кровообращения – мозговому инсульту. [3]. При этом, летальность у таких пациентов, по данным современных авторов, более 37% от всех случаев смерти, связанных с сердечно-сосудистой патологией [2, 5]. Удельная частота инсультов в мире колеблется от 0,9 до 5 случаев на тысячу населения ежегодно и составляет не менее 10 млн инсультов [1]. Доля ишемических нарушений среди которых, составляет 80% [6]. Исходом более 60% ишемических инсультов является инвалидизация, причем доля нуждающихся в постоянной посторонней помощи составляет около 40% [4]. Одним из наиболее радикальных и бурно развивающихся методов предотвращения развития ишемического инсульта является хирургическое вмешательство, направленное на удаление, суживающих просвет сосуда, атеросклеротических бляшек. Однако, не смотря на доказанную эффективность хирургической профилактики, проблемы послеоперационных неврологических осложнений и возникновение повторных стенозов в зоне каротидной эндартерэктомии (КЭЭ) до конца не разрешены [4, 6]. Помимо этого, наряду с чисто хирургическими проблемами, особую важность приобретает необходимость раннего выявления каротидных стенозов и адекватного их устранения на ранних этапах развития патологии, в период сохраненной физиологической компенсации организма [1]. Широкое внедрение в 90-е годы ХХ века ультразвуковых диагностических методов с возможностью исследования гемодинамики, позволило выявлять стенотические поражения магистральных артерий головы (МАГ) на самых ранних этапах формирования атеросклеротической бляшки. Ультразвуковое сканирование позволяет дать количественную оценку выраженности стеноза МАГ, провести дифференциальную диагностику атеросклеротических стенозов артерий с их поражениями другого генеза, получить характеристику бляшки магистральной артерии (плотность, гетерогенность, наличие ульцерации и др.). Однако проведение скриннинговых ультразвуковых исследований выявило довольно большой процент так называемых малых и асимптомных АС бляшек, наличие которых никак не кор- Сведения об авторах: Гуляев Сергей Александрович – д.м.н., невролог, эпилептолог, специалист по функциональной диагностике, эпилептолог института Детской неврологии и эпилепсии им. святителя Луки Овчинников Алексей Васильевич – невролог, асисстент кафедры нервных болезней, нейрохирургии и медицинской генетики, Владивостокский государственный медицинский университет Архипенко Инга Викторовна – к.м.н. невролог, эпилептолог, специалист по функциональной диагностике, «Медицинский центр на Миля» Симптом абс. % Головная боль 35 78 Шум в голове 40 89 Общая слабость 28 62 Снижение работоспособности 29 64 Общая утомляемость 40 89 НЕВРОЛОГИЯ Таблица 1. Характеристика общемозговой неврологической симптоматики по результатам неврологического обследования Таблица 2. Субъективная характеристика пациентами нарушений когнитивных функций в сравнении с результатами теста MMSE Симптом Субъективное выявление в группах MMSE (среднее значение в группе) Снижение памяти 29 28 Снижение внимания 26 29 Трудность выполнения повседневной работы на производстве 15 27 Трудность выполнения повседневной работы в быту 12 28 Таблица 3. Анализ преимущественного поражения МАГ, по данным УЗ Дуплексного исследования Степень выраженности поражения МАГ Поражение МАГ малая (0–29%) умеренная (30–49%) выраженная (50–69%) Всего (человек) % Лево 25 7 0 32 71 Право 5 8 0 13 29 Двустороннее 0 0 0 0 0 Таблица 4 Распределение целевой группы в зависимости от степени выраженности стенотического поражения МАГ Степень выраженности поражения МАГ Число больных малая (0–29%) умеренная (30–49%) выраженная (50–69%) критическая (70–99%) окклюзия (100%) Абс. 30 15 0 0 0 % 67 33 0 0 0 Материал и методы Было обследовано 45 больных в возрасте от 60 лет и старше, страдающих атеросклеротическим поражением магистральных артерий головы умеренной степени (до 50%) с отсутствием в анамнезе указаний на эпизоды ТИА и ОНМК, а так же объективно выявляемой очаговой неврологической симптоматики. Степень стенотического поражения магистральных артерий головы выявлялась при помощи метода двумерного УЗ-сканирования с цветовым картированием потока крови (УЗ-дуплекс). Всем больным было проведено рутинное ЭЭГ-исследование с оценкой фоновой записи, проводимой в состоянии спокойного расслабленного бодрствования и оценкой изменений биоэлектрической активности головного мозга во время проведения функциональных нагрузочных проб (фотостимуляция и гипервентиляция). Критериями исключения являлись указания на длительно существующую, некомпенсируемую артериальную гипертензию, ранее перенесенный мозговой инсульт, опухоль головного мозга, эпилепсия, указание в анамнезе на наличие ревматоидного заболевания, злоупотребление алкоголем, прием психотропных и наркотических веществ, наличие производственных интоксикаций, нарушения сердечного ритма, а так же патология клапанов сердца. Результаты и их обсуждение Неврологическое обследование При проведении рутинного неврологического обследования спонтанные жалобы отсутствовали. Активно выявлялись общемозговые неврологические симптомы в виде указаний на периодически возникающие диффузные головные боли, общее снижение работоспособности, утомляемость, ухудшение памяти и внимания (табл. 1, 2). Вместе с тем, проведение объективного тестирования когнитивных Трудный пациент № 12, ТОМ 10, 2012 релировало с причинами обращения пациента за медицинской помощью [7]. В настоящее время под асимптомным понимается стеноз сонной артерии, в бассейне кровоснабжения которой отсутствовали преходящие или стойкие очаговые неврологические симптомы (при этом у пациента могут иметься те или иные неспецифические признаки дисциркуляторной энцефалопатии). По степени сужения артерий стенозы принято квалифицировать как: малый (0–29%), умеренный (30–49%), выраженный (50–69%), критический (70–99%), окклюзию (100%). Стенозы менее 50% не рассматриваются как предмет возможной хирургической коррекции и подлежат только наблюдению и симптоматическому консервативному лечению, поскольку считается, что такое сужение просвета сосуда не вызывает развития нарушений структуры внутрисосудистых потоков и не приводит к развитию объективной неврологической симптоматики. Однако у большинства подобных больных в клинической картине заболевания присутствуют различные субъективные жалобы и общемозговые неврологические симптомы, в частности, нарушения памяти и внимания [6]. Учитывая относительную бедность клинических и нейровизуализационных данных у таких пациентов, объективное исследование функционального состояния центральной нервной системы приобретает важное значение для ранней диагностики развития заболевания и выбора оптимальных сроков лечения. В нашем исследовании был проведении анализ изменений ЭЭГ характеристик у больных с асимптомными стенозами, верифицированными, по данным ультразвукового дуплексного исследования, для выявления их влияния на функциональную активность ЦНС. 19 КУПИРОВАНИЕ БОЛИ Изменения характеристик БЭАГМ при проведении функциональных нагрузочных проб у пациентов с стенотическим поражением МАГ (малой степени – А, умеренной степени – Б) А (ФС p>0,5, ГВ p<0,1) Б (ФС p>0,5, ГВ p<0,1) функций (тест MMSE) не выявил достоверного снижения. Фокальная неврологическая симптоматика отсутствовала. Общие обследования неврологических и когнитивных функций выявили преобладание субъективных жалоб, не подтвержденных результатами объективных исследований, что соответствовало критериям диагностики хронических цереброваскулярных заболеваний (дисциркуляторная энцефалопатия) I степени. Трудный пациент № 12, ТОМ 10, 2012 Характеристика УЗ дуплексного сканирования обследуемой группы 20 Всем пациентам было проведено транскраниальное дуплексное сканирование магистральных артерий головы с выявлением атеросклеротического поражения. Результаты дуплексного сканирования представлены в табл. 3. У большинства обследованных была выявлена малая степени стенотического поражения МАГ: не более 30% от общего диаметра сосуда. Пациенты с критической степенью стеноза или окклюзией МАГ в исследовании отсутствовали (табл. 4). В основном стенотические поражения МАГ регистрировались в левом каротидном бассейне (71%). Поражения правого каротидного бассейна выявлялись в меньшем количестве случаев (29%) и двусторонние поражения не выявлялись (0%). Исследование биоэлектрической активности головного мозга (ЭЭГ) Анализ электроэнцефалограмм показал, что достоверных изменений биоэлектрической активности между фоновой активностью, регистрируемой в покое, и активностью регистрируемой во время проведения функциональных нагрузочных проб с фотостимуляционной нагрузкой не было выявлено (статистически достоверными изменениями, p>0,05, были только проявления общей десинхронизации ритмов при ФС). В то же время при проведении функциональной пробы с гипервентиляцией были получены более выраженные изменения биоэлектрической активности (рисунок), характеризовавшиеся нарастанием выраженности фокальных паттернов замедления фонового ритма (p>0,01). Исследование биоэлектрической активности головного мозга у пациентов, имеющих асимптомные стенотические поражения магистральных артерий головы, обнаружили, что, несмотря, на относительную бедность клинической картины у таких пациентов, ЭЭГ-исследование обнаруживает преходящие изменения, характеризующиеся феноменом фокального периодического (продолженного) замедления, соответствующего по локализации с бассейном кровоснабжения пораженного сосуда. Данные изменения практически отсутствовали в состоянии покоя, но проявлялись во время выполнения пациентом функциональных нагрузочных проб, из которых наиболее значимой была проба с гипервентиляцией, приводящая к перманентной гипоксии корковых структур у таких пациентов, то есть свидетельствовали о скрытой недостаточности мозгового кровообращения, которая при своем дальнейшем существовании может приводить к развитию клинически значимой патологии. Полученные в ходе исследования у пациентов с асимптомными стенозами магистральных артерий головы данные свидетельствуют, что их т.н. асимптомность достаточно условна. Стенотические поражения малых, гемодинамически незначимых степеней, практически не влияющие на состояние мозгового кровотока в покое, тем не менее, могут вызывать нестойкие, преходящие изменения мозговой гемодинамики при выполнении различных нагрузок. Вероятно, подобные нарушения и приводят к развитию той субъективной неврологической симптоматики, которая и вынуждает таких пациентов обращаться к врачу, но бедность объективных данных зачастую оставляет таких пациентов без лечения до тех пор, пока у них не разовьется та или иная степень декомпенсации (в виде ТИА, инсульта и пр.). Но проведение лечебных мероприятий на этом этапе уже потребует больших сил и затрат, чем на этапах с сохраненными компенсаторными возможностями. Заключение Таким образом, необходимость раннего выявления каротидных стенозов и адекватного их устранения на ранних этапах развития патологии, в период сохраненной физиологической компенсации организма, поднимаемые в различных научных работах, приобретают новое значение. Они требуют нового рассмотрения вопросов компенсации кровообращения не только в состоянии покоя, но и при различных функциональных нагрузках, что необходимо тщательно учитывать при разработке стратегии лечения таких пациентов, особенно при выборе методов консервативного и оперативного лечения. Литература 1. Бокерия Л.О., Работников B.C., Алшибая М.М., Сигаев И.Ю., Мерзляков В.Ю. Дифференцированный подход к хирургическому лечению больных ИБС с поражением БЦА. Журн. неврологии и психиатрии им. С.С.Корсакова. Инсульт. 2003; 9: 198. 2. Козлов Б.Н., Щипакин О.В. Коррекция церебральной гемодинамики у больных атеросклерозом мозговых артерий. Медикобиологические аспекты нейро-гуморальной регуляции: Тр. конф., посвящ. 35-летию ЦНИЛ. Томск. 1997; 26–27. Случай шейно-черепного синдрома с вегетативными респираторными кризами в неврологической практике Article describes the case of neck pain complicated with cranial irradiation and developing of vegetative respiratory crises. Such pathological symptoms often follow by traumatic neck injury. Presented case report of complicated neck pain shows dexalgin benefits. Dexalgin® is supposed to relieve pain as well as other signs of cervicocranial syndrome. Keywords: neck pain, headache, Dexalgin®, vegetative respiratory crisis. М.Н.Дадашева1, Л.А.Подрезова1, Е.К.Романенко2 1 МОНИКИ им. М.Ф.Владимирского, Москва 2Первый МГМУ им. И.М.Сеченова, Москва В статье описывается случай боли в шее с осложненным течением – иррадиацией в голову и респираторными вегетативными кризами. Наиболее часто подобные симптомы возникают после травмы. Приведенный клинический пример подтвердил факт, что препарат из группы НПВП Дексалгин® заслуженно занимает достойное место в своей группе и его применение позволяет в короткие сроки купировать болевой синдром. Ключевые слова: боль в шее, головная боль, Дексалгин®, респираторный вегетативный криз. The case of cervicocranial syndrome with vegetative respiratory crises in neurological practice M.N.Dadasheva1, L.A.Podrezova1, E.K.Romanenko2 1 M.F.Vladimirsky MRSRCI, Moscow 2 I.M.Sechenov First MSMU, Moscow Проблема боли в шее и голове является одной из актуальных проблем в медицине. Боль в шее не только снижает работоспособность больных, но и ухудшает качество жизни, являясь причиной развития вегетативных расстройств. Известно, что причина появления и развития данной патологии различна, нередко развивается после травмы. В 15–20% случаев боль в шее имеет не только локальный характер, но иррадиирует в голову, способствуя развитию цервикогенной головной боли, что усложняет диагностику и ведение такого больного. Это объясняется анатомическим строением шеи, огромной нагрузкой, которую она испытывает, ранним развитием в ней дегенеративного процесса. Как показывает наша практика, пациенты с болью в шее, осложненной цервикогенной головной болью, посещают различных специалистов, но не всегда получают адекватную медицинскую помощь [1–3]. В настоящей работе будет рассмотрен вариант боли в шее травматического генеза, осложненный цервикогенной головной болью с вегетативными пароксизмами, примером чему служит следующее наблюдение. Больной Л., 44 лет, обратился в поликлинику к терапевту с жалобами на постоянную боль в шее, головную боль упорного, мучительного характера, с периодическими приступами нехватки воздуха, ощущением тревоги, чувством жжения, пульсации, онемения в голове. Из анамнеза известно, что рос физически слабым, беспокойным, легко возбудимым. По характеру был застенчивым, робким, нерешительным, легко ранимым. В старших классах много времени уделял занятиям, в этот период отмечает появление боли в шее и голове при переутомлении, нарушение сна, однако к врачам не обращался. После окончания института устроился на фирму, где вынужден был длительно сидеть за компьютером, из-за чего нередко отмечались боль в шее и голове. Сведения об авторах: М.Н.Дадашева – д.м.н., проф. кафедры общей врачебной практики ГБУЗ МО МОНИКИ им. М.Ф.Владимирского Л.А.Подрезова – д.м.н., проф. кафедры терапии ГБУЗ МО МОНИКИ им. М.Ф.Владимирского Е.К.Романенко – аспирант кафедры неврологии Первого МГМУ им. И.М.Сеченова НЕВРОЛОГИЯ 8. Чернявский A.M., Виноградова Т.Е. Программа борьбы с инсультом, переходящими нарушениями мозгового кровообращения и дисциркуляторными энцефалопатиями. Методические рекомендации. Новосибирск. 2002; 17. 9. Alsaadi T.M., Koopmans S., Apperson M., Farias S. Levetiracetam monotherapy for elderly patients with epilepsy. Seizure 2004; 13: 58–60. 10. Baran M., Stecker M. Epilepsy in a rural elderly population. Epileptic Disord. 2007; 9 (3): 256–70. 11. Poza J.J. Management of epilepsy in the elderly. Neuropsychiatr Dis Treat. 2007 December; 3 (6): 723–728. 12. So E.L., Annegers J.F., Hauser W.A., O'Brien P.C., Whisnant J.P: Populationbased study of seizure disorders after cerebral infarction. Neurology. 1996; 46: 350–5. Трудный пациент № 12, ТОМ 10, 2012 3. Лагода О.В. Значение структурных особенностей атеросклеротических бляшек и степени стеноза внутренней сонной артерии в патогенезе ишемических нарушений мозгового кровообращения: Дис. канд. мед. наук. М.: 1998; 95. 4. Панфилов С.Д. Хирургическая тактика при малых асимптомных атеросклеротических стенозах сонных артерий: Дис. канд. мед. наук. Томск, 1993; 210. 5. Покровский А.В. Первичная профилактика ишемического инсульта и возможности сосудистой хирургии. Журнал неврологии и психиатрии (приложение «Инсульт»). 2003; 9: 96–98. 6. Покровский А.В., Белоярцев Д.Ф., Орехов П.Ю. Факторы риска рестенозов ВСА после каротидной эндартерэктомии. Журнал неврологии и психиатрии им. С.С. Корсакова. Инсульт. 2003; 9: 208. 7. Чельдиев К.В. Выбор метода хирургического лечения стенотических поражений внутренних сонных артерий. Автореф. дисс. канд. мед. наук. 2008; 47. 21 КУПИРОВАНИЕ БОЛИ Месяц назад попал в автоаварию, в тот же день в травмпункте был осмотрен врачом. Поскольку головой не ударялся и сознания не терял, был отпущен домой без каких-либо рекомендаций. Однако после травмы боль в шее и голове отмечались постоянно. Воспоминания об автоаварии провоцировали приступ, сопровождающийся сердцебиением, нехваткой воздуха, эмоциональным напряжением, тревогой, страхом. Особенностью были зависимость от положения, усиление ее и появление «хруста» и скованности при длительном нахождении в фиксированной позе. Боль и скованность в шее с ограничением движения головой возникали после ночи или к концу рабочего дня, при этом обычные аналгетики или спазмолитики, которые пациент начал принимать по совету коллег, были малоэффективны. При обращении к терапевту больной высказал свои жалобы, а также тревожные опасения по поводу своего здоровья. В связи с чем были проведены анализы крови, ЭКГ, ЭХО-КГ, которые патологии не выявили. Учитывая головную боль и вегетативную симптоматику, был назначен курс сосудистой терапии на 2 нед, однако эффекта от лечения получено не было. Учитывая сохраняющиеся жалобы, была рекомендована консультация невролога. При неврологическом осмотре были выявлены болезненность тригеминальных точек справа. Сглаженность шейного лордоза и ограничение объема движения в шее. Пальпаторно отмечалось напряжение мышц шеи, болезненность остистых отростков и паравертебральных точек на уровне СIII–CVII, точек выхода большого и малого затылочных нервов, поверхностно расположенных связок (выйной, межостной и надостной связок). Выраженный красный дермографизм, дистальный гипергидроз. Оживление сухожильных рефлексов. Легкая неустойчивость в позе Ромберга. Трудный пациент № 12, ТОМ 10, 2012 Информация о препарате 22 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА Фармакодинамика Декскетопрофена трометамол – действующее вещество препарата Дексалгин® 25 – нестероидный противовоспалительный препарат, оказывающий анальгезирующее, противовоспалительное и жаропонижающее действия. Механизм действия связан с ингибированием синтеза простагландинов на уровне циклооксигеназ (ЦОГ-1 и ЦОГ-2). Анальгезирующий эффект наступает через 30 мин после перорального приема, продолжительность терапевтического действия достигает 4–6 ч. При комбинированной терапии с анальгетиками опиоидного ряда декскетопрофена трометамол значительно (до 30–45%) снижает потребность в опиоидах. Фармакокинетика Всасывание. Максимальная концентрация в сыворотке после перорального приема декскетопрофена трометамола достигается в среднем через 30 мин (15–60 мин). Одновременный прием пищи замедляет всасывание препарата. Площади под кривой «концентрация–время» после однократного и повторного приемов сходны, что указывает на отсутствие кумуляции препарата. Распределение. Для декскетопрофена трометамола характерен высокий уровень связывания с белками плазмы крови (99%). Среднее значение объема распределения составляет менее 0,25 л/кг, период полураспределения составляет около 0,35 ч. Выведение. Главным путем выведения декскетопрофена является конъюгация его с глюкуроновой кислотой с последующим выведением почками. Период полувыведения декскетопрофена трометамола составляет 1,65 ч. У лиц пожилого возраста наблюдается удлинение периода полувыведения в среднем до 48% и снижение общего клиренса препарата. Результаты обследования. Рентгенограмма шейного отдела позвоночника: шейный лордоз выпрямлен, смещения позвонков не выявлено, распространенные признаки остеохондроза, более выраженные на уровне СIV–СVI – снижение высоты дисков, неровность замыкательных пластин тел позвонков. Остеофиты в унковертебральной области СIII–СVI с двух сторон размером 4–5 мм, задние остеофиты на этом уровне, спондилез. ЭЭГ: снижение альфа-ритма, небольшая дизритмия и наличие мелких низковольтных медленных волн. Очаговые нарушения отсутствуют. УЗДГ экстракраниальных сосудов: стенки сосудов не уплотнены, комплекс «интима+медиа» не утолщен, внутренний контур стенок ровный. Просвет исследованных артерий однороден. Диаметр правой позвоночной артерии – 3,2 мм, левой – 3,0 мм. Тенденция к понижению индекса резистентности обеих внутренних сонных и позвоночной артерий. Левая позвоночная артерия S-образно извита. МРТ шейного отдела позвоночника: протрузия 2 мм на уровне СII–СIII. МРА: умеренная извитость левой позвоночной артерии. Учитывая наличие цервикальной хлыстовой травмы в анамнезе, длительное нахождение в фиксированной позе во время работы за компьютером, а также выявленные изменения в шейном отделе позвоночника и в позвоночных артериях, больному был поставлен диагноз: Дорсопатия. Остеохондроз позвоночника, спондилез. Травматическая вертеброгенная цервикалгия. Шейно-черепной синдром с вегетативными респираторными кризами. Учитывая, что ведущей жалобой была боль в шее, патогенетически обоснованным при этой патологии считается назначение нестероидных противовоспа- ДЕКСАЛГИН® 25(Берлин-Хеми АГ/Менарини Групп, Германия) Декскетопрофен Таблетки п.о. 25 мг ПОКАЗАНИЯ К ПРИМЕНЕНИЮ • купирование болевого синдрома различного генеза (в том числе послеоперационные боли, боль при метастазах в кости, посттравматические боли, боль при почечной колике, альгодисменорея, ишиалгия, радикулит, невралгии, зубная боль и др.); • симптоматическое лечение острых и хронических воспалительных, воспалительно-дегенеративных и метаболических заболеваний опорно-двигательного аппарата (в том числе ревматоидный артрит, спондилоартрит, остеоартроз, остеохондроз). Препарат предназначен для симптоматической терапии, уменьшения боли и воспаления на момент применения. СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ Дексалгин® 25 принимают внутрь во время еды. В зависимости от интенсивности болевого синдрома рекомендуемая доза для взрослых составляет 12,5 мг (1/2 таблетки) каждые 4–6 ч или 25 мг (1 таблетка) каждые 8 ч. Максимальная суточная доза – 75 мг. У пациентов пожилого возраста и пациентов с нарушением функции печени и/или почек терапию препаратом Дексалгин® 25 следует начинать с более низких доз. Максимальная суточная доза составляет 50 мг. Дексалгин® 25 не предусмотрен для длительной терапии, курс лечения препаратом не должен превышать 3–5 дней. Разделы: Противопоказания, С осторожностью, Применение при беременности и лактации, Лекарственное взаимодействие, Побочные эффекты, Передозировка. – см. в инструкции по медицинскому применению препарата. лительных препаратов (НПВП), механизм действия которых заключается в ингибировании циклооксигеназы (ЦОГ), способствующей превращению арахидоновой кислоты в простагландины. Из имеющегося в настоящее время широкого арсенала НПВП необходимо было выбрать такой, который обладал бы быстрым и выраженным обезболивающим эффектом и оптимальным профилем безопасности, имел бы разные формы – как ампулы для инъекций, так и таблетки. Препаратом выбора стал Дексалгин® (декскетопрофен), который представляет собой водорастворимую соль правовращающего изомера кетопрофена и в нашей практике показал высокую эффективность в купировании болевого синдрома при заболеваниях опорно-двигательного аппарата. Дексалгин® оказывает обезболивающее, жаропонижающее и противовоспалительное действие. Преимущество препарата обусловлено двойным механизмом действия, центральным и периферическим, а также тем, что он быстро купирует боль и препятствует хронизации боли, предотвращая тем самым формирование «болевой памяти». Препарат начинает действовать уже через 30 мин после приема. Анальгетический эффект сохраняется 4–6 ч (для таблетированной формы). Дексалгин® выпускается в ампулах по 2 мл (50 мг) и таблетках по 25 мг. Пациенту был назначен стандартный курс: в первые 2 дня в виде инъекций 3 раза в день с последующим переходом на таблетированную форму по 1 таблетке 25 мг 3 раза в день до 5 дней. Дополнительно были назначены немедикаментозные методы лечения – физиотерапия (магнитотерапия, ультразвуковая терапия), мануальная терапия, иглорефлексотерапия, психотерапия. На фоне комплексной медикаментозной и немедикаментозной терапии больной уже через 10 дней отметил значительное улучшение – уменьшились боль в шее и голове, головокружение. В конце курса лечения он был направлен на лечебную гимнастику и массаж, оказывающие болеутоляющее, миорелаксирующее и сосудорасширяющее действие Таким образом, у пациента после травмы развился шейно-черепной синдром. Еще в 1928 г. Гарольдом Крове предложил называть гиперрефлексорные и гиперэкстензионные травмы шеи, полученные чаще во время дорожно-транспортного происшествия термином «цервикальная хлыстовая травма», при которой после удара в автомобиль сзади туловище пострадавшего совершает движение вперед, но голова отклоняется назад в краниоцервикальном сочленении и в сегментах СI–СII, а в нижних шейных сегментах СIII–СVII происходит разгибание. После чего развивается клиника цервикального синдрома и краниалгии. Краниалгия связана с ирритацией верхне-шейных корешков, большого затылочного нерва, шейных мышц и связок. При раздражении позвоночного нерва и артерии появляются симптомы в виде головокружения, зрительных и координаторных нарушений, различные вегетативные проявления – в данном случае респираторные панические атаки [3]. Таким образом, лечение больных с болью в шее должно быть комплексным с учетом патогенеза, стадии заболевания, клинического течения. Учитывая результаты многочисленных клинических исследований, свой собственный практический опыт, можно сделать вывод, что с целью оптимизации терапии представляется целесообразным включение в лечебный комплекс при осложненной боли в шее эффективного и обладающего высоким профилем безопасности препарата Дексалгин® в виде инъекций и ТЕРАПИЯ НИЗКОМОЛЕКУЛЯРНЫМИ ГЕПАРИНАМИ таблеток на короткий период – в среднем на 5 дней. Представленное клиническое наблюдение является типичным случаем посттравматической цервикалгии и цервикогенной головной боли, осложненной сосудистыми и вегетативными расстройствами у тревожной личности, в связи с чем потребовался даже курс психотерапии. Анализ приведенного наблюдения показал, что диагностические трудности были обусловлены тем, что с самого начала терапевтом не была прослежена связь боли в шее и голове с травмой, а также ошибочно был сделан акцент на головной боли, игнорировались личностные особенности больного (невропатическая конституция в детском возрасте, «психосоматический» тип реагирования) и профессиональные особенности, что в конечном итоге привело к длительному лечению. Использование бемипарина в качестве средства профилактики венозных тромбозов в общей хирургии и оперативной онкологии Трудный пациент № 12, ТОМ 10, 2012 Н.В.Стуров, Д.А.Медянцева РУДН, Москва 24 Бемипарин является новым низкомолекулярным гепарином, обладающим наибольшей активностью в отношении активированного Х фактора, что определяет высокую эффективность в профилактике тромбообразования. В статье приводится обзор результатов клинических исследований по использованию бемипарина в качестве средства профилактики венозных тромбозов и эмболий в общей хирургии и оперативной онкологии. Ключевые слова: бемипарин, Цибор®, абдоминальная хирургия, онкология, венозные тромбозы, профилактика. Bemiparin for venous thrombosis prevention in general surgery and surgical oncology N.V.Sturov, D.A.Medyantceva PFUR, Moscow Bemiparin is a new low molecular weight heparin which presents the highest anti-Xa-activity, therefore Таким образом, разработка патогенетически обоснованных принципов лечения при осложненной боли в шее является сложной проблемой, решение которой может быть достигнуто путем привлечения широкого круга специалистов и комплексного подхода к терапевтическим мероприятиям, включающим не только фармакотерапию, но и немедикаментозные методы лечения, в том числе психотерапию. Литература 1. Бененс А.Л., Епифанов В.А. Гемодинамика в вертебробазилярном бассейне у больных с осложненной травмой шейного отделе позвоночника. Патолог. позвоночника. Л.: 1982; 44–46. 2. Кукушкин М.Л., Хитров Н.К. Общая патология боли. М.: Медицина, 2004; 141. 3. Хабиров Ф. А. Клиническая неврология позвоночника. Казань, 2001; 472. the drug has a strong effectiveness in prevention of venous thrombosis. The article reviews clinical trials of bemiparin for venous thrombosis prevention in general surgery and surgical oncology. Keywords: bemiparin, Zibor®, abdominal surgery, oncology, venous thrombosis, prevention. Введение В последнее время наблюдается рост интереса отечественных клиницистов к вопросам тромбопрофилактики в общехирургической практике и онкологии. Известно, что частота глубоких венозных тромбозов и эмболий (ВТЭ) у пациентов отделений абдоминальной хирургии при отсутствии тромбопрофилактики может достигать 20–30% (в зависимости от основной патологии, сопутствующих заболеваний и факторов риска, в том числе массы тела), а частота смертельной и несмертельной тромбоэмболии легочной артерии и ее ветвей (ТЭЛА) – 0,3–0,8% [1]. В связи с этим профилактика тромбозов в общей хирургии, особенно при высоком риске ВТЭ, является статистически и клинически обоснованной. У онкологических пациентов клетки злокачественных опухолей выделяют в системный кровоток прокоагулянтные факторы, поэтому частота ВТЭ у этой категории больных заметно выше, чем в среднем в популяции. Стратификация риска ВТЭ В отечественных рекомендациях по профилактике ВТЭ приводится четкий алгоритм оценки риска тромбоза в зависимости от заболевания пациента, анамнестических данных, а также от вида проведенной операции (табл. 1, 2) [2]. Используя эти данные, легко определить показания к проведению тромбопрофилактики. В общей хирургии больных с низким риском ВТЭ следует максимально быстро активизировать. Целесообразно использовать компрессионный трикотаж или эластическое бинтование нижних конечностей интраоперационно и в послеоперационном периоде. Больным с умеренным и высоким риском развития ВТЭ назначают нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ) или Сведения об авторе: Стуров Николай Владимирович – к.м.н., доцент кафедры общей врачебной практики РУДН Риск ТГВ при отсутствии профилактики Степень риска Характеристика пациентов Малые операции длительностью не более 1 ч у пациентов до 40 лет без дополнительных ФР ВТЭ Низкая <Менее 10% Острые нехирургические заболевания, не требующие постельного режима Большие операции у пациентов 40–60 лет без дополнительных ФР Большие гинекологические операции у пациенток моложе 40 лет на фоне приема эстрогенов ХИРУРГИЯ Таблица 1. Оценка степени риска развития ВТЭ Малые операции у пациентов старше 60 лет Малые операции у пациентов 40–60 лет с ФР Изолированные переломы костей голени Разрыв связок и сухожилий голени Умеренная 10–40% Госпитализация с ХСН III–IV ФК Острые инфекционные или воспалительные заболевания, требующие постельного режима Заболевания ЦНС и ПНС с обездвиженностью или длительным постельным режимом Острые заболевания легких с ДН, не требующие ИВЛ Ожоги площадью до 20% поверхности тела Термоингаляционная травма I–II степени Сепсис Верифицированная тромбофилия Большие операции у пациентов старше 60 лет Большие операции у пациентов 40–60 лет, имеющих дополнительные ФР (ВТЭ в анамнезе, рак и пр.) Эндопротезирование крупных суставов, операции при переломах бедра Тяжелая и сочетанная травма, повреждение спинного мозга Высокая 40–80% Ожоги площадью более 20% поверхности тела Термоингаляционная травма III ст. Осложнения ожоговой болезни Химио-, рентгено-, или радиотерапия у пациентов с онкологическим заболеванием ОНМК с глубоким парезом или плегией Острые заболевания легких с ДН и требующие ИВЛ Примечание. ТГВ – тромбоз глубоких вен нижних конечностей, ФР – факторы риска, ХСН – хроническая сердечная недостаточность, ФК – функциональный класс, ЦНС – центральная нервная система, ПНС – периферическая нервная система, ДН – дыхательная недостаточность, ИВЛ – искусственная вентиляция легких. Рис. 1. Профиль безопасности применения бемипарина в исследовании [4]. * – p<0,035; ** – p=0,015 НМГ в профилактике ВТЭ В качестве средств венозной тромбопрофилактики на сегодняшний день НМГ используются наиболее активно, особенно на стационарном этапе лечения. Достоинствами НМГ являются: высокая биодоступность при подкожном введении (почти 100%), низкая активность в отношении тромбина (IIа-фактора) и отсутствие необходимости контроля коагулограммы пациента. Новым представителем НМГ, быстро входящим в клиническую практику, является бемипарин, к отличительным чертам которого можно отнести наименьшую молекулярную массу из всех НМГ (3600 Да), наиболее продолжительный период полувыведения (5–6 ч) и наибольшую активность в отношении активированного X фактора свертывания крови (соотношение активности анти-Xa/анти-IIa составляет 8:1) [3]. В настоящее время идет накопление опыта по использованию бемипарина в качестве средства профилактики ВТЭ в общей хирургии и оперативной онкологии. Использование бемипарина в абдоминальной хирургии В двойном слепом, рандомизированном многоцентровом исследовании с участием 184 пациентов низкого и среднего риска развития ВТЭ сравнили эффективность бемипарина со стандартным нефракционированным гепарином (НФГ) [4]. Бемипарин вводился подкожно по 2500 МЕ каждые 24 ч, начиная с первой дозы за 2 ч до начала операции. НФГ назначался в дозе 5000 МЕ подкожно каждые 12 ч в течение 7 дней. Трудный пациент № 12, ТОМ 10, 2012 фондапаринукс в дозах и в сроки, рекомендованные производителем. Целесообразно использовать компрессию в интра- и послеоперационном периодах. При высоком риске кровотечения или активном кровотечении тромбопрофилактику начинают с компрессии (трикотаж, эластичные бинты), антикоагулянты назначаются после устранения риска рецидива кровотечения. Касательно продолжительности, тромбопрофилактика в общей хирургии осуществляется у пациентов с низким риском до полной активации, у больных со средним и высоким риском развития ВТЭ – как минимум до выписки из стационара (7–10 дней). 25 ТЕРАПИЯ НИЗКОМОЛЕКУЛЯРНЫМИ ГЕПАРИНАМИ Таблица 2. Большие и малые хирургические операции при оценке риска развития ВТЭ Вид операции (условный) Примеры Общая хирургия: гастрэктомия, панкреатэктомия, колэктомия, резекция желудка или кишечника, осложненная аппендэктомия, холецистэктомия по экстренным показаниям, ампутация бедра, бариатрические операции Гинекология/акушерство: экстирпация матки, кесарево сечение, ампутация матки Травматология/ортопедия: остеосинтез бедра, протезирование суставов, остеосинтез костей голени, операции на позвоночном столбе Урология: чреспузырная аденомэктомия, экстирпация мочевого пузыря, нефрэктомия с лимфоаденэктомией и/или Большие операции удалением опухолевого тромба из нижней полой вены Нейрохирургические операции: любые виды операций Сердечно-сосудистая хирургия: артериальная реконструкция, аортокоронарное шунтирование Комбустиология: некрэктомия ожоговых ран на площади более 10% поверхности тела, аутодермопластика более 15% поверхности тела Общая хирургия: плановая холецистэктомия, аппендэктомия, грыжесечение Гинекология/акушерство: роды, аборт Травматология/ортопедия: вмешательство по поводу деформации стопы, артроскопия коленного сустава Малые операции Урология: трансуретральная аденомэктомия Сосудистая хирургия: флебэктомия, кроссэктомия при восходящем тромбофлебите поверхностных вен Комбустиология: некрэктомия ожоговых ран на площади до 10% поверхности тела, аутодермопластика до 15% поверхности тела В итоге ни в одной группе ТГВ и ТЭЛА отмечено не было, однако были выявлены преимущества бемипарина в плане безопасности использования (рис. 1). Эффективность и высокий профиль безопасности бемипарина в абдоминальной хирургии у пациентов среднего и высокого риска были показаны в проспективном исследовании [5] (n=203). При среднем риске развития ВТЭ после операции на органах брюшной полости бемипарин назначался в дозе 2500 МЕ/сут, при высоком риске – в дозе 3500 МЕ/сут. Основной массе пациентов доступ к брюшной полости выполнялся по пупочной складке (59,1%). Первая доза вводилась за 2 ч до начала операции, продолжительность тромбопрофилактики в среднем составила 2,52±2 дня. В итоге наблюдались только 2 эпизода ВТЭ (оба нефатальные): 1 дистальный ТГВ и 1 ТЭЛА. У 77,8% пациентов не наблюдалось никаких осложнений тромбопрофилактики с использованием бемипарина. В остальных случаях развившиеся осложнения были в основном оценены как незначительные: небольшая гематома в области операционного шва (6,9%), экхимозы в области инъекций бемипарина Трудный пациент № 12, ТОМ 10, 2012 Информация о препарате 26 ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ Фармакодинамика. Бемипарин натрия является антикоагулянтом прямого действия и относится к группе низкомолекулярных гепаринов. Снижение свертываемости крови под влиянием бемипарина натрия связано с тем, что он усиливает угнетающее действие антитромбина III на ряд факторов свертывания крови (Ха и в меньшей степени на IIа). Фармакокинетика. Абсорбция и элиминация препарата описываются линейной кинетикой 1-го порядка. Абсорбция: после подкожного введения бемипарин натрия быстро всасывается, биодоступность составляет 96%. Максимальная антифактор-Ха активность в плазме крови при введении препарата в профилактических дозах – 2500 ME и 3500 ME – достигается через 2–3 ч с пиками активности порядка 0,34±0,08 и 0,45±0,07 ME антифактор-Ха/мл соответственно. Антифактор-IIа активность при введении препарата в вышеуказанных дозах не обнаруживается. Максимальная антифактор-Ха активность в плазме крови при введении препарата в терапевтических дозах – 5000, 7500, 10 000 и 12 500 ME – достигается через 3–4 ч с пиками активности порядка 0,54±0,06, 1,22±0,27, 1,42±0,19 и 2,03±0,25 ME антифактор-Ха/мл соответственно. Антифактор-IIа активность порядка 0,01 МЕ/мл была обнаружена при введении препарата в сле- (9,9%). Из серьезных осложнений наблюдались 2 случая выраженных кровотечений (1%) и 4 интраоперационных кровотечения (2%). Никому из больных не потребовалась введение препаратов крови. Так же не наблюдалось аллергических реакций и случаев тромбоцитопении. Можно заключить, что бемипарин является эффективным и обладающим высоким профилем безопасности средством профилактики ВТЭ в общехирургической практике. Использование бемипарина в оперативной онкологии У пациентов с раком органов брюшной полости и малого таза наблюдается повышенный риск тромбообразования в раннем и отдаленном послеоперационных периодах. В зарубежной литературе анализируется целесообразность проведения у больных с данным видом патологии послеоперационной тромбопрофилактики с использованием НМГ в течение 4 нед против стандартных 7–10 дней [6]. В отечественных рекомендациях по профилактике ВТЭ указывается, что у пациентов, перенесших ЦИБОР® Бемипарин натрия Раствор для подкожного введения 2500 МЕ, 3500 МЕ дующих дозах: 7500, 10 000 и 12 500 ME. Элиминация: при введении бемипарина натрия в дозе 2500–12 500 ME период полувыведения составляет около 5–6 ч, поэтому препарат назначают 1 раз в сутки. В настоящее время данных, описывающих способность бемипарина натрия связываться с белками плазмы, его метаболизм и выведение у человека, не имеется. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ • профилактика тромбоэмболии у пациентов при общехирургических вмешательствах и ортопедических операциях; • профилактика тромбоэмболии у пациентов с высоким или умеренным риском тромбообразования (без хирургического вмешательства); • вторичная профилактика рецидивов венозной тромбоэмболии у пациентов с тромбозом глубоких вен и преходящими факторами риска; • профилактика свертывания крови в системе экстракорпорального кровообращения при проведении гемодиализа. Разделы: Режим дозирования, Противопоказания, Особые указания, Передозировка, Лекарственное взаимодействие, Состав, Характеристика – см. в инструкции по медицинскому применению препарата. ТГВ, симптоматические нефатальные ТЭЛА и случаи смерти по причине ВТЭ. Главной конечной точкой профиля безопасности служили случаи больших кровотечений. Главная конечная точка эффективности была зарегистрирована у 10,1% пациентов группы бемипарина и 13,3% больных в группе плацебо. Хотя различия между группами не достигли статистически достоверного уровня (р=0,263), уровень относительного риска развития ВТЭ в группе бемипарина оказался ниже на 24,4%. Частота наступления дополнительной конечной точки оказалась достоверно ниже в группе бемипарина (0,8% против 4,6%, p=0,016), а относительный риск развития ВТЭ в группе бемипарина оказался ниже на 82,4% по сравнению с группой плацебо (рис. 2). Риск геморрагических осложнений при продлении тромбопрофилактики бемипарином на 3 нед достоверно не увеличился. Серьезные кровотечения развились у 0,6% больных группы бемипарина против 0,3% – группы плацебо (недостоверные различия, p=0,572). Результаты исследования CANBESURE позволяют сделать вывод, что продленная до 4 недель тромбопрофилактика бемипарином в дозе 3500 МЕ/сут после абдоминальных или тазовых операций по удалению злокачественных опухолей достоверно снижает риск развития серьезных ВТЭ без повышения риска геморрагических осложнений, по сравнению со стандартным недельным курсом тромбопрофилактики прямыми антикоагулянтами. Другим основанием к использованию НМГ, в частности бемипарина, у онкологических больных могут служить данные о способности гепаринов тормозить рост опухолевых клеток и их метастазирование [9]. Недавно представленные результаты исследования ABEL позволяют утверждать, что добавление бемипарина в дозе 3500 МЕ/сут в течение 26 дней пациентам, получающим химио- и лучевую терапию по поводу ограниченного мелкоклеточного рака легкого достоверно увеличивает выживаемость пациентов. Так, средний показатель общей выживаемости в группе бемипарина составил 161,8 нед против 49,3 нед в группе только химио- и лучевой терапии (р=0,012), а показатель двухлетней выживаемости – 68,6% против 29,4% соответственно (p=0,0042). Помимо этого, бемипарин умешал частоту ВТЭ без роста риска кровотечений [10]. Поскольку большинство онкологических пациентов можно отнести к группе высокого риска ВТЭ, использование бемипарина у этой категории хирургических больных представляется довольно перспективным. ХИРУРГИЯ Рис. 2. Основные результаты исследования CANBESURE (пояснения в тексте) [8] Трудный пациент № 12, ТОМ 10, 2012 крупные операции по поводу онкологических заболеваний, а также у пациентов с уже имевшимися ВТЭ в анамнезе введение НМГ целесообразно продлить до 4 нед [2]. Эффективность бемипарина в качестве средства послеоперационной профилактики тромбозов у онкологических пациентов была изучена в ретроспективном исследовании (n=197) [7]. Большинству пациентов (n=134) было выполнено оперативное вмешательство по поводу рака кишечника. Первая доза бемипарина вводилась стандартно до операции, однако 22,8% больных получили первую дозу уже после операции. 73 пациента (37,1%), согласно хирургическим критериям, имели высокий риск развития ВТЭ и получали бемипарин в дозе 3500 МЕ/сут, хотя по современным критериям к категории высокого риска ВТЭ следовало отнести 95,9% больных. У 3 пациентов, отнесенных к группе среднего риска развития ВТЭ и получавших бемипарин в дозе 2500 МЕ/сут (первая доза до начала операции), развился венозный тромбоз с клинической симптоматикой. У пациентов были зарегистрированы 4 больших и 5 малых кровотечений. Меньшая частота кровотечений (2,2% против 5,3%; р=0,48) и побочных эффектов (2,2% против 9,9%; р=0,11) наблюдалась у пациентов, которым бемипарин был назначен после операции. Частота кровотечений статистически не зависела от дозы бемипарина (4,0% против 5,5%; p=0,72). 2 пациента скончались в результате сердечно-легочной недостаточности и сепсиса. Касательно экономической эффективности, послеоперационное начало терапии бемипарином вело к экономии 909 евро/пациента в сравнении с предоперационным началом тромбопрофилактики ввиду меньшей продолжительности пребывания в стационаре (9 против 11 дней) и меньшего числа осложнений. Был сделан вывод, что у онкологических пациентов профилактику ВТЭ с помощью НМГ целесообразно начинать после оперативного вмешательства. Важные данные по продолжительности профилактики ВТЭ были получены в двойном слепом многоцентровом исследовании CANBESURE (n=703) [8]. В это исследование были включены пациенты старше 40 лет, которым было проведено хирургическое вмешательство по поводу ранее диагностированных злокачественных опухолей (первичных или метастатических) желудочно-кишечного тракта, мочевыводящих путей или женской репродуктивной системы. В исследование включались только пациенты с ожидаемой продолжительностью жизни не менее 3 мес, у которых операция проводилась под общим наркозом или спинномозговой анестезией и длилась не менее 30 мин. Перед рандомизацией все пациенты получали бемипарин подкожно в дозе 3500 МЕ 1 раз в сутки в течение 8±2 дня (первая доза вводилась через 6 ч после операции). Затем больных случайным образом разделили на группу продолжения тромбопрофилактики бемипарином в том же режиме в течение дополнительных 20±2 дней и группу плацебоконтроля. Через 28 дней после операции проводилась двусторонняя восходящая венография. Отдаленные результаты наблюдали в течение 3 мес. Главной конечной точкой эффективности служила совокупность симптоматических и бессимптомных ТГВ, нефатальных ТЭЛА, а также случаев смерти от любых причин. Проводился так же проспективный учет дополнительной комбинированной конечной точки, включавшей в себя проксимальные 27 ТЕРАПИЯ НИЗКОМОЛЕКУЛЯРНЫМИ ГЕПАРИНАМИ Трудный пациент № 12, ТОМ 10, 2012 Заключение Приведенные данные позволяют говорить о высоких эффективности и профиле безопасности использования бемипарина у пациентов среднего и высокого риска развития ВТЭ. Традиционно большое внимание тромбопрофилактике у хирургических пациентов уделяется в оперативной гинекологии и ортопедии, однако не следует забывать, что практически все хирургические пациенты находятся в группе риска развития послеоперационных венозных тромбозов. Бемипарин можно успешно использовать у пациентов общехирургического и онкологического профиля с умеренным или высоким риском развития ВТЭ в качестве средства тромбопрофилактики. Литература 1. García Sabrido J.L., Pacheco Sánchez D. Profilaxis de la enfermedad tromboembЧlica perioperatoria en cirugТa general. Cir Esp. 2001; 69: 49–55. 2. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология. 2010; 4: 1: 42. 3. Martínez-González J., Vila L., Rodríguez C. Bemiparin: secondgeneration, low-molecular-weight heparin for treatment and prophylaxis of venous thromboembolism. Expert Rev Cardiovasc Ther. 2008 Jul; 6 (6): 793–802. 4. Moreno González E., Fontcuberta J., de la Llama F. Prophylaxis of thromboembolic disease with RO-11 (ROVI), during abdominal surgery. Hepato-Gastroenterology. 1996; 43: 744–747. 5. Hidalgo M., Figueroa J.M. Prophylaxis of venous thromboembolism in abdominal wall surgery. Hernia. 2000; 4: 242–247. 6. Bergqvist D., Agnelli G., Cohen A.T. et al. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med. 2002 Mar 28; 346 (13): 975–80. 7. Balibrea J.L., Altimiras J., Larruzea I. et al. Optimal dosing of bemiparin as prophylaxis against venous thromboembolism in surgery for cancer: an audit of practice. Int J Surg. 2007 Apr; 5 (2): 114–9. 8. Monreal B.M., Vignoli A., Lecumberri V.R. et al. Bemiparin in oncology. Drugs. 2010 Dec 14; 70 Suppl 2: 35–42. 9. Rickles F.R., Edwards R.L., Barb C. et al. Abnormalities of blood coagulation in patients with cancer. Fibrinopeptide A generation and tumor growth. Cancer. 1983 Jan 15; 51 (2): 301–7. 10. ABEL trial: A phase II randomized trial adding bemiparin (B) to chemo-radiotherapy (CT-RT) in limited-stage small cell lung cancer (SCLC)–Final results. 2012 ASCO Annual Meeting . Abstr 7095. Cit. in: J Clin Oncol 30, 2012. Лекарственное растение – шиповник майский. Лечебные свойства шиповника, как лекарственного растения были известны в России еще в 17 веке. В биологический состав шиповника входят витамины К, Е, А, Р, группы В. Богат он микроэлементами: кальцием, калием, железом, магнием, натрием, марганцем, медью, хромом и так далее. Сахара, пектины, дубильные вещества, органические кислоты, эфирные масла, которые входят в состав шиповника, тоже важны для нормальной жизнедеятельности человека. Шиповник оказывает полезные свойства в лечении органов пищеварения, почек, различных воспалительных процессов. Применяется растение как средство уничтожения болезнетворных бактерий. Корни растения оказывают вяжущее действие, а полученное из семян масло шиповника применяется в качестве заживляющего и противовоспалительного На обложке номера – Шиповник майский. средства (его наносят на раны, язвы, экземы, гнойники и т.п.). Условно виды шиповника разделены на две секции: высоковитаминных (коричных) с содержанием аскорбиновой кислоты в плодах от 2 до 17% и низковитаминных (собачьих) с содержанием аскорбиновой кислоты 0,5–1,2%. Благодаря высокому содержанию аскорбиновой кислоты (витамин С) шиповник в разных видах (отвар или чай из шиповника) применяется для общего укрепления, повышения иммунитета, профилактики ОРВИ в холодное время года, лечения атеросклероза. Довольно успешно используется шиповник и в лечении повышенного давления, проблем с сосудами, а также расстройств мочеполовой системы. Медицина рекомендует шиповник как желчегонное и мочегонное средство. Он улучшает обмен веществ, помогает при малокровии, холецистите, желчнокаменной болезни. По материалам: http://www.rasteniya-lecarstvennie.ru; http://atdiet.ru 28 ГЕНЕТИЧЕСКОЕ ЗАБОЛЕВАНИЕ Трудный пациент № 12, ТОМ 10, 2012 30 Клинические трудности диагностики синдрома Прадера-Вилли В.И.Гузева, Л.Б.Бессонова, К.А.Насеко Санкт-Петербургский государственный педиатрический медицинский университет Детская городская больница №4, Санкт-Петербург В настоящее время в неврологическом сообществе дискутируется вопрос, каким образом трактовать диагноз детский церебральный паралич (ДЦП). Что это? Самостоятельное заболевание, имеющее различные формы или набор синдромов при различном поражении центральной нервной системы. С увеличением возможностей диагностики (появление высокопольной МРТ, увеличение количества методик и возможностей медико-генетического консультирования) происходит переоценка взглядов на данную проблему. С конца 80-х годов ХХ века значительно увеличилось количество новой генетической патологии, нарушений обмена, пороков развития головного мозга, аномалий развития мозжечка и мальформации структур головного мозга. Картина клинических проявлений у данной группы больных укладывается в симптомокомплекс ДЦП. Уточнение этиопатогенеза возникновения заболевания имеет большое значение для решения вопроса о прогнозе течения, терапии и самое главное прогнозе для родителей о возможности рождения у них здорового ребенка. Существует мнение о том, что каждая 60-я семья имеет измененный генотип при сохраненном фенотипе. Поэтому столь важным является настороженность невролога, тщательный сбор анамнеза и внимательный осмотр больного. Представляем вашему вниманию 2 случая поздней диагностики синдрома Прадера-Вилли, несмотря на то что пациенты, о которых пойдет речь, находились под постоянным наблюдением неврологов, эндокринологов и генетиков. Ключевые слова: синдром Прадера-Вилли, трудности диагностики. Difficulties of Prader-Willi syndrome diagnostics V.I.Guzeva, L.B.Bessonova, K.A.Naseko St. Petersburg State Pediatric Medicine University Children city hospital №4, St. Petersburg Neurology communities keep on currently trying to deal with spastic infantile cerebral palsy (ICP) defini- tion and diagnostics. What is ICP? Separately standing disease with various forms or sum of different CNS lesions syndromes? MRI, increase in quantity of techniques, medico-genetic analyses provides re-evaluating of ICP. Since 80-es number of new genetic pathologies, metabolic disorders, brain malformations have been investigated. Symptoms of congenital brain disorders often are similar to those in ICP. Data on pathogenesis of brain congenital lesions should be taken in account during genetic consultation in order to provide the birth of healthy child. Every 60th family is considered to have changes genotype and intact phenotype. Vigilance of neurologists, careful history recording and attentive patient examination is also helpful for diagnostics. The article presents 2 cases of delayed Prader-Willi syndrome diagnostics in spite of neurologist, endocrinologist and geneticist constant supervision. Keywords: Prader-Willi syndrome, clinical manifestations, difficulties of diagnostics. Синдром Прадера-Вилли (СПВ) впервые описан швейцарскими педиатрами А. Prader и H. Willi в 1956 г. Встречается у 1 на 25 000–10 000 новорожденных. Синдром Прадера-Вилли вызывается делецией родительской копии импринтированных SNRPN гена малого ядерного рибонуклепротеинового полипептида N и гена necdin, который находится рядом с кластерами мРНК: SNORD64, SNORD107, SNORD108 и двумя копиями SNORD109, 29 копией SNORD116 (HBII-85) и 48 копией SNORD115 (HBII 52). Они расположены на 15-й хромосоме в регионе 15q11-13. Это так называемый PWS/AS регион может быть потерян в результате действия одного из нескольких генетических механизмов в большинстве случаев через мутации. Другие менее распространенные механизмы включают: униотцовскую дисомию, случайные мутации, хромосомные транслокации и делеции гена. Риск рождения больного ребенка в семье, где уже есть один больной потомок, зависит от генетического механизма, который вызвал расстройство. Вероятность рождения больного ребенка составляет менее 1%, если у него наблюдается делеция гена или униотцовская дисомия, если же у ребенка мутация региона, для которого характерно явление импринтинга, то эта вероятность возрастает до 50%, в случае появления хромосомных транслокаций риск возникновения болезни у следующего ребенка составляет 25%. Для диагностики всех известных механизмов возможно использование пренатального тестирования [1]. Минимальные диагностические признаки: мышечная гипотония, гипогонадизм, ожирение, умственная отсталость, маленькие кисти и стопы. Клиническая характеристика: дети с синдромом Прадера-Вилли обычно рождаются доношенными с нерезко выраженной внутриутробной гипотрофией, предлежание в 10–40% – ягодичное. Различают две фазы синдрома [2]. Сразу после рождения отмечают тяжелую мышечную гипотонию. Симптом настолько выражен, что дети не совершают спонтанных движений и даже не могут сосать. Их приходится кормить через Сведения об авторах: В.И.Гузева – доктор медицинских наук, профессор, главный внештатный детский невролог МЗ России, Санкт-Петербургский государственный педиатрический медицинский университет Л.Б.Бессонова – врач высшей категории, заслуженный врач РФ, ДГБ №4 Святой Ольги, Санкт-Петербург К.А.Насеко – студентка 6 курса. Санкт-петербургский государственный педиатрический медицинский университет Клинические наблюдения пациентов с синдромом Прадера-Вилли Мальчик О. 3 года 11 мес. Родился от второй беременности, протекавшей на фоне угрозы прерывания, на сроке 15–16 нед, гестоза, многоводия. ОРВИ – на 20-й неделе. На 27-й неделе, по данным УЗИ – плод не растет. Роды – 2-е (1-дочь, 14 лет, здорова) со стимуляцией на 37–38-й неделе. Масса при рождении 2250 г, длина тела – 48 см. По шкале Апгар – 7/8 баллов. Состояние тяжелое, за счет неврологической симптоматики: крик слабый, диффузная мышечная гипотония, отсутствие сосательного рефлекса, брадикардия. На 6-е сутки переведен в ДГБ №1 с диагнозом задержка внутриутробного развития (ЗВУР) по диспластическому типу, синдром угнетения ЦНС, стигмы дизэмбриогенеза (низко расположенные ушные раковины, готическое небо, короткие глазные щели), двухсторонний крипторхизм. На КТ головного мозга: признаки черепно-мозговой травмы, умеренный отек головного мозга. Врожденный порок сердца (ДМЖП), НК 0. Проводилась электронейромиограмма в возрасте 15 дней. Заключение: признаки выраженного снижения амплитуды вызванной активности с мышц нижних конечностей на фоне снижения функциональной возбудимости нейронов поясничного утолщения с двух сторон без при- ПЕДИАТРИЯ знаков нарушения нервно-мышечного взаимодействия. Умеренное замедление скорости проведения импульса с нижних конечностей может быть обусловлено задержкой миелинизации. Амплитуды произвольной активности с мышц верхних и нижних конечностей умеренно снижены, без достоверной асимметрии сторон. Признаков поражения нервов верхних конечностей, мотонейронов спинного мозга, первично-мышечного утолщения не выявлено. ЭНМГ данных за миопатию, спинальную амиотрофию не получено. Выписан с диагнозом : гипоксически-травматическое поражение головного мозга. Вегетативная дисфункция. Псевдобульбарный синдром. ЗВУР по гипотрофическому типу. В 4 мес в ДГБ №4 пациенту дано направление в медико-генетический центр (МГЦ). Заключение МГЦ: резидуальная энцефалопатия с миопатическим компонентом. В 2009 г. поставлен диагноз: Детский церебральный паралич. Атонически-астатическая форма. Задержка психомоторного развития(ЗПМР). В 2011 г. оперирован по поводу правостороннего крипторхизма – полное низведение невозможно (короткий канатик), левое яичко в паховом канале, малых размеров. Пациент консультирован генетиком по поводу задержки психомоторного развития, подозрения на синдром Прадера-Вилли, врожденную миопатию. Данные при лабораторном исследовании не подтвердились, рекомендовали повторный анализ. Заключение эндокринолога: низкорослость смешенного генеза, крипторхизм. В 2012 г. рекомендовано обследование в московском медико-генетическом центре (МГЦ). Первоначально в МГЦ последовал отказ в проведении медико-генетического обследования, мотивированный тем, что клинически ребенок не похож на больного с синдромом Прадера-Вилли, но родители настояли на проведении обследования. Заключение генетика: убедительных клинических данных за врожденные миопатию и показаний для ДНК-диагностики тех форм, ДНК-диагностика которых проводится не выявлено. Проведен анализ аллельного метилирования промоторной области гена SNRPN методом метил-специфической ПЦР. Результат: отсутствие неметилированного аллеля, что характерно для синдрома Прадера-Вилли. Мальчик Б. 5 лет. Родился от первой беременности, протекавшей на фоне угрозы прерывания на 8–9, 28-й неделях. По данным УЗИ, на 33 нед – многоводие. Ягодичное предлежание. Роды – на 40-й неделе, плановое кесарево сечение. Тугое обвитие пуповины вокруг шеи. Масса тела при рождении – 2480 г, рост – 47 см. Оценка по шкале Апгар – 8/9 баллов. Состояние после рождения: средней степени тяжести, крик слабый, неохотный. Мышечная гипотония, гипорефлексия. Тургор тканей снижен, подкожно-жировой слой истончен. Стигмы дизэмбриогенеза (готическое небо, низко расположенные ушные раковины). Сосательный рефлекс сохранен. В возрасте 5 дней поступает в ДГБ №4 Санкт-Петербурга с диагнозом хроническая внутриутробная гипоксия. ЗВУР по диспластическому типу. Дисплазия тазобедренных суставов. Гипоксически-ишемическое поражение нервной системы II степени, двухсторонний крипторхизм. Неоднократно давались направления в МГЦ по поводу подозрения на синдром Прадера-Вилли. Консультация в МГЦ – кариотип 46XY нормальный. Повторная консультация: данных за наследственный синдром нет. Трудный пациент № 12, ТОМ 10, 2012 зонд или из пипетки. Вследствие тяжелой мышечной гипотонии у них резко задерживается становление статических и локомоторных функций: они не держат голову, не сидят и т.д. Могут не вызываться или быть сниженными так называемые физиологические рефлексы новорожденных – Моро, шаговый, ползания по Бауэру и др. Также отмечают наклонность к гипотермии. В эту фазу болезни других симптомов синдрома может и не быть. Это служит поводом для диагностики перинатальной энцефалопатии, миопатии различного генеза или другого неврологического заболевания. Вторая фаза болезни развивается через несколько недель, месяцев или к концу первого – началу второго года жизни. Гипотония уменьшается, развивается булимия: ребенок постоянно испытывает голод, активно ищет еду и, как следствие, у него развивается ожирение. Характерный вид имеет распределение подкожно-жировой клетчатки: больше всего ее на туловище и проксимальных отделах конечностей – бедрах, плечах. Стопы и кисти рук поэтому представляются диспропорционально маленькими. В эту фазу начинает обращать на себя внимание умственная отсталость: речь затруднена, словарный запас чрезвычайно мал [3]. Характерен гипогонадизм. Обычно у пациентов имеется также недостаточность секреции ФСГ и ЛГ, что может приводить к задержке полового созревания и недоразвитию половых желез [4]. У мальчиков наблюдается гипоплазия полового члена, у девочек – гипоплазия больших и малых половых губ. В дальнейшем характерно развитие сахарного диабета. В биохимическом анализе крови отклонений в содержании липидов, белков, аминокислот или ферментов не выявляют [3]. Своевременная диагностика и рациональное лечение значительно улучшают прогноз заболевания. Таким детям необходим в раннем возрасте массаж, ЛФК, мониторинг изменений костно-мышечных систем, коррекция питания и когнитивных отклонений, лечение эндокринологической патологии, хирургические вмешательства. 31 ТРУДНОСТИ ДИАГНОСТИКИ 2008 г. данные электронейромиографии: признаков органического поражения мотонейронов спинного мозга и данных за миопатию не получено. Пациенту поставлен диагноз: Детский церебральный паралич. Атонически-астатическая форма. Задержка психомоторного развития. Задержка психоречевого развития. Двухсторонний крипторхизм. Рекомендовано МРТ головного мозга. В октябре 2009 г. производилось низведение правого яичка. Осмотр эндокринологом: гипогонадизм, задержка роста, синдром Прадера-Вилли? В январе 2010 г. проведен молекулярно-цитогенетический анализ. Результат: FISH-исследование , ishdel (15) (g 11-g11.3) (d15 SIO -) (D15 S11-)( SNRPN-) GABRB3-). Заключение: молекулярно-цитогенетический анализ проведен на лимфоцитах периферической крови пациента с использованием локус-специфических ДНК-зондов . Подтверждено наличие делеции g11-13 15 хромосомы, что соответствует диагнозу синдром Прадера-Вилли. Случай множественной миеломы, выявленной в стадии терминальной почечной недостаточности Трудный пациент № 12, ТОМ 10, 2012 И.Т.Муркамилов, Р.Р.Калиев Кыргызская государственная медицинская академия им. И.К.Ахунбаева Национальный Центр кардиологии и терапии им. академика Мирсаида Миррахимова, Бишкек, Кыргызстан 32 Медико-социальная значимость данной патологии обусловлена персистирующим течением заболевания, широкой вариабельностью симптомов, часто поздним развитием специфических клинических проявлений, а также низким уровнем качества жизни больных миеломной болезнью при среднем сроке выживаемости не более 3–5 лет. Ключевые слова: множественная миелома, миеломная нефропатия, почечная недостаточность. Заключение Данными клиническими примерами мы хотели подчеркнуть трудности диагностики синдрома ПрадераВилли. В обоих случаях дети наблюдались эндокринологом и неврологом, исключались эндокринологическая и неврологическая патология. Генетики проявили формальный подход к диагностике заболевания. Выявление синдрома Прадера-Вилли у пациентов не является основанием для наблюдения только эндокринологом. По мере роста и развития ребенка необходим контроль и других специалистов, в том числе неврологов. Литература 1. Все про гены. (www.vse-pro-geny.com). Генетические заболевания. Статья синдром Прадера-Вилли. 2. Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е.. Наследственные синдромы и медико-генетическое консультирование. «Практика» 1996; 228. 3. Артамонов Р.Г. Редкие болезни в педиатрии. Дифференциально-диагностические алгоритмы. «ГЭОТАР-Медиа» М.: 2007; 46–47. 4. Тейлор Р.Б. Трудный Диагноз. Том 2. М.: «Медицина» 1992; 338. The case of multiple myeloma diagnosed at the stage of severe renal failure I.T.Murkamilov, R.R.Kaliev I.K.Akhunbaev Kyrgyzstan State Medicine Academy M.Mirrakhimov Cardiology and Internal Medicine National Center, Bishkek, Kyrgyzstan Medical and social importance of multiple myeloma is due to persistent course, wide symptoms, often late developing of specific clinical signs, as well as low quality of life in patients with multiple myeloma and median survival of less than 3-5 years. Keywords: multiple myeloma, myeloma nephropathy, renal failure. Введение Множественная миелома (ММ) представляет собой перманентно прогрессирующую опухоль, характеризующуюся инфильтрацией костного мозга плазматическими клетками, наличием моноклонального иммуноглобулина в сыворотке крови и моче, а также сопровождающуюся остеолитическими поражениями костей [1–3, 12, 15, 28]. Термин «множественная миелома» был предложен в 1873 г. Сведения об авторах: Муркамилов Ильхам Торобекович – аспирант кафедры терапии общей практики с курсом семейной медицины Кыргызской государственной медицинской академии им. И.К.Ахунбаева Калиев Рысбек Рысмамбетович – д.м.н. профессор зав. кафедрой терапии общей практики с курсом семейной медицины Кыргызской государственной медицинской академии им. И.К.Ахунбаева ОНКОЛОГИЯ при этом она длительное время остается единственным проявлением болезни [16, 25]. Потеря белка с мочой до нефротического уровня при ММ не сопровождается отеками, гипопротеинемией, гиперхолестеринемией [17, 21]. Известны случаи, когда упорная, стойкая протеинурия была единственным симптомом миеломной болезни на протяжении многих лет. Иногда протеинурия может задолго предшествовать появлению других симптомов этой болезни. В подобных случаях заболевание долго протекает под маской хронического гломерулонефрита с изолированным мочевым синдромом. Миеломная нефропатия является важнейшим неблагоприятным прогностическим фактором и одинаково уменьшает выживаемость пациентов при различных стадиях заболевания [18, 26, 31]. При этом бета 2-микроглобулин может служить ранним маркером ПН [19, 20, 27]. Несмотря на активное изучение и множество проведенных исследований, по настоящее время остается неясным, что является причиной этого заболевания, и как можно предотвратить его развитие. Клинический случай. Наблюдался пациент с множественной миеломой, выявленной в стадии ПН. Больной К., 53 года, поступил в клинику 24.11.10 г. с жалобами на одышку в покое, усиливающуюся при малейшей нагрузке, локальные боли в тазобедренном и плечевом суставах слева, тошноту, рвоту, периодически возникающие отеки на правой руке. В анамнезе: в 1985 г. при проведении планового обследования было выявлено повышение АД до 140/90 мм рт. ст., была рекомендована немедикаментозная терапия. Далее при периодическом наблюдении отмечалось повышение АД до 160/100 мм рт ст. В 1997 г. после перенесенного ОРВИ появились гематурия, отеки и стойкое повышение АД. При обследовании в отделении нефрологии было выявлено повышение СОЭ до 65 мм/ч, гемоглобина – 145 г/дл. Других изменений в общем анализе крови (ОАК) обнаружено не было. Также отмечалась гиперхолестеринемия (6,5 ммоль/л), суточная протеинурия составляла – 1562 мг с сохранной скоростью клубочковой фильтрации (СКФ) – 80 мл/мин. При УЗИ исследовании структурной патологии внутренних органов не выявлено. Деструктивных изменений костей черепа и таза также не наблюдалось. На основании полученных данных был выставлен диагноз: хронический гломерулонефрит гипертоническая форма. В отделении и амбулаторно проводилась коррекция АД b-адреноблокаторами (атенолол) и игибиторами ангиотензинпревращающего фермента (моноприл). При обследовании в динамике в 2000 г. отмечено нарастание степени протеинурии до 4134 мг/сут с сохранной азотовыделительной функцией почек (креатинин сыворотки крови – 83 мкмоль/л). В ОАК: гемоглобин – 162 г/дл, СОЭ составила 30 мм/ч. С 2007 г. отмечено увеличение лимфатических узлов (подчелюстных) и повышение креатинина сыворотки крови до 148 мкмоль/л, который в 2009 г. вырос до 259 мкмоль/л. Тогда же было выявлено снижение СКФ до 27,3 мл/мин и гемоглобина до 117 г/дл. СОЭ составила 78 мм/ч. Однако при исследовании мочи белок Бенс-Джонса обнаружен не был. На фоне проводимой терапии сохранялись стабильное повышение СОЭ, креатинина сыворотки крови и анемия, несмотря на прием рекомбинантного человеческого эритропоэтина (рекормон). В августе 2010 г. перенес пневмонию нижней доли справа, антибактериальную терапию получал амбулаторно. Трудный пациент № 12, ТОМ 10, 2012 Джон Рустицким. Связь этого заболевания с патологией плазматических клеток впервые обнаружил Райт в 1900 г. ММ встречается преимущественно у лиц мужского пола, редко у женщин, течение болезни у которых более доброкачественное [4–6]. Своевременная и правильная диагностика миеломной болезни и ее осложнений остается краеугольным камнем современной онкогематологии и терапии. Известно, что до момента установления диагноза в течение многих месяцев и даже лет такие часто встречающиеся симптомы, как протеинурия, персистирующее повышение СОЭ ретроспективно могут быть однозначно расценены как проявления ММ [7, 29, 30]. Заболеваемость ММ составляет 1% от всех случаев онкологических заболеваний, а в структуре гемобластозов до 15% [7, 8, 27, 30]. Ежегодно в Европейских странах регистрируются четыре новых случая на 100 000 населения [8, 17, 19]. Заболеваемость ММ в России составляет 1,2 на 100 000 населения [9]. По данным отдельных авторов [10, 11], распространенность ММ в Амурской области России находится на 4-м месте в структуре гемобластозов и составляет 1,4 случая на 100 тыс населения. В Украине заболеваемость ММ составляет 2,4 случая на 100 тыс человек [12]. По данным Durie B.G [13], распространенность ММ среди афроамериканцев составляет 10–12 и до 0,5 – 1 случаев на 100 тыс человек – у жителей Азии. Клиническая картина ММ в ее развернутой стадии складывается из ряда синдромов: костного, почечного, анемического и геморрагического. Рентгенологически в костях выявляется остеопороз с очагами деструкции, однако в некоторых случаях изменения костей отсутствуют. Плазматические клетки вырабатывают цитокины, они стимулируют рост и активность остеокластов, деятельность которых приводит к разрушению костей (резорбции). Развитие остеопорозов и остеодеструкции под влиянием остеокласт-стимулирующего фактора при ММ сопровождается повышением содержания кальция в сыворотке крови, которое в развернутой стадии заболевания наблюдается у всех больных с частым присоединением такого грозного осложнения как остеолиз [14, 22, 32]. При утрате более 30% массы костной ткани у больных могут отмечаться тяжелый остеопороз или очаги разрушения костной ткани, которые на рентгеновских снимках костей проявляются в виде «дыр». Эти изменения могут привести к снижению прочности скелета и способствовать развитию переломов. Другим органом, который наиболее часто поражается при ММ, является почка. Поражения почек при ММ – миеломная нефропатия («cast nephropathy») – обусловлены нефротоксичностью легких цепей иммуноглобулинов, гиперкальциемией, гиперурикемией и отложением аномального парапротеина. В исследованиях последних лет в генезе миеломной нефропатии большая роль отводится легким цепям иммуноглобулинов. Находящиеся в плазме крови легкие цепи иммуноглобулинов фильтруются через почки, повторно поглощаются и катаболизируются в почках. Дальнейшее повреждение канальцев ведет к образованию белковых цилиндров, а также реабсорбции белка В1. Таким образом, развивается воспаление с последующим фиброзом и почечной недостаточностью (ПН). Клинически миеломная нефропатия проявляется упорной, изолированной, значительной протеинурией с постепенным переходом в хроническую ПН [15, 23, 24, 29]. Однако иногда в 9–12,5% случаев ММ дебютирует с тяжелой ПН, требующей заместительной почечной терапии, 33 ТРУДНОСТИ ДИАГНОСТИКИ Трудный пациент № 12, ТОМ 10, 2012 34 21 ноября 2010 г. с нарастающими признаками ПН поступил в Национальный Центр кардиологии и терапии имени академика Мирсаида Миррахимова. При осмотре выявлены бледность, сухость кожи и слизистых оболочек, дефицит массы тела (65 кг при росте 182 см), ортопноэ, отеки на голенях, стопах, в правой верхней конечности и передней брюшной стенки. Увеличенные лимфоузлы подчелюстной области слева, не спаянные с кожей, безболезненные, туго-эластичной консистенции. Органы дыхания и кровообращения без особенностей. АД сидя – 130/80 мм рт. ст., стоя – 120/80 мм рт. ст., пульс – 76 уд/мин. Язык влажный, чистый. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Симптом поколачивания по XII ребру – отрицательный с обеих сторон. При обследовании в ОАК выявлены: признаки анемии (эритроциты – 2,5¥1012/л, гемоглобин – 68 г/дл, цветовой показатель – 0,8, ретикулоциты – 8%, гематокрит – 20%), повышение СОЭ – 70 мм/ч, лейкоцитоз – до 9,9¥109/л с палочкоядерным сдвигом влево до 12%. Морфология эритроцитов характеризовалась уменьшением среднего диаметра эритроцитов до 4,3 мкм . Содержание железа в сыворотке крови составило 7 мкмоль/л. На фоне терапии рекормоном и препаратами железа в динамике повышение уровня гемоглобина не отмечалось, сохранялось повышение СОЭ – до 75 мм/ч. Лейкоцитоз на фоне антибактериальной терапии несколько уменьшился до 9,0¥109/л, со снижением палочкоядерных клеток до 8%. В общем анализе мочи выявлено снижение удельного веса (1007), протеинурия (2617 мг/л), цилиндрурия и белок Бенс-Джонса. В динамике, несмотря на проводимую терапию, отмечалось нарастание протеинурии до 7500 мг/л и лейкоцитурии до 6250 в 1 мл мочи. Кроме того, наблюдались гиперкалиемия (6,6 ммоль/л), азотемия (креатинин 654 мкмоль/л), падение СКФ до 11,63 мл/мин и прирост суточной протеинурии до 8246 мг в сочетании с гиперфибриногенемией (7770 мг/л). При электрофорезе белков сыворотки крови на фоне нормального содержания общего белка отмечалось снижение фракции альбуминов и повышение глобулинов за счет b- и g-глобулинов. Было проведено исследование показателей иммунного статуса, где отмечалось значительное повышение концентрации в крови иммуноглобулина (Ig) G – 28,0 мг/мл (норма – 5,3–16,5 мг/мл), при умеренном увеличении содержании Ig М класса до 3,0 мг/мл. Учитывая что, у больного отмечалось стабильное повышение СОЭ, дефицит массы тела, лимфоаденопатия в подчелюстной области и резистентная к терапии протеинурия, развившаяся гипохолестеринемия (2,0 ммоль/л) были проведены анализы на специфические процессы (бруцеллез и туберкулез), были получены отрицательные результаты. Показатели кислой, щелочной фосфатазы, лактатдегидрогеназы и уровень печеночных трансаминаз были в пределах нормы. Со стороны сердечно-сосудистой системы на эхокардиографии было выявлено уплотнение створок аортального клапана, умеренная систолическая дисфункция левого желудочка (фракция выброса 56%) при нормальных показателях толщины стенок сердца. Из за выраженных отеков на нижних конечностях, резистентных к диуретикам, была проведена допплерография сосудов нижних конечностей, где выявлен выраженный лимфостаз с обеих сторон. Учитывая обнаружение белка Бенс-Джонса в моче для исключения миеломной нефропатии больному была проведена рентгенография плоских костей и компьютерная томография костей таза, где в боковой проекции черепа выявлены множественные очаги деструкции различной величины в передней, средней и задней ямках. Локальных патологических образований в тазобедренных суставах и позвоночнике обнаружено не было. В последующем больному после консультации гематолога проведена стернальная пункция. При исследовании костного мозга отмечалось увеличение числа плазматических клеток до 38% на фоне обильного клеточного пунктата и выраженного сужения гранулоцитарного ростка костного мозга, а также обнаружение продуктов катаболизма легких цепей иммуноглобулинов, происходящих в почках, что позволило выставить следующий клинический диагноз: Множественная миелома IIIВ, терминальная стадия. Хроническая болезнь почек 5 стадия. Хроническая почечная недостаточность, терминальная стадия. Гиперкалиемия. Больной был переведен в стационар гематологического профиля. В гематологическом центре была проведена специфическая терапия с использованием химиотерапии комбинированного режима VAD. Однако в связи с нарастающей азотемией, пациент был переведен в отделение гемодиализа. 27 декабря 2010 г. при подключении к аппарату «искусственная почка» у больного развилась фибрилляция желудочков. Реанимационные мероприятия оказались безуспешными, была констатирована биологическая смерть. Таким образом, можно констатировать наличие случая, довольно редко встречающейся множественной миеломы, дебютировавшей с поражения почек и длительной протеинурией, однако специфические симптомы ММ (белок Бенс–Джонса и остеодеструкция) были выявлены только на стадии тяжелой ПН. Учитывая документированные выпиской из медицинского учреждения указания на упорную протеинурию, стабильное повышение СОЭ, а также регулярное лечение на протяжении ряда лет, раннее развитие анемии, не коррелирующее с азотемией, и флюктуация количества гемоглобина, несмотря на длительный прием эритропоэтина (около года), у пациента имелась ММ, протекавшая под маской хронического гломерулонефрита [14, 23]. В связи с вышеизложенным надо полагать, что прогноз течения болезни данного пациента определялся в основном темпами нарастания ПН [26, 31]. На наш взгляд, данный клинический случай демонстративен, как вариант течения ММ с поздним развитием таких специфических симптомов, как белок Бенс–Джонса в моче и остеодеструкции. Литература 1. Нефрология: Руководство для врачей. Под ред. Тареевой Е.И. М.: 2000; 688. 2. Комаров Ф.И., Хазанов А.И., Калинин А.В. Диагностика и лечение внутренних болезней. М.: 1999; 3: 403–410. 3. Мухин Н.А. Нефрология. Национальное руководство. М.: ГЭОТАР-Медиа. 2009; 720. 4. Рябов СИ. В кн. Внутренние болезни. Учебник для вузов. СПб.: СпецЛит 2004; 661–665. 5. Белова А.В., Боженова Л.М., Костина О.А. и соавт. Изучение факторов прогноза выживаемости больных с множественной миеломой в условиях городской многопрофильной больницы. Здравоохранение Дальнего Востока. 2009; 2: 50–52. 6. Вотякова О.М., Османов Д.Ш., Демина Е.А. и др. Использование велкейда при множественной миеломе. Тер. Арх. 2007; 7: 70–74. ОНКОЛОГИЯ 21. Gu M., Wilton R., Stevens F.J. Diversity and diversification of light chains in myeloma: the specter of amyloidogenesis by proxy. Contrib. Nephrol. 2007; 153: 156–181. 22. Гельцер Б.И., Кочеткова Е.А., Жилкова Н.Н. и др. Патофизиологические и терапевтические аспекты поражения костей при множественной миеломе. Клиническая медицина. 2009; 12: 14–19. 23. Herrera G.A., Joseph L., Gu X. et al. Renal pathologic spectrum in an autopsy series of patients with plasma cell dyscrasia. Arch. Pathol. Lab. Med. 2004; 128 (8): 875–879. 24. Кобзева И.В., Тепляков В.В., Карпенко В.Ю. и др. Комплексный подход к лечению больных множественной миеломой. Тер. Арх. 2008; 7: 70–72. 25. Митина Т.А., Голенков А.К. Клиническая характеристика кумулятивного эффекта велкейда при резистентной и рецидивирующей множественной миеломе. Тер. Арх. 2008; 7: 48–50. 26. Антипова Л.Г. Факторы прогноза терапии при миеломной болезни. Тер. Арх. 1983; 8: 59–63. 27. Андреева Н.Е. Вялотекущая множественная миелома (smoldering, indolent multiple myeloma). Тер. Арх. 1983; 8: 55–59. 28. Eleutherakis-Papaiakovou V., Bamias A., Gika D. et al. Greek Myeloma Study Group. Renal failure in multiple myeloma: incidence, correlations, and prognostic significance. Leuk. Lymphomaю 2007; 48 (2): 337–341. 29. Бирюкова Л.С., Никитина Е.А., Рехтина И.Г. и др. Первичная структура вариабельного региона легких цепей в патогенезе миеломной нефропатии. Гематология и трансфузиологияю.2009; 6: 28–33. 30. Enqvist S., Sletten K., Stevens F. et al. Germ line origin and somatic mutations determine the target tissues in systemic AL-amyloidosisP. LoS ONE. 2007; 2 (10): 981. 31. Рехтина И.Г., Чавынчак Р.Б. Прогностические факторы при множественной миеломе, осложненной почечной недостаточностью. Тер. Арх. 2008; (1): 84–88. 32. Горчакова С.В., Рехтина И.Г., Яцков К.В., и соавт. Болезнь депозитов моноклональных иммуноглобулинов как редкий вариант поражения почек при множественной миеломе. Тер. Арх. 2009; (7): 78–82. Трудный пациент № 12, ТОМ 10, 2012 7. Шулутко Б.И., Макаренко С.В. Стандарты диагностики и лечение внутренних болезней. ЭЛБИ. СПб.; 2007; 381–384. 8. Антипова Л.Г., Андреева Н.Е. Высокая продолжительность жизни при миеломной болезни. Тер. Арх. 1985; 7: 7–14. 9. Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и в странах СНГ в 2000 г. М.: РАМН РОНЦ им. Н.Н.Блохина; 2002. 10. Ландышев Ю.С., Войцеховский В.В. Современные аспекты диагностики и лечения множественной миеломы. Новые Санкт-Петербургские врачебные ведомости. 2006; 4: 18–22. 11. Андреева Н.Е. К вопросу о возможности полного выздоровления при множественной миеломе. Тер. Арх. 1985; 7: 7–11. 12. Новак В.Л. Гематология в Украине: проблемы, перспективы развития. Мистецтво лікування. 2006; 1 (27): 9–11. 13. Durie B.G.M. Patient Handbook Multiple Myeloma (Cancer of the Bone Marrow). International Myeloma Foundation. Edition 2008; 44. 14. Варшавский В.А., Бирюкова Л.С., Рехтина И.Г. и др. Обратимость тяжелой почечной недостаточности при миеломной болезни. Нефрология и диализа. 2009; 3: 257–262. 15. Рехтина И.Г., Бирюкова Л.С., Варшавский В.А. и др. Множественная миелома у реципиентов почечного трансплантата. Тер. Арх. 2010; 7: 76–79. 16. Torra R., Blade J., Cases А. et al. Patients with multiple myeloma requiring long-term dialysis: presenting features, response to therapy, аnd outcome in a series of 20 cases. Br. J. Haematol. 1995; 91: 854–859. 17. Randles E.G., Thompson J.R., Martin D.J., Ramirez-Alvarado M. Structural alterations within native amyloidogenic immunoglobulin light chains. J. Mol. Biol. 2009; 389: 199–210. 18. Щербакова Е.О., Ватазин А.В., Прокопенко Е.И. и др. Трудности диагностики множественной миеломы, дебютировавшей синдромом ОПН. Нефрология и диализ. 2006; 4: 370–374. 19. Бирюкова Л.С., Рехтина И.Г. Поражения почек при моноклональных иммуноглобулинопатиях. Тер. Арх. 2006; 12: 91–94. 20. Sanders P.W. Myeloma kidney. Kidney. Int 1993; 25: 1–7. 35 НОВОСТИ МЕДИЦИНЫ Трудный пациент № 12, ТОМ 10, 2012 36 Компания «Новартис Фарма» и Страховая Группа «УРАЛСИБ» запустили первый в России проект, основанный на принципах персонализированной медицины 19 декабря 2012 г. – компания «Новартис Фарма» и Страховая Группа «Уралсиб» представили общественности первый в России проект, основанный на принципах персонализированной медицины для пациентов с рассеянным склерозом. Данный проект имеет своей целью предоставление качественной сервисной поддержки и комплексного медицинского сопровождения пациентов с рассеянным склерозом, которые начинают прием инновационного препарата «Гилениа» по показанию лечащего врача. Проект является уникальным в своем роде, так как впервые в российской практике пациенты с диагнозом рассеянный склероз получат доступ через систему добровольного медицинского страхования к современным клиникам и лабораториям высокого уровня, что обеспечит удобную терапию, регулярное наблюдение и необходимые лабораторные исследования. Программа состоит из трех этапов. Первый этап – обследование для подтверждения отсутствия противопоказаний и выявления возможных факторов риска возникновения нежелательных явлений при приеме «Гилениа». Второй этап – мониторинг состояния пациента в день первого приема препарата. Третий – дальнейшее сопровождение, предусматривающее ежемесячную диагностику состояния пациентов, проходящих терапию с помощью «Гилениа». В основе программы лежит страховая схема, в которой задействовано более трех тысяч медицинских учреждений по всей стране, что позволит пациентам с рассеянным склерозом получать доступ к дополнительным сервисам, необходимым для эффективного проведения терапии. В частности, это лабораторные обследования, электрокардиография (ЭКГ), при необходимости вакцинация против ветряной оспы, консультация кардиолога, офтальмолога, 6-часовой мониторинг после приема первой дозы и т.д. Выбор заболевания данного проекта объясняется целым рядом факторов. Рассеянный склероз – это заболевание, относящееся к разряду особо тяжелых. Сегодня в мире насчитывается около 3 млн пациентов с диагнозом рассеянный склероз, в России заболеваемость составляет от 30 до 100 случаев на 100 000 населения. По данным Минздрава, в России официально зарегистрировано 50 тысяч больных с диагнозом рассеянный склероз. Социальная значимость заболевания также подчеркивается тем, что страдают им молодые, трудоспособные люди возраста 20–45 лет, чаще женщины, и половина пациентов через 10–15 лет после начала заболевания имеет высокие риски инвалидизации. «Подобные проекты, как, например, программа по Гилении, являются частью стратегии «Новартис», направленной на поддержку мер Правительства РФ по улучшению качества медицинского обслуживания и системы здравоохранения в России. Для реализации этих целей мы активно сотрудничаем как с Правительством и регионами, так и частными компаниями. В данном случае нашим партнером стала Страховая Группа «УРАЛСИБ». Мы уверены, что благодаря нашим совместным усилиям нам удастся повысить общую результативность терапии и в результате повысить качество жизни пациентов с рас- сеянным склерозом», – прокомментировал запуск проекта Вадим Власов, президент группы компаний «Новартис» в России. «До недавнего времени отсутствовали успешные стратегии лечения рассеянного склероза. Однако с внедрением инновационных препаратов нового поколения ситуация изменилась радикальным образом – говорит Алексей Бойко, Президент Российского комитета исследователей рассеянного склероза (РОКИРС). – Вместе с тем, необходимо понимать, что применение мощных высокотехнологичных препаратов, изменяющих ход заболевания, сопряжено с целым рядом рисков. Внедрение программ поддержки пациентов на основе принципов персонализированной медицины позволяет если не избежать осложнений полностью, то, во всяком случае, минимизировать риски насколько это возможно». Фулвестрант (Фазлодекс) в дозировке 500 мг увеличивает медиану общей выживаемости на 4,1 месяца по сравнению с дозировкой 250 мг Лечение эстрогенрецепторпозитивного местнораспространенного (после прогрессирования на адъювантной эндокринной терапии) или метастатического рака молочной железы (после одной линии эндокринной терапии), у женщин в постменопаузе фулвестрантом, в дозировке 500 мг, повышает выживаемость, по сравнению с дозировкой 250 мг, что подтверждают результаты сравнительного клинического исследования III фазы CONFIRM. Об этом объявил доктор Ангело Ди Лео, директор онкологического медицинского центра «Сандро Питильяни» (Sandro Pitigliani Medical Oncology Unit) на Симпозиуме по вопросам терапии рака молочной железы в Сан-Антонио – крупнейшей конференции, собравшей на одной площадке порядка 10 тыс специалистов по лечению рака молочной железы более чем 100 стран мира. Результаты окончательного анализа общей выживаемости пациентов, принявших участие в исследовании, свидетельствуют о том, что изменение дозировки фулвестранта 250 мг на 500 мг снижает риск летального исхода на 19% . При приеме фулвестранта, в дозировке 500 мг, медиана общей выживаемости составила 26,4 мес, а при дозировке 250 мг – 22,3 мес (относительный риск = 0,81; доверительный интервал 95% к 0,96; p=0,016). Доктор Ангело Ди Лео: «Мы очень довольны полученными результатами; они убедительно свидетельствуют о том, что прием фулвестранта, в дозировке 500 мг, увеличивает медиану общей выживаемости на 4,1 месяца и снижает риск летального исхода на 19% по сравнению с дозировкой 250 мг. Эти данные соответствуют результатам анализа медианы выживаемости на предыдущих этапах исследования, что позволяет нам сделать уверенный вывод о более высокой эффективности этого метода лечения». Юрий Руказенков, доктор медицины, директор по медицинской науке «АстраЗенека»: «В структуре онкологической заболеваемости женщин во всем мире рак молочной железы по-прежнему стоит на первом месте. Полученные результаты клинических исследований подтверждают важную роль фулвестранта, в дозировке 500 мг, в борьбе с этим страшным недугом». НОВОСТИ МЕДИЦИНЫ CONFIRM – это двойное слепое рандомизированное многоцентровое клиническое исследование III фазы. В ходе исследования CONFIRM, сравнивалась эффективность препарата Фазлодекс в дозировке 500 мг (n=362) и 250 мг (n=374) для лечения эстрогенрецептор-позитивного местно-распространенного или метастатического рака молочной железы у женщин в постменопаузе, которые уже получали одну линию эндокринотерапии или эндокринную терапию адъювантно. Компания «Сандоз» приняла участие в третьей Междисциплинарной Международной конференции Manage Pain 2012 В гостинице Холидей Инн Сокольники 9–10 ноября прошла третья Междисциплинарная Международная конференция Manage Pain 2012 (Управляй болью!). В мероприятии приняли участие ведущие российские и международные неврологи, терапевты, анестезиологи, ревматологи, психиатры, урологи, гастроэнтерологи, эндокринологи и врачи других специальностей. Одним из основных событий конференции стал сателлитный симпозиум «Здесь и Сейчас!» компании «Сандоз», который был посвящен многообразию форм препарата Кетонал®, используемых при лечении различных состояний с острой болью у пациентов, а также проблеме неправильного исполь- зования медикаментов и особенности терапии острого болевого синдрома. Препараты данной группы обычно используются при острых и хронических заболеваниях сопровождающихся болью и воспалением. В настоящее время проводятся исследования, целью которых является определение влияния НПВП на колоректальный рак, и сердечно-сосудистые заболевания. В симпозиуме приняли участие более 500 врачей со всей России, перед которыми выступили М.Л.Кукушкин, проф., д.м.н., зав. лаб. Патофизиологии боли НИИ общей патологии и патофизиологии боли РАМН; Е.Г.Филатова, проф., д.м.н., главный врач Клиники головной боли и вегетативных расстройств имени академика А.Вейна; А.Б.Данилов, д.м.н., проф. каф. нервных болезней факультета последипломного профессионального обучения ПМГМУ им. И.М.Сеченова, и А.Л.Верткин, проф., д.м.н., зав. каф. клинической фармакологии ММСУ. Кетонал® (Кетопрофен) выделяется в группе универсальных НПВП за счет максимальной выраженности обезболивающего эффекта и хорошим профилем безопасности, его анальгетический эффект сопоставим с силой опиоидных препаратов – не случайно Кетонал® (100 мл/2 мл, ампулы) включен в укладки машин скорой помощи. И в США, и в Европе кетопрофен разрешен к применению без ограничений по длительности приема», – говорит Кирко Кирков, представитель Подразделения рецептурных препаратов компании «Сандоз». Трудный пациент № 12, ТОМ 10, 2012 Основные технические требования к статьям, предоставляемым в редакцию журнала «Трудный пациент» 38 Рукопись в электронном варианте должна быть напечатана через 1,5–2 интервала в текстовом редакторе Word. Объем до 20 000 знаков (8–10 листов в текстовом редакторе Word). В выходных данных статьи указываются: название, инициалы и фамилии авторов, их место работы, город, ученая степень, ученое звание, электронный адрес (который указывается в напечатанной статье). Статья должна включать резюме (на русском и английском языках), ключевые слова. Таблицы должны быть пронумерованы последовательно и напечатаны. Фотографии таблиц не принимаются. Каждая таблица должна иметь краткий заголовок, соответствующий содержанию, цифры в таблицах – цифрам в тексте. Пояснения к таблицам даются в сносках, в них следует также раскрыть все нестандартные сокращения, использованные в таблице. В тексте должны быть ссылки на все таблицы. Иллюстрации должны быть выполнены профессионально или представлены в виде четких глянцевых чернобелых фотографий, размером 127¥173 мм (не более 203¥254 мм). Названия и объяснения деталей должны быть даны только в подписях к иллюстрациям, а не на самих иллюстрациях. В тексте статьи обязательны ссылки на рисунок. Таблицы и рисунки не должны дублировать друг друга. Подписи к рисункам делаются на отдельном листе с указанием номера рисунка. Для графиков и диаграмм отмечается, что дано по осям координат на приведенных кривых и т. п. В формулах должны быть четко размечены все элементы: строчные (м) и прописные (М) буквы, синим отмечены латинские буквы, красным – греческие, четко выделяются подстрочные и надстрочные индексы; в случае цифр и букв, сходных по написанию (0 – цифра, О – буква), должны быть сделаны соответствующие пометки. Сокращения и символы должны быть использованы только стандартные. Не использовать сокращения в заглавии и резюме статьи. Все сокращения (за исключением единиц измерения) могут быть использованы только после упоминания полного термина. Цитируемые источники литературы во всех видах публикаций нумеруются в порядке их упоминания в тексте арабскими цифрами и заключаются в квадратные скобки. В библиографическом описании указываются фамилия, инициалы автора, название статьи, журнала, год, том, номер журнала, номера страниц «от» и «до»; в случае монографии – фамилия и инициалы автора (редактора), название, город, издательство, год, количество страниц. Материал не должен содержать более 3 таблиц или рисунков. Статьи, ранее опубликованные или направленные в какой-либо другой журнал или сборник, не должны присылаться.