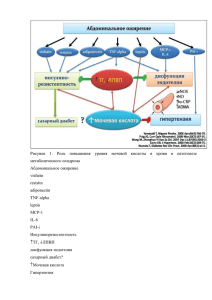
Медицинский алфавит. Современная лаборатория 3 / 2013
реклама

e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 1 2 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 3 4 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru Современная лаборатория № 3 Медицинский алфавит Серия журналов для специалистов № 16 (206) 2013 www.medalfavit.ru Издатель: ООО «Альфмед» Тел.: (495) 616‑48‑00 E‑mail: medalfavit@mail.ru Учредитель и главный редактор издательства ООО «Альфмед»: Т. В. Синицка Адрес редакции: 129344 г. Москва, ул. Верхоянская, д. 18, к. 2 Тел.: (495) 616‑48‑00, 221‑76‑48 E‑mail: medalfavit@mail.ru Главный редактор серии журналов «Медицинский алфавит»: А. С. Ермолов Председатель редакционного совета журнала «Медицинский алфавит» серии «Современная лаборатория»: С. Н. Щербо д. м. н. профессор, заведующий кафедрой клинической лабораторной диагностики ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н. И. Пирогова», г. Москва Руководитель отдела рекламы и маркетинга: Ю. В. Попов medalfavit@bk.ru Руководитель отдела продвижения, распространения, выставочной деятельности и подписки: Ирена Синицка medalfavit_pr@mail.ru Редакция оставляет за собой право сокращения и стилистической правки текста без дополнительных согласований с авторами. Мнение редакции может не совпадать с точкой зрения авторов опубликованных материалов. Редакция не несет ответственности за последствия, связанные с неправильным использованием информации. Журнал зарегистрирован Министерством РФ по делам печати, теле-, радиовещания и средств массовых коммуникаций. Рег. номер ПИ № 77–11514 от 04.01.2002 Уст. тираж 12 000. Формат А4. Цена договорная. При перепечатке ссылка на журнал «МА» обязательна. За содержание рекламы ответственность несет рекламодатель. За достоверность сведений, изложенных в статьях, ответственность несет автор. Наш индекс в каталоге «РОСПЕЧАТЬ» 36228 e-mail: medalfavit@mail.ru Содержание: 6 План мероприятий, проводимых Российской ассоциацией медицинской лабораторной диагностики в 2013 году 7 Роль провоспалительных цитокинов в развитии ишемического тубулярного повреждения почек у больных после аортокоронарного шунтирования И. И. Дементьева, Ю. А. Морозов, М. А. Чарная, В. И. Садовников 12 Современные методологические аспекты лабораторной диагностики системы протеина С и значение её исследования в хирургии В. В. Егорова, М. И. Титова, В. С. Демидова, Ю. А. Амирасланов, Н. Г. Аскеров, А. А. Звягин, Н. А. Назаренко, А. Л. Берковский 18 Новые представления о диабетической нефропатии: гиперфильтрация, прерывистая микроальбуминурия, солевой парадокс В. В. Вельков 38 Индекс гемолиза: от обсуждения к решению проблем преаналитического качества О. А. Клименкова, В. С. Берестовская, Е. С. Ларичева 41 Новые возможности диагностики гепарин-индуцированной тромбоцитопении у кардиохирургических больных О. В. Петрова, Т. Г. Егорова, О. И. Мурыгина, Т. В. Вавилова 46 Значение правильного выбора гематологического анализатора в диагностике изменений показателей крови у лиц старших возрастных групп В. А. Пичковская, Н. И. Сюч, Ю. В. Федечкина 52 Алгоритм выявления носителей менингококка в очаге генерализованной формы менингококковой инфекции И. С. Королева, Т. А. Максина 54 Лабораторный мониторинг профилактики рахита у детей по результатам исследований мочи Д. Ю. Соснин, О. Ю. Ненашева 58 Иммуноферментная тест-система для серодиагностики герпеса II типа Г. В. Ковтонюк, Л. А. Ганова, К. А. Шепелин 62 Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии О. В. Тихомирова, Е. В. Бутырина, Н. Н. Зыбина, М. Ю. Фролова 70 Основные преимущества использования вакуумных систем для взятия крови В. С. Лынёв, Ю. С. Косарева 76 Оборудование ЗАО «КРОНТ-М» для лабораторий 82 Подписка на журнал C 2011 года журнал «Медицинский алфавит» включен в НАУЧНУЮ ЭЛЕКТРОННУЮ БИБЛИОТЕКУ и РОССИЙСКИЙ ИНДЕКС НАУЧНОГО ЦИТИРОВАНИЯ (РИНЦ) Медицинский алфавит. Современная лаборатория 3 / 2013 5 Редакционный совет журнала «Современная лаборатория» серии «Медицинский алфавит» Главный редактор Щербо Сергей Николаевич Вавилова Татьяна Владимировна д. м. н, профессор кафедры клинической лабораторной диагностики ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И. И. Мечникова», г. Санкт-Петербург, vtv.lab@rambler.ru Гильманов Александр Жанович д. м. н., профессор, заведующий кафедрой биохимии и лабораторной диагностики ГОУ ВПО «Башкирский государственный медицинский университет» Минздрава России, г. Уфа, alex_gilm@mail.ru Годков Михаил Андреевич д. м. н., врач высшей категории, руководитель отдела лабораторной диагностики ГБУЗ «НИИ СП им. Н. В. Склифосовского», г. Москва, mgodkov@yandex.ru Долгих Татьяна Ивановна д. м. н., профессор, заведующий центральной научноисследовательской лабораторией и руководитель академического центра лабораторной диагностики Омской государственной медицинской академии, г. Омск, prof_dolgih@mail.ru Косырев Александр Борисович к. м. н, доцент кафедры биохимии РМАПО, генеральный директор ООО ТПО «Медиолаб», г. Москва, mediolab@mail.ru Первушин Юрий Владиславович к. м. н., профессор, заведующий кафедрой клинической лабораторной диагностики с курсом бактериологии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Минздрава России Полонский Виталий Олегович к. м. н., старший региональный менеджер ЗАО «Вектор-Бест-Европа» (московское представительство ЗАО «Вектор-Бест»), г. Москва, pvovp@ya.ru Тарасенко Ольга Анатольевна д. м. н., ФГУЗ «Головной центр гигиены и эпидемиологии» ФМБА России (ГЦГиЭ), зам. главного врача, г. Москва, dvoryanka@mail.ru Терёхина Наталья Александровна д. м. н., профессор, заведующий кафедрой биохимии Пермской государственной медицинской академии им. академика Е. А. Вагнера, г. Пермь Шипулин Герман Александрович к. м. н., руководитель отдела молекулярной диагностики и эпидемиологии ФГУН «ВНИИ эпидемиологии» Роспотребнадзора России, г. Москва, german@pcr.ru Щербо Сергей Николаевич д. м. н. профессор, заведующий кафедрой клинической лабораторной диагностики ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н. И. Пирогова», г. Москва Эмануэль Владимир Леонидович д. м. н., профессор, заведующий кафедрой клинической лабораторной диагностики с курсом молекулярной медицины, директор научно-методического центра Минздрава России по молекулярной медицине на базе СПбГМУ им. И. П. Павлова, вицепрезидент Российской ассоциации медицинской лабораторной диагностики, главный специалист-эксперт по клинической лабораторной диагностике Росздравнадзора по Северо-Западному федеральному округу, г. Санкт-Петербург, vladimirem1@gmail.com РОССИЙСКАЯ АССОЦИАЦИЯ МЕДИЦИНСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ План мероприятий, проводимых Российской ассоциацией медицинской лабораторной диагностики в 2013 году 01–03 октября 2013, СК «Олимпийский», г. Москва 27–30 октября 2013, Бали, Индонезия XVII Форум «Национальные дни лабораторной медицины России–2013» 13th Asia-Pacific Federation for Clinical Biochemistry and Laboratory Medicine Congress Организатор: Научно-практическое общество специалистов лабораторной медицины, Российская ассоциация медицинской лабораторной диагностики Организатор: IFCC 03 октября 2013, СК «Олимпийский», г. Москва Симпозиум с международным участием: «Вакуумные системы для взятия крови: актуальные вопросы и практические решения» 22–26 июня 2014, Стамбул, Турция IFCC-WorldLab 2014–21st International Congress of Clinical Chemistry and Laboratory Medicine Организатор: IFCC Организатор: Becton Dickinson 23–24 октября 2013, г. Челябинск Научно-практическая конференция «Современные лабораторные тесты: новые технологии и клиническая значимость» и специализированная выставка «Лабмедицина-2013» 119526, Москва, а/я 117 Тел./факс: +7 (495) 433‑24‑04 www.ramld.ru Е‑mail: ramld@ramld.ru Организатор: РАМЛД 6 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru Роль провоспалительных цитокинов в развитии ишемического тубулярного повреждения почек у больных после аортокоронарного шунтирования И. И. Дементьева, д. б. н., проф., рук. лаборатории экспресс-диагностики Ю. А. Морозов, к. м. н., вед. научный сотрудник лаборатории экспресс-диагностики, А. В. Гончарова, врач лаборатории экспресс-диагностики М. А. Чарная, д. б. н., главный научный сотрудник лаборатории экспресс-диагностики В. И. Садовников, д. м. н., проф., главный научный сотрудник лаборатории интраоперационной диагностики отдела лучевой и функциональной диагностики ФГБУ «Российский научный центр хирургии им. академика Б. В. Петровского» РАМН, г. Москва Role of proinflammatory cytokines in renal tubular damage in patients undergoing coronary artery bypass grafting I. I. Dementieva, Yu. A. Morozov, A. V. Concharova, M. A. Charnaya, V. I. Sadovnikov Petrovsky National Research Centre for Surgery under the Russian Academy of Medical Sciences, Moscow, Russia Резюме В статье приводятся данные об изучении провоспалительных цитокинов у больных после аортокоронарного шунтирования. Показано, что развивающееся к концу операции ишемическое повреждение эпителия почечного канальца в первую очередь обусловливает его функциональную неполноценность, что выражается в значительном возрастании уровня NGAL в крови. Гибель тубулярных эпителиоцитов сопровождается макрофагально-нейтрофильной инфильтрацией почечных канальцев, которая определяется высокими уровнями ИЛ-6, ИЛ-8 и ИЛ-18 (первая волна апоптоза на первые сутки после операции). Вторая волна апоптоза развивается на седьмые сутки и обусловливает вторичное повышение ИЛ-6, ИЛ-8 и ИЛ-18. Изменения МСР-1/креатинин отражают динамику инфильтрации моноцитами тубулярной ткани. Отсутствие значимых изменений показателей ФНО-α/креатинин и ИЛ-1β/креатинин говорит за альтернативный путь активации системы комплемента с развитием воспалительной реакции в тубулярном аппарате без местного усиления синтеза ФНО-α и ИЛ-1β. Summary The article presents data on the study of pro-inflammatory cytokines at patients after coronary arteries bypass grafting. It is shown that developing operation by the end of ischemic renal tubule epithelial damage primarily determines its functional deficiency, resulting in a significant increase of blood NGAL level NGAL. The loss of tubular epithelial cells is accompanied by neutrophil infiltration of macrophage-tubule, which is defined by high IL-6, IL-8 and IL-18 levels (the first apoptosis wave at 1st day after operating). The second apoptosis wave develops at day 7th and causes a secondary increase IL-6, IL-8 and IL-18 levels. The changes reflect the dynamics of MCP-1/creatinine infiltration by monocytes tubular fabric. The absence of significant changes in the TNF-α/creatinine and IL-1β/ creatinine speake for an alternative pathway of complement activation with the development of inflammatory reaction in the tubular apparatus without amplification of local synthesis of TNF-α and IL-1β. Key words: coronary arteries bypass grafting; cytokines; apoptosis; renal tubules. Ключевые слова: коронарное шунтирование; цитокины; апоптоз; почечные канальцы. Введение Эксперименты на животных и исследования в клинике свидетельствуют, что при повреждении ишемии клеток почечных канальцев большинство клеток остаются жизнеспособными, при этом возможно или полное отсутствие их травмы, либо повреждение не является летальным, и клетки проходят восстановление [2]. Гибель эндотелиоцитов также реализуется через два основных патофизиологических механизма. Первый механизм — некроз, который характеризуется хаотическим течением, потерей целостности мембран клеток, e-mail: medalfavit@mail.ru И. И. Дементьева Ю. А. Морозов цитоплазматическим отеком и целлюлярной фрагментацией. Другой механизм — апоптоз протекает более длительно и для него свойственны фрагментация ДНК, уменьшение объема и вакуолизация цитоплазмы и ядра, постепенное разрушение клеточной мембраны до апоптозных телец, которые выводятся путем фагоцитоза [13, 20]. При ишемии почки эти две формы клеточной гибели могут сочетаться. Однако, несмотря на то, что апоптоз является основным механизмом гибели клеток почечных канальцев при остром повреждении, суще- ствует несколько спорных моментов относительно вклада апоптоза в этот процесс [24]. Во-первых, при апоптозе происходит гибель лишь 3–5 % клеток, что явно недостаточно для развития тяжелых ренальных нарушений. Во-вторых, апоптоз чаще встречается в дистальных, в то время как некроз — в проксимальных канальцах. В-третьих, апоптоз можно рассматривать как физиологический процесс, который удаляет поврежденные клетки и, следовательно, может быть полезным для органа и организма в целом [4]. Однако после ишемического ОПП Медицинский алфавит. Современная лаборатория 3 / 2013 7 Таблица 1 Изменения цитокинов в крови и моче у больных, перенесших коронарное шунтирование (среднее, min, max) До операции Конец операции 1-е сутки 3-и сутки 7-е сутки Кровь Моча Кровь Моча Кровь Моча Кровь Моча Кровь Моча ИЛ-6 4 (2–6) 10,5 (6–20) 52,9 (6–120) 27,1 (6–115) 66,2 (6–180) 61,2 (15–210) 61 (16–120) 13 (6–20) 10,6 (6–16) 29,2 (15–55) ИЛ-8 7,6 (5–18) 19,4 (5–55) 21,1 (5–50) 23,9 (5–65) 17,6 (15–25) 54,4 (15–220) 30,8 (15–90) 35 (15–65) 18,3 (10–35) 80 (15–190) ИЛ-18 69,1 (50–88) 59,9 (30–100) 79,9 (50–120) 58,1 (25–88) 86,9 (65–120) 80,2 (50–135) 90,7 (70–110) 59 (50–78) 97,7 (88–111) 59 (50–65) ИЛ-1β 2,5 (2–3,1) 6,4 (2,5–10,3) 2,6 (1,8–3,1) 5,2 (2,8–9,5) 5,1 (2,5–10) 5,9 (3,7–9,4) 5,3 (2,5–10) 4,7 (2,8–6,8) 5,4 (2,5–13,7) 6,2 (3,6–9,6) ФНО-α 11,0 (10–15) 15,3 (10–18,8) 22,2 (10–40) 18,5 (10–50) 18,2 (10–40) 15,2 (10–25) 11,8 (10–15) 13,7 (10–15) МСР-1 109,9 (35–185) 319 (200–450) 170,9 (103–400) 325,5 (31–2 000) 172,9 (100–321) 532,2 (110–1 050) 186,4 (93–320) 566,1 (250–1 050) 20,6 (12,3–40) 21,9 (11,7–30) 177,3 (100–250) 257,3 (250–269) Примечание: данные представлены как средние (min–max). апоптоз протекает в два этапа: первый начинается через 6–12 часов после повреждения и достигает пика в течение трех дней. В эту фазу происходит нарушение функций в первую очередь здоровых клеток, что сопровождается развитием почечной дисфункции. Второй этап наступает примерно через семь дней, и его роль заключается в удалении отмерших и поврежденных клеток и, следовательно, в восстановлении функции ренального канальца [26]. Цель работы Изучить лабораторные показатели, диагностирующие развитие острого ишемического тубулярного повреждения почек у больных после операции аортокоронарного шунтирования. Материалы и методы Обследованы 18 больных, которым выполнена операция коронарного шунтирования в условиях искусственного кровообращения. Длительность перфузии составила 88,4 ± 10,4 минут, время пережатия аорты — 56,9 ± 11,2 минут, минимальная температура — 35,1 ± 0,5 °C. В крови и моче определяли концентрации интерлейкинов-6 (ИЛ-6, пг / мл), 8 (ИЛ-8, пг/мл), 18 (ИЛ-18, пг/мл), 1β (ИЛ-1β, пг/мл), фактора некроза опухолей-альфа (ФНО-α, пг / мл), моноцитарного хемотаксического белка-1 (МСР1, пг/мл) методом твердофазового «сэндвич»-варианта иммуноферментного анализа с применением моно- и поликлональных антител к соответствующему цитокину (реактивы фирмы «Вектор-Бест», Новосибирск, Россия). На приборах 8 BUN-1 и Crea-2 (фирма Beckman, Германия) измеряли содержание мочевины и креатинина в крови и моче (мг %). Методом иммуноферментного анализа (фирма R&D System, США) в моче определяли концентрацию нейтрофильного желатиназо-ассоциированного липокалина (NGAL, пг/л) как показатель функции почечного канальца, Рассчитывали цитокин-креатининовый коэффициент как отношение концентрации цитокина в моче к креатинину плазмы. Исследование проводили до, в конце операции, на 1-е, 3-и и 7-е сутки после хирургического вмешательства. Для математической обработки результатов исследования использовалась компьютерная программа SPSS for Windows (версия 11). Для проверки вариационных рядов на нормальность распределения применялся тест Шапиро-Уилка. Количественные данные представлены как среднее (минимум; максимум). Достоверность различий определяли по критерию непараметрической статистики Манна-Уитни. Статистическая достоверность присваивалась при значении р < 0,05. Результаты Изменения цитокинов на этапах исследования представлены в таблице 1. Из представленных данных видно, что можно выделить несколько групп цитокинового ответа в крови после операции коронарного шунтирования. Группа 1 — повышение непосредственно в конце операции: ИЛ-6, ИЛ-8, ФНО-α, МСР-1, причем в дальнейшем уровень ИЛ-6 нарастал до трех суток со значительным уменьшением практически Медицинский алфавит. Современная лаборатория 3 / 2013 до исходных величин на седьмые послеоперационные сутки, содержание ИЛ-8 уменьшалось в первые сутки после операции с выраженным подъемом на третьи послеоперационные сутки и повторным снижением к седьмым суткам, хотя и превышая дооперационные значения более чем в два раза. После повышения концентрации ФНО-α на 1–3 сутки она оставалась стабильно повышенной, а на седьмые сутки после хирургического вмешательства возвращалась к исходным величинам. МСР-1 был стабильно повышенным вплоть до седьмых суток после операции. Однако концентрации этих цитокинов в моче максимально повышались не в конце операции, а только на первые послеоперационные сутки и за исключением ФНО-α снижались на третьи и вторично возрастали на седьмые сутки после операции. Группа 2 — повышение на первые сутки после операции: ИЛ-1β — не выявлено возрастания его концентрации в конце операции, в дальнейшем его уровень был более чем в два раза выше дооперационных значений вплоть до седьмых суток. В моче уровень ИЛ-1β, напротив, снижался до третьих послеоперационных суток, а на седьмые сутки после хирургического вмешательства отмечены максимальные величины этого цитокина в моче. Группа 3 — динамическое нарастание концентрации от конца операции до седьмых послеоперационных суток: ИЛ-18. Содержание ИЛ-18 в моче значительно возрастало на первые сутки после операции, а с третьих суток возвращалось к исходным величинам. Выявлена несколько другая динаe-mail: medalfavit@mail.ru мика показателя цитокин в моче / мг креатинина (рис. 1). Видно, что максимальное повышение концентрации NGAL в крови как проявление нарушения функции почечных канальцев определяется непосредственно сразу после хирургического вмешательства. На 1–3 сутки после операции отмечалась практически полная репарация тубулярного аппарата, а в дальнейшем регистрировалось вторичное ухудшение функции ренальных канальцев. При этом ФНО-α/креатинин, ИЛ-1β/креатинин практически не изменялись на всех этапах исследования. В конце операции ИЛ-8/креатинин и ИЛ-6/креатинин находились на дооперационном уровне, ИЛ-18/ креатинин недостоверно увеличивался. На первые сутки после операции эти три показателя значительно повышались по сравнению с исходными значениями, причем максимально возрастали ИЛ-6/креатинин и ИЛ-8/ креатинин. Показатель МСР-1/креатинин достоверно снижался в конце операции со значительным подъемом на первые сутки после хирургического вмешательства. На третьи сутки регистрировалось уменьшение МСР-1/креатинин даже ниже исходных величин, а на седмые сутки — повторное и сопоставимое со значениями на первые сутки возрастание. Обсуждение ФНО-α представляет собой полипептид, продуцируемый моноцитами / макрофагами, эндотелием, в особых случаях активированными Т-лимфоцитами и оказывает цитотоксическое, иммуномодулирующее и провоспалительное действие, способствуя накоплению в крови комплекса свободных радикалов и перекиси водорода [21]. В результате высвобождения ФНО-α повышается проницаемость капилляров, повреждается эндотелий сосудов, и возникает внутрисосудистый тромбоз. Также ФНО-α увеличивает синтез нейтрофилами и моноцитами молекул эндотелиальной лейкоцитарной и внутрисосудистой адгезии. Провоспалительный эффект ФНО-α усиливается тем, что он способен индуцировать синтез других провоспалительных соединеe-mail: medalfavit@mail.ru Рисунок 1. Динамика показателя цитокин в моче/мг креатинин и NGAL в плазме у больных, перенесших коронарное шунтирование. ний, обладающих хемоаттрактивным действием, таких как ИЛ-1, ИЛ-6, ИЛ-8, которые активируют макрофаги и Т-лимфоциты и регулируют миграцию и дегрануляцию нейтрофилов [9]. Другим не менее важным участником процесса воспаления является ИЛ-6, который относится к группе медиаторов доиммунного воспаления и продуцируется в основном Т-лимфоцитами, макрофагами и клетками эндотелия в ответ на прямое раздражение. Гиперпродукция цитокина сочетается с повышенной экспрессией его в канальцах почки, по данным гистохимического анализа нефробиоптатов [25]. Основная функция ИЛ-8 заключается в том, что он активирует нейтрофилы и моноциты и вызывает их хемотаксис в очаг воспаления [19]. Экспериментальные исследования L. Hang с соавт. (2000) установили ведущую роль ИЛ-8-рецепторов в развитии фиброза почечного интерстиция, а дисфункция указанных структур приводила к нарушению трансэпителиальной миграции нейтрофилов и формированию очагов нефросклероза [11]. Провоспалительный цитокин ИЛ1β синтезируется в очаге воспаления в основном активированными макрофагами и является основным медиатором системной воспалительной реакции. ИЛ-1 влияет не только на прогрессирование гломерулопатий, стимулируя синтез молекул межклеточной адгезии, но и на развитие фиброза почечного интерстиция. При этом он усиливает пролиферацию фибробластов, отвечающих на воздействия ИЛ-1 [15]. Экспериментально установлена роль провоспалительного цитокина интерлейкина-18 в реакции повреждения канальцевого эпителия, в процессе которой провоспали­тельный цитокин в больших количествах выделяется с мочой [6]. ИЛ-18 выявляется в моче пациентов с острой почечной недостаточностью ишемического происхождения через 4–6 и пиком через 12 часов после воздействия повреждающего фактора [17]. Кроме диагностической функции, ИЛ-18 может иметь прогностическое значение в отношении продолжительности острой почечной недостаточности и сроков восстановления почечной функции. Проведенное исследование по- Медицинский алфавит. Современная лаборатория 3 / 2013 9 казало, что основные провоспалительные цитокины ФНО-α, ИЛ-6 и ИЛ-8, уровень которых повышается непосредственно после операции, определяют первичный иммунный ответ на ишемическое повреждение тубулярного эпителия, обеспечивая привлечение иммунокомпетентных клеток в очаг асептического воспаления. Интересно отметить, что ИЛ-1β и ИЛ-18 обусловливают непосредственное развитие воспалительного процесса в почечных канальцах уже с первых суток после операции. К настоящему времени установлено, что снижение уровня клубочковой фильтрации связано с тубулоинтерстициальными повреждениями, выраженность и тяжесть которых у пациентов коррелируют с различными формами гломерулита. Установлено, что MCP-1 экспрессирует главным образом тубулярные, а не гломерулярные клетки. Обнаружено, что именно этот цитокин опосредует в первую очередь повреждения канальцев и интерстиция, а не гломерул, способствуя накоплению вблизи клеток канальцевого эпителия активированных макрофагов, повреждающих тубулярные клетки [23]. Значение МСР-1 в развитии тубулоинтерстициальных изменений связано с его способностью привлекать в интерстициальную ткань моноциты — основные клетки в составе инфильтратов почечного интерстиция [3]. Воспалительная реакция играет важную роль в ишемическом повреждении почек. Эндотелиальная дисфункция значительно усиливается генерацией большого количества медиаторов воспалительного ответа — провоспалительных цитокинов (ТНФ-α, ИЛ-6, ИЛ-1β, TGF-β) и цитокинов хемотаксиса (МСР-1, ИЛ-8, RANTES) [14, 18]. Нейтрофилы являются первыми из лейкоцитов, которые определяются в почках после ишемического повреждения. Макрофаги также способны накапливаться в канальцах почек, как было показано на животных моделях, и этот процесс регулируется МСР-1 и индукцией рецептора ССR2 на макрофагах [8, 22]. Активация системы комплемента при ишемическом остром почечном повреждении влечет усиление воспалительной реакции. По сравнению 10 с другими органами, в которых при ишемии-реперфузии система комплемента активируется по классическому пути, установлено, что в почках этот процесс протекает по альтернативному пути, а также по пути манноз-связывающего лектина [5, 12, 16]. Ранее считалось, что конечным активным компонентом системы комплемента является С5b, однако сейчас установлена преобладающая роль С5а-компонента [1, 10, 27, 28]. C5a является мощным хемоаттрактантом для нейтрофилов, моноцитов и Т-клеток. В почках рецептор к С5а-компоненту локализуется в проксимальных канальцах и на интерстициальных макрофагах [7]. Заключение Таким образом, проведенное нами исследование позволило выявить, что развивающееся к концу операции ишемическое повреждение эпителия почечного канальца в первую очередь обусловливает его функциональную неполноценность, что выражается в значительном возрастании уровня NGAL в крови. Гибель тубулярных эпителиоцитов сопровождается макрофагально-нейтрофильной инфильтрацией почечных канальцев, которая определяется высокими уровнями цитокиновых хемоаттрактантов — ИЛ-6, ИЛ-8 и ИЛ-18. Максимум их действия приходится на первые сутки после операции, когда в почках развивается первая волна апоптоза, с последующим уменьшением до тетьих суток. С седьмых суток развивается вторая волна апоптоза, которая обусловливает вторичное повышение ИЛ-6, ИЛ-8 и ИЛ-18. Изменения МСР-1/креатинин отражают динамику инфильтрации моноцитами тубулярной ткани. Высокие значения ИЛ-8/креатинин на седьмые сутки после хирургического вмешательства отражают процессы развития склероза в канальцевой системе почек, и его уровень может быть прогностическим признаком стойкого нарушения функции почечных канальцев в послеоперационном периоде. Отсутствие значимых изменений показателей ФНО-α/креатинин и ИЛ-1β/креатинин говорит за аль- Медицинский алфавит. Современная лаборатория 3 / 2013 тернативный путь активации системы комплемента с развитием воспалительной реакции в тубулярном аппарате без местного усиления синтеза ФНО-α и ИЛ-1β. Список литературы 1. Arumugam T. V., Shiels I. A., Woodruff T. M. et al. // Shock. 2004. V. 21. P. 401–409. 2. Dagher P. C. // Kidney Int. 2004. V. 66. P. 506–509. 3. Daha M., van Kooten C. // Nephrol. Dial. Transplant. 2000. V. 15 (Suppl. 6). P. 41–43. 4. Damianovich M., Ziv I., Heyman S. N. et al. // Eur. J. Nucl. Med. Mol. Imaging. 2006. V. 33. P. 281–291. 5. de Vries B., Walter S. J., Peutz-Kootstra C.J. et al. // Am. J. Pathol. 2004. V. 165. P. 1677–1688. 6. Devarajan P. // Expert. Opin. Med. Diagn. 2008. V. 2 (4). P. 387–398. 7. Fayyazi A., Scheel O., Werfel T. et al. // Immunology. 2000. V. 99. P. 38–45. 8. Furuichi K., Wada T., Iwata Y. et al. // J. Am. Soc. Nephrol. 2003. V. 14. P. 2503–2515. 9. Giraudo E., Primo L., Audero E. et al. // J. Biol. Chem. 1998. V. 273. P. 22128–22135. 10.Guo R. F., Ward P. A. // Annu. Rev. Immunol. 2005. V. 23. P. 821–852. 11. H a n g L . , F r e n d e u s B . , G o d a l y G . , Svanborg C. // J. Infect. Dis. 2000. V. 182 (6). P. 1738–1748. 12. Holers V. M., Thurman J. M.: // Mol. Immunol. 2004. V. 41. P. 147–152. 13. Kaushal G. P., Basnakian A. G., Shah S. V. // Kidney Int. 2004. V. 66. P. 500–505. 14. Kielar M. L., John R., Bennett M. et al. // J. Am. Soc. Nephrol. 2005. V. 16. P. 3315–3325. 15. Lonnemann G., Shapiro L., Engler-Blum G. et al. // Kidney Int. 1995. V. 47 (3). P. 837–844. 16.Moller-Kristensen M., Wang W., Ruseva M. et al. // Scand. J. Immunol. 2005. V. 61. P. 426–434. 17. Parikh C. R., Mishra J., Thiessen-Philbrook H. // Kidney Int. 2006. V. 70 (1). P. 199–203. 18. Ramesh G., Reeves W. B. // Kidney Int. Suppl. 2004. V. 91. P. S56-S61. 19. Rosenberg H. F. // Philadelphia. 1999. P. 61–76. 20.Saikumar P., Venkatachalam M. A. // Semin. Nephrol. 2003. V. 6. P. 512–521. 21.Subauste M. C., Choi D. C., Proud D. // Inflammation. 2001. V. 25 (6). P. 373–380. 22.Sung F. L., Zhu T. Y., Au-Yeung K.K., Siow Y. L. // Kidney Int. 2002. V. 62. P. 1160–1170. 23.Taal M. W., Zandi-Nejad K., Weening B. et al. // Kidney Int. 2000. V. 58 (4). P. 1664–1676. 24.Villanueva S., Cespedes C., Vio C. P. // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2005. V. 290. P. R861-R870. 25.Wang J., Konda R., Sato H. et al. // J. Urol. 2001. V. 165 (1). P. 210–214. 26.Wei Q., Yin X. M., Wang M. H., Dong Z. // Am. J. Physiol. Renal Physiol. 2006. V. 290. P. F35-F42. 27.Yamada K., Miwa T., Liu J. et al. // J. Immunol. 2004. V. 172. P. 3869–3875. 28.Zhou W., Farrar C. A., Abe K. et al. // J. Clin. Invest. 2000. V. 105. P. 1363–1371. e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 11 Современные методологические аспекты лабораторной диагностики системы протеина С и значение её исследования в хирургии В. В. Егорова, М. И. Титова, В. С. Демидова, Ю. А. Амирасланов, Н. Г. Аскеров, А. А. Звягин, Н. А. Назаренко, А. Л. Берковский Институт хирургии им. А. В. Вишневского, г. Москва Modern methodological aspects of laboratory diagnosis of protein C system and the value of its research in surgery Резюме Работа посвящена анализу исследования системы протеина С при диагностике и лечении хирургических больных. Нарушения системы протеина С отмечены при поражениях печени, сосудистой патологии, у больных с раневой инфекцией. Нарушения системы протеина С обусловлены как снижением уровня и активности протеина С и S, так и наличием в особых случаях мутантного фактора V (Лейдена). Показана информативность тестирования протеина С в прогностических целях у тяжёлой группы хирургических больных. Обоснована необходимость правильного подбора методики определения системы протеина С с учётом характера заболевания и типа антикоагулянтной терапии. Ключевые слова: гемостаз, свёртывающая система крови, система протеина С, тромбоз, воспаление, хирургия. Summary This paper analyzes role of protein C system in the diagnosis and treatment of surgical patients. Violations of protein C system are observed in patients with lesions of liver, vascular disease and patients with wound infection. Disorders of protein C system are caused by decrease in level and activity of protein C and S, and in special cases by presence of mutant factor V (Leiden). The study shows high informational value of protein C testing in forecasting purposes for heavy surgical patients. The study justifies the necessity of proper selection of methods for determining protein C system, given the nature of disease and type of anticoagulant therapy. Keywords: hemostasis, coagulation, protein C system, thrombosis, inflammation, surgery. В процессе оперативного лечения у хирургических больных свёртывающаяся система крови подвергается большим изменениям и требует постоянного динамического контроля [3, 7, 20]. В последние десятилетия большое значение уделяется изучению антикоагулянтной системы протеина С, действующей на уровне эндотелия сосудистой стенки. Система протеина С включает следующие компоненты: • протеин С, синтезирующийся в печени и являющийся витамин-К-зависимой протеазой; • протеин S — кофактор активации протеина С; • тромбомодулин (ТМ) — мембранный белок; • эндотелиальный рецептор протеина С, располагающийся на эндотелиальных клетках (ЭРПС); • С4-связывающий протеин (С4-СП), который ингибирует кофакторную функцию протеина S. Протеин С (ПрС) синтезируется в печени в форме неактивного одноцепочечного гликопротеина с последующим превращением в зрелую двухцепочечную форму, которая преобладает в плазме [26, 32, 36]. Механизм действия Активация ПрС происходит, когда тромбин (Т) связывается с ТМ, и в присутствии ионов кальция (СA) этот комплекс повышает активность ПрС в 10 тысяч раз [22, 32, 36, 37]. Открытый в 1990-х годах, ЭРПС связывает ПрС, концентрируя его рядом с комплексом Т+ТМ, и повышает его активность в десять раз [35, 37]. Будучи активированным, ПрС находится в связанном состоянии 12 Рисунок 1. Система протеина С. Активированный протеин С (АПС), сопрягаясь с теназным комплексом на фосфолипидной поверхно‑ сти (активированный тромбоцит), вызывает деградацию фактора V. ТМ — тромбомодулин. С4-С5 — связывающий протеин. ПрС — про‑ теин С. ПрS — протеин S. IIa, Va — активированные плазменные факторы. Vi — деградированный фактор. с эндотелиальным рецептором (ЭР), не обладая при этом антикоагулянтной активностью. В случае диссоциации от эндотелия и связывания с протеином S активированный ПрС в крови инактивирует факторы Va и VШа, что и предупреждает ранний этап тромбинообразования (рис. 1). Таким образом, активированный протеин С (АПС) способен ингибировать тромбиногенез на ранней стадии каскада свёртывания. Другой важной функцией АПС является его способность ускорять плазминоген-зависимый лизис сгустка, что также является проявлением его противосвёртывающих свойств [10, 14, 38]. Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru АПС ингибирует образование тромбина и, таким образом, снижает тромбинозависимый этап воспалительного процесса [15, 18, 29, 40]. АПС защищает эндотелий от повреждения, препятствуя апоптозу эндотелиальных клеток и способствуя их выживаемости. В последние годы открыты связанные формы этого белка и липопротеидов очень низкой плотности (липопротеидсвязанный АПС) у больных в критических состояниях, что важно для прогнозирования неблагоприятных исходов у тяжёлых больных [21] Таким образом, АПС обладает многонаправленной функцией в динамической системе взаимодействия коагуляции, фибринолиза, воспаления и репаративных процессов в тканях [15, 18, 23, 28]. Сниженный уровень ПрС у ряда лиц является фактором повышенного риска возникновения тромбозов [6, 10, 22, 36]. О дефиците ПрС можно говорить, если его уровень в крови составляет менее 60–70 % от нормы, при этом проявления тромботических манифестаций начинаются при снижении уровня белка до 40–50 %. Гетерозиготные дефициты ПрС связаны с повышенным риском возникновения венозных тромбозов [8, 12, 13]. Предполагается, что риск их возникновения увеличивается в десять раз. При этом содержание ПрС составляет 50 % нормы, но зачастую протекает бессимптомно или проявляется после 30 лет. Гетерозиготный дефицит ПрС проявляется ранними тромбозами: инфарктом миокарда, тромбоэмболией системы лёгочной артерии, тромбозами глубоких и поверхностных вен нижних конечностей у субъектов молодого возраста, часто имеющих гиперстенический тип телосложения [9, 13, 21]. Более полное понимание причин так называемых идиопатических венозных тромбозов произошло после открытия В. Dahlbeck новой формы тромбофилии в 1993 году, получившей название резистентности к АПС [24]. Причиной этого феномена является мутация гена фактора V (фактор V Leiden). Мутация приводит к замене аргинина в 506 положении фактора V на глутамин. Высокая распространённость данной патологии отмечается у молодых пациентов, имеющих семейный анамнез тромбозов. Частота резистентности к АПС обнаружена в 5 % общей популяции и приблизительно у 40 % страдающих тромбозами. В возрасте 50 лет около 40 % лиц с подобной недостаточностью пережили тромботические эпизоды [1, 2, 10]. Нарушение активации ПрС возникает при патологических состояниях, связанных с наличием таких факторов, как гипоксия, эндотоксин, интерлейкин-1, фактор некроза опухоли альфа, высокий уровень гомоцистеина (все они ускоряют свёртывание, индуцируя экспрессию тканевого фактора, и подавляют транскрипцию тромбомодулина эндотелиальными клетками) [23, 28, 33]. Показана информативность тестирования ПрС в прогностических целях в септических состояниях (характеризуется повышенным потреблением, разрушением и нарушением синтеза ПрС) [3, 4, 5, 11]. Уровень активности ПрС < 40 %, а также снижение более чем на 10 % за один день при сепсисе коррелирует с неблагоприятным прогнозом [27, 31, 39]. e-mail: medalfavit@mail.ru Целью работы явилась оценка и анализ методологических аспектов лабораторной диагностики системы ПрС в хирургической практике и изучение её диагностической значимости. Задачи исследования Изучить состояние системы ПрС у различных групп хирургических больных при заболеваниях печени, сосудистых заболеваниях, ранах и раневой инфекции. Исследовать корреляционную связь ПрС с факторами свёртывающей системы и метаболитами, синтезирующимися в печени. Выявить заболевания, характеризующиеся клинически значимыми изменениями компонентов системы ПрС. Проанализировать методики определения ПрС и его изменений у различных групп хирургических больных. Материал исследования Всего исследовано 365 больных. Группы обследованных Количество больных Доноры 25 Больные с сосудистыми заболеваниями 80 Больные с заболеваниями печени 129 Больные с раневой инфекцией 156 Методы исследования В проведённой работе по изучению системы ПрС были использованы различные методы исследования. На первом этапе работы определение уровня ПрС проводилось методом энзимоиммуносорбентного анализа (ELISA) с использованием реактивов фирмы Берингер-Маннхайм путём определения антигена ПрС [6, 7]. Референтные значения ПрС для данного метода составили 99,5 ± 1,47 %. Этот метод позволяет определить уровень снижения концентрации ПрС, но не позволяет определить функциональную активность системы ПрС, что важно знать при сосудистой патологии, когда склеротическим и воспалительным процессами повреждается эндотелий стенки сосуда, где происходит активация ПрС. В этих случаях наиболее результативные данные получены при исследовании функционального состояния системы ПрС коагулогическим методом по определению нормализованного отношения (НО), предложенного фирмой «РЕНАМ» [2, 8, 13]. НО = (АЧТВакт/АЧТВ) больного (АЧТВакт/АЧТВ) нормы х НО калибр. НО у 25 доноров = 1,32 ± 0,15 ед. НО калибр. — нормализованное отношение плазмы-калибратора, указано в паспорте на набор. В основу формулы положены измерения АЧТВ больного, когда активация эндогенного ПрС происходит под действием фракции яда щитомордника, что удлиняет время свертывания плазмы в тесте АЧТВ. Медицинский алфавит. Современная лаборатория 3 / 2013 13 В норме НО составляет 0,7–1,3. Значения меньше 0,7 свидетельствуют о значительных нарушениях в системе ПрС (функциональная неполноценность, сниженный синтез протеина С, протеина S) или о наличии мутантного фактора V (Лейден), резистентного к действию ПрС, исследованию которого в последнее время придаётся всё большее значение. Коагулогический метод, предложенный фирмой «РЕНАМ», легко автоматизируется, оценивает активность ПрС, фиксирующегося карбоксилированной частью на фосфолипидах сосудистой стенки. Исказить результаты теста могут такие факторы, как присутствие мутантного фактора V, волчаночного антикоагулянта, а также терапия пациентов гепарином, когда АЧТВ и тромбиновое время резко удлиняется в 1,5–2 раза. Поэтому в последнее время для определения уровня ПрС используется метод с хромогенными субстратами, который не зависит от применения антикоагулянтов. Определение ПрС проводится с использованием хромогенного субстрата S-2366 pyro Glu-Pro-Arg-pNA-HCL на автоматическом коагулометре ACL-9000. Уточнены средние референтные значения ПрС, которые составили 94–124 %. Исследования показывают, что данный метод специфичен, легко автоматизируется, его возможно производить как со свежей плазмой, так и с плазмой после размораживания. Необходимо отметить, что при лечении непрямыми антикоагулянтами (антагонистами витамина К) появляются формы ПрС, которые не обладают антикоагулянтной активностью, но регистрируются хромогенными субстратами — PIVKA-формы, которые могут завышать истинные результаты ПрС. Представленные способы изучения ПрС надежны в производственной работе в хирургической клинике, но требуют индивидуального подхода при выборе метода диагностики нарушений системы ПрС и учета применения антикоагулянтной терапии у пациентов. Результаты и их обсуждение Как было отмечено, ПрС синтезируется в печени, и поэтому патологические процессы, происходящие в этом органе, могут отражаться на показателях этого белка. В первых работах, проведённых методом ELISA, где количество ПрС было выражено в процентах, было установлено, что при различных заболеваниях печени, сопровождающихся нарушениями её функций, происходит снижение синтеза ПрС, наиболее выраженное у больных циррозом печени, механической желтухой, при опухолевом поражении печени [6, 7]. В механизме снижения ПрС при заболеваниях печени основную роль играет угнетение её белковосинтезирующей функции при тяжёлой дистрофии гепатоцита. Подтверждением этому явилась выявленная высокая корреляция (г = 0,62) между снижением уровней ПрС и псевдохолиностеразы [6, 7, 12, 13]. В дальнейшем было показано снижение уровня общей активности системы ПрС у больных с разными очаговыми поражениями печени. Так, НО в этой группе до операции составило 0,87 ± 0,11, что на 34 % меньше по сравнению 14 с НО у доноров (р < 0,05). Выраженное снижение НО у данной группы больных связано с нарушением белоковосинтезирующей функции печени, что подтверждается положительной корреляцией между содержанием в плазме ПрС и фибриногена, а также между ПрС и общим белком (г = 0,31) [12, 16]. Более выраженное снижение НО у этих больных отмечено в первые дни после таких операций, как гемигепатэктомии. Так, НО в первый день составило 0,65 ± 0,07, что на 25 % ниже дооперационного уровня. Это значительное падение НО можно объяснить удалением большого объёма печёночной паренхимы, а также свидетельствует о продуцировании внутрисосудистого тромбина и развитии гиперкоагуляционных реакций, связанных с обширностью операционной травмы. В дальнейшем отмечалось постепенное восстановление активности системы ПрС, и к 14 дню после операции НО составило уже 0,83 ± 0,06, что определяется компенсаторными возможностями оставшейся после резекции функционально активной паренхимы печени. Проведённый нами анализ информативности основных параметров дооперационного функционального резерва печени в прогнозе послеоперационной печёночной недостаточности показал, что наиболее чувствительными лабораторными показателями, отражающими вероятность развития тяжёлой формы печёночной недостаточности, оказались дооперационные уровни снижения ПрС и альбумина [7, 16]. В группе больных, перенесших ПГГЭ, в первые послеоперационные сутки отмечалось снижение показателей ПрС до 50 %, альбумина до 29,25 ± 0,64 г/л. Уровень ПрС был снижен до 3–7 суток, после чего отмечена тенденция к повышению его показателей. Поэтому ПрС наряду с альбумином может быть использован как надёжный маркер белок-синтезирующей функции печени и в прогнозе развития печёночной недостаточности. Таблица 1 Динамика изменений общей активности ПрС у больных с очаговыми поражениями печени Активность системы ПрС (НО) Доноры n = 20 1,32 ± 0,15 Больные с очаговыми поражениями печени (злокачественные и доброкачественные опухоли) до операции после oперации, 1-й день после oперации, 14 дней 0,87 ± 0,11 (р < 0,05) 0,65 ± 0,07 (р < 0,05) 0,83 ± 0,06 (р < 0,05) У больных с сосудистыми заболеваниями также отмечено снижение активности системы ПрС по сравнению с донорским. НО в среднем составило 0,77 ± 0,06 (р < 0,05), что значительно меньше по сравнению с донорами. При этом важно отметить, что эти нарушения были обусловлены снижением активности протеинов С и S, а также были обнаружены случаи мутантного фактора V (фактор V Leiden), исследованию которого в настоящее время в клинике придаётся всё большее внимание. У 1/3 больных с сосудистой патологией (атеросклеротическое Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru поражение аорты и её ветвей) из 25 обнаружено 8 случаев снижения НО, обусловленное изолированным снижением протеина S. Так, у этих больных при наличии НО, колеблющегося в пределах 0,37–0,57, количество ПрС было в пределах нормы (87–137 %), а фактор V Leiden не был обнаружен. По-видимому, это обусловлено снижением активности протеина S-кофактора ПрС или какого-либо другого компонента этой системы [2]. Следовательно, у больных с сосудистой патологией необходимо исследовать все компоненты системы протеина С. Следующей группой пациентов, у которых исследовали систему ПрС, были больные с гнойной хирургической инфекцией различной степени тяжести. Статистически достоверное снижение уровня ПрС (р < 0,05) отмечено у септических больных и больных с тяжёлой воспалительной реакцией. В ходе исследования было обнаружено снижение количества ПрС у больных средней тяжести до 86 %, а в случае тяжелого течения более значительное достоверное снижение до 63 %. Как показывают представленные данные, между двумя группами больных имеются различия по уровню ПрС. Однако если такие факторы гемостаза, как фибриноген, фибринолитическая активность, антитромбин III быстро реагируют на возникновение гнойно-хирургической инфекции, то уровень ПрС снижается постепенно, сообразно развитию органной недостаточности (наиболее часто печёночной) под воздействием токсических веществ, образующихся в ходе раневого процесса. Проведённое нами исследование системы ПрС у больных с различными формами диабетической стопы также показало свою значимость при диагностике тяжести раневого процесса при диабете и выявлении ранних признаков септического состояния этих больных (табл. 3). НО у больных с нейропатической формой диабетической стопы было снижено до 0,85 ± 0,07, при этом уровень НО ниже 0,7 отмечен в 22 % случаев. У больных с нейроишемической формой диабетической стопы НО было более снижено и составило 0,68 ± 0,06, что вдвое ниже уровня по сравнению с донорским (р < 0,05). Критический уровень НО ниже 0,7 отмечен в 51 % случаев, что говорит о более тяжёлом поражении системы ПрС у больных этой группы с часто развивающимися осложнениями: диабетическая гангрена стопы и нижних конечностей. Интересно отметить, что в зарубежных и отечественных работах последних лет у ряда больных с сахарным диабетом отмечается наличие резистентности к АПС [21, 28, 30, 37]. В проведённых нами исследованиях мы также встретились с данной патологией у больных с диабетической стопой. Из 65 больных фактор Лейдена был обнаружен в шести случаях, что составило 9,2 % пациентов. Полученные данные свидетельствуют о значительных нарушениях в системе ПрС у больных с различными формами диабетической стопы, проявляющихся в снижении активности системы ПрС в плазме в обеих исследуемых группах, и способствуют выявлению неблагоприятного типа течения раневого процесса. e-mail: medalfavit@mail.ru Таблица 2 Изменения показателей плазменного гемостаза при острой гнойной хирургической инфекции в зависимости от тяжести состояния больных Состояние больных Показатели гемостаза контрольная группа n = 20 средняя тяжесть n = 17 тяжелое состояние n = 13 Фибринолитическая активность, мин. 212 ± 17,0 370,5 ± 3,41х 327,27 ± 9,83х Фибриноген, г/л 2,4 ± 0,21 4,41 ± 0,15х 4,47 ± 0,23х ХШ ф, % 93,7 ± 19,62 82,75 ± 7,04 33,93 ± 2,24х Тр. вр., с 18,3 ± 1,34 28,78 ± 1,14х 13,44 ± 0,92х АТШ, % 95,4 ± 2,13 67,89 ± 2,42х 52,1 ± 2,6х Протр. инд., % 92 ± 2,04 76,67 ± 0,58х 68,38 ± 1,67х Протеин С, % 99,5 ± 1,47 86,2 ± 1,34 62,9 ± 2,74х Примечание: х — указывает на достоверность различий по отноше‑ нию к контрольной группе показателей. Таблица 3 Изменение показателей гемостаза у больных с диабетической стопой Показатели гемостаза Доноры n = 20 Больные с нейро‑ патической фор‑ мой диабетиче‑ ской стопы, n = 36 Больные с нейрои‑ шемической фор‑ мой диабетической стопы, n = 29 Фибринолитиче‑ ская активность, мин. 212 ± 17 409 ± 11х 360 ± 15х Фибриноген, г/л 2,4 ± 0,2 5,8 ± 0,24х 3,8 ± 0,2 XII 1ф, % 93,7 ± 19,6 144,4 ± 8,0х 145 ± 7х АЧТВ, с 32,0 ± 0,6 36,7 ± 1,14 42,2 ± 1,4 Пр.инд., % 92,2 ± 2,04 72,4 ± 1,3х 63,1 ± 1,7х AT ш, % 96,4 ± 2,13 83,2 ± 2,1 67,1 ± 2,4х 1,32 ± 0,15 0,85 ± 0,007х РКФМ 28,6 ± 1,1 Протеин С, НО 28,2 ± 1,8 0,68 ± 0,06х Примечание: х — указывает на достоверность различий по отноше‑ нию к контрольной группе показателей. Таблица 4 Изменение показателей гемостаза у больных с ХВН Показатели Доноры ВРВ ПТФС Фибриполитическая активность, мин. 212 ± 17 286 ± 12,6 301 ± 13,2 Фибриноген, г/л 2,4 ± 0,2 2,95 ± 0,2 2,86 ± 0,2 АЧТВ, с 32,0 ± 0,6 40,4 ± 2,3* 33,1 ± 2,1* Фактор ХШ, % 93,7 ± 19,6 105,2 ± 12,9* 75,4 ± 7,3* Тр. время, с 18,3 ± 1.3 20,2 ± 0,7 21,7 ± 1,03 Протр. индекс, % 92 ± 2,04 69,3 ± 3,0 72,1 ± 2,8 Активность AT III, % 96,4 ± 2,13 81,2 ± 8,9 82,0 ± 8,5 Протеин С, НО 1,0 ± 0,3 Число тромбоцитов 250 ± 5,2 0,96 ± 0,03* 0,72 ± 0,03* 287,4 ± 12,3* 236,2 ± 15,5 Примечание: * — достоверное различие показателей между первой и второй группами больных. Медицинский алфавит. Современная лаборатория 3 / 2013 15 Как было отмечено выше, повышенный риск возникновения венозных тромбозов связан с гетерозиготным дефицитом ПрС. Нами обследованы пациенты с хронической венозной недостаточностью (ХВН), осложненной трофическими язвами. Проведённые исследования системы гемостаза показали, что у больных с данной патологией отмечается некоторая активация свёртывающей системы при торможении уровня фибринолиза и снижении антикоагулянтного потенциала крови за счёт снижения АТ III и ПрС, что представлено в табл. 4. Исследование активности системы ПрС показало, что она также реагирует на процесс поражения сосудистой стенки при ХВН. У больных с варикозным расширением вен (ВРВ) нормализованное отношение ПрС в среднем составило 0,96 ± 0,03. У больных же с посттромбофлебитическим синдромом (ПТФС) снижение активности ПрС было более выражено. Так, НО составило 0,72 ± 0,03, что на 30 % ниже донорского уровня (р < 0,05) и является практически нижним пределом нормы. При этом критический уровень НО ПрС ниже 0,7 был отмечен у больных с ВРВ только в 3 из 32 случаев, в то время как у больных с ПТФС ПрС ниже критической цифры (0,7) встречался в 14 из 29 случаев. Эти данные подтверждают факт, что при ПТФС стенки венозных сосудов повреждены более значительно, что создаёт благоприятные условия для активности процесса тромбообразования. Представленный в настоящей работе материал подтверждает большую значимость исследования компонентов системы ПрС в хирургической практике с учётом правильного подбора методики определения ПрС. Выводы 1. В настоящее время наиболее информативными и достоверными методами исследования системы ПрС являются: метод ELISA, коагулогический метод (фирма «РЕНАМ»), метод с использованием хромогенных субстратов. 2. При анализе изменений показателей системы ПрС необходим правильный подбор методики определения системы ПрС с учётом характера заболевания и типа антикоагулянтной терапии больного. 3.У больных с поражениями печени имеется снижение уровня и активности системы ПрС, что связано с нарушениями белковообразовательной функции печени. 4. Наиболее значительное снижение НО у больных с опухолевыми поражениями печени отмечается в первые дни после гемигепатэктомий, что обусловлено масштабами резекций печени, а также защитной реакцией организма в ответ на операционную травму. 5.У больных с сосудистой патологией при исследовании системы ПрС выявляется наиболее частый процент нарушений в этой системе по сравнению с другими группами обследуемых больных в связи с нарушениями как протеина С, так и протеина S, а также выявленной резистентностью к АПС в ряде случаев. 6. Исследования системы ПрС у больных с раневой инфекцией показывают снижение её уровня и активности. Эти нарушения обусловлены как снижением 16 активности протеинов С и S, так и наличием в особых случаях мутантного фактора V (фактор V Leiden), определяемого коагулогическим методом. Список литературы 1. Баркаган З. С., Гервазиев В. Б., Цывкина Л. П. и др. «Первый опыт диагностики тромбофилии, обусловленной резистентностью к активированному протеину С». Терапевтический архив. 1997. 69 № 2 стр.35–37. 2. Берковский А. Л., Васильев С. А., Качалова Н. Д. и др. «Лабораторные тесты для исследования противосвертывающей системы протеина С». V Всероссийская конференция. Тромбозы, Геморрагин и ДВС-синдром. Проблемы лечения. 22–24 марта 2000. Москва, стр.38–39. 3. Брехов Е. И., Пасечник И. Н., Калинников В. В., Скобелев Е. И., Сычёв А. В. «Современный взгляд на проблему критических состояний в хирургической клинике». Ж. «Рос. мед. вести», 2008 г., т 13, № 3, стр. 17–22. 4. Галстян Г. М., Берковский А. Л., Васильев С. А., Дрожжин А. А., Сергеева Е. В. «Влияние активированного протеина С на систему гемостаза при сепсисе». Ж. «Инфекция в хирургии», 2004, т. 2, № 4, стр. 7–13. 5. Гельфанд Б. Р. «Применение активированного протеина С в лечении больных тяжёлым сепсисом». Ж. «Хирургия», 2004, т. 6, № 1. 6. Егорова В. В. «Клиническое значение определения протеин С-зависимых нарушений гемостаза у хирургических больных». Автореферат канд. диссертации, Москва 1989, стр. 25. 7. Егорова В. В., Назаренко Н. А., Карелин А. А., Титова М. И., Вишневский В. А., Курочкин А. Н., Агафонов В. А. «Протеин С как один из показателей функциональной активности гепатоцита при обширных резекциях печени». Ж. «Анналы хирургической гапатологии», 2001, № 2, стр. 57–63. 8. Егорова В. В., Амирасланов Ю. А., Светухин А. М., Аскеров Н. Г., Титова М. И., Доронина Л. П., Берковский А. Л., Сергеева Е. В., Васильев С. А. «Исследование системы протеина С у больных с хронической венозной недостаточностью». Ж. «Инфекция в хирургии» РАСХИ, 2004, т. 2, № 4, стр. 13–15. 9. Егорова В. В., Демидова В. С., Титова М. И., Емельянов Д. Р. «Исследование многофункциональной системы протеина С в решении клинических задач плановой и экстренной хирургии». Труды научно-практической конференции, Москва, 2009 г. «Лабораторная медицина в свете Концепции развития здравоохранения России до 2020 года». Стр. 99–100. 10. Ена Я. М., Платонова Т. Н., Сушко Е. А. и др. «Биологическая роль и клиническое значение протеина С». Врачебное дело, 1992, № 6, стр. 20–25. 11. Ерин Д. Н. «Роль снижения уровня протеинов C, S и антитромбина III при инфекционно-септическом ДВС-синдроме и коррекция их дефицита криосупернатантом». Автореферат канд. диссертации. Барнаул. 1999, стр. 26. 12. Карелин А. А., Адамян А. А., Титова М. И., Егорова В. В. «Клиническое значение определения протеин С-зависимых нарушений гемостаза у хирургических больных». Клиническая медицина, № 5, 1995, стр. 57–59. 13. Карелин А. А., Назаренко Н. А., Егорова В. В., Васильев С. А., Сергеева Е. В., Титова М. И., Земляной А. Б., Берковский А. Л. «Исследование нарушений антикоагулянтной системы протеина С при различных клинических состояниях». Ж. «Клиническая медицина», 2002 г., № 11, стр. 46–50. 14. Коган А. Е., Струкова С. М. «Протеин С: механизмы активации и антикоагулянтного действия». Биохимия 1993; 58. № 6, стр. 827–844. 15.Макарова А. М. Дис. канд. «Протекторное действие активированного протеина С при воспалении и репарации тканей», 2007 г. 16. Назаренко Н. А. «Обширные резекции печени». Автореферат докт. диссертации. Москва, 2005, стр. 45. 17.Светухин А. М., Амирасланов Ю. А., Земляной А. Б., Титова М. И., Истратов В. Г., Руднева В. Г., Егорова В. В., Короткина Р. Н., Терехова Р. П., Доронина Л. П. «Особенности нарушений системы гемокоагуляции и их коррекция у больных с гнойно-некротическими формами синдрома диабетической стопы». Ж. «Хирургия», 2006, № 10, стр. 30–34. Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru 18.Струкова С. М. «Роль тромбоцитов и сериновых протеиназ в сопряжении свёртывания крови и воспаления». Ж. «Биохимия», 2004, т. 69, стр. 1314–1331. 19.Суханов В. А.. «Воспалительный коагуляционный ответ как часть синдрома системной воспалительной реакции (SIRS)». Ж. «Интенсивная терапия», 2006, № 1. 20.Титова М. И., Амирасланов Ю. А., Земляной А. Б., Доронина Л. П., Руднева В. Г., Егорова В. В., Демидова В. С., Аскеров Н. Г. «Программы антитромботической коррекции нарушений системы гемостаза при гнойной хирургической инфекции в до и послеоперационном периоде». Ж «Вестник национального медико-хирургического центра им. Н. И. Пирогова», 2013, т. 8, № 2, стр. 119–124. 21.Шифман А. М., Гуменюк Е. Г., Ившин А. А., «Активированный протеин С и преэклампсия». Рос. мед. журнал, 2006, № 3, стр. 28. 22.Bertina R. M., Broekmans A. W., van der Linden I. K. et al. Protein C deficiency in a Dutch family with thrombotic disease. Throm. Haemostas., 1982, vol 148, № 1, p.1–5. 23.Bouwens E. A., Stavenuiter F. Mosnier L. O. Mechanisms of anticoagulant and cytoprotective actions of the protein C pathway. J. Thromb. Haemost.2013, Jun; 11 Suppl 1: 242–253. 24.Dahlback B. Resistance to activated protein C as risk factor for thrombosis: molecular mechanism, laboratory investigation and clinical managements. Semin in hematol. 1997, 34 (3), p. 217–234. 25.Dhainaut J. F., Yan S. B., Carion A. et al. Sjluble thrombomodulin, plasmaderived unactivated protein C, and recombinated human activated protein C in sepsis. Critical Care medicine, 2002, v 30, № 5, p. 318–324. 26.Esmon C. T. Protein C: biochemistry, physiology and clinical implications. Blood, 1983, № 2, p.1155–1158. 27.Esmon C. T., Fuku dome K., Mather T. et al. Inflammation, sepsis and coagulation. Haematologica, 1999, vol. 84, p. 254–259. 28.Esmon C. T. The Anticoagulant and Anti-inflammatory Roles of the Protein C Anticoagulant Pathway. J. Autoimmun. 2000, 15: 113–116. 29.Esmon C. T. Protein C anticoagulant pathway and its role in controlling microvascular thrombosis and inflammation. Crit. Care Med., 2001, vol. 29, № 7, p. 48–52. e-mail: medalfavit@mail.ru 30.Eimear M., Gleeson, James S. O’Donnel, Roger J. S. Preston. The endothelial cell protein C receptor: cell surface conductor of cytoprotective coagulation factor signaling. Cellular and Molecular Life Sciences, 2012, vol. 69, issue 5, p. 717–726. 31.Faust S. N., Levin M., Harrison O. B. et al. Disfunction of endothelial protein C activation in severe meningococcal sepsis. N. Engl. J. Med., 2001, vol. 345, № 6, p. 408–416. 32.Griffin J. H. Clinical studies of protein C. Semin. Thrombos. Hemost. 1984. Vol. 10, p.162. 33.Grinnell B. W., Yan S. B. Novel antithrombotics base on modulation of the protein C pathway. Coron Artery DIS, 1998, vol. 9, p. 89–97. 34.Kanji S., Devlin J. W., Piekos K. A., Racine E. Recombinant human activated protein C, drofrecogin alfu (activated): a novel therapy for severe sepsis. Pharmacotherapy, 2001, vol. 21, № 11, p. 1389–1402. 35.LaRosa S.P., Vincent J. L., Bellomo R. et al. Baseline characteristics of patients enrolled in the phase III trial of rhAPC in severe sepsis. Crit. Care Med. 2000, 28, A 48. 36.Liaw P. C.Y., Neuennschwander P. F., Smirnov M. D. Mechanisms by wich soluble endothelial cell protein C receptor modulates protein C and activated protein C function. J. Biol. Che, 2000, vol. 275, № 8, p.5447–5452. 37.Sadler J. E. Thrombomodulin structure and function. Thromb. Haemost, 1997, vol. 78, p. 392–395. 38.Sakata Y., Loskutoff D. J., Gladson C. L. et al. Mechanisms of protein C-dependant clotlysis: role of plasminogen activator inhibitor. Blood, 1986, vol. 68, p. 1218–1223. 39.Vincent J. L., Dhainant J. F., LaRosa S.P. et al. Effect of baseline Protein C, antithrombin and IL-6 levels on the mortality reduction associated with recombinant human activated protein C in patients with severe sepsis. Am. J. Resp. Crit. Care Med. 2001, 163, A 17. 40.Yan S. B., Grinnell B. W. Antithrombotic and anti-inflammatory agents of the protein C anticoagulant pathway. Ann. Rep. Med. Chem., 1994, vol. 11, p. 103–112. Медицинский алфавит. Современная лаборатория 3 / 2013 17 Новые представления о диабетической нефропатии: гиперфильтрация, прерывистая микроальбуминурия, солевой парадокс В. В. Вельков, ЗАО «ДИАКОН», г. Пущино, Московская область The new concept of the diabetic nephropathy: hyperfiltration, intermittent microalbuminuria, the salt paradox Velkov V. V., ZAO DIAKON, Pushchino, Moscow Region Резюме Обзор данных, согласно которым ранним признаком развития диабетической нефропатии является ренальная гиперфильтрация. Наличие при сахарном диабете гиперфильтрации приводит к более быстрому ухудшению ренальных функций, чем при исходной нормофильтрации. Рассмотрены также данные, согласно которым: а) на ранних стадиях диабетической нефропатии снижение СКФ может происходить до развития микроальбуминурии; б) микроальбуминурия только в половине случаев связана с последующим развитием протеинурии. Особо дискутируются: а) «тубулоцентрический» механизм гиперфильтрации, вызываемый повышением реабсорбции в проксимальных канальцах и нарушением тубуло-гломерулярной обратной связи и б) «солевой парадокс», согласно которому снижение концентрации NaCl в диете пациентов с сахарным диабетом повышает риск развития терминальных стадий ренальных заболеваний и неблагоприятных исходов. Приводятся широко обсуждаемые в мировой медицинской литературе доводы в пользу того, что лабораторная диагностика диабетической нефропатии должна включать регулярное и одновременное измерение трех, в большой степени, независимых друг от друга параметров: цистатина С, альбумина, и креатинина. Ключевые слова: диабетическая нефропатия, гиперфильтрация, микроальбуминурия, протеинурия, тубуло-центрический механизм, солевой парадокс. Summary The review of the published data demonstrating that renal hyperfiltration is the early indication of development of diabetic nephropathy. In diabetes mellitus the presence of the hyperfiltration strongly accelerates the worsening of renal functions in comparison with that of initial normofiltration. The special attention is given to the facts, that: a) in the early stages of diabetic nephropathy the decline of glomerular filtration rate could occur before development of microalbuminuria, and, b) microalbuminuria is associated with future development of proteinuria only in 50 % of cases. The tubulo-centric mechanisms of hyperfiltration and the ‘salt paradox’ are discussed. It was concluded, that laboratory diagnostics of the development of diabetic nephropathy should include the regular and simultaneous measurement of three predominately independent parameters: cystatin C, albumin and creatinine. Key words: diabetic nephropathy, hyperfilatration, microalbuminuria, proteinuria, tubulocentric mechanism, salt paradox. Т рудно переоценить актуальность ранней диагностики диабетической нефропатии, мониторинга ее течения и прогнозирования ее развития. Недавно обнародованные национальные рекомендации включают исчерпывающее и подробное изложение общепризнанных основных принципов скрининга, диагностики, профилактики и подходов к лечению хронической болезни почек (ХБП) [1]. Как подчеркивается в указанных рекомендациях, «распространенность ХБП сопоставима с такими социально значимыми заболеваниями, как эссенциальная гипертензия и сахарный диабет. В среднем признаки повреждения почек или умеренное / выраженное снижение скорости клубочковой фильтрации ожидаются у каждого десятого в общей популяции. При этом сопоставимые цифры были получены как 18 в индустриальных странах с высоким уровнем жизни, так и в развивающихся странах со средним и низким доходом населения» [1]. Именно с такой высокой значимостью проблем диагностики ХБП и связано большое количество исследований в этой области, направленных на выявление самых ранних признаков инициации этой патологии, на выяснение механизмов ее возникновения и прогрессирования. Данный краткий обзор посвящен попытке рассмотрения некоторых, возможно весьма значимых, а поэтому и весьма дискутируемых представлений, связанных с механизмами развития диабетической нефропатии (ДН). Основное внимание будет уделено гломерулярной гиперфильтрации и связи скорости клубочковой фильтрации (СКФ) с микроальбуминурией и протеинурией. Медицинский алфавит. Современная лаборатория 3 / 2013 Гиперфильтрация: миф или реальность? Что предсказывает микроальбуминурия? В 1996 году в журнале Kidney International была опубликована статья с весьма многозначительным названием «Теория гиперфильтрации: смена парадигмы в нефрологии» [2]. Парадигма, как известно, это «совокупность фундаментальных научных установок, представлений и терминов, принимаемая и разделяемая научным сообществом и объединяющая большинство его членов». Так что же должно заставить медицинское сообщество изменить свои представления о развитии ХБП и изменить как практику ее лабораторной диагностики, так и алгоритмы ее терапии? Еще 1981 году утверждалось, что при развитии ДН ранние гемодинамические изменения, направленные, как e-mail: medalfavit@mail.ru можно было предполагать, на восстановление сниженной функции нефронов, приводят к клубочковой гиперфильтрации. А гиперфильтрация, в свою очередь, ведет не к нормализации почечной функции, а к цепной реакции патологических событий, приводящих к резкому и все ускоряющемуся падению ренальных функций [3]. Таким образом, 30 лет назад было высказано предположение, что самый ранний диагностический признак развития ХБП — не снижение СКФ, а ее повышение. Общепринято, что предиктором развития тяжелых стадий ДН считается микроальбуминурия. По этой причине для предотвращения развития ренальной дисфункции (падения СКФ < 60 мл/мин./1,73м 2) микроальбуминурию подавляют с помощью блокады ренин-альдостерон-ангиотензиновой системы (РААС). Однако мета-анализ результатов 33 крупномасштабных клинических испытаний, включавших 77 групп пациентов с ранними стадиями сахарного диабета первого и второго типа (СД 1 и СД 2) показал, что подавление микроальбуминурии на ранних стадиях СД не предотвращало падения СКФ. Действительно, в проспективных наблюдениях было обнаружено, что в течение первого года при антигипертензивной терапии ингибиторами РААС соотношения альбумин/креатинин действительно снижались (%): а) у нормотензивных пациентов с СД 1 на 5,9 ± 4,3; б)у нормотензивных пациентов с СД 2 на 10,5 ± 5,4; в) у гипертензивных с ранним СД 1 на 7,6 ± 11,1; г) у гипертензивных с ранним СД 2 на 18,4 ± 6,2; д)у гипертензивных с поздним СД 2 на 20,8± 5,5. Однако при этом ежегодное снижение СКФ (дельта СКФ, мл/ мин./1,73м 2) составляло: а)при СД 1 — на 2,0 ± 0,5; б ) у н о рм от е н з и в н ы х с СД 2 на 1,6 ± 0,5; в)у гипертензивных с ранним СД 2 на 2,1 ± 0,3 г) у гипертензивных с поздним СД 1 на 9,8 ± 1,5 д)у гипертензивных с поздним СД 2 на 9,2 ± 1,1 e-mail: medalfavit@mail.ru Таким образом, при раннем СД, в отличие от позднего, снижение соотношения альбумин/креатинин при антигипертензивной терапии не предсказывало последующего замедления падения СКФ. По мнению авторов этого мета-анализа, «оценка эффективности ренопротективной антигипертензивной терапии должна базироваться не только на альбуминурии, но и на СКФ» [4]. В другом исследовании в течение 4,5 лет наблюдали 784 гипертензивных пациента с высоким риском ССЗ, получавших ингибитор ангиотензин-превращающего фермента телмисартан (telmisartan) и (или) блокатор ангиотензинового рецептора рамиприл (ramipril). Как оказалось, данная терапия хотя и снижала протеинурию, но не предотвращала падения ренальных функций, которые оценивались согласно удвоению креатинина, диализу, смертности [5]. Итак, действительно ли происходит сдвиг парадигмы? Действительно ли ранние стадии развития ХБП связаны с гиперфильтрацией? Действительно ли поздние стадии ХБП, связанные со значительным падением СКФ, не связаны с альбуминурией? Что такое гиперфильтрация? Международных и согласованных критериев гиперфильтрации пока нет. Традиционно гиперфильтрацией считаются показатели СКФ, превышающие значение таковой для 95-й процентили здоровой популяции на величину, соответствующую двум стандартным отклонения [6]. Такое определение гиперфильтрации, по мнению некоторых авторов, игнорирует тот факт, что гиперфильтрация может происходить в одиночном нефроне при в целом сниженной СКФ. Поэтому некоторые исследователи определяют гиперфильтрацию, как повышение фильтрационной фракции (ФФ). ФФ — это отношение СКФ к почечному плазматоку. Значения ФФ повышаются, если ренальный плазматок понижается в большей степени, чем снижается СКФ. Нормальное значение фильтрационной фракции для здоровых взрослых составляет 18,7 ± 3,2 % [7]. Определение ФФ предусматривает одновременное измерение СКФ и ренального плазматока с помощью инфузии радиоактивно меченного п-аминогиппурата, который удаляется из циркуляции при однократном прохождении через почки за счет гломерулярной фильтрации и секреции в проксимальных канальцах. Считается, что клиренс п-аминогиппурата отражает ренальный плазматок, но является неточным в случаях тубулярной патологии [7]. При наблюдении десяти пожилых пациентов с излишним весом, мягкой гипертензией, но без клинических признаков СД или ренальной патологии, измерялись: СКФ (клиренс 99m-диэтилентриаминопентауксусной кислоты) и плазматок (удаление из сыворотки радиоактивно меченного по иоду 131-I гиппурана) и инсулинорезистетность (эугликемический клэмп-тест)..Обнаружено, что при повышении концентрации NaCl в диете ни значения СКФ (68,1 ± 7,7–78,0 ± 6,6 мл/мин./1,73 м 2), ни показатели фильтрационной фракции (0,21 ± 0,02–0,22 ± 0,02) существенно не изменялись. Однако при низкосолевой диете была зафиксирована обратная взаимосвязь между значениями ФФ и скоростью удаления глюкозы (мг/кг веса без учета жировой массы) как при низком уровне инсулина (r = –0,70), так и при высоком (r = –0,83). При повышении солевой нагрузки эта взаимосвязь ослаблялась. Авторы считают, что «высокие значения инсулинорезистетности, но не повышение соли в диете, может предпрасполагать пожилых гипертензивных индивидов к ренальным повреждениям за счет ухудшения ренальной гемодинамики путем повышения гломерулярного плазматока, что в результате приводит к гиперфильтрации» [8]. В целом в данный момент гиперфильтрация определяется по крайней мере тремя разными способами. Во-первых, как аномально высокая гломерулярная фильтрация всей почкой, во‑вторых, как повышенная фильтрационная фракция и, в‑третьих, как повышенная фильтрация через нефрон [9]. Медицинский алфавит. Современная лаборатория 3 / 2013 19 Таблица 1 Пограничные уровни гиперфильтрации (> 95-й процентили) и гипофильтрации (< 5-й процентили) в зависимости от возрастного интервала [18] Возрастной интервал, лет 20–29 30–39 40–49 50–59 60–69 70–89 Гиперфильтрация, мужчины > 117 > 108 > 103 > 98 > 95 > 96 Гипофильтрация, мужчины < 75 < 70 < 65 < 60 < 55 < 50 Гиперфильтрация, женщины > 129 > 116 >106 > 101 > 95 > 90 Гипофильтрация, женщины < 77 < 71 < 65 < 60 < 55 < 51 Оставив тяжелый выбор между этими положениями результатам будущих исследований и резолюциям грядущих международных конференций, подчеркнем, что, несмотря на все эти вышеуказанные трудности, на практике в большинстве исследований значениями гиперфильтрации считают те, которые находятся в диапазоне от 125 мл/мин./1,73м 2 до 145 мл/мин./1,73м 2 [10–11]. Подробное изложение текущих представлений о механизмах гиперфильтрации можно найти в недавних обзорах [9, 12–15]. Еще одна сложность, связанная с корректностью определения уровней как гиперфильтрации, так и гипофильтрации, — их зависимость от возраста. У здоровых людей с возрастом показатели СКФ снижаются. Каковы критерии и гиперфильтрации и гипофильтрации в зависимости от возраста и пола? Еще в ранних исследованиях было установлено, что в недиабетической популяции после 40 лет СКФ ежегодно снижается на 1 мл/мин./1,73м 2 (дельта СКФ — 1 мл/мин./1,73 м 2/год) [16]. В дальнейшем при наблюдении 662 пациентов с СД 2, выяснилось, что без поправки на возраст доля лиц с гиперфильтрацией составляла 7,4 %, а после поправки — 16,6 % [17]. Для более точного решения этой проблемы в Японии в течение десяти лет наблюдались 99 140 мужчин и женщин в возрасте от 20 до 89 лет. СКФ определяли с помощью сывороточного креатинина по формуле MDRD, адаптированной для японской популяции. Вся исследованная популяция была распределена на возрастные группы (20–29 лет, 30–39 лет и т. д.) [18]. Гиперфильтрацией считали уровень СКФ, превышающий значения, характерные для 95-й процентили популяции здоровых лиц с учетом пола и возраста, гипофильтрацией полагали значения СКФ ниже 5-й процентили. 20 Показано, что пограничные уровни гиперфильтрации и гипофильтрации с возрастом действительно понижаются, см. табл. 1. Подчеркнем, что данные пограничные уровни гиперфильтрации и гипофильтрации характерны для японской популяции. Как правильно измерять гиперфильтрацию СКФ по креатинину: «слепая зона» от гиперфильтрации до третьей стадии ХБП Золотой стандарт точного измерения СКФ — внутривенная инфузия экзогенного маркера, который полностью фильтруется в клубочках, в канальцах не абсорбируется и не секретируется. Однако из-за сложности и высокой стоимости эти методики редко используется даже в научных исследованиях. Наиболее распространенные методы определения СКФ те, которые основаны на измерении эндогенного маркера креатинина. Это: 1) клиренс креатинина (который систематически завышает СКФ) изза тубулярной секреции креатинина, особенно при низких значениях СКФ; 2) применение формул, учитывающих концентрацию сывороточного креатинина и антропометрические показатели; эти методики также неточны, в зоне гиперфильтрации они занижают реальные значения СКФ, а в зоне ранней гипофильтрации нет пропорциональности между ранним снижением СКФ, выявляемым по экзогенному маркеру, и повышением сывороточного креатинина [19]. Действительно, при определении значений дельты СКФ у пациентов с СД 1 с исходной СКФ, составлявшей 106 ± 2,6 мл/мин./1,73м 2, измеренной с помощью экзогенного маркера (меченный радиоактивным техницием диэтилен-триамин — пентауксусная кислота), дальнейшие определения Медицинский алфавит. Современная лаборатория 3 / 2013 СКФ в течение десяти лет проводили как с помощью креатинина, так и с помощью экзогенного маркера. Оказалось, что определение СКФ, основанное на креатинине, занижало истинный градиент падения СКФ на 50 % (20). Широко распространенная формула для расчета СКФ по сывороточному креатинину (например, MDRD) дает удовлетворительное определение СКФ в диапазоне, характеризующем снижение СКФ от третей стадии ХБП до терминальных стадий ренальных заболеваний (ТСРЗ), а в диапазоне от 150 до 60 мл/мин./1,73м 2 пропорциональности между истинными значениями СКФ и уровнями сывороточного креатинина нет. В частности, при СД 2 формула MDRD серьезно занижает истинные значения СКФ на всем диапазоне вплоть до 60 мл/мин./1,73м 2 [21]. Действительно, весьма убедительно показано, что в зоне умеренной СКФ формула MDRD определяет их значения у пациентов с СД 2 менее точно, чем у здоровых индивидов [22, 23]. В целом недостатки креатинина, как маркера СКФ, таковы: 1) из-за большого функционального резерва почек концентрация креатинина может не изменяться в случаях, когда большая часть почек уже не функционирует; 2)при снижении клубочковой фильтрации происходит компенсаторное повышение канальцевой секреции креатинина, в результате чего происходит ложное завышение оценки функции почек; 3)уровни креатинина очень инерционны, это не позволяет своевременно оценивать изменения СКФ при ухудшении или улучшении ренальных функций: 4)при острых изменениях функции почек креатинин недостаточно точно отражает реальную картину до тех пор, пока не достигается некоторая стабилизация состояния почек, что чаще всего происходит через 24–48 часов после первоначального повреждения, 5)на ранних стадиях развития ренальной дисфункции в диапазоне СКФ выше 115 мл/мин./1,73 м 2 (гиперфильтрация) и от 90 до 40 e-mail: medalfavit@mail.ru мл/мин./1,73м 2 (ранние стадии гипофильтрации) нет пропорциональности между уровнями креатинина и истинными значениями СКФ [24]. В 2009 году была опубликована формула CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), имеющая большую точность, чем MDRD, особенно в диапазоне СКФ > 60 мл/мин./1,73м 2. Формула использует значения уровней сывороточного креатинина и возрастные и этнические характеристики [25]. В недавно проведенном исследовании при наблюдении 842 пациентов с СД, имевших разную тяжесть альбуминурии и ХБП, сравнивали точность определения СКФ по формулам CKD-EPI и MDRD. Показано, что при нормоальбуминурии значения СКФ, согласно CKD-EPI, были выше, чем при использовании формулы MDRD: 103 (91–115) против 97 (85– 113 мл/мин./1,73 м 2. Формула CKD-EPI выявляла 76,7 % случаев ХБП первой стадии (СКФ > 90 мл/мин./1,73м 2), а формула MDRD — 65,1 %. При микрои макроальбуминурии и при тяжелых стадиях ХБП разницы в точности обеих формул найдено не было. Авторы считают, что «формула CKD-EPI является лучшим маркером СКФ для пациентов с нормоальбуминурией и гиперфильтрацией и может использоваться для скрининга ранних ренальных нарушений при СД» [26]. Большинство более точных исследований, включающих измерение гиперфильтрации, выполняются с помощью однократной внутривенной инфузии таких экзогенных маркеров СКФ, как инулин, иогексол, иоталамат и маркеров, содержащих изотопную метку, таких как этилен-диамино-тетра-ацетат (ЭДТА), диэтилен-триамино-тетра-ацетат. Сравнительно недавно появился эндогенный маркер СКФ, по свой точности сопоставимый с экзогенными. Цистатин С — точный маркер СКФ: от гиперфильтрации до гипофильтрации Цистатин С — это белок семейства цистатинов (молекулярная масса 13 Кда), его функция — ингибитор цистеиновых протеаз. С постоянной скоростью синтезируется всеми ядросодержащими клетками. Имеe-mail: medalfavit@mail.ru Рисунок 1. Динамика СКФ у пациентов с СД 2, измеренная с помощью клиренса иоталамата, цистатина С и креатинина. Снижение СКФ в диапазоне от гиперфильтрации до нормофиль‑ трации, определяемое по иоталамату и цистатину С, прогнозирует развитие ХПН третьей стадии, измерение СКФ по креатинину такой прогностической способности не имеет [30]. ет 100 %-ный клиренс, полностью фильтруется в почках, полностью реабсорбируется и катаболизируется в проксимальных канальцах. Канальцами не секретируется. В норме в моче практически не обнаруживается. Уровень в плазме практически не зависит ни от пола, ни от мышечной массы, ни от возраста (идеальный педиатрический и гериатрический маркер СКФ). При тубулярных патологиях в больших количествах выходит в мочу. В целом сывороточный цистатин С — маркер гломерулярной дисфункции, наиболее точный эндогенный индикатор СКФ на всем ее диапазоне; уровень цистатина С в моче — маркер тубулярной дисфункции [27–29]. При сравнении с экзогенным маркером (клиренс диэтилен-триамин-пента-ацетата, меченного радиоактивным технецием) наиболее точным эндогенным маркером гиперфильтрации у пациентов с СД 1 оказался цистатин С [30]. У 85 пациентов с СД 1 СКФ измеряли в течение десяти лет. Исходная СКФ (по экзогенному маркеру) составляла 106,1 мл/мин./1,7м 2. Сравнивали значения дельта СКФ, определенные с помощью креатинина (Кокрофт-Гульт, MDRD) и цистатина С (по формуле Хоек, СКФ = 86,7 / цистатин С (мг/л) — 4,2). Значения дельта СКФ (мл/мин./1,73м 2 в год) составляли: по экзогенному маркеру 6,5; по Кокрофту-Гульту 3,6; по MDRD 3,4; по цистатину С 6,1 [20]. В другом исследовании у 30 пациентов с СД 2 в течение четырех лет регулярно определяли СКФ с помощью иоталамата и цистатина С. При серийных измерениях СКФ было обнаружено, что предиктором падения СКФ является не только высокий исходный уровень гиперфильтрации, но и значения дельта СКФ в ее нормальном интервале от ~ 150 мл/мин./1,73м 2 (гиперфильтрация) до 80 мл/мин./1,73 м 2 (нормофильтрация), определенные с помощью экзогенного маркера и цистатина С, рис. 1. Определение СКФ с помощью креатинина (MDRD) не выявляло ни гиперфильтрации, ни снижения СКФ в диапазоне от 150 до 80 мл/мин./1,73 м 2. Собственно, именно поэтому этот диапазон и называется «слепой зоной креатинина» [30]. Так, в большом исследовании, включавшем наблюдение 10 403 пациентов, даже при СКФ (по цистат и н у С ) , с о с т а вл я в ш е й 6 0 – 7 4 мл/мин./1,73м 2, и при отсутствии альбуминурии (альбумин/креатинин < 10 мг/г), был обнаружен повышенный риск развития ХБП, ССЗ и смертности. В целом, как оказалось, около 10 % лиц из данной популяции имели повышенный риск развития Медицинский алфавит. Современная лаборатория 3 / 2013 21 ХБП, при стандартной диагностике по микроальбумину и по СКФ по креатинину эти индивиды оказались бы не выявлены [31]. Отметим, что весьма полезны методы определения СКФ согласно одновременному определению сывороточных уровней цистатина С и креатинина [32, 33]. Весьма существенно, что цистатин С — это также и маркер преклинического заболевания почек, которое характеризует лиц: а) без клинических заболеваний почек; б) с «нормальной» СКФ по креатинину > 60 мл/мин./1,73 м 2; но в) с повышенным сывороточным цистатином С ≥ 1,0 мг/л. Преклиническое заболевание почек независимо от других факторов обусловливает риск клинических заболеваний почек и риск развития их сердечно-сосудистых осложнений [34]. В США измерение цистатина С рекомендуется для рутинного скрининга ренальной дисфункции и связанных с ней ССЗ у всех лиц от 55 лет и старше [35]. Итак, многочисленными исследованиями показано: как маркер СКФ сывороточный цистатин С значительно превосходит сывороточный креатинин и клиренс креатинина, так как способен: 1) диагностировать самые ранние изменения СКФ: а) гиперфильтрацию и ранние стадии гипофильтрации, 2)быстро отслеживать снижение СКФ при развитии ОПП (острое повреждение почек), 3)точно оценивать ренальные функции у педиатрических и гериатрических пациентов, 4)прогнозировать сердечно-сосудистые и другие осложнения дисфункции почек [27–29, 36–38]. Состояния и патологии, связанные с гиперфильтрацией Беременность При нормальной беременности СКФ и объем кровотока в почках повышаются на 40–65 % и на 50–85 % соответственно [39]. При неосложненной беременности гиперфильтрация с ренальными повреждениями не связана и после родов СКФ быстро приходит в норму [9]. 22 Курение При длительном наблюдении 649 здоровых индивидов было найдено, что у курильщиков высокий риск гиперфильтрации и протеинурии связан с повышенным уровнем высокочувствительного С-реактивного белка (маркер эндотелиальной дисфункции) [40]. В уже упоминавшемся японском исследовании, включавшем 10 118 лиц (мужчины, возраст 40–55 лет, не имевшие в начале наблюдения протеинурии или ренальной дисфункции), обнаружилось, что курильщики имеют риск развития гиперфильтрации, составлявший 1,32 и риск протеинурии, равный 1,51 [41]. Аутосомальное доминантное поликистозное заболевание почек (autosomal dominant polycystic kidney disease, ADPKD) Это наиболее частое генетически опосредованное заболевание, ведущее к ХБП и ТСРЗ [42]. В длительном исследовании показано, что у детей с ADPKD при гиперфильтрации (клиренс креатинина > 140 мл/мин./1,73 м 2) повышены размер почек и дельта СКФ. Так, у детей с ADPKD и исходной гиперфильтрации дельта СКФ составляла 5,0 ± 0,8 мл/год, а у детей без гиперфильтрации — 1,0 ± 0,4 мл/год [43]. Фокальный сегментированный гломерулосклероз (focal segmental glomerulosclerosis, FSGS) в настоящее время наиболее распространенная причина нефротического синдрома у взрослых. Одна из причин первичного FSGS — мутации в щелевой диафрагме (slit diaphragm) и в цитоскелете подоцитов, другая причина — аутоиммунные повреждения подоцитов [44, 45]. Вторичный FSGS наблюдается при гипертрофии почек при ожирении, после значительного уменьшения ренальной массы и повышении нагрузки на оставшиеся функциональные нефроны [46]. Показано, что эти патологии характеризуются гиперфильтрацией [47]. Талассемия При этой патологии гиперфильтрация наблюдается у одной трети детей и взрослых (48,49). Так, у 51 % из 280 больных с гомозиготной сер- Медицинский алфавит. Современная лаборатория 3 / 2013 повидно-клеточной анемией обнаружилась гиперфильтрация (MDRD). Среди таких пациентов 49 % имели только гиперфильтрацию и нормоальбуминурию, 36 % гиперфильтрацию с микроальбуминурией и 15 % гиперфильтрацию с макроальбуминурией. Полагается, что гиперфильтрация при серповидно-клеточной анемии связана с васкулопатией, ассоциированной с хроническим гемолизом [50]. Гиперфильтрация также может быть при синдроме обструктивного апноэ во время сна [51], односторонней агензии почек [52], врожденной олигонефропатии [53], а также приобретенном снижении массы почек [54]. У таких пациентов развивается ранняя протеинурия, связанная с гломерулосклерозом. Метаболический синдром Метаболический синдром (МС) связан с высоким риском прогрессирования к СД 2 и диабетической нефропатии и с риском развития макрососудистых и микрососудистых осложнений. Связана ли с МС гиперфильтрация? С какими его факторами? МС, как известно, диагностируется при наличии любых трех из пяти факторов, включающих триглицеридемию, пониженный уровень ЛПВП, гипергликемию, повышенное кровяное давление и повышенную окружность талии. Наблюдались 1 572 практически здоровых мужчин, средний возраст 18,2 года. СКФ определяли по клиренсу креатинина (Кокрофт-Гульт). МС был диагностирован у 137 лиц (8,7 %) и оказался связанным с повышением риска гиперфильтрации в 6,9 раза. При этом излишний вес повышал риск гиперфильтрации в 6,6 раза, повышенное давление в 3,8 раза и сниженный ЛПВП в 1,8 раза [55]. Недавние исследования на лабораторных животных подтвердили, что главный фактор риска гиперфильтрации при МС — ожирение. Оказалось, что на ранних стадиях МС гиперфильтрация связана с ренальной адипозностью и повышенной микроваскулярной пролиферацией, которая затрагивает ренальный кортекс и предшествует инициации оксидативного стресса и активации воспаления [56]. e-mail: medalfavit@mail.ru Ожирение При наблюдении 12 лиц с тяжелым ожирением (ИМТ > 38 кг/м 2) и не имевших СД и 9 здоровых лиц без ожирения было установлено, что клиренс инулина при ожирении составил 136 ± 8 мл/мин./1,73 м 2 против 90 ± 5 мл/мин./1,73м 2 в контрольной группе [57]. В недавнем исследовании, включавшем 8 592 лица без СД, СКФ, определяемая по клиренсу креатинина, была прямо пропорциональна показателям ИМТ [58]. Снижение ИМТ снижает гиперфильтрацию При измерении клиренса инулина показано, что у лиц с тяжелым ожирением СКФ после гастропластики снизилась от 145 ± 14 до 110 ± 7 мл/мин./1,73 м 2 с параллельным снижением ИМТ на 32 % [62]. В аналогичном исследовании у 61 пациента с ожирением после бариатрической хирургии были получены сходные результаты (наблюдение в течение 24 месяцев) [63]. В другом исследовании при наблюдении 140 пациентов с ожирением, повергшихся бариатрической хирургии, значительное снижение веса было связано со снижением СКФ от 150 до 115 мл/мин./1,73м 2 в течение восьми месяцев [64]. ных с гипертензией, индуцированной повышенными концентрациями NaCl с помощью ингибитора вазопептидазы — омапатрилата (omapatrilat) и ингибитора ангиотензин-превращающего фермента каптоприла (captopril) гиперфильтрация была связана с последующим быстрым падением ренальной функции и развитием гломерулосклероза [66]. Недавно проведенное наблюдение 1 106 гипертензивных индивидов (возраст 33,1 ± 8,5 лет, кровяное давление 146 ± 10,5 / 94 ± 5,0 мм Hg, клиренс креатинина > 60 мл/мин./1,73м 2) включало измерение систолического давления и уровней эпинефрина и норэпинефрина в моче (за 24 часа). Гиперфильтрация (СКФ ≥ 150 мл/мин./1,73м 2) была диагностирована у 210 индивидов. Независимыми предикторами гиперфильтрации оказались (соотношение рисков): а) ожирение — 6,1; б) мужской пол — 2,9; в) амбулаторная гипертензия — 2,0; г) «синдром белого халата» > 15 мм Hg; д) интенсивное потребление кофе и ж) эпинефрин > 25 мкг/ > кг/24 часа. Авторы полагают, что «гиперреактивность на стресс, определяемая по уровню эпинефрина и „синдрома белого халата” на ранних стадиях гипертензии связаны с гломерулярной гиперфильтраций» [67]. Особо отметим, что цистатин С — весьма точный показатель гиперфильтрации при гипертензии. Так, у лиц с СКФ (по цистатину С) в верхней терцили > 115 мл/мин./1,73м 2 альбуминурия развивалась более часто, чем в при СКФ нижней терцили. Значения СКФ по креатинину такой прогнозирующей способности не имели. В общем, «определение СКФ по цистатину С на ранних стадиях гипертензии — это более чувствительный метод для прогнозирования развития микроальбуминурии, чем определение клиренса креатинина» [59]. Гипертензия При наблюдении 37 молодых индивидов с мягкой гипертензией и 45 нормотензивных лиц обнаружено, что гиперфильтрация связана с активацией ЦНС и РААС, при этом СКФ у гипертензивных лиц была повышена на 10,5 ± 7,2 мл/мин./1,73м 2 против 6,8 ± 5,7 мл/мин./1,73м 2 в контрольной группе [65]. У лабораторных живот- Нарушенная толераность к глюкозе Исследование включало 1 560 лиц, возраст 50–62 года, без СД, нарушение толерантности к глюкозе составляло 5,6–6,9 ммоль/л, СКФ определяли по клиренсу иогексола, гиперфильтрацией считали СКФ > 90-й процентили, проводились поправки на пол, возраст, вес, рост, на применение ингибиторов РААС. Ожирение и гипертензия При наблюдении мужчин с гиперетензией было обнаружено, что при ожирении средние значения СКФ составляют 165,3 ± мл/мин./1,73 м 2 против 119,3 ± 1,7. Это свидетельствует о том, что при ожирении почки более чувствительны к неблагоприятному влиянию повышенного кровяного давления, чем при нормальном весе [59]. Однако, согласно сравнительно недавним наблюдениям, ожирение может приводить к гиперфильтрации и дальнейшему прогрессированию ХПН и у лиц без гипертензии [60, 61]. e-mail: medalfavit@mail.ru Действительно, нарушенная толерантность к глюкозе оказалась связанной с гиперфильтрацией: отношение рисков — 1,56. Расчеты показали, что повышение прерандиальной глюкозы или гликозилированного гемоглобина (HbA1c) на одну единицу повышало риск гиперфильтрации на 1,97 и 2,23 соответственно. Выше уровня глюкозы, равного 5,4 ммоль/л, СКФ повышается более круто. Связи между уровнями инсулина натощак и гиперфильтрацией найдено не было. Таким образом, как утверждают авторы, уже «пограничный уровень гипегликемии связан с гиперфильтрацией». В целом, в данном исследовании нарушенная толерантность к глюкозе была связана с гиперфильтрацией независимо от возраста, пола, ИМТ, кровяного давления, статуса курения и уровня инсулина. Авторы полагают, что «у лиц с предиабетом или с прегипертензией должен проводиться точный мониторинг СКФ для выявления индивидов с гиперфильтрацией, которые могут иметь повышенный риск последующего нарушения функции почек» [68]. В другом исследовании, при наблюдении 111 пациентов с гипертензией (стадия I или II) и не имевших СД, было обнаружено, что гиперфильтрация может быть показателем раннего нарушения функции миокарда. Исследовали связь между ренальной гемодинамикой и гипертрофией левого желудочка (эхокардиография), ренальный кровоток определяли с помощью аминогиппуровой кислоты, меченной с помощью иода-131 и клиренса креатинина. Показано, что СКФ положительно связана с массой левого желудочка, при этом у гипертензивных пациентов с гипертрофией левого желудочка наблюдалась гиперфильтрация (по сравнению с пациентами без гипертрофии левого желудочка), при этом различий в объеме ренального кровотка выявлено не было. Таким образом, «у гипертензивных пациентов гиперфильтрация может быть индикатором ранних патологических изменений в миокарде» [69]. Предиабет и прегипертензия В упоминавшемся уже японском исследовании, в котором десять лет наблюдались 99 140 мужчин Медицинский алфавит. Современная лаборатория 3 / 2013 23 и женщин, было также обнаружено, что у лиц с гиперфильтрацией преимущественно были повышены уровни препрандиальной глюкозы, а у лиц с гипофильтрацией преимущественно были: а) более старший возраст, в) высокая мочевая кислота, г) дислипидемия и д) протеинурия. Гиперфильтрация была связана также с риском развития хронической почечной недостаточности. Отношения рисков гиперфильтрации составляли: а) предиабет первой стадии — 1,29; б) предиабет второй стадии — 1,58; в) диабет — 2,47; г) прегипертензия первой стадии — 1,1; д) прегипертензия второй стадии — 1,33; е) гипертензия — 1,5. Связи гипофильтрации с предиабетом и прегипертензией найдено не было (контрольная группа — лица с нормофильтрацией). Авторы заключают, что «риск гиперфильтрации возрастает с повышением стадии предиабета и прегипертензии. Поэтому у индивидов с предиабетом и прегипертензией должен проводиться мониторинг почечных функций. Ранняя терапия гипергликемии и гипертензии у пациентов с гиперфильтрацией может быть необходимой для предотвращения развития нарушений почек» [18]. Гиперфильтрация при альбуминурии, не связанной с СД При наблюдении 77 228 лиц, не имевших СД, СКФ определяли согласно клиренсу креатинина и измеряли скорость экскреции альбумина (СЭА) в мочу. Согласно значениям СЭА (мг/24 часа) вся когорта была разделена на четыре группы: первая — 0–15, (контроль); вторая — 15–30; третья — 30–300 и четвертая > 300 (макроальбуминурия). После необходимых поправок оказалось, что уровни экскреции альбумина, составлявшие 15–30 и 30–300 мг/24 часа были связаны с повышением риска гиперфильтрации, составлявшим 1,8 и 1,7 соответственно. Макроальбуминурия (> 300 мг/24 часа) была связана со снижением СКФ, риск которого составлял 4,3. Итак, гиперфильтрация может быть связана с повышением экскреции альбумина даже у лиц без гипергликемии [70]. 24 Гиперфильтрация при сахарном диабете СД 1. Среди пациентов с СД первого типа (СД 1) доля лиц с гиперфильтрацией обычно находится в диапазоне от 40 до 60 % [17, 71, 72]. В отдельных исследованиях эта доля составляла 13 % [73], в других 67 % [74] и достигала 75 % [75]. Факторами, связанными с повышенной вероятностью гиперфильтрации при СД 1, являются: 1) уровень альбуминурии, 2) длительность заболевания, 3) ранний возраст инициации болезни, 4) пубертатный статус [76]. Определение при СД СКФ с помощью измерения сывороточного цистатина С, в отличие от креатинина, точно отражало динамику СКФ при гиперфильтрации, нормофильтрации и гипофильтрации, приближая ее значения к измеренным с помощью экзогенных маркеров [77, 78]. Чем выше гипергликемия, тем выше гиперфильтрация. Еще в ранних исследованиях было обнаружено, что гиперфильтрация положительно связана с повышением HbA1c [79]. Основной детерминант гиперфильтрации на ранних стадиях СД 1 — гипергликемия. На этих стадиях гиперфильтрация также связана с увеличением размера почек и может быть нормализована с помощью интенсивной терапии инсулином [80]. Отклик повышения СКФ в ответ на повышение гипергликемии весьма быстрый: достаточно было у пациентов с СД 1 в течение 80 минут зафиксировать глюкозу на уровне 12,5 ммоль/л, как у пациентов с гиперфильтрацией СКФ дополнительно повышалась на 12 %, а у пациентов с СД 1 и с нормофильтрацией, как и в контрольной группе, подобного не наблюдалось [81, 82]. СД 2. При использовании как креатинина, так и экзогенных маркеров гиперфильтрация обнаруживалась примерно у 50 % пациентов с впервые диагностированным СД 2 (83–85). В других исследованиях было обнаружено, что доля лиц с СД 2, имеющих гиперфильтрацию, может составлять 0 % (86,87), 6 % (88), 35 % и 45 % (83,89) и даже 62 % (90). Основные факторы, которые привели к такой Медицинский алфавит. Современная лаборатория 3 / 2013 вариабельности результатов исследований, разные: возраст пациентов, степень гликемического контроля, длительность заболевания, методы определения СКФ [91]. Более того, начало развития СД 2 происходит, как правило, за семь лет до постановки диагноза, Таким образом, точно установить, была ли у пациента с текущей нормофильтраций предшествовавшая гиперфильтрация весьма затруднительно. Не исключительно, что действительный риск гиперфильтрации при СД 2 выше, чем устанавливаемый в исследованиях [92]. Наиболее точное определение СКФ при СД 2 — с помощью цистатина С. Так, для дискриминации между СД 2 с нормальной СКФ (> 80 мл/мин./1,73м 2) и сниженной СКФ (< 80 мл/мин./1,73м 2) диагностическая точность цистатина С составляла 90 %, креатинина — 77 %. При пограничном уровне цистатина С, равном 0,93 мг/л, количество ложноположительных результатов — 7,7 %, ложноотрицательных — 1,9 %. При пограничном уровне креатинина, равном 87,5 мкмоль/л, количество ложноположительных результатов — 5,8 %, а ложноотрицательных — 17,0 % [93]. Итак, приведенные данные свидетельствуют: при ренальных патологиях исходная гломерулярная гиперфильтрация может быть связана с более тяжелым ухудшением почечных функций, чем при нормофильтрации. Является ли альбуминурия предиктором нефропатии? Общепринято, что предиктором развития тяжелых ДН считается микроальбуминурия. Такой вывод был сделан на основе исследований, проведенных в начале восьмидесятых годов [94–96]. В этих исследованиях пациенты с микроальбуминурией (скорость экскреции альбумина в мочу — СЭА от 30 до 300 мкг/мин.) наблюдались от 7 до 14 лет, при этом поздние стадии нефропатии действительно развились у 60–90 % из них. На этом основании было решено, что микроальбуминурия — состояние, которое приводит к протеинурии, которая, в свою очередь, инициирует процесс утраты почечных функций, ведущий e-mail: medalfavit@mail.ru к ТСРЗ [97]. Далее следовал вывод: микроальбуминурия — это сигнал для начала терапии, направленной на предотвращение протеинурии с помощью блокады РААС [98, 99]. Впоследствии, однако, выяснилось, что микроальбуминурия — это не однозначно обязательная стадия прогрессирования к поздним стадиям нефропатии, а динамический процесс, который скорее вернется к нормоальбуминурии, чем приведет к протеинурии [100–103]. В недавних широкомасштабных исследованиях показано, что большинство (52 %) микроальбуминурических пациентов с СД 1 на самом деле имеют динамический процесс, который был назван «прерывистой микроальбуминурией» (intermittent microalbuminuria) [104], при котором, как показало шестилетнее наблюдение, спонтанная ремиссия к нормоальбуминурии происходит приблизительно в 50 % случаев [100, 101]. В целом риск ремиссии к нормоальбуминурии перевешивает риск прогрессирования к протеинурии [100–107]. Таким образом, микрольбуминурия не обязательно ведет к протеинурии и поздним стадиям ХБП. Более того, прогрессирование к тяжелой нефропатии также может происходить без протеинурии. Прогрессирование ХБП поздним стадиям возможно и без альбуминурии Наблюдали 79 пациентов с СД 1, у которых в течение первых четырех лет развилась микроальбуминурия, затем их наблюдали еще в течение 12 лет. Обнаружено, что риск прогрессирования к 3–5 стадии ХБП (СКФ < 60 мл/мин./1,73м 2) составлял 29 %. Однако примерно у половины пациентов, у которых протеинурии не было, тем не менее также развивалось снижение СКФ < 60 мл/мин./1,73м 2, при этом независимо от применения ингибиторов ангиотензин-превращающего фермента [108]. В другом исследовании наблюдался 301 пациент с микроальбуминурией и 268 лиц с нормоальбуминурией. СКФ измеряли с помощью цистатина С. Показано: а) микроальбуминурия — это динамический процесс с высокой e-mail: medalfavit@mail.ru вероятностью ремиссии к нормоальбуминурии; б) падение СКФ происходит только у трети пациентов, притом как с ранней микроальбуминурией, так и с длительной. Таким образом, по мнению авторов, «поскольку микроальбуминурия только в 30 % случаев связана с падением СКФ < 60 мл/мин./1,73м 2, надежным индикатором ухудшения ренальных функций является серийное определение СКФ по цистатину С» [109]. Таким образом, микроальбуминурия не обязательно предсказывает развитие протеинурии, а снижение ренальной функции (согласно падению СКФ) не обязательно связано с развитием альбуминурии. Это означает, что для корректной и своевременной диагностики ХБП показатели СКФ, микроальбумин и протеинурия должны регулярно измеряться как комплекс независимых друг от друга диагностических маркеров [110]. Снижение СКФ и повышение альбуминурии — это раздельные процессы по крайней мере на ранней стадии нефропатии Еще в 1984 году при исследования пациентов с СД 1: а) с исходной СКФ 155 мл/мин./1,73м 2 и микроальбуминурией и б) с исходной СКФ 143 мл/мин./1,73м 2 и нормоальбуминурией неожиданно обнаржилось, что ранее снижение ренальной функции происходило у 31 % пациентов с микроальбуминурий и у 9 % с нормоальбуминурией. У пациентов с удвоенным повышением СЭА (наблюдение четыре года) была более высокая частота раннего снижения СКФ (67,7 %), чем у пациентов со стабильной микроальбуминурией (32,2 %). Количество лиц с СД 1, прогрессирующих до третьей стадии ХБП (в расчете на 1 000 индивидов в год), составляло при нормоальбуминурии — 1,0; при микроальбуминурии — 1,3; при макроальбуминурии — 36,1. Таким образом, как утверждали авторы, «на ранних стадиях развития диабетической нефропатии снижение СКФ и повышение СЭА — это раздельные (separate) процессы, которые становятся более связанными на поздних стадиях ее прогрессирования» [96]. В проспективном исследовании наблюдались 5 422 мужчины и жен- щины (средний возраст 61 год). Все пациенты были разделены на четыре группы, имевшие следующие характеристики: а) наличие или отсутствие микроальбуминурии (критерии микроальбуминурии — отношение альбумин/креатинин > 17 и > 25 мкг/мг у мужчин и у женщин соответственно); б) повышенный (≥ 1,0 мг/л) или нормальный сывороточный цистатин С. В течение 4,7 лет ХБП третьей стадии (СКФ ≥ 60 мл/мин. / 1,73 м 2) развилась у 554 лиц (10 %). Обнаружено, что а) у 13,7 % пациентов был повышенный цистатин С; при этом риск ХБП третьей стадии составлял 1,37; б) у 8,4 % была микроальбуминурия, риск ХБП третьей стадии составлял 1,57; в) у 2,7 % был повышенный цистатин С и микроальбуминурия, риск ХБП третьей стадии составлял 2,12. Авторы считают, что «цистатин С и микроальбуминурия — это независимые факторы риска ХБП третьей стадии, которые могут применяться для скрининга лиц, такой риск имеющих» [111]. При СД 1 снижение СКФ может начинаться до микроальбуминурии Как уже говорилось, начиная с 80-х годов клинический диагноз диабетической нефропатии основывается на прогрессировании альбуминурии. Полагается, что начало падения СКФ начинается вместе с развитием микроальбуминурии и поэтому, как предполагается, процесс, приводящий к микроальбуминурии, является причиной снижения СКФ. В 2003 году было установлено, что при СД 1 предиктивное значение микроальбуминурии по отношению к развитию ХПН составляет 30–50 %. А спонтанная ремиссия микроальбуминурии происходит у более чем 50 % пациентов [100]. Позднее было показано, что у 25 % лиц с СД 1 снижение СКФ < 60 мл/мин./1,73м 2 происходит до микроальбуминурии. По мнению авторов, «микроальбуминурия предсказывает снижение СКФ в интервале 6–14 лет у только 60–80 % пациентов с СД 1» [109]. В другом исследовании в течение 15 лет у 89 из 1 439 пациентов с СД 1 было обнаружено персистирующее снижение СКФ до < 60 Медицинский алфавит. Современная лаборатория 3 / 2013 25 мл/мин./1,73м 2, при этом 21 пациент из этих 89 имел нормоальбуминурию [112]. Недавнее исследование, основанное на определении СКФ с помощью цистатина С, показало: снижение ренальной функции при СД 1 у трети пациентов происходит до развития альбуминурии [113]. При СД 2 снижение СКФ может начинаться до микроальбуминурии Исследования с точным измерением СКФ (радиоактивно меченные экзогенные маркеры) показали, что 25 % пациентов с СД 2 и нормоальбуминурей прогрессируют до ХБН третьей стадии [114]. В большом и точном исследовании (клиренс иолталамата в моче) было обнаружено, что при СД 2 на начальной стадии ДН ранее снижение СКФ происходило: а) у 32 % пациентов с нормальным исходным соотношением альбумин/ креатинин в моче, б) у 42 % с микроальбуминурией и 3) у 72 % с макроальбуминурией. А развитие ТСРЗ в течение десяти лет имело место: а) у 41 % больных с ранним снижением СКФ и б) у 15 % пациентов вообще без такового. Был сделан вывод: «ранее снижение СКФ часто происходит до начала микроальбуминурии, но ухудшение ренальной функции, предсказывающее ТСРЗ, зависит от прогрессирования к макроальбуминурии» [115]. В целом у 24 % лиц с СД 1 и у 20 % лиц с СД 2 ХБП развивается до третьей стадии (СКФ < 60 мл/мин./1,7м 2) без микроальбуминурии и макроальбуминурии. Авторы обзорной статьи, в которой это утверждается, считают, что отсутствие согласованности между значениям СЭА и СКФ делают необходимым поиск новых маркеров, которые выявляли бы лиц с диабетом, имеющих риск снижения СКФ, независимо от прогрессирующего повышения СЭА. Поэтому «СЭА и СКФ должны измеряться вместе, как независимые друг от друга и взаимно незаменимые маркеры диабетической нефропатии» [116]. Следующий вопрос, связана ли c прогрессированием ДН ранняя тубулярная дисфункция, диагностируемая на основании маркеров, измеряемых в моче? 26 Ранняя тубулярная дисфункция ускоряет прогрессирование ДН Многократно показано, что в развитии ДН принимают участие как гломерулярные, так и тубулоинтерстициальные повреждения (см. обзор 117). u-Цистатин Показано, что у пациентов с СД 2 и нормоальбуминурией уровни s-цистатина С в сыворотке и в моче (u-цистатин С) при СКФ ≤ 60 (мл/ мин./1,73 м 2) были выше, чем при СКФ > 60. Так, уровни цистатина С составляли (мг/л): в сыворотке — при СКФ > 60 мл/мин./1,73м 2–0,86, при СКФ ≤ 60–1,21, в моче — п р и С КФ > 6 0 – 0 , 0 5 5 , п р и СКФ ≤ 60–1,108 мг/л. Полагается, что это вызвано развитием тубулярных нарушений еще до манифестации гломерулярной патологии. Авторы считают, что при СД 2 «уровни цистатина С в сыворотке и в моче связаны с субклиническим тубулярным повреждением и могут быть ранними маркерами гломерулярной и тубулярной патологии, предшествующей альбуминурии» [118]. В следующем исследовании проводили наблюдение 237 пациентов с СД 2, у которых в течение 13–44 месяцев измерялись соотношение u-цистатин/креатинин (urinary cystatin C to creatinine ratio, UCCR) и соотношение белков мочи, не относящихся к альбумину/креатинин (urinary nonalbumin protein to creatinine ratio, UNAPCR). Найдено, что значения обоих параметров были связаны со снижением СКФ. Значения UCCR имели положительную корреляцию со снижением СКФ в субпопуляции пациентов с СКФ ≥ 60 мл/мин./1,73м 2, а у пациентов с СКФ ≥ 60 мл/мин./1,73м 2 и с нормоальбуминурией с падением СКФ были связаны значения UNAPCR, но не UCCR. Регрессионный анализ показал, что значения UNAPCR и UNAPCR, соответствующие верхней терцили, связаны с прогрессированием к третей стадии ХБП. Авторы считают, что «уровни цистатина С в моче и концентрация белков мочи, не относящихся к альбумину, могут быть предикторами прогрессирования ДН при СД 2» [119]. Медицинский алфавит. Современная лаборатория 3 / 2013 Весьма интересными оказались результаты исследования связи уровней u-цистатина С у лабораторных животных с ДН (Zucker diabetic fatty rats). Обнаружено, что уровни u-цистатина С были повышенными даже у животных, у которых еще не было видимых гистопатологических ренальных нарушений. С прогрессированием ДН экспрессия цистатина С в проксимальных канальцах (иммуногистохимия) возрастала и была прямым образом связана с прогрессированием нефропатии [120]. NGAL, neutrophil gelatinase–associated lipocalin — липокалин, ассоциированный с желатиназой нейтрофилов, другое название липокалин 2. NGAL является компонентом острой фазы воспаления, принимает участие в процессах, связанных с регуляцией пролиферации поврежденных клеток и также может оказывать бактериостатическое действие. При развитии ОПП ишемической, нефротоксической или другой этиологии повышенный уровень NGAL с кровотоком поступает в почки и стимулирует дифференцировку и восстановление поврежденных ренальных эпителиальных клеток. Одновременно при ОПП NGAL начинает синтезироваться в дистальных нефронах и через два часа в больших количествах поступает в мочу и тем самым препятствует развитию инфекций мочеполового тракта. В целом при развитии ОПП повышенный «плазменный» NGAL абсорбируется в проксимальных канальцах и в мочу не секретируется, «ренальный» NGAL синтезируется в тонких восходящих окончаниях петли Генле и в собирательных трубках и поступает в мочу. Такое повышение уровня NGAL в моче является ранним диагностическим указанием на развитие ОПП разной этиологии [121]. СД 1. При наблюдении в течение четырех лет 78 пациентов с ДН при СД 1 было выявлено, что ежегодное повышение u-NGAL составляло 15 %, а снижение СКФ (51-Cr-ЭДТА) — 3,7 мл/мин. Однако исходные уровни u-NGAL не были связаны с падением СКФ, но предсказывали развитие ТСРЗ и летальность. Однако после поправок на известные e-mail: medalfavit@mail.ru факторы риска развития ТСРЗ такая взаимосвязь исчезла [122]. Аналогичные результаты были получены в другом исследовании, когда в моче 63 пациентов с СД 1 и ренальной патологией в течение трех лет измерялись NGAL, белок, связывающий жирные кислоты печеночного типа (liver-fatty acid-binding protein, LFABP), и белок повреждения почек — 1 (kidney injury molecule-1, KIM-1). Повышенные уровни u-NGAL и LFABP были связаны с быстрым падением СКФ, но после поправок на традиционные факторы риска дополнительной прогностической информации не давали [123]. СД 2 В относительно раннем исследовании при наблюдении 56 пациентов с СД 2 всех индивидов разделили на три группы (с нормоальбуминурией, микрольбуминурией и с ДН). Измерялись уровни NGAL в сыворотке и в моче. Как оказалось, у всех пациентов уровни s-NGAL и u-NGAL были: 1) повышенными (что существенно также и у пациентов с нормоальбуминурией); 2) степень такого повышения была параллельна тяжести ДН. Авторы высказали предположение, что «повышение синтеза s-NGAL может играть важную роль в патофизиологических механизмах адаптации почек, направленных на снижение тяжести тубулярной дисфункции, вызванной СД» [124]. В дальнейшем при наблюдении в течение 3,5 лет 177 пациентов с СД 2 и протенурией показано, что повышенные уровни u-NGAL и u-KIM-1 связаны с повышенным падением СКФ (при u-NGAL в верхней квартили ежегодное падение СКФ составляло 5,1 против 2,8 мл/мин./1,73м 2 в нижней квартили и при KIM-1 6,0 против 3,2). Однако дополнительной прогностической информации эти маркеры не давали [125]. Гиперфильтрация и ХБП: «чем выше влез, тем больнее падать» Впервые связь между уровнем исходной гиперфильтрации и последующим повышением СЭА и падением СКФ была обнаружена в 1984 и 1986 годах [87, 96]. В неe-mail: medalfavit@mail.ru давнем восьмилетнем наблюдении было обнаружено, что у пациентов с гипертензией I стадии величина СКФ является сильным и независимым предиктором альбуминурии. При этом у пациентов с исходной гиперфильтрацией развитие этой патологии происходит наиболее часто и наиболее быстро, риск равития микроальбуминурии при гиперфильтрации составлял 4,0 [59].Затем в исследовании, в котором в течение 18 лет наблюдали когорту из 423 лиц, у которых СД 1 был диагностирован еще в детстве, было показано, что гиперфильтрация была сильным фактором риска развития умеренной ренальной дисфункции, но не нефропатии с соотношением альбумин/ креатинин > 200мкг/мин. [126] Гиперфильтрация и дельта падения СКФ при СД 1 В трех независимых исследованиях [76, 96, 127] было показано, что исходная гиперфильтрация связана с повышенным риском последующего прогрессирования ХПН по крайней мере к микроальбуминурии. При повышении глюкозы до 13,5 ммоль/л СКФ повышается, но при превышении этого порогового уровня СКФ начинает снижаться. И тем быстрее, чем выше была гиперфильтрация [128]. Весьма показательны результаты мета-анализа, проведенного в 2009 году и включавшего наблюдение 780 пациентов с СД 1 в 12 разных исследованиях. У 130 пациентов в течение 11,2 лет развилась нефропатия, при этом исходная гиперфильтрация была связана с риском прогрессирования к микроальбуминурии, составляющим 2,71 (по сравнению с пациентами с исходной нормофильтрацией). Разница в СКФ между группой с исходной гиперфильтрацией и группой с нормольфильтрацией составляла 13,8 мл/мин./1,73 м 2. Был сделан вывод, что: а) гиперфильтрация — это обычная патология, связанная с СД 1, в особенности при плохом гликемическом контроле и б) гиперфильтрация связана с серьезным повышением риска развития микроальбуминурии [129]. Однако при наблюдении в течение 15 лет 426 пациентов с СД 1 и исходной нормоальбуминурией было показано, что гиперфильтрация (СКФ по цистатину С > 97,5-й процентили, 134 мл/мин./1,73м 2 для мужчин, 149 мл/мин./1,73м 2 для женщин) обнаруживалась у 24 % индивидов и не была связана с риском развития микроальбуминурии [130)] Чем вызваны такие несовпадения результатов исследований, касающихся связи гиперфильтрации, альбуминурии и при СД обоих типов? Похоже, тем, что разные авторы использовали разные критерии микроальбуминурии. Согласно согласованным критериям, микроальбуминурия имеет место, если два из трех измерений показывают СЭА с мочой > 20 мкг/мин [131]. Однако сравнительно недавние исследования показали, что такой критерий не гарантирует действительного выявления и мониторинга микроальбуминурии при СД 1 в течение длительных сроков. При использовании стандартного критерия микроальбуминурии спонтанная регрессия от микроальбуминурии к нормоальбуминурии происходит у 35–64 % пациентов [132]. Действительно, в течение шести лет ремиссия от микроальбуминурии к нормоальбуминурии была зафиксирована у 58 % пациентов с СД 1, притом независимо от терапии с помощью ингибиторов ангиотензин-превращающего фермента [100]. В целом мета-анализ результатов десяти исследований показывает: исходная гиперфильтрация повышает риск развития микроальбуминурии и макроальбуминурии в два раза [59, 75]. Гиперфильтрация и дельта падения СКФ при СД 2 При наблюдении в течение пяти лет 32 пациентов с СД 2 и нормофильтрацией и 13 пациентов с гиперфильтрацией было показано, что при гиперфильтрации дельта СКФ составила 7,3 мл/мин., что было в три раза выше, чем у пациентов с нормофильтрацией. Расчеты с необходимыми поправками показали, что исходная гиперфильтрация, но не повышенные уровни HbA1c и кровяного давления, предсказывали более высокие значения дельта СКФ [89]. Весьма показательно недавнее исследование, выявившее, что гиперфильтрация — это действительно сильный и независимый не только Медицинский алфавит. Современная лаборатория 3 / 2013 27 маркер, но и фактор риска ускоренной утраты ренальных функций и прогрессирования нефропатии при СД 2 [133]. Из 600 пациентов с СД 2 15 % исходно имели гиперфильтрацию (СКФ > 120 мл/мин./м 2, клиренс иогексола) и альбуминурию (< 200 мкг/мин.). В течение четырех лет наблюдения у всех пациентов с гиперфильтрацией дельта СКФ составляла в среднем на 3,37 мл/мин./м 2 в год, т. е. в четыре раза больше, чем дельта СКФ в общей популяции. Более того, у пациентов с исходной гиперфильтрацией к шестому месяцу наблюдения СКФ снижалась в 13 (!) раз быстрее, чем у пациентов с исходной нормофильтрацией. После фазы такого крутого падения СКФ ее дальнейшее снижение замедлилось и соответствовало таковому для пациентов с исходной нормофильтрацией и было сходным в обеих группах. В группе с гиперфильтрацией риск развития микроальбуминурии составлял 23,4 %, в группе с нормофильтрацией 10,6 %. Эффективность терапии, направленной на снижение гипергликемии и гипертензии, в разных группах также была весьма разной. После шести месяцев указанной терапии у пациентов с исходной гиперфильтрацией дельта СКФ составляла 4,19 мл/мин./1,73 м 2 в год, у пациентов с нормофльтрацией 3,23 мл/мин./1,73 м 2 в год. Существенно, что терапия гипергликемии и гипертензии в группе с гиперфильтрацией была менее эффективна, чем в группе с нормофильтрацией, хотя все лечебные мероприятия в обеих группах были одинаковы [133]. В общем, имеющиеся в настоящее время данные позволяет полагать, что: а) при исходной гиперфильтрации падение СКФ при развитии нефропатии происходит более круто, чем при исходной нормофильтрации; б) после начала терапии инсулином гиперфильтрация быстро снижается. В целом клубочковая гиперфильтрация повышает риск развития последующих ренальных нарушений. Все это позволяет считать, что гиперфильтрация — сильный предиктор быстрого снижения СКФ. В связи с этим возникают вопросы, что такое гиперфильтрация: физиологически нейтральный маркер, 28 прогнозирующий быстрое прогрессирование ХПН, или патогенетический фактор диабетической нефропатии? Вызывается гиперфильтрация нарушением гемодинамических или метаболических факторов? Что является мишенью таких нарушений: клубочки или канальцы, или и то и другое? Но сначала несколько слов о морфологических и гистологических особенностях почек, связанных с гиперфильтрацией. Гиперфильтрация и нефромегалия Ранние исследования показали, что у молодых пациентов с СД 1 (средняя длительность заболевания 4,9 года) и с гиперифильтраций вес почек (с поправками на поверхность тела) повышен на 22 % [80]. Но показатель СКФ в расчете на грамм веса почек был одинаковым как у диабетиков, так и в контрольной группе. Это свидетельствовало о том, что гиперфильтрация — это патогенетический фактор нефромегалии [134], однако у лабораторных животных увеличение размера почек предшествовало гиперфильтрации [135]. При наблюдении взрослых пациентов с СД 1 обнаружилось, что нефромегалия связана с микроальбуминурией [136]. Действительно, пациенты с СД 1 с объемом почек > 300 мл/1,73 м 2 имели шансы на микроальбуминурию в восемь раз выше, чем те, кто имел объем почек < 300 мл/1,73 м 2 [137]. Гистологические данные показали, что гиперфильтрация при ожирении связана с гломеруломегалией, которая обнаруживается до развития микроальбуминурии и ренальной дисфункции [138, 139]. В недавнем исследовании обнаружено, что у лиц с длительным СД и СКФ < 60 мл/мин./1,73 м 2 риск развития нефропатии значительно повышен по сравнению с пациентами, имеющими нормальной размер почек [140]. В целом пациенты с гиперфильтрацией предрасположены к быстрому развитию альбуминурии и прогрессированию к ТСРЗ и имеют увеличенный объем почек и более быстрое падение СКФ после гиперфильтрации [75]. Медицинский алфавит. Современная лаборатория 3 / 2013 Гиперфильтрация и ультраструктурные нарушения почек В исследовании 15 пациентов с СД 1 (длительность болезни > 5 лет, СЭА 15–30 мкг/мл, средняя СКФ 137 мл/мин./1,73м 2) результаты биопсии показали, что некоторые компоненты почек имели повышенный размер. При этом показатель вариации толщины базальных мембран > 70 % и общий индекс гломерулопатии были предикторами: а) среднего уровня HbA1c в течение 5 лет, б) длительности диабета и в) показателей СКФ, определенной в период от 2 до 5 лет до проведения биопсии. Был сделан вывод, что «исходная гиперфильтрация может быть предиктором морфологических изменений в клубочках» [141]. В другом исследовании у 36 преимущественно нормоальбуминурических пациентов с СД 1 (возраст от 13 до 25 лет) в течение первых двух лет гиперфильтрация составляла 150 мл/мин./1,73м 2. Наиболее значимая связь была выявлена между гиперфильтрацией, толщиной базальной мембраны и значениями HbA1c, измеренными до биопсии [142]. Аналогичные результаты были получены и при наблюдении 243 детей и взрослых с СД 1 и имевших в первые два года СКФ 142 ± 28 мл/мин./1,73м 2 и ультраструктурные нарушения базальной мембраны [143]. Более того, как оказалось, при СД 1 гиперфильтрация и увеличенный размер базальных клубочковых мембран предсказывали развитие микроальбуминурии (наблюдение пять лет) [132]. В целом при диабете гипергликемия и гиперфильтрация связаны с ультрастуктурными повреждениями почек. Механизмы гиперфильтрации Механизмы развития гиперфильтрации могут включать: 1) гиперфильтрацию на уровне одиночных нефронов, 2) на уровне всей почки и 3) на уровне оставшейся функционирующей части почек после снижения активности ее поврежденной части [3, 144]. Ранние исследования, проведенные в начале восьмидесятых на лабораторных животных, показали, что скорее гемодинамические, а не метаболические нарушения приводят к диабетической гломерунефропатии [145,146]. e-mail: medalfavit@mail.ru Гиперфильтрация на уровне одиночных нефронов и на уровне всей почки Полагается, что на ранних стадиях диабетической нефропатии гиперфильтрация на уровне всей почки отражает генерализованное повышение фильтрации в одиночных нефронах. На поздних стадиях деградация все большего количества нефронов ведет к гиперфильтрации части нефронов, оставшихся еще неповрежденными [147]. На лабораторных животных показано, что снижение потребления белков задерживает развитие диабетической нефропатии и снижает гиперфильтрацию на уровне одиночных нефронов [3]. У пациентов с СД 1 и СКФ < 60 мл/мин./1,73м 2 снижение белков в диете от 1,0–1,1 до 0,6–0,7 г/кг снижало дельту СКФ от 6–10 мл/мин./1,73м 2 до < 2 мл/мин./1,73м 2 [147, 148]. Все это согласуется с тем, что гиперфильтрация на уровне одиночных нефронов связана с последующим падением СКФ на уровне всей почки. Действительно, исследования на животных показали, что прогрессирование ренальной патологии связано с компенсаторным повышением СКФ в одиночных нефронах и с повышением гидростатического давления в клубочковых капиллярах [145]. Позднее, однако, было высказано предположение, что «концепция единственного патогенетического фактора» недостаточна для того, чтобы объяснить сначала инициацию гиперфильтрации, а потом резкое падение ренальной функции. Скорее всего, такой механизм вызывается множественными факторам, в связи с чем была сформулирована т. н. многоударная гипотеза (multi-HIT) гиперфильтрации. Такими факторами могут быть: а) пожилой возраст, б) ожирение, в) генетическая предрасположенность, г) диабет, д) гипертензия, е) снижение количества нефронов, ж) высокий уровень экскреции альбумина с мочой, и др. [149, 150] Гиперфильтрация и повышенный сердечный выброс при ожирении Такой выброс — это адаптивный механизм, направленный на обеспечение адекватной гломерулярной перфузии при повышенной массе тела [61]. e-mail: medalfavit@mail.ru При этом количество нефронов остается тем же и при повышении веса отнюдь не возрастает. Таким образом, повышенный сердечный выброс повышает кровоток через нефроны, что ведет к повышению внутрикапиллярного гломерулярного давления, в итоге к гиперфильтрации и затем к падению СКФ [150]. Гиперфильтрация и нарушения периферических сосудов Недавно показано, что гиперфильтрация связана с низкой ригидностью артерий (low arterial stiffness) и дисфункцией эндотелия. Поэтому полагается, что «состояние гиперфильтрации отражает как микроваскулярные, так и макроваскулярные функциональные изменения» [151]. Гиперфильтрация и гормоны На гиперфильтрацию могут влиять многие гормональные факторы, в частности: предсердный натрийутретический пептид, релаксирующий фактор, связанный с эндотелием (endothelial-derived relaxing factor), простагландины, тромбоксаны, кинины, циклооксигеназа-2, протеинкиназа C-b [13, 17, 152]. Оксидативный стресс стимулирует гиперфильтрацию При ожирении, при метаболическом синдроме, при СД может происходить оксидативный стресс, повреждающий структуру ренальных белков и липидов [153, 154], в частности, ангиотензиновых рецепторов [155], что может приводить к гиперфильтрации. Окисленный ЛПНП, обычно обнаруживаемый при ожирении и при ХБП, как оказалось, стимулирует синтез ангиотензина II, что затем повышает синтез трансформирующего фактора роста b и ингибитора активатора плазминогега-1, что в итоге способствует прогрессированию гломерулярного фиброза [156, 157]. Воспаление и гиперфильтрация Показано, что с ренальными повреждениями и, в частности, с гиперфильтрацией связаны повышенные уровни высокочувствительного С-реактивного белка, провоспалительных цитокинов и циркулирующих свободных жирных кислот [158]. Гиперфильтрация и ренинальдостерон-ангиотензиновая система Действительно, при ожирении и СД активация РААС связана с гиперфильтрацией и прогрессированием ренальных повреждений [158]. Весьма принципиально, что при ожирении повышенная активность РААС ведет к повышению реабосрбции натрия в проксимальных канальцах, что затем вызывает повышение кровяного давления и развитие гиперфильтрации [159]. Факторы, снижающие гиперфильтрацию Гликемический контроль: влияние на СКФ и альбуминурию. СД 1 Самый важный фактор, определяющий наличие гиперфильтрации при СД 1, — неконтролируемая гипергликемия. Раннее снижение гипергликемии с помощью инсулина может нормализовать СКФ [80]. Более того, даже после 12 лет жизни с СД 1 длительная интенсивная терапия может нормализовать гиперфильтрацию [81]. Существенно, что при СД 1 интенсивный контроль гипергликемии снижает не только гиперфильтрацию, но и риск развития и микроальбуминурии и макроальбуминурии и снижает значения дельты СКФ [160, 161]. В проспективном наблюдении 12 пациентов с СД 1, гипефильтрацией и средним уровнем HbA1c > 10 % в течение года шести пациентам проводили снижение гипергликемии с помощью инсулиновой помпы, а другим шести — с помощью традиционной терапии (контрольная группа). Уже через три месяца инсулиновая помпа снизила HbA1c до ~ 7 % и СКФ с 150 мл/мин./1,73м 2 до 130 мл/мин./1,73 м 2. Затем эти показатели оставались неизменными в течение всего срока наблюдения. В контрольной группе СКФ не изменилась. После прекращения терапии с помощью инсулиновой помпы СКФ вернулась к гиперфильтрации [81]. Недавние исследования длительностью в 22 года показали, что ранний и интенсивный контроль глюкозы значительно снижает риск падения СКФ ниже 60 мл/мин./1,73м 2 [162]. Медицинский алфавит. Современная лаборатория 3 / 2013 29 СД 2 При СД 2 интенсивный гликемический контроль снижает риск микроальбуминурии, но, как неожиданно оказалось, не оказывает терапевтического действия на прогрессирование СКФ [163–165]. В другом исследовании было показано, что при СД 2 интенсивный контроль гликемии в течение десяти лет не оказывал положительного влияния на альбуминурию и сывороточный креатинин [166]. Росиглитазон (Rosiglitazone) — препарат, повышающий чувствительность к инсулину, также снижает и тяжесть эндотелиальной дисфункции. Показано, что этот препарат у пациентов с ранним СД 2 снижает гиперфильтрацию, улучшает биодоступность NO и снижает нарушения в органах, обычно поражаемых при СД 2 и микроальбуминурии [167]. Недавно на лабораторных животных было обнаружено, что введение проинсулинового С-пептида снижало гиперфильтрацию на 24 % и при этом без изменения гликемического контроля [168]. Антигипертензивная терапия замедляет падение СКФ Антигипертензивная терапия с помощью ингибиторов РААС замедляет скорость падения СКФ, прекращение такой терапии возвращает падение СКФ к уровню, который был до ее начала [169]. Начало антигипертензивной терапии у 42 пациентов с СД 2 и нефропатией в течение первых шести месяцев быстро уменьшало значения дельты СКФ (по креатинину), исходно составлявшее 1,5 мл/мин. в месяц, до 0,35 мл/мин. в месяц. Затем замедление падения СКФ было более медленным. Если терапию отменяли, падение СКФ возвращалось к начальному уровню. Полагалось, что быстрое снижение падения СКФ на начальной стадии терапии вызывается действием ингибитора ангиотензин-превращающего фермента на гемодинамику, а замедление снижения СКФ на втором этапе действием препарата, на этой стадии замедляющим прогрессирование нефропатии [170]. Действительно, наибольшее замедление падения СКФ с помощью антигипертензивной терапии происходит преимущественно на ранних стадиях 30 развития нефропатии, при этом как у пациентов с СД, так и у пациентов без такового. Это весьма убедительно показал мета-анализ 12 клинических исследований, включавших 1 102 пациентов с почечной недостаточностью, имевших или не имевших СД, имевших или не имевших систолическую сердечную недостаточность (наблюдение проводилось три года) [171]. Антигипертензивная терапия снижает альбуминурию Еще в ранних исследованиях было показано, что ингибиторы ангиотензин-превращающего фермента и блокаторы ангиотензиновых рецепторов обычно, хотя и не всегда, снижают тяжесть альбуминурии у пациентов как с микроальбуминурией, так и макроальбуминурией [172]. Однако такая терапия при микрольбуминурии хотя и снижает СЭА, но не связана с последующим замедлением скорости падения СКФ, что еще раз указывает на то, что на ранней стадии нефропатии развитие микроальбуминурии и падение СКФ разобщены [4]. В течение десяти лет наблюдались 227 пациентов с СД 1 и персистирующей микроальбуминурией (30–300 мг/24 часа). Критерием диабетической нефропатии считали СЭА > 300 мг/24 часа в трех последовательных образцах мочи. Исходно у пяти пациентов наблюдалось прогрессирование к нефропатии, однако при интенсивной антигипертензивной терапии у 29 больных произошло возвращение к нормоальбуминурии. Что интересно, при этом гликемический контроль и давление не изменились [173]. Прекращение антигипертензивной терапии может приводить пациентов с СД 2 с уже достигнутой нормоальбуминурией к микроальбуминурии [174]. Антиатерогенная терапия замедляет падение СКФ Наблюдали пациентов с СД 2, ранее не имевших ССЗ, 34 % пациентов имели исходную СКФ (MDRD) от 30 до 60 мл/мин./1,73 м 2. Аторвастатин приводил к умеренному снижению дельты СКФ (на 0,18 мл/мин./1,73м 2 в год), в особенности у пациентов с микроальбуминурией (улучшение на 0,38 мл/мин./1,73м 2 в год). При этом Медицинский алфавит. Современная лаборатория 3 / 2013 у 970 пациентов с более умеренными сниженными значениями СКФ (30–60 мл/мин./1,73 м 2) наблюдалась снижение главных сердечно-сосудистых событий на 42 %, включая снижение ишемических инсультов на 61 %. Однако снижения микроальбуминурии и альбуминурии при терапии аторвастатином отмечено не было [175]. В течение пяти лет наблюдали 9 795 пациентов с СД 2, получавших фенофибраты или плацебо [176]. Фенофибраты повышали креатинин плазмы, но при переводе больных на плацебо креатинин быстро возвращался к контрольному уровню. Затем, однако, СКФ при терапии фенофибратами снижалась медленнее, чем в группе «плацебо», падение СКФ составляло в группе «фенофибратов» 1,9 мл/мин./1,73 м 2 в год, в группе «плацебо» на 6,9 мл/мин./1,73 м 2. Интересно, что наибольшую эффективность предотвращения быстрого снижения СКФ фенофибраты показали у пациентов с исходной триглицеридемией или одновременно с триглицеридемией и пониженным ЛПВП. Фенофибраты также снижали уровни альбумина и соотношение альбумин/ креатинин на 24 %, при этом прогрессирование к альбуминурии у группы «фенофибраты» было на 14 % ниже, чем в группе «плацебо», а снижение альбуминурии было на 18 % выше, чем в контроле. В целом, несмотря на обратимое начальное повышение креатинина плазмы, фенофибраты у пациентов с СД 2 замедляют падение СКФ и развитие альбуминурии [176]. Тубулоцентрическая теория гиперфильтрации Для начала вспомним, как регулируется скорость клубочковой фильтрации. Для нормальной функции нефронов необходимо, чтобы скорость потока крови, через них проходящей, находилась в достаточно узком нормальном диапазоне. Нормальной считается СКФ, при которой концентрация глюкозы и NaCl в канальцах имеет четко определенную концентрацию. Если эта концентрация понижена — это сигнал для повышения СКФ, если повышена — сигнал для снижения (см. обзор 177). Таким образом, функции клубочков регулируются за счет механизма тубулярно-глоe-mail: medalfavit@mail.ru мерулярной обратной связи. Первичный сенсор величины СКФ — дистальные канальцы. Сигналы из них поступают в специальный почечный центр, координирующий фильтрацию и реабсорбцию. Этот центр — macula densa — область плотно упакованных призматических эпителиальных клеток дистального извитого канальца нефрона в области, прилегающей к почечному тельцу. Сенсор концентрации NaCl в macula densa — особый белковый комплекс Na-K-2Cl-котранспортер. При изменении баланса показателей ионного состава клетки macula densa стимулируют синтез ренина клетками юкстагломерулярного аппарата. Регуляция секреции ренина зависит от концентрации в дистальном канальце NaCl, поступающего в macula densa. Чем больше NaCl в моче, идущей из дистального канальца, тем выше секреция ренина [177]. При изменении артериального давления происходит сокращение или расширение афферентных и эфферентных артериол — сосудов мышечного типа, входящих и, соответственно, выходящих из каждого клубочка. Таким образом, macula densa регулирует СКФ путем активации РААС, которая, в свою очередь, влияет на интенсивность системного и почечного кровообращения, на водно-солевой обмен и на объем циркулирующей в почках крови [177]. Упрощенная схема работы тубуло-гломерулярного механизма такова. В дистальных канальцах: а) высокая концентрация NaCl, поступающего в macula densa, — это сигнал о повышенной СКФ, направленный на ее снижение путем «сужения». (вазоконстрикции) афферентных артериол; б) низкая концентрация NaCl, поступающего в macula densa, — сигнал о сниженной СКФ, направленный на ее повышение путем «расширения» (вазодилятации) афферентных артериол. Гипергликемия вызывает гиперреабсорбцию в проксимальных канальцах и снижение NaCl в дистальных канальцах Повышение реабсорбции NaCl в проксимальных канальцах было обнаружено при определении СКФ (клиренс 51Cr-ЭДТА) и измерении клиренса Li+ у 11 амбулаторных пациентов с СД 1, не имевших признаков e-mail: medalfavit@mail.ru Рисунок 2. Схема нарушения тубуло-гломерулярного механизма, приводящая к гиперфиль‑ трации (подробности в тексте). диабетической нефропатии. У пациентов СКФ составляла 136 ± 10,2 против 108 ± 13,6 мл/мин./1,73 м 2 (у десяти здоровых лиц). При этом при гиперфильтрации скорость реабсорбции в проксимальных канальцах была повышена (78,7 ± 3,2 % против 73,6 ± 4,9 %) [178]. Затем на лабораторных животных (крысы с экспериментальным диабетом) было показано, что экспериментальное снижение концентрации NaCl в проксимальных канальцах вызывает гиперфильтрацию. Как показано, гиперфильтрация была связана с понижением на 20– 30 % концентрации Na+ и K+ в ранней области дистальных канальцев, примыкающей к проксимальным канальцам. Это отражало повышенную реабсорбцию в зоне, предшествующей раннему дистальному канальцу, т. е. в проксимальном канальце [179]. Аналогичные результаты были получены при наблюдении 55 пациентов с СД 1 и нормоальбуминурией. СКФ измеряли с помощью клиренса инулина, реабсорбцию измеряли в проксимальных и дистальных канальцах. Как оказалось, гиперфильтрация (СКФ ≥ 130 мл/мин./1,73 м 2) была обнаружена у 15 (25 %) пациентов, которая, в свою очередь, была связана с повышенной реабсорцией NaCl в проксимальных канальцах, но не с реабсорцией в дистальных канальцах [167]. В другом исследовании при наблюдении 12 пациентов с ИМТ > 36 и 19 лиц с нормальным весом было обнаружено, что при ожирении СКФ была повышена на 61 %. Определение показателей клубочковой фильтруемой фракции и фракции экскреции лития четко показало: гиперфильтрация связана с повышенной реабсорбцией NaCl в проксимальных канальцах [180]. В недавнем исследовании наблюдали 363 лица, имеюших СД 2 или нарушенную толерантность к глюкозе и гипертензию. Определяли СКФ (экзогенные маркеры) и тубулярную реабсорцию NaCl (клиренс лития). Вероятность гиперфильтрации (СКФ > 140 мл/мин./1,73м 2) составляла: при гипертензии — 17,2 %, при нарушенной толерантности к глюкозе — 29,2 %, при СД 2–52,8 %. Во всех этих случаях гиперфильтрация была связана с повышенной реабсорбцией NaCl в проксимальных канальцах [181]. Отметим, что недавно на лабораторных животных было обнаружено, что введение проинсулинового С-пептида снижало гиперфильтрацию на 24 % за счет дилятации эфферентных артериолей и ингибирования тубулярной реабсорбции NaCl. Что принципиально, гликемический контроль при этом не изменялся [168]. В целом при хронической гипергликемии проксимальные канальцы за счет гиперактивации тубулярного Na+/глюкозного котранспортера повышают реабсорцию NaCl, поступающего в macula densa, которая воспринимает это как сигнал о сниженной СКФ и повышает ее, рис. 2. Медицинский алфавит. Современная лаборатория 3 / 2013 31 В общем, многочисленные исследования показали, что при раннем диабете происходит аномальное повышение реабсорбции NaCl и глюкозы в проксимальных канальцах, что снижает концентрацию NaCl «вниз по течению», идущему в дистальные канальцы, что затем сигнализирует в macula densa о якобы сниженной СКФ, хотя в действительности СКФ нормальна. В целом возникновение гиперфильтрации является результатом (рис. 2): а) повышения реабсорбции NaCl и глюкозы, о суще ствляемой в проксимальном канальце с помощью Na+/ глюкозного котранспортера; б)снижения концентрации NaCl, поступающего в дистальные канальцы и затем в macula densa; в) повышения продукции вазодилятаторов в macula densa; г) снижения давления в капсулах Боумана; д)снижения констрикции афферентной артериоли, что приводят к повышению потока входящий крови и тем самым к гиперфильтрации (см. обзоры 182–186). Каковы молекулярные нарушения, приводящие к повышению чувствительности проксимальных канальцев к реабсорбции? Есть данные, что они связаны с «диабетическими» нарушениями роста и дифференцировки проксимальных канальцев. Такой «диабетический» рост проксимальных канальцев связан с быстрой пролиферацией, гипертрофией, а потом с быстрым старением, характерным для старых клеток, в которых прекращение роста направлено на предотвращение репликации поврежденной ДНК. В результате такие «быстро выросшие и преждевременно постаревшие» проксимальные канальцы утрачивают способность нормально реагировать на изменение концентраций NaCl и глюкозы. Похоже, что эти нарушения связаны так же и с воспалением, с нарушением баланса цитокинов [177]. Итак, поскольку гиперфильтрация — это фактор риска, утяжеляющий диабетическую нефропатию, гиперфильтрацию надо диагностировать как можно раньше и сразу понижать. 32 Механизм, вызывающий гиперфильтрацию, — это сниженная концентрация NaCl, поступающая в macula densa и заставляющая тубуло-гломерулярный механизм работать «с точностью до наоборот». Как известно, пациентам с СД и гипертензией рекомендуется диета со сниженным содержанием соли [187]. Солевой парадокс В 1995 году на лабораторных животных с СД 1 был получен странный результат: на ранних стадиях СД пониженный уровень NaCl в диете повышал СКФ, при этом повышались объем фильтруемой крови, вес почек (нефромегалия) и снижались общая ренальная, васкулярная резистентность и уровень ангиотензина AIIk [188]. Это затем было подтверждено в специальных исследованиях [189, 190]. Чем же вызывается такой парадокс? В опытах на крысах с СД 1 проводили прямое измерение концентраций Na+, Cl- и K+ в одиночных нефронах и в дистальных зонах канальцев. Как оказалось, у крыс без СД 1 солевая нагрузка не привела ни к нарушению тубуло-гломерулярного сигнала, ни к изменениям СКФ в одиночном нефроне. У крыс с диабетом концентрации Na+, Cl- и K+ были пропорциональны уровнями соли в диете, но значения СКФ обратно пропорциональны «правильным» тубуло-гломерулярным сигналам [189]. Таким образом, на ранних стадиях диабета тубуло-гломерулярный механизм «с точностью до наоборот» реагирует на уровень соли в диете: при высокой соли снижает скорость фильтрации (а надо бы повысить), а при низкой соли повышает (а надо бы понизить). Такая контринтуитивная закономерность была названа солевым парадоксом [188]. А что покажет высокосолевая диета? Опыты проводили на крысах с индуцированным СД 1, потреблявших высокосолевую диету (1 % NaCl в воде для питья). Оказалось [191], что при высокосолевой диете: а) повышалась экскреция NaCl как у крыс с СД, так и у контрольных (без СД); Медицинский алфавит. Современная лаборатория 3 / 2013 б)у контрольных крыс (пили водопроводную воду) не было никаких изменений СКФ и в объеме фильтруемой крови; в)у контрольных крыс происходило снижение общей ренальной васкулярной резистентности, пропорциональное повышение СКФ (клиренс инулина), объема фильтруемой крови и повышение веса почек; г) у крыс с ранним СД изменений в общей ренальной васкулярной резистетности, объеме циркулирующей крови и весе почек не было, однако наблюдалось парадоксальное снижение СКФ; д)у крыс с установившимся диабетом происходило снижение общей ренальной васкулярной резистетности, повышение объема фильтруемой (как и у контрольных крыс), но ни повышения СКФ (как при раннем диабете), ни увеличения веса почек не наблюдалось [191]. Как говорилось, при микроальбуминурии антигипертензивная терапия с помощью ингибиторов РААС практически не предотвращает ни протеинурию, ни развитие терминальных стадий ренальных заболеваний. При СД снижение соли в диете повышает гиперфильтрацию и ускоряет развитие терминальных стадий ренальных заболеваний Весьма принципиальные результаты были получены при наблюдении пациентов с СД 1, потреблявших диету с уменьшенной концентрацией NaCl. Так, 12 пациентов с СД 1 без осложнений наблюдались в течение пяти лет. Все они потребляли или высокосолевую диету (200 ммоль/день) или низкосолевую (20 ммоль/день). СКФ измеряли с помощью клиренса инулина и пара-аминогиппурата. При низкосолевой диете СКФ была значительно выше (124 ± 4 мл/мин./1,73 м 2), чем при высокосолевой (107 ± 8 мл/мин./1,73 м 2). При этом ренальная васкулярная резистентность при низкосолевой была ниже (94 ± 6 мм Hg/л/мин.), чем при высокосолевой (107 ± 17 мм Hg/л/мин.). В целом ограничение соли в диете вместо того, e-mail: medalfavit@mail.ru чтобы скорректировать ренальную гиперперфузию, утяжеляло ренальную дисфункцию [192]. Два недавних больших когортных исследования пациентов с СД 1 и СД 2 неожиданно обнаружили, что низкосолевая диета связана с повышения риска ТСРЗ и смертности от всех причин [193, 194]. В исследовании, проведенном в Австралии, в течение 10 лет наблюдали 4 638 пациентов с СД 2 и с высокими уровнями ожирения, ретинопатии, гипертензии, высокой частотой встречаемости ХПН и ССЗ. У всех пациентов проводился регулярный мониторинг поглощения NaCl в образцах мочи (24 часа). Обнаружилось, что интенсивность поглощения соли у пациентов была разной, но для каждого индивида в течение периода наблюдения оставалась постоянной. У одной трети пациентов экскреция NaCl в мочу составляла < 150 ммоль/день и у одной трети > 208 ммоль/день. Неожиданно обнаружилось, что увеличение экскретируемого NaCl на 100 ммоль/день связано со снижением смертности на 30 %, а снижение — с повышением смертности [193]. Другое аналогичное исследование было проведено в Финляндии и включало десятилетнее наблюдение 2 807 пациентов с длительным СД 1 и высокой встречаемостью гипертензии и ретинопатии. Обнаружилось, что кумулятивный риск развития ТСРЗ был обратно пропорционально и монотонно связан с поглощением NaCl, снижение поглощения NaCl от 90-й до 10-й процентили приводило к десятикратному повышению вероятности развития ТСРЗ [193]. Итак, «два новых когортных исследования свидетельствуют о том, что ограничение соли в диете у пациентов с сахарным диабетом приносит больше вреда, чем пользы» [194]. Диабетическая нефропатия в трех измерениях Согласно текущим рекомендациям, низкая СКФ и наличие микроальбуминурии или протеинурии считаются маркерами ренальной дисфункции. Хотя в настоящее время и полагается, что микроальбуминуe-mail: medalfavit@mail.ru рия и играет фундаментальную роль в развитии диабетической нефропатии, из-за высокой встречаемости случаев ремиссии микроальбуминурии и низкого риска ее прогрессирования к протеинурии, как полагают некоторые авторы, «микроальбуминурия больше не может рассматриваться как независимый предиктивный маркер поздних стадий ХБП» [186]. Именно гиперфильтрация — самая ранняя и потенциально обратимая стадия нефропатии. Поэтому и выказывается точка зрения, что «выявление гиперфильтрации среди лиц с предиабетом и прегипертензией может быть решающим для назначения превентивных мероприятий» [186]. Согласно текущим представлениям, наиболее точным алгоритмом диагностики ренальной дисфункции может быть регулярное определения не двух, как ранее, маркеров — «микро / макроальбумин и креатинин», а трех: «микро- / макроальбумин, креатинин» и цистатин С [195]. Выводы 1. Гиперфильтрация при СД вызывается нарушением механизма тубулярно-гломерулярной связи. 2. Гиперфильтрация — самый ранний диагностический признак диабетической нефропатии, проявляющийся даже при нормольбуминурии, ее наличие прогнозирует более быстрое снижение ренальных функций, чем при отсутствии гиперфильтрации. 3. Снижение ренальной функции (согласно снижению СКФ) может происходить до микроальбуминурии. 4. Микроальбуминурия не является надежным маркером диабетической нефропатии, только примерно в половине случаев наличие микроальбуминурии может прогнозировать развитие протеинурии. 5. Снижение микроальбуминурии с помощью ингибиторов РААС практически не предотвращает падения СКФ.. 6. Креатинин является маркером поздних стадий развития ренальной дисфункции. 7.У пациентов с сахарным диабетом снижение NaCl в диете приводит к повышению риска терминальных стадий ренальных заболеваний. 8. Для своевременной и адекватной диагностики диабетической нефропатии целесообразно измерение уровней цистатина С, альбумина и креатинина. Список литературы 1. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению. Нефрология, 2012, 1, 89–115. 2. Brenner BM, Lawler EV, Mackenzie HS. The hyperfiltration theory: a paradigm shift in nephrology. Kidney Int. 1996;49 (6):1774–7. 3. Hostetter TH, Olson JL, Rennke HG et al., Hyperfiltration in remnant nephrons: a potentially adverse response to renal ablation. Am J Physiol. 1981;241 (1): F85–93. 4. Jerums G, Panagiotopoulos S, Premaratne E, et al. Lowering of proteinuria in response to antihypertensive therapy predicts improved renal function in late but not in early diabetic nephropathy: a pooled analysis. Am J Nephrol 2008;28:614–27. 5. Mann JF, Schmieder RE, McQueen M, et al. for the ONTARGET investigators. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial. Lancet 2008;16:547–53. 6. National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, classification, and stratification. Part 4. Definition and classification of stages of chronic kidney disease. Am. J. Kidney Dis.2002, 39, S46–S75. 7. Huang SH, Sharma AP, Yasin A et al. Hyperfiltration affects accuracy of creatinine eGFR measurement. Clin J Am Soc Nephrol. 2011;6 (2):274–80. 8. Dengel DR, Goldberg AP, Mayuga RS et al. Insulin resistance, elevated glomerular filtration fraction, and renal injury. Hypertension. 1996;28 (1):127–32. 9. Helal I, Fick-Brosnahan GM, Reed-Gitomer B et al. Glomerular hyperfiltration: definitions, mechanisms and clinical implications. Nat Rev Nephrol. 2012;8 (5):293–300. 10. Chaiken RL, Eckert-Norton M, Bard M et al (1998) Hyperfiltration in African-American patients with type 2 diabetes. Cross-sectional and longitudinal data. Diabetes Care 21:2129–2134. 11. Dahlquist G, Stattin EL, Rudberg S (2001) Urinary albumin excretion rate and glomerular filtration rate in the prediction of diabetic nephropathy; a long-term follow-up study of childhood onset type-1 diabetic patients. Nephrol Dial Transplant 16:1382–1386. 12. Cherney DZ, Sochett EB, Lai V et al. Renal hyperfiltration and arterial stiffness in humans with uncomplicated type 1 diabetes. Diabetes Care 2010; 33: 2068–2070. 13. Cherney DZ, Sochett EB. Evolution of renal hyperfiltration and arterial stiffness from adolescence into early adulthood in type 1 diabetes. Diabetes Care 2011; 34: 1821–1826. 14. Frische S. Glomerular filtration rate in early diabetes: ongoing discussions of causes and mechanisms. J Nephrol. 2011;24 (5):537–40. 15. Palatini P. Glomerular hyperfiltration: a marker of early renal damage in pre-diabetes and pre-hypertension. Nephrol Dial Transplant. 2012;27 (5):1708–14. 16. Rius F, Pizaro E, Salinas I, Lucas A, et al. RAge as a determinant of glomerular filtration rate in noninsulin- dependent diabetes mellitus. Nephrol Dial Transplant 1995, 10:1644–1647. 17. Premaratne E, MacIsaac RJ, Tsalamandris C et al. Renal hyperfiltration in type 2 diabetes: effect of age-related decline in glomerular filtration rate. Diabetologia, 2005 48:2486–2493. Медицинский алфавит. Современная лаборатория 3 / 2013 33 18. Okada R, Yasuda Y, Tsushita K et al. Glomerular hyperfiltration in prediabetes and prehypertension. Nephrol Dial Transplant. 2012;27 (5):1821–5. 36. Macisaac RJ, Premaratne E, Jerums G Estimating glomerular filtration rate in diabetes using serum cystatin C. Clin Biochem Rev. 2011;32 (2):61–7. 19. Stevens, L. A., Coresh, J., Greene, T. & Levey, A. S. Assessing kidney function — measured and estimated glomerular filtration rate. N. Engl. J. Med 2006, 54, 2473–2483. 37. Inker LA, Okparavero A. Cystatin C as a marker of glomerular filtration rate: prospects and limitations. Curr Opin Nephrol Hypertens. 2011;20 (6):631–9. 20. Premaratne E, MacIsaac R, Finch S, et al. Serial measurements of cystatin C are more accurate than creatinine-based methods indetecting declining renal function in type 1 diabetes. Diabetes Care 2008, 31:971–973. 21. Levey AS, Stevens LA, Schmid CH, et al., A new equation to estimate glomerular filtration rate, Ann Intern Med, 2009;150:604–12. 22. Camargo EG, Soares AA, Detanico AB, et al., The Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) equation is less accurate in patients with type 2 diabetes when compared with healthy individuals, Diabet Med, 2011;28:90–5. 23. Rognant N, Lemoine S, Laville M, et al., Performance of the chronic kidney disease epidemiology collaboration equation to estimate glomerular filtration rate in diabetic patients, Diabetes Care, 2011;34:1320–2. 24. Thomas C, Thomas L. Renal failure — measuring the glomerular filtration rate. Dtsch Arztebl Int. 2009; 106 (51–52): 849–854. 25. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Annals of Internal Medicine 2009, 150 (9): 604–12. 26. Lovrenčić MV, Biljak VR, Božičević S et al. Estimating glomerular filtration rate (GFR) in diabetes: The performance of MDRD and CKD-EPI equations in patients with various degrees of albuminuria. Clin Biochem. 2012 Aug 8. 27. Вельков В. В. Цистатин С: новые возможности и новые задачи для лабораторной диагностики. Часть 1.Клинико — лабораторны й консилиум. 2010, 5, (36), 23–31, электронная версия: http://www.diakonlab.ru/files/Docs/SciArticles/ Cystatin_C_Rev_Site (2).pdf последнее использование — 28–04–2013. 28. Вельков В. В. Цистатин С: новые возможности и новые задачи для лабораторной диагностики. Часть 2. Клинико — лабораторный консилиум. 2011, 1, (37), 27–38. 29. Вельков В. В. Цистатин С: новые возможности и новые задачи для лабораторной диагностики. Часть 3. Клинико — лабораторный консилиум. Научно-практический журнал. 2011, 2, (38), 31–37. 30. Perkins BA, Nelson RG, Ostrander BE et al. Detection of renal function decline in patients with diabetes and normal or elevated GFR by serial measurements of serum cystatin C concentration: results of a 4-year follow-up study. J Am Soc Nephrol. 2005; 16 (5):1404–12. 31. Waheed S, Matsushita K, Sang Y, et al. Combined association of urea and cystatin C–based estimated GFR with mortality, coronary heart disease, and heart failure outcomes: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Kidney Dis. 2012;60 (2):207–216. 32. Stevens LA, Coresh J, Schmid CH, et al., Estimating GFR using serum cystatin C alone and in combination with serum creatinine: a pooled analysis of 3,418 individuals with CKD, Am J Kidney Dis, 2008;51:395–406. 33. Peralta CA, Shlipak MG, Judd S et al. Detection of chronic kidney disease with creatinine, cystatin C, and urine albumin-to-creatinine ratio and association with progression to end-stage renal disease and mortality. JAMA. 2011;305 (15):1545–52. 34. Shlipak MG, Praught ML, Sarnak MJ., Update on cystatin C: new insights into the importance of mild kidney dysfunction. Curr Opin Nephrol Hypertens 2006; 15: 270–275. 35. Shlipak MG. Cystatin C: research priorities targeted to clinical decision making. Am J Kidney Dis 2008; 51:358–61. 34 38. Odutayo A, Cherney D. Cystatin C and acute changes in glomerular filtration rate. Clin Nephrol. 2012; 78 (1):64–75. 39. Conrad, K. P., Jeyabalan, A., Danielson, L. A. Et al. J. Role of relaxin in maternal renal vasodilation of pregnancy. Ann. NY Acad. Sci. 2005, 1041, 147–154. 40. Sauriasari R, Sakano N, Wang DH et al. C-reactive protein is associated with cigarette smoking-induced hyperfiltration and proteinuria in an apparently healthy population. Hypertens Res 2010; 33: 1129–1136. 41. Maeda I, Hayashi T, Sato KK et al. Cigarette smoking and the association with glomerular hyperfiltration and proteinuria in healthy middle-aged men. Clin J Am Soc Nephrol 2011; 6: 2462–2469. 42. Franz, K. A. & Reubi, F. C. Rate of functional deterioration in polycystic kidney disease. Kidney Int. 1983, 23, 526–529. 43. Helal, I. Reed B, McFann K et al. Glomerular hyperfiltration and renal progression in children with autosomal dominant polycystic kidney disease. Clin. J. Am. Soc. Nephrol.2011, 6, 2439–2443. 44. Santin, S. Santín S, Bullich G, Tazón-Vega Bet al. Clinical utility of genetic testing in children and adults with steroid-resistant nephrotic syndrome. Clin. J. Am. Soc. Nephrol.2011,6, 1139–1148). 45. Ingelfinger, J. R. MYO1E, focal segmental glomerulosclerosis, and the cytoskeleton. N. Engl. J. Med 2011, 365, 368–369. 46. Darouich S, Goucha R, Jaafoura MH et al. Clinicopathological characteristics of obesity-associated focal segmental glomerulosclerosis. Ultrastruct. Pathol.2011, 5,176–182. 47. Kambham, N., Markowitz, G. S., Valeri, A. M et al. Obesity-related glomerulopathy: an emerging epidemic. Kidney Int.2001, 59, 1498–1509. 48. Schmitt, F. Martinez F, Brillet G, et al. Early glomerular dysfunction in patients with sickle cell anemia. Am. J. Kidney Dis1998, 32, 208–214. 49. Quinn CT, Johnson VL, Kim HY et al. Renal dysfunction in patients with thalassaemia. Br J Haematol. 2011;153 (1):111–7. 50. Haymann JP, Stankovic K, Levy P et al. Glomerular hyperfiltration in adult sickle cell anemia: a frequent hemolysis associated feature. Clin. J. Am. Soc. Nephrol.2010,5,756–761. 51. Kinebuchi, S. Kazama JJ, Satoh M, et al. Shortterm use of continuous positive airway pressure ameliorates glomerular hyperfiltration in patients with obstructive sleep apnea syndrome. Clin. Sci. (Lond.) 2004,107, 317–322. 52. Rugiu C, Oldrizzi L, Lupo A et al. Clinical features of patients with solitary kidneys. Nephron 1986; 43: 10–15. 53. Brenner BM, Chertow GM. Congenital oligonephropathy and the etiology of adult hypertension and progressive renal injury. Am J Kidney Dis 1994; 23: 171–175. 54. Solomon LR, Mallick NP, Lawler W. Progressive renal failure in a remnant kidney. Br Med J 1985; 291: 1610–1611. 55. Tomaszewski M, Charchar FJ, Maric C et al. Glomerular hyperfiltration: a new marker of metabolic risk. Kidney Int 2007; 71: 816–821. 56. Li Z, Woollard JR, Wang S et al. Increased glomerular filtration rate in early metabolic syndrome is associated with renal adiposity and microvascular proliferation. Am J Physiol Renal Physiol 2011; 301: F1078–F1087. 57. Chagnac A, Weinstein T, Korzets A et al. Glomerular hemodynamics in severe obesity. Am J Physiol Renal Physiol, 2000, (5),278: F817–F822. 58. Verhave JC, Hillege HL, Burgerhof JG et al. The association between atherosclerotic risk factors and renal function in the general population. Kidney Int 2005, 67:1967–1973. Медицинский алфавит. Современная лаборатория 3 / 2013 59. Palatini P, Mormino P, Dorigatti F et al. Glomerular hyperfiltration predicts the development of microalbuminuria in stage 1 hypertension: the HARVEST. Kidney Int 2006; 70: 578–584. 60. Zoccali C, Seck SM, Mallamaci F. Obesity and the epidemiology and prevention of kidney disease: waist circumference versus body mass index. Am J Kidney Dis. 2011;58 (2):157–9. 61. Wuerzner G, Pruijm M, Maillard M et al. Marked association between obesity, glomerular hyperfiltration: a cross-sectional study in an African population. Am J Kidney Dis. 2010; 56: 303. 62. Chagnac A, Weinstein T, Herman M, et al. The effects of weight loss on renal function in patients with severe obesity. J Am Soc Nephrol, 2003,14:1480–1486. 63. Navarro-Díaz, M. Serra A, Romero R, et al. Effect of drastic weight loss after bariatric surgery on renal parameters in extremely obese patients: long-term follow-up. J. Am. Soc. Nephrol.2006,17, S213–S217. 64. Serra A, Romero R, Roux-en-Y gastric bypass, on renal function and blood pressure in morbidly obese patients. J. Nephrol. 2009, 22 (5), 637–646. 65. Schmieder RE, Veelken R, Schobel H et al. Glomerular hyperfiltration during sympathetic nervous system activation in early essential hypertension. J Am Soc Nephrol 1997; 8: 893–900. 66. Quaschning T, D’Uscio LV, Shaw S et al. Vasopeptidase inhibition restores renovascular endothelial dysfunction in salt-induced hypertension. J Am Soc Nephrol 2001; 12: 2280–2287. 67. Palatini P, Dorigatti F, Saladini F et al. Factors Associated With Glomerular Hyperfiltration in the Early Stage of Hypertension. Am J Hypertens. 2012 Jun 7. 68. Melsom T, Mathisen UD, Ingebretsen OC et al. Impaired fasting glucose is associated with renal hyperfiltration in the general population. Diabetes Care. 2011;34 (7):1546–51. 69. Schmieder RE, Messerli FH, Garavaglia G, et al.Glomerular hyperfiltration indicates early target organ damage in essential hypertension. JAMA 1990, 264:2775–2780. 70. Pinto-Sietsma SJ, Janssen WM, Hillege HL et al. Urinary albumin excretion is associated with renal functional abnormalities in a nondiabetic population. J Am Soc Nephrol. 2000,11:1882–1888. 71. Caramori ML, Gross JL, Pecis M, et al.Glomerular filtration rate, urinary albumin excretion rate, and blood pressure changes in normoalbuminuric normotensive type 1 diabetic patients: an 8-year follow-up study. Diabetes Care, 1999, 22:1512–1516. 72. Lervang HH, Jensen S, Brochner-Mortensen J, et al. Does increased glomerular filtration rate or disturbed tubular function early in the course of childhood type 1 diabetes predict the development of nephropathy? Diabet Med. 1992, 9:635–640. 73. Chiarelli F, Verrotti A, Morgese G. Glomerular hyperfiltration increases the risk of developing microalbuminuria in diabetic children. Pediatr Nephrol. 1995, 9:154–158. 74. Azevedo MJ, Gross JL. Follow-up of glomerular hyperfiltration in normoalbuminuric type 1 (insulin-dependent) diabetic patients. Diabetologia, 1991,34:611. 75. Jerums G, Premaratne E, Panagiotopoulos S et al. The clinical significance of hyperfiltration in diabetes. Diabetologia. 2010;53 (10):2093–104. 76. Amin R, Turner C, van Aken S et al. The relationship between microalbuminuria and glomerular filtration rate in young type 1 diabetic subjects: The Oxford Regional Prospective Study. Kidney Int, 2006, 68:1740–1749. 77. MacIsaac RJ, Tsalamandris C, Thomas MC et al.Estimating glomerular filtration rate in diabetes: a comparison of cystatin-C- and creatinine-based methods. Diabetologia. 2006, 49:1686–1689. 78. MacIsaac RJ, Tsalamandris C, Thomas MC et al. The accuracy of cystatin C and commonly used creatinine-based methods for detecting moderate and mild chronic kidney disease in diabetes. Diabet Med. 2007, 24:443–448. e-mail: medalfavit@mail.ru 79. Dahlquist G, Aperia A, Broberger O et al. Renal function in relation to metabolic control in children with diabetes of different duration. Acta Paediatr Scand 1983; 72: 903–909. 100. Perkins BA, Ficociello LH, Silva KH, et al. Regression of microalbuminuria in type 1 diabetes. N Engl J Med 2003;348:2285–93. 80. Mogensen CE, Andersen MJ. Increased kidney size and glomerular filtration rate in untreated juvenile diabetes: normalization by insulin-treatment. Diabetologia. 1975, 11:221–224. 101. Giorgino F, Laviola L, Cavallo Perin P, et al. Factors associated with progression to macroalbuminuria in microalbuminuric Type 1 diabetic patients: the EURODIAB Prospective Complications Study. Diabetologia 2004;47:1020–8. 81. Wiseman MJ, Saunders AJ, Keen H et al. Effect of blood glucose control on increased glomerular filtration rate and kidney size in insulin-dependent diabetes. N Engl J Med 1985,312:617–621. 102. Araki S, Haneda M, Sugimoto T, et al. Factors associated with frequent remission of microalbuminuria in patients with type 2 diabetes mellitus. Diabetes 2005;54:2983–7. 82. Wiseman MJ, Mangili R, Alberetto M, et al. Glomerular response mechanisms to glycemic changes in insulindependent diabetics. Kidney Int. 1987, 31:1012–1018. 103. Perkins BA, Krolewski AS. Early nephropathy in type 1 diabetes: a new perspective on who will and who will not progress. Curr Diab Rep 2005;5:455–63. 83. Vora, JP. Dolben J, Dean JD, et al. Renal hemodynamics in newly presenting non-insulin dependent diabetes mellitus. Kidney Int. 1992, 41, 829–835. 104. Amin R, Widmer B, Prevost AT, et al. Risk of microalbuminuria and progression to macroalbuminuria in a cohort with childhood onset type 1 diabetes: prospective observational study. BMJ 2008;336:697–701. 84. Keller CK., Bergis KH, Fliser D. et al. Renal findings in patients with short-term type 2 diabetes. J. Am. Soc. Nephrol.1996,7, 2627–2635. 105. Roy MS, Affouf M, Roy A. Six-year incidence of proteinuria in type 1 diabetic African Americans. Diabetes Care 2007;30:1807–12. 85. Nelson RG. Bennett PH, Beck GJ, et al. Development and progression of renal disease in Pima Indians with non-insulin-dependent diabetes mellitus. Diabetic Renal Disease Study Group. N. Engl. J. Med. 1996, 335,1636–1642. 106. de Boer IH, Sibley SD, Kestenbaum B, et al. Central obesity, incident microalbuminuria, and change in creatinine clearance in the epidemiology of diabetes interventions and complications study. J Am Soc Nephrol 2007;18:235–43. 86. Schmitz A. Renal function changes in middleaged and elderly Caucasian type 2 (non-insulindependent) diabetic patients — a review. Diabetologia.1993, 36:985–992. 107. Raile K, Galler A, Hofer S, et al. Diabetic nephropathy in 27,805 children, adolescents, and adults with type 1 diabetes: effect of diabetes duration, A1C, hypertension, dyslipidemia, diabetes onset, and sex. Diabetes Care 2007;30:2523–8. 87. Damsgaard EM, Mogensen CE. Microalbuminuria in elderly hyperglycaemic patients and controls. Diabet Med, 1996, 3:430–435. 88. Gragnoli G, Signorini AM, Tanganelli I et al. Prevalence of glomerular hyperfiltration and nephromegaly in normo- and microalbuminuric type 2 diabetic patients. Nephron, 1993,65:206–211. 89. Silveiro SP, Friedman R, de Azevedo MJ et al. Fiveyear prospective study of glomerular filtration rate and albumin excretion rate in normofiltering and hyperfiltering normoalbuminuric NIDDM patients. Diabetes Care, 1996,19:171–174. 90. Vedel P, Obel J, Nielsen FS et al. Glomerular hyperfiltration in microalbuminuric NIDDM patients. Diabetologia, 1996 39:1584–1589. 91. Jerums G, Premaratne E, Panagiotopoulos S et al. The clinical significance of hyperfiltration in diabetes. Diabetologia. 2010;53 (10):2093–104. 92. Harris MI, Klein R, Welborn TA, et al. Onset of NIDDM occurs at least 4–7 yr before clinical diagnosis. Diabetes Care 1992,15:815–819. 93. Mussap M, Dalla Vestra M et al. Cystatin C is a more sensitive marker than creatinine for the estimation of GFR in type 2 diabetic patients. Kidney Int. 2002;61 (4):1453–61. 94. Viberti GC, Hill RD, Jarrett RJ, et al. Microalbuminuria as a predictor of clinical nephropathy in insulindependent diabetes mellitus. Lancet 1982;1:1430–2. 95. Parving, HH.; Oxenboll, B.; Svendsen, PA., et al.. Early detection of patients at risk of developing diabetic nephropathy: A longitudinal study of urinary albumin excretion; Acta Endocrinol., 1982,100, 550–5. 96. Mogensen CE, Christensen CK. Predicting diabetic nephropathy in insulin-dependent patients. N Engl J Med 1984;311:89–93. 97. Williams ME. Diabetic nephropathy: the proteinuria hypothesis. Am J Nephrol 2005;25:77–94. 98. ACE Inhibitors in Diabetic Nephropathy Trialist Group. Should all patients with type 1 diabetes mellitus and microalbuminuria receive angiotensin-converting enzyme inhibitors? A metaanalysis of individual patient data. Ann Intern Med. 2001;134:370–9. 99. American Diabetes Association Clinical Practice Guidelines. Nephropathy in Diabetes. Diabetes Care 2004;27: S79–S83. e-mail: medalfavit@mail.ru 108. Perkins BA, Ficociello LH, Roshan B et al. In patients with type 1 diabetes and new-onset microalbuminuria the development of advanced chronic kidney disease may not require progression to proteinuria. Kidney Int. 2010;77 (1):57–64. 109. Perkins BA, Ficociello LH, Ostrander BE, et al. Microalbuminuria and the risk of early progressive renal function decline in type 1 diabetes. J Am Soc Nephrol 2007;18:1353–61. 110. Perkins BA, Krolewski AS. Early nephropathy in type 1 diabetes: the importance of early renal function decline. Curr Opin Nephrol Hypertens. 2009;18 (3):233–40. 111. Shastri S, Katz R, Shlipak MG et al. Cystatin C and albuminuria as risk factors for development of CKD stage 3: the Multi-Ethnic Study of Atherosclerosis (MESA). Am J Kidney Dis. 2011;57 (6):832–40. 112. Molitch ME, Steffes M, Sun W, et al., Development and progression of renal insufficiency with and without albuminuria in adults with type 1 diabetes in the diabetes control and complications trial and the epidemiology of diabetes interventions and complications study, Diabetes Care, 2010;33:1536–43. 113. Rosolowsky ET, Niewczas MA, Ficociello LH et al. Between hyperfiltration and impairment: demystifying early renal functional changes in diabetic nephropathy. Diabetes Res Clin Pract. 2008;82 Suppl 1: S46–53. 114. MacIsaac RJ, Tsalamandris C, Panagiotopoulos S, et al., Nonalbuminuric renal insufficiency in type 2 diabetes, Diabetes Care, 2004;27:195–200. 115. Pavkov ME, Knowler WC, Lemley KV, et al., Early renal function decline in type 2 diabetes, Clin J Am Soc Nephrol, 2012;7;78–84. 116. Macisaac RJ, Jerums G, Diabetic kidney disease with and without albuminuria, Curr Opin Nephrol Hypertens, 2011;20:246–57. 117. Gilbert RE, Cooper ME. The tubulointerstitium in progressive diabetic kidney disease: more than an aftermath of glomerular injury? Kidney Int. 1999;56 (5):1627–37. Review. 118. Jeon YK, Kim MR, Huh JE et al. Cystatin C as an Early marker of Nephropathy in Patients with Type 2 Diabetes. J Korean Med Sci. 2011; 26 (2):258–63. 119. Kim SS, Song SH, Kim IJ, et al. Urinary Cystatin C and Tubular Proteinuria Predict Progression of Diabetic Nephropathy. Diabetes Care. 2012 Oct 23. 120. Togashi Y, Miyamoto Y. Urinary cystatin C as a biomarker for diabetic nephropathy and its immunohistochemical localization in kidney in Zucker diabetic fatty (ZDF) rats. Exp Toxicol Pathol. 2012 Jul 11. 121. Вельков В. В., NGAL-« ренальный тропонин», — ранний маркер острого повреждения почек: актуальнеость для нефрологии и кардиохирургии, Клинико-лабораторный консилиум, Научно-практический журнал 2011,№ 4 (40), 24–43. 122. Nielsen SE, Hansen HP, Jensen BR et al. Urinary neutrophil gelatinase-associated lipocalin and progression of diabetic nephropathy in type 1 diabetic patients in a four-year follow-up study. Nephron Clin Pract. 2011;118 (2):130–5. 123. Nielsen SE, Andersen S, Zdunek D, et al. Tubular markers do not predict the decline in glomerular filtration rate in type 1 diabetic patients with overt nephropathy. Kidney Int. 2011;79 (10):1113–8. 124. Bolignano D, Lacquaniti A, Coppolino G, et al. Neutrophil gelatinase-associated lipocalin as an early biomarker of nephropathy in diabetic patients. Kidney Blood Press Res. 2009;32 (2):91–8. 125. Nielsen SE, Reinhard H, Zdunek D, et al. Tubular markers are associated with decline in kidney function in proteinuric type 2 diabetic patients. Diabetes Res Clin Pract. 2012;97 (1):71–6. 126. Costacou T, Orchard TJ. Renal hyperfiltration in relationto low renal function and incidence of overt nephropathyamong individuals with type 1 diabetes. Diabetologia, 2009. 52 (Supp. 1): S414. 127. Amin R, Turner C, van Aken S et al The relationship between microalbuminuria and glomerular filtration rate in young type 1 diabetic subjects: The Oxford Regional Prospective Study. Kidney Int 2005 68:1740–1749. 128. Wiseman MJ, Viberti GC, Keen H (1984) Threshold effect of plasma glucose in the glomerular hyperfiltration of diabetes. Nephron 1984, 38:257–260. 129. Magee GM, Bilous RW, Cardwell CR et al. Is hyperfiltration associated with the future risk of developing diabetic nephropathy? A meta-analysis. Diabetologia. 2009; 52 (4):691–7. 130. Ficociello LH, Perkins BA, Roshan B et al. Renal hyperfiltration and the development of microalbuminuria in type 1 diabetes. Diabetes Care, 2009, 32:889–893. 131. Mogensen CE, Chachati A, Christensen CK et al. Microalbuminuria: an early marker of renal involvement in diabetes. Uremia Invest, 1985, 9:85–95. 132. Steinke JM, Sinaiko AR, Kramer MS et al. The early natural history of nephropathy in type 1 diabetes III. Predictors of 5-year urinary albumin excretion rate patterns in initially normoalbuminuric patients. Diabetes, 2005, 54:2164–2171. 133. Ruggenenti P, Porrini EL, Gaspari F et al. Glomerular Hyperfiltration and Renal Disease Progression in Type 2 Diabetes. Diabetes Care. 2012, Jul 6. 134. Hostetter TH.Hypertrophy and hyperfunction of the diabetic kidney, J Clin Invest, 2001, 107:161–162. 135. Bak M, Thomsen K, Christiansen T, et al. Renal enlargement precedes renal hyperfiltration in early experimental diabetes in rats. J Am Soc Nephrol, 2000,11:1287–1292. 136. Lawson ML, Sochett EB, Chait PG, et al. Effect of puberty on markers of glomerular hypertrophy and hypertension in IDDM. Diabetes, 1996 45:51–55. 137. Zerbini G, Bonfanti R, Meschi F et al. Persistent renal hypertrophy and faster decline of glomerular filtration rate precede the development of microalbuminuria in type 1 diabetes. Diabetes, 2006, 55:2620–2625. 138. Henegar, JR, Bigler, SA,, et al.Functional and structural changes in the kidney in the early stages of obesity. J. Am. Soc. Nephrol 2001,12,1211–1217. 139. 139.. Goumenos, DS. Kawar B, El Nahas M et al. Early histological changes in the kidney of people with morbid obesity. Nephrol. Dial. Transplant. 2009, 24, 3732–3738. Медицинский алфавит. Современная лаборатория 3 / 2013 35 140. Rigalleau V, Laurent F, Montaudon M, et al. Large kidneys predict poor renal outcome in subjects with diabetes and chronickidney disease. BMC Nephrol. 2010; 11:3. 141. Rudberg S, Osterby R, Dahlquist G et al. Predictors of renal morphological changes in the early stage of microalbuminuria in adolescents with IDDM. Diabetes Care, 1997,20:265–271. 142. Berg UB, Torbjornsdotter TB, Jaremko G et al. Kidney morphological changes in relation to long-term renal function and metabolic control in adolescents with IDDM. Diabetologia, 1998,41:1047–1056. 143. Drummond K, Mauer M. The early natural history of nephropathy in type 1 diabetes: II. Early renal structural changes in type 1 diabetes. Diabetes, 2002,51:1580–1587. 144. Brenner BM. Hemodynamically mediated glomerular injury and the progressive nature of kidney disease. Kidney Int, 1983, 23:647–655. 145. Zatz R, Meyer TW, Rennke HG et al.Predominance of hemodynamic rather than metabolic factors in the pathogenesis of diabetic glomerulopathy. Proc Natl Acad Sci USA,1985,82:5963–5967. 146. Brenner BM, Meyer TW, Hostetter TH (1982) Dietary protein intake and the progressive nature of kidney disease: the role of hemodynamically mediated glomerular injury in the pathogenesis of progressive glomerular sclerosis in aging, renal ablation, and intrinsic renal disease. N Engl J Med 307:652–659. 147. Walker JD, Bending JJ, Dodds RA et al. Restriction of dietary protein and progression of renal failure in diabetic nephropathy. Lancet, 1989,2:1411–1415. 148. Zeller K, Whittaker E, Sullivan L et al. Effect of restricting dietary protein on the progression of renal failure in patients with insulin-dependent diabetes mellitus. N Engl J Med,1991,324:78–84. 149. Nenov VD, Taal MW, Sakharova OV et al. Multihit nature of chronic renal disease. Curr Opin Nephrol Hypertens, 2000,9:85–97. 150. Kramer H, Luke A, Bidani A et al. Obesity and prevalent and incident CKD: the Hypertension Detection and Follow-Up Program. Am J Kidney Dis, 2005; 46: 587–594. 151. Cherney DZ, Sochett EB, Lai V et al. Renal hyperfiltration and arterial stiffness in humans with uncomplicated type 1 diabetes. Diabetes Care 2010; 33: 2068–2070. 152. Sabatini S, Kurtzman NA. Role of hyperfiltration in the pathogenesis of diabetic nephropathy. In: Sharma S. Prabhakar (ed). Advances in Pathogenesis of Diabetic Nephropathy. New York, NY: Nova Science Publishers, Inc., 2011, pp. 21–48. 153. Vaziri ND, Bai Y, Ni Z et al. Intra-renal angiotensin II/AT1 receptor, oxidative stress, inflammation, and progressive injury in renal mass reduction. J Pharmacol Exp Ther 2007; 323: 85–93. 154. Hernandez-Marco R, Codoner-Franch P, Pons Morales S et al. Oxidant/ antioxidant status and hyperfiltration in young patients with type 1 diabetes mellitus. Pediatr Nephrol 2009; 24: 121–127. 155. Li Z, Woollard JR, Wang S et al. Increased glomerular filtration rate in early metabolic syndrome is associated with renal adiposity and microvascular proliferation. Am J Physiol Renal Physiol 2011; 301: F1078–F1087. 156. Chalmers L, Kaskel FJ, Bamgbola. The role of obesity and its bioclinical correlates in the progression of chronic kidney disease. Adv Chronic Kidney Dis 2006; 13: 352–364. 157. Satriano J. Kidney growth, hypertrophy and the unifying mechanism of diabetic complications. Amino Acids 2007; 33: 331–339. 158. Zoccali C. Overweight, obesity and metabolic alterations in chronic kidney disease. Prilozi-Contributions, Sec Biol Med Sci 2009; 30: 17–31. dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group, N Engl J Med, 1993;329:977–86. 161. [No authors listed]. Sustained effect of intensive treatment of type 1 diabetes mellitus on development and progression of diabetic nephropathy: the Epidemiology of Diabetes Interventions and Complications (EDIC) study, JAMA, 2003;290:2159–67. 162. DCCT/EDIC Research Group, de Boer IH, Sun W, Cleary PA, et al., Intensive diabetes therapy and glomerular filtration rate in type 1 diabetes, N Engl J Med, 2011;365:2366–76. 163. Patel A, MacMahon S, Chalmers J et al., Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial, Lancet, 2007;370:829–40. 164. Zoungas S, de Galan BE, Ninomiya T, et al., Combined effects of routine blood pressure lowering and intensive glucose control on macrovascular and microvascular outcomes in patients with type 2 diabetes, Diabetes Care, 2009;32:2068–74. 165. Ismail-Beigi F, Craven T, Banerji MA, et al., Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial, Lancet, 2010;376:419–30. 166. 166.Holman RR, Paul SK, Bethel MA, et al., 10-year follow-up of intensive glucose control in type 2 diabetes, N Engl J Med, 2008;359:1577–89. 167. Pistrosch, F. Herbrig K, Kindel B, et al. Rosiglitazone improves glomerular hyperfiltration, renal endothelial dysfunction, and microalbuminuria of incipient diabetic nephropathy in patients. Diabetes 2005, 54, 2206–2211. 168. Nordquist L, Brown R, Fasching A, et al. Proinsulin C-peptide reduces diabetes-induced glomerular hyperfiltration via efferent arteriole dilation and inhibition of tubular sodium reabsorption. Am J Physiol Renal Physiol, 2009, 297: F1265–F1272. 169. Parving HH, Andersen AR, Smidt UM, et al., Early aggressive antihypertensive treatment reduces rate of decline in kidney function in diabetic nephropathy, Lancet, 1983;1:1175–9. 170. Hansen HP, Rossing P, Tarnow L et al. Increased glomerular filtration rate after withdrawal of longterm antihypertensive treatment in diabetic nephropathy. Kidney Int. 1995;47 (6):1726–31. 171. Bakris GL, Weir MR, Angiotensin-converting enzyme inhibitor associated elevations in serum creatinine: is this a cause for concern? Arch Intern Med, 2000;160:685–93. 172. Rossing P, Hommel E, Smidt UM, et al., Reduction in albuminuria predicts a beneficial effect on diminishing the progression of human diabetic nephropathy during antihypertensive treatment, Diabetologia, 1994;37:511–6. 173. Schjoedt KJ, Hansen HP, Tarnow L et al. Long-term prevention of diabetic nephropathy: an audit. Diabetologia. 2008;51 (6):956–61. 174. Gaede P, Tarnow L, Vedel P, et al., Remission to normoalbuminuria during multifactorial treatment preserves kidney function in patients with type 2 diabetes and microalbuminuria, Nephrol Dial Transplant, 2004;19:2784–8. 175. Colhoun HM, Betteridge DJ, Durrington PN, et al., Effects of atorvastatin on kidney outcomes and cardiovascular disease in patients with diabetes: an analysis from the Collaborative Atorvastatin Diabetes Study (CARDS), Am J Kidney Dis, 2009;54:810–9. 159. 159.Cogan MG. Angiotensin II: a powerful controller of sodium transport in the early proximal tubule. Hypertension 1990; 15: 451–458. 176. Davis TM, Ting R, Best JD, et al., Effects of fenofibrate on renal function in patients with type 2 diabetes mellitus: the Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) Study, Diabetologia, 2011;54:280–90. 160. [No authors listed]. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin- 177. Vallon V The proximal tubule in the pathophysiology of the diabetic kidney. Am J Physiol Regul Integr Comp Physiol. 2011;300 (5): R1009–22. 36 Медицинский алфавит. Современная лаборатория 3 / 2013 178. Brochner-Mortensen J, Stockel M, Sorensen PJ et al. Proximal glomerulo-tubular balance in patients with type 1 (insulin-dependent) diabetes mellitus. Diabetologia. 1984;27:189–192. 179. Vallon V, Richter K, Blantz RC et al. Glomerular hyperfiltration in experimental diabetes mellitus: potential role of tubular reabsorption. J Am Soc Nephrol. 1999;10:2569–2576. 180. Vervoort G, Veldman B, Berden JH et al. Glomerular hyperfiltration in type 1 diabetes mellitus results from primary changes in proximal tubular sodium handling without changes in volume expansion. Eur J Clin Invest, 2005, 35:330–336. 181. Chagnac A, Herman M, Zingerman B et al. Obesityinduced glomerular hyperfiltration: its involvement in the pathogenesis of tubular sodium reabsorption. Nephrol Dial Transplant, 2008 23:3946–3952. 182. Persson P, Hansell, P Palm F Tubular reabsorption and diabetes-induced glomerular hyperfiltration Acta Physiol (Oxf). 2010; 200 (1): 3–10. 183. Cherney DZ, Sochett EB. Evolution of renal hyperfiltration and arterial stiffness from adolescence into early adulthood in type 1 diabetes. Diabetes Care 2011; 34: 1821–1826. 184. Vallon V, Thomson SC. Renal function in diabetic disease models: the tubular system in the pathophysiology of the diabetic kidney. Annu Rev Physiol. 2012;74:351–75. 185. Frische S. Glomerular filtration rate in early diabetes: ongoing discussions of causes and mechanisms. J Nephrol. 2011;24 (5):537–40. 186. Palatini P. Glomerular hyperfiltration: a marker of early renal damage in pre-diabetes and prehypertension. Nephrol Dial Transplant. 2012;27 (5):1708–14. 187. Bantle JP, Wylie-Rosett J, Albright AL et al. Nutrition recommendations and interventions for diabetes: a position statement of the American Diabetes Association. Diabetes Care. 2008; 31 (Suppl. 1): S61–S78. 188. Vallon V, Wead LM, Blantz RC. Renal hemodynamics and plasma and kidney angiotensin II in established diabetes mellitus in rats: effect of sodium and salt restriction. J Am Soc Nephrol. 1995;5 (10):1761–7. 189. Vallon V, Huang D-Y, Deng A et al. Salt-sensitivity of proximal reabsorption alters macula densa salt and explains the paradoxical effect of dietary salt on glomerular filtration rate in diabetes mellitus. J Am Soc Nephrol. 2002;13:1865–1871. 190. Birk C, Richter K, Huang DY et al. The salt paradox of the early diabetic kidney is independent of renal innervation. Kidney Blood Press Res. 2003;26:344–350. 191. Vallon V, Kirschenmann D, Wead LM, et al. Effect of chronic salt loading on kidney function in early and established diabetes mellitus in rats. J Lab Clin Med. 1997;130 (1):76–82. 192. Miller JA. Renal responses to sodium restriction in patients with early diabetes mellitus. J Am Soc Nephrol. 1997;8:749–755. 193. Ekinci EI, Clarke S, Thomas MC et al. Dietary salt intake and mortality in patients with type 2 diabetes. Diabetes Care. 2011;34:703–709. 194. Thomas MC, Moran J, Forsblom C, et al. The association between dietary sodium intake, ESRD, and all-cause mortality in patients with type 1 diabetes. Diabetes Care. 2011; 34:861–866. 195. Abdelmalek JA, Rifkin DE. Cystatin C, creatinine, and albuminuria: bringing risk into 3 dimensions. Am J Kidney Dis. 2012;60 (2):176–8. e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 37 Индекс гемолиза: от обсуждения к решению проблем преаналитического качества О. А. Клименкова 1, врач клинической лабораторной диагностики В. С. Берестовская 2, к. м. н., доцент кафедры клинической лабораторной диагностики Е. С. Ларичева 2, ассистент кафедры клинической лабораторной диагностики О. А. Клименкова СПб ГУЗ «Консультативно-диагностический центр для детей», г. Санкт-Петербург ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И. И. Мечникова», г. Санкт-Петербург 1 2 В. С. Берестовская Резюме Обсуждается значимость и приемлемость использования процента гемолизированных образцов как индикатора качества преаналитического этапа. Расчёт процента гемолиза базируется на измерении индекса гемолиза (Hemolysis Index, HI) анализаторами линии cobas. Отмечается, что в связи с отсутствием стандартного подхода к оценке гемолиза нижняя граница HI была установлена как минимальное значение гемоглобина, влияющее на результат. Показано, что для централизованной лаборатории измерение индекса гемолиза позволяет определить контрагентов, которым необходимо провести мероприятия по улучшению качества взятия и транспортировки образцов. Предлагается провести исследование по сравнению уровней преаналитического качества лабораториям, имеющим возможность измерения индекса гемолиза. Ключевые слова: преаналитический этап, индикатор качества, процент гемолиза, индекс гемолиза, уровень качества. Summary There is a discussion about value and acceptance of using a percent of hemolysis as an indicator of pre-analytical phase quality. Percent of hemolyzed samples calculations are based on the measurement of hemolysis index (HI) on the analyzers cobas family. It is stated that, due to the lack of standardization of hemolysis measurement, the lower bound of HI was stated as the lowest hemoglobin limit, which misrepresents the final result. Measurement of hemolysis index allows laboratory to define contractors which need to improve the quality of samples collection and transportation. It is proposed to make a benchmarking of the pre-analytical quality levels in laboratories that have the ability to measure the index of hemolysis. Е. С. Ларичева В Key words: pre-analytical phase, quality indicator, percentage of hemolysis, hemolysis index, quality level. последние годы практическое здравоохранение всё большее внимание уделяет вопросам безопасности пациентов. Для лабораторной медицины это выразилось в первую очередь в осознании того, что концентрация усилий только на качестве аналитического этапа недостаточна для обеспечения высокого уровня полного процесса тестирования (TTP, Total Testing Process) [4]. В 2008 году Международная федерация клинической химии и лабораторной медицины (IFCC) впервые представила рабочую группу под названием «Лабораторные ошибки и безопасность пациента» (Laboratory Errors and Patient Safety Working Group, WGLEPS), основной задачей которой стал выбор наилучших стратегий для повышения безопасности паци38 ентов [6]. Членами WG-LEPS были определены и систематизированы индикаторы качества всех этапов TTP, а сотрудникам лабораторий было предложено принять участие в программе по определению значимости и приемлемости использования этих индикаторов [7]. Общепризнано, что наибольший вклад в общее число ошибок ТТР вносит преаналитический этап. Неслучайно, что из 25 индикаторов качества ТТР, предложенных WG-LEPS, 16 были предназначены для оценки качества именно преаналитического этапа. К наиболее обсуждаемым индикаторам качества преаналитического этапа относился процент гемолизированных образцов — показатель, сообщаемый как процент проб с гемолизом относительно общего числа образцов. Медицинский алфавит. Современная лаборатория 3 / 2013 В 2011 году были подведены первые итоги его практического применения [7], а в 2013 году этот показатель был включен в модель 56 индикаторов качества ТТР, из которых 34 относятся к преаналитическому этапу [5]. В отечественной литературе также было опубликовано исследование, посвященное использованию процента гемолиза как индикатора качества преаналитического этапа, определение которого основано на измерении индекса гемолиза HI [1]. Цель настоящего исследования — оценить значимость и приемлемость применения процента гемолиза в качестве индикатора качества преаналитического этапа в Санкт-Петербургском консультативно-диагностическом центре для детей (СПб КДЦД). e-mail: medalfavit@mail.ru Материал и методы Измерение индекса гемолиза было проведено на анализаторах cobas 6000 (c 501) и cobas Integra 400 plus (Roche Diagnostics) в период с января по июль 2013 года. HI был определён в 34 502 образцах сыворотки пациентов, полученных в процедурном кабинете СПб КДЦД и доставленных в межрайонную клинико-диагностическую лабораторию (МЦКДЛ) СПб КДЦД из десяти поликлиник для взрослых. Данные результатов исследования были получены из лабораторной информационной системы «PSM — АКЛ клиническая лаборатория» (Roche — «Акросс инжиниринг»); статистическую обработку проводили в программе Excel (Windows). Рисунок 1. Уровень гемолиза, соответствую‑ щий концентрации гемоглобина в сыворотке 50 мг/дл (50 HI). Результаты и обсуждение Критерии выбора дискриминационных значений Измерение индекса гемолиза на анализаторах линии cobas выполняется автоматически, а передача данных с анализаторов в лабораторную информационную систему (ЛИС) не создаёт сложностей для получения и обработки данных [2]. Однако, по нашему мнению, существует проблема методического характера, связанная с тем, что критерии отнесения образца к гемолизированному не установлены. Показательно, что в предварительных данных WGLEPS, содержащих дискриминационные значения для оптимального, приемлемого, минимального и недопустимого уровня качества, также указывается, что ограничением этого проекта является отсутствие стандартизации в оценке гемолиза [7]. В первую очередь это связано с тем, что результаты, обобщённые WG-LEPS, были получены из лабораторий, осуществлявших как визуальную, так и автоматизированную оценку гемолиза. Во вторых, как показало мультицентровое исследование, посвященное автоматизированному измерению HI, в зависимости от используемой производителем технологии, результат может быть получен как в качественном, так и в количественном выражении [3]. e-mail: medalfavit@mail.ru Рисунок 2. Уровень гемолиза, соответствую‑ щий концентрации гемоглобина в сыворотке 10 мг/дл (10 HI). В литературе мы обнаружили рекомендации по использованию индекса гемолиза в диапазоне выше 15 и менее 50 HI, как индикатора качества внелабораторной части преаналитического этапа [1]. Необходимо отметить, что значение индекса гемолиза выше 50 мг/дл (рис. 1) принято относить к гемолизу, видимому глазом [9]. При количественном измерении HI результат отражает содержание свободного гемоглобина в сыворотке или плазме, выраженное в мг/дл. В частности, в нашем исследовании для анализаторов линии cobas значение 10 HI соответствует концентрации гемоглобина 10 мг/дл. Происхождение минимальной границы 15 HI связано с тем, что 15 мг/дл (150 мг/л) является пределом обнаружения гемолиза на анализаторе Vitros 5,1 [1, 8]. Однако способ определения HI на анализаторах линии cobas является более чувствительным и позволяет достоверно определять свободный гемоглобин в сыворотке при концентрации 5 мг/дл (5 HI). Для того, чтобы ответить на вопрос, стоит ли устанавливать минимальную границу измерения индекса гемолиза на пределе обнаружения HI, мы проанализировали инструкции к реагентам линии cobas. В соответствии с данными производителя, минимальное значение гемолиза, способного потенциально влиять на результат пациента (в частности, креатинкиназа МВ), соответствует 10 HI. Таким образом, критерием минимальной границы выбранного нами диапазона индекса гемолиза выше 10 и менее 50 HI стал приоритет безопасности пациента. Следует обратить внимание на то, что гемолиз в сыворотке с 10 HI визуально не определяется (рис. 2) и может быть выявлен только при автоматизированном измерении. Оценка качества преаналитического этапа контрагентов СПб КДЦД на основе расчёта процента образцов с гемолизом выше 10 и менее 50 HI Для расчёта дискриминационных значений диапазона HI с целью установления оптимального, приемлемого, минимального и неприемлемого уровня преаналитического качества мы использовали методику, приведённую в публикациях Sciacovelli L. с соавт. и А. В. Мошкина [7, 1]. На рис. 3 приведен процент образцов сыворотки с гемолизом в диапазоне выше 10 и менее 50 HI, полученных в процедурном кабинете СПб КДЦД и доставленных из десяти поликлиник для взрослых — контрагентов МЦКДЛ СПб КДЦД. Объединив эти данные, мы рассчитали уровни преаналитического качества для каждой медицинской организации (табл. 1). Оптимальному уровню качества соответствовали четыре медицинские организации (МО), в том числе СПб КДЦД (рис. 3). По одному контрагенту попали в категории приемлемого и минимального уровня преаналитического качества. Также наше исследование позволило выявить пять контрагентов с неприемлемым уровнем качества. Следовательно, процент гемолизированных образцов, рассчитанных на основе автоматизированного измерения HI Медицинский алфавит. Современная лаборатория 3 / 2013 39 Рисунок 3. Процент образцов сыворотки с индексом гемолиза выше 10 и менее 50 HI, посту‑ пивших в МЦКДЛ СПБ КДЦД в период с января по июль 2013 года. Таблица 1 Критерии оценки преаналитического качества образцов сыворотки, полученной в СПб КДЦД, и доставленных из десяти медицинских организаций для взрослых Процент образцов в диапазоне выше 10 и менее 50 HI Количество МО, соответствующих критерию качества Оптимальный < 5,2 % 4 Приемлемый 5,2–6,9 % 1 Минимальный 7,0–8,7 % 1 Неприемлемый > 8,7 % 5 Уровень качества на анализаторах линии cobas, действительно является значимым индикатором, объективно отражающим проблемы преаналитического этапа в конкретной МО. Проведенное нами исследование позволило сформировать целевую группу контрагентов МЦКДЛ СПб КДЦД для организации и проведения мероприятий, направленных на улучшение качества преаналитического этапа (взятия и транспортировки образцов сыворотки). В 2013 году Plebani M. и соавт. определили критерии приемлемости индикатора качества [5]: • возможность использования различными лабораториями; • научная обоснованность с акцентом на областях, имеющих значимость для обеспечения качества лабораторной медицины; • реализуемость и доступность как со стороны производителя, так и в отношении пороговых значений; • своевременность получения и возможность использования их для улучшения лабораторного качества. 40 По нашему мнению, процент гемолизированных образцов, рассчитанный с учётом HI на анализаторах линии cobas, соответствует всем перечисленным требованиям. Измерение HI проводится автоматически, результат передаётся в ЛИС, для обработки данных не требуется сложных статистических методов, а процент гемолиза, определяемый по каждому контрагенту, позволяет своевременно выделить заказчиков лабораторного исследования, требующих принятия мер по улучшению взятия и транспортировки материала. Исследование Lippi G. и соавт. показало высокую воспроизводимость результатов HI в различных лабораториях, использующих анализаторы производства Roche Diagnostics [3], поэтому мы предлагаем всем лабораториям, использующим оборудование линии cobas, включиться в работу для разработки, определения и внедрения в практику критериев уровней качества преаналитического этапа, установленных на основе процента гемолиза. Медицинский алфавит. Современная лаборатория 3 / 2013 Заключение На протяжении многих лет профессиональное сообщество обсуждало трудности, связанные с построением системы качества на преаналитическом этапе. Для централизованной лаборатории индекс гемолиза, измеряемый во всех образцах сыворотки, делает возможным сравнение качества взятия и транспортировки материала, поступающего от различных контрагентов. Принципиально важно, что процент гемолизированных образцов выступает в роли объективного аргумента при выстраивании политики обеспечения качества, поэтому внедрение индекса гемолиза в лабораторную практику — это переход от обсуждения к решению проблем преаналитического этапа. Список литературы 1. Мошкин А. В. Индекс гемолиза как индикатор качества внелабораторной части преаналитического этапа лабораторного исследования. // Клиническая лабораторная диагностика. — 2012. — № . 11. — с. 63–64. 2. Сывороточные индексы: сокращение ошибок в лабораторной медицине. URL: rochediagnostics.ru/rochediagnostics/ data/serum_indices.pdf. Дата обращения 13.08.2013. 3. Lippi G., Salvagno G. L., Blanckaert N., et al. Multicenter evaluation of the hemolysis index in automated clinical chemistry systems. // Clin Chem Lab Med. — 2009. — Vol.47, № 8. — р.934–939. 4. Plebani M. Laboratory errors: How to improve pre- and post-analytical phases? // Biochemia Medica. — 2007. — Vol.17, № 1. — р.5–9. 5. Plebani M., Chiozza M. L., Sciacovelli L. Towards harmonization of quality indicators in laboratory medicine.// Clin Chem Lab Med — 2013. — Vol. 51, № 1. — р. 187–195. 6. Sciacovelli L., Plebani M. The IFCC Working Group on laboratory errors and patient safety. // Clinica Chimica Acta — 2009. — Vol. 404. — р.79–85. 7. Sciacovelli L., O’Kane M. et al. Quality Indicators in Laboratory Medicine: from theory to practice. Preliminary data from the IFCC Working Group Project on Laboratory Errors and Patient Safety. // Clin Chem Lab Med — 2011. — Vol. 49, № 5. — р. 835–844. 8. Soderberg J., Jonsson P. A. et al Haemolysis index — an estimate of preanalytical quality in primary health care. // Clin Chem Lab Med. — 2009. — Vol.47, № 8. — р. 940–944. 9. V e r m e e r H . J . , T h o m a s s e n E . , d e Jonge N. Automated Processing of Serum Indices Used for Interference Detection by the Laboratory Information System. // Clinical Chemistry. — 2005. — Vol. 51, № . 1. — р. 244–247. e-mail: medalfavit@mail.ru Новые возможности диагностики гепарининдуцированной тромбоцитопении у кардиохирургических больных О. В. Петрова, Т. Г. Егорова, О. И. Мурыгина, Т. В. Вавилова Федеральное государственное бюджетное учреждение «Федеральный центр сердечно — сосудистой хирургии» Министерства здравоохранения Российской Федерации (г. Астрахань), Россия Государственное бюджетное образовательное учреждение высшего профессионального образования «Северо-Западный государственный медицинский университет им. И. И. Мечникова» Министерства здравоохранения Российской Федерации, Россия, Санкт-Петербург Diagnostics of the heparin-induced thrombocytopenia at cardiosurgical patients O. V. Petrova, D. G. Tarasov, T. G. Egorova, O. I. Mureagina, S. A. Shashin Federal state budgetary establishment «Federal center cardiovascular surgery» (Astrakhan) Russia Резюме У 25 пациентов из 250, оперированных по поводу хронической ревматической болезни сердца в условиях искусственного кровообращения и принимавших в послеоперационном периоде гепарин, на 3–5 сутки была отмечена тромбоцитопения. У десяти пациентов из них (4 % от общего количества) диагностировали гепарин-индуцированную тромбоцитопению (ГИТ) с помощью иммунохроматографического метода определения иммуноглобулинов класса G к комплексу гепарин-тромбоцитарный фактор 4 с использованием тест-систем STic Expert HIT® (Stago, Франция). У трех пациентов гепарин-индуцированная тромбоцитопения сопровождалась развитием осложнений (тромбоз мезентеральных сосудов, нарушение мозгового кровообращения — инсульт), у семи пациентов гепарин-индуцированная тромбоцитопения протекала бессимптомно. На фоне использования низкомолекулярных гепаринов ГИТ развивалась значительно реже: в 0,9 % случаев. У этих пациентов ГИТ протекала бессимптомно. Результаты исследования согласуются по частоте выявленных случаев с данными литературы. Тест-системы STic Expert HIT® с успехом могут быть использованы для ранней диагностики ГИТ у кардиохирургических больных. Ключевые слова: тромбоцитопения, гепарин-индуцированная тромбоцитопения, кардиохирургия, гепарин, низкомолекулярные гепарины. Summary At 25 patients from 250, operated concerning a chronic rheumatic heart trouble in the conditions of artificial blood circulation and accepting in the postoperative period heparin, for 3–5 days is noted thrombocytopenia. For 10 patients from the 25 diagnosed heparin induced thrombocytopenia by means of an immunochromatography method of definition of immunoglobulin of a class G to a complex heparin — platelet factor 4. Three patients have heparin — the induced thrombocytopenia was accompanied by development of complications (thrombosis of mesenteric vessels, violation of brain blood circulation — the stroke), at seven patients is heparin — the induced thrombocytopenia proceeded asimptomatic. At 12 patients of 118 operated concerning a chronic rheumatic heart trouble in the conditions of artificial blood circulation and accepting in the postoperative period low molecular weight heparin, for 3–5 days thrombocytopenia is noted. For the 1st patient from the 12 diagnosed heparin — the induced thrombocytopenia which proceeded asimptomatic. Key words: thrombocytopenia, heparin-induced thrombocytopenia, cardiosurgical, heparin, low molecular weight heparin. Введение Нефракционированный гепарин (гепарин) и низкомолекулярные гепарины (НМГ — эноксапарин, дальтепарин, надропарин) широко используются у кардиохирургических больных в периоперационном периоде для предупреждения нежелательного тромбообразования и обеспечения безопасного искусственного кровообращения в ходе хирургического вмешательства. Однако применение этих препаратов сопряжено с риском развития гепарин-индуцированной тромбоцитопении, которая является грозным осложнением с клиническими проявлениями в виде тромбозов. Гепарин-индуцированная тромбоцитопения (ГИТ) — это форма имe-mail: medalfavit@mail.ru мунной тромбоцитопении, которая возникает в результате формирования специфических антител и развивается на фоне применения гепарина (как нефракционированных, так и низкомолекулярных форм). Частота развития ГИТ у пациентов, принимающих гепарин, составляет 1–5 %, у пациентов, принимающих низкомолекулярные гепарины (НМГ), составляет 0,5–1 % [1, 2, 4]. Ключевым звеном в патогенезе ГИТ является синтез специфических иммуноглобулинов класса G (чаще, чем А или М) к комплексу гепарин / тромбоцитарный фактор 4 (гепарин-ТФ4). Взаимодействие иммуноглобулинов G и тромбоцитарного фактора 4 приводит к образованию иммунного комплекса, который сор- бируется на мембране тромбоцитов, в результате чего происходит активация (агрегация) тромбоцитов с последующим их разрушением и выделением из поврежденных тромбоцитов вазоактивных веществ (серотонина, гистамина, аденозина фосфата). Агрегировавшие тромбоциты выводятся из кровотока и количество их в периферической крови снижается на 50 % и более от исходных значений. Образовавшийся иммунный комплекс (гепарин-ТФ4) способен повреждать не только тромбоциты, но и другие клетки крови, а также эндотелиоциты. В результате этого в крови появляется тканевой фактор (тканевой тромбопластин), а сосудистая стенка теряет свои антикоагулянтные свойства. Медицинский алфавит. Современная лаборатория 3 / 2013 41 Следствием происходящих процессов является повышенный синтез тромбина и риск тромботических осложнений (тромбоз глубоких вен, инфаркт миокарда, инсульты головного мозга и ДВС-синдром) [2, 4, 5, 7]. Геморрагические осложнения на фоне ГИТ развиваются редко. Заподозрить развитие ГИТ у кардиохирургических пациентов в послеоперационном периоде можно на основании снижения количества тромбоцитов на 50 % и более на 5–14 день приема гепарина и НМГ или в первые сутки (с анамнезом инфузии гепарина за последние 100 дней или аллергической реакции во время предыдущих инъекций). Предварительная оценка состояния больного при подозрении на ГИТ проводится в использованием правила 4Т: Thrombocytopenia (тромбоцитопения), Timing (время развития на 4–5 сутки), Thrombosis (тромбоз), oTher cause (исключение других причин тромбоцитопении). Не стоит забывать о том, что причинами тромбоцитопении у кардиохирургических больных в послеоперационном периоде могут быть гематома и кровотечение [1, 4]. Лабораторная диагностика ГИТ может выполняться по двум направлениям: функциональные исследования и тесты, основанные на реакции антиген-антитело с целью определения иммуноглобулинов класса G к комплексам гепарин-ТФ4 или влияния этих комплексов на тромбоциты любым доступным методом [1, 4, 5, 6]. Функциональные тесты: 1. тест высвобождения серотонина — «золотой стандарт» лабораторной диагностики ГИТ. Метод основывается на взаимодействии меченых 14С серотонином тромбоцитов донора, гепарина и инактивированной от тромбина сыворотки пациента. Метод имеет высокую чувствительность 80 % (по некоторым данным, до 100 %) и специфичность 90–95 %; 2. тест агрегации тромбоцитов гепарином. Оценка агрегации отмытых тромбоцитов донора в плазме пациента с добавлением гепарина. Чувствительность 90 %, специфичность 30–50 %; 42 3. проточная цитометрия основана на поиске косвенных признаков активации тромбоцитов, в частности, определении P-селектина, микровезикул, аннексина V. Преимуществом функциональных тестов являются высокие информативные характеристики, однако тесты сложные, дорогие, подчас длительные, недостаточно стандартизованные, используются нечасто. Иммунологические тесты: 4. иммунологиче ский те ст для определения АТ к гепарину методом твердофазного иммуноферментного анализа, основанный на идентификации ГИТ-антител. Метод обладает высокой чувствительностью и низкой специфичностью ввиду большой частоты ложноположительных результатов; 5. иммунохроматографический метод определения антитела к гепарин-ТФ4, чувствительность 95 %, специфичность около 80 %, время исполнения несколько часов; 6. использование полимерных частиц, покрытых ТФ4. При наличии специфических антител в сыворотке пациента происходит агглютинация и осаждение частиц за счет реакции антиген-антитело. Метод находится на стадии апробации. Общие свойства: быстрые и технически более простые тесты, однако они выявляют как активирующие тромбоциты антитела, так и нейтральные к ним, что дает большое количество ложно-положительных результатов и более низкую специфичность. В настоящее время продолжается поиск новых тестов для диагностики ГИТ, которые не требовали бы дополнительного или специального оборудования и специальной подготовки специалистов лабораторной диагностики, были бы просты в исполнении, имели высокую специфичность и чувствительность. Оптимальное время исполнения: 25–30 минут от забора крови, что имеет значение для принятия клинических решений у пациентов с тромбоцитопенией. Медицинский алфавит. Современная лаборатория 3 / 2013 Цель исследования Определение частоты развития и возможностей диагностики гепарин-индуцированной тромбоцитопении у кардиохирургических больных с помощью тест-систем STic Expert HIT® (Stago, Франция). Материалы и методы исследования В исследование были включены 368 пациентов (женщин) с хронической ревматической болезнью сердца (ХРБС) и поражением клапанного аппарата, оперированных в Федеральном центре сердечно-сосудистой хирургии в г. Астрахань. Больным выполнялась клапанная коррекция и имплантация искусственных клапанов сердца. Средний возраст больных составил 58,08 ± 1,39 лет. На дооперационном этапе пациентам проводили антикоагулянтуную терапию (гепарин подкожно по 5 000 Ед) для профилактики тромбоэмболических осложнений. Оперативные вмешательства проводились в условиях искусственного кровообращения, гипотермии, антеградной кардиоплегии. Использовали экстракорпоральные контуры фирмы Medtronic (США) с оксигенатором Quadrox (Maquet, США). Длительность операции в среднем составила 174 ± 21,5 минуты, время искусственного кровообращения 117,98 ± 4,5 минут, время пережатия аорты 81,11 ± 3,64 минуту. Для создания гипокоагуляции перед искусственным кровообращением вводили гепарин из расчета 3,0–4,0 мг/кг массы тела. Контроль адекватности гепаринизации проводили по времени активированного свертывания крови, поддерживая его значения во время искусственного кровообращения в диапазоне 480–600 с. Нейтрализацию гепарина осуществляли 1 % раствором протамина сульфата из соотношения гепарин: протамин 1:1,5. В послеоперационном периоде проводилась антикоагулянтная терапия: гепарин или низкомолекулярный гепарин (эноксапарин — Клексан) с переходом на варфарин. Количество тромбоцитов в периферической крови определяли при поступлении и в послеоперационном e-mail: medalfavit@mail.ru периоде на автоматическом гематологическом анализаторе Sysmex 2000i (Sysmex Corporation, Япония). Лабораторный контроль за варфаринотерапией проводили с помощью определения протромбинового времени (ПВ) и стандартизованного показателя — международного нормализованного отношения (МНО); контроль за гепаринотерапией с помощью активированного частичного тромбопластинового времени (АЧТВ), референсный интервал 24–35 с. Дополнительно исследовали антитромбин, референсный интервал 80–120 % и D-димер для контроля за уровнем тромбинемии и формированием перекрестно-сшитого фибрина, cut-off 0,5 мкг/мл. Протромбиновое время с расчетом МНО, АЧТВ, антитромбин определяли на автоматическом коагулометре Sta Compaсt (фирма Stago, Франция). D-димер определяли на иммунохимическом анализаторе Cardiac Reader (фирма Roche, Германия). Для подтверждения ГИТ использовали тест-системы STic Expert HIT®. Принцип метода — обнаружение иммуноглобулинов G к комплексу гепарин-ТФ4 с помощью сухой иммунохроматографии. Результаты и обсуждение Пациентов, оперированных больных по поводу ХРБС, разделили на две группы: I группа (250 больных) в послеоперационном периоде получала нефракционированный гепарин и варфарин; II группа (118 пациентов) в послеоперационном периоде получала низкомолекулярный гепарин (эноксапарин — Клексан) и варфарин. В раннем послеоперационном периоде (3–5 сутки) у 25 больных первой группы была отмечена тромбоцитопения со снижением количества тромбоцитов на 50 % и более. Использование шкалы 4Т и исследования с помощью тест-системы STic Expert HIT®: диагноз «ГИТ» был поставлен у десяти пациентов, что составило 4 % от общего количества в группе I. У трех пациентов из десяти с подтвержденной ГИТ процесс протекал с осложнениями (тромбоз мезентериe-mail: medalfavit@mail.ru альных сосудов и нарушение мозгового кровообращения по ишемическому типу). Частота развития осложнений у пациентов с ГИТ составила 30 %. У семи пациентов (70 %) ГИТ протекала без осложнений (бессимптомно) и после отмены гепарина количество тромбоцитов на 5–7 сутки достигало референсных пределов. Во II группе больных на фоне низкомолекулярного гепарина ГИТ встречалась значительно реже: в 0,9 % случаев (12 из 118 пациентов). При этом диагноз «ГИТ» не вызывал сомнений у одного пациента. Клиническое течение было бессимптомным. Частота развития ГИТ у пациентов, принимавших эноксапарин, составила 0,9 %. Клинический пример 1 Больная П., 53 лет, диагноз «хроническая ревматическая болезнь сердца. Митральный стеноз. Регургитация III степени. Легочная гипертензия I степени. Хроническая сердечная недостаточность 2а, второй функциональный класс». Выполнена операция протезирования митрального клапана. Длительность искусственного кровообращения составила 114 минут, пережатия аорты — 94 минуты, гипотермия — 33 °C, интраоперационная кровопотеря — 1 000 мл. Предоперационная подготовка: вводили подкожно гепарин по 5 000 ЕД. Интраоперационно для создания гипокоагуляции использовали гепарин из расчета 3,0–4,0 мг/кг массы тела, по окончании операции нейтрализацию гепарина осуществляли 1 % раствором протамина сульфата из соотношения гепарин/протамин 1:1,5. В послеоперационном периоде пациентка получала гепарин (подкожно 5 000 ЕД) и варфарин. При поступлении количество тромбоцитов в периферической крови составило 256 × 10/9 л. В первые сутки после оперативного вмешательства количество тромбоцитов 179 × 10/9 л, АЧТВ — 60 с, МНО — 1,1. На вторые сутки количество тромбоцитов 141 × 10/9 л, АЧТВ — 58 с, МНО — 1,3. На третьи сутки количество тромбоцитов 87 × 10/9 л, АЧТВ — 53 с, МНО — 1,5, антитромбин 88 %, Д-димер — 1,2 мкг/мл. На третьи сутки послеоперационного периода в связи со снижением количества тромбоцитов в периферической крови проводится тест на ГИТ, результат: тест на ГИТ положительный (обнаружены иммуноглобулины G к гепарин-ТФ4). На основании лабораторных исследований (тромбоцитопении и положительного теста на ГИТ) диагностирована ГИТ, гепарин отменен. На четвертые сутки количество тромбоцитов 58 × 10/9 л, АЧТВ 28 с, МНО — 1,9. На пятые сутки количество тромбоцитов 41 × 10/9 л, АЧТВ 30 с, МНО — 2,1, антитромбин 85 %, Д-димер — 2,6 мкг/мл. У пациентки диагностирован тромбоз мезентеральных сосудов, кишечная непроходимость. На шестые и седьмые сутки состояние пациентки крайне тяжелое, количество тромбоцитов 38 × 10/9 л, АЧТВ 29 с, МНО — 2,5, AT III — 80 %, Д-димер — 4,0 мкг/мл. На седьмые сутки гибель пациентки. При аутопсии тромбоз мезентериальных сосудов. Клинический пример 2 Больная Г., 55 лет, диагноз «хроническая ревматическая болезнь сердца. Митральный стеноз. Регургитация III степени. Легочная гипертензия I степени. Хроническая сердечная недостаточность 2а, второй функциональный класс». Выполнена операция протезирования митрального клапана. Длительность искусственного кровообращения составила 98 минут, пережатия аорты — 75 минут, гипотермия — 34 °C, интраоперационная кровопотеря — 975 мл. Предоперационная подготовка: вводили подкожно гепарин по 5 000 ЕД. Интраоперационно для создания гипокоагуляции использовали гепарин из расчета 3,0–4,0 мг/кг массы тела, по окончании операции нейтрализацию гепарина осуществляли 1 % раствором протамина сульфата из соотношения гепарин/протамин 1:1,5. В послеоперационном периоде пациентка получала гепарин (подкожно 5 000 ЕД) и варфарин. При поступлении количество тромбоцитов в периферической крови составило 225 × 10/9 л. В первые сутки после оперативного вмеша- Медицинский алфавит. Современная лаборатория 3 / 2013 43 тельства количество тромбоцитов 157 × 10/9 л, АЧТВ 60 с, МНО — 1,1. На вторые сутки количество тромбоцитов 133 × 10/ 9 л, АЧТВ 60 с, МНО — 1,4, антитромбин — 90 %. На третьи сутки количество тромбоцитов 81 × 10/9 л, АЧТВ 48 с, МНО — 1,7, антитромбин — 86 %. На третьи сутки послеоперационного периода в связи со снижением количества тромбоцитов в периферической крови проводится тест на ГИТ, результат: тест на ГИТ положительный (обнаружены иммуноглобулины G к гепарин-ТФ4). Диагностирована ГИТ, гепарин отменен. На четвертые сутки количество тромбоцитов 79 × 10/9 л, АЧТВ 28 с, МНО — 2,0, антитромбин — 83 %. На четвертые сутки на основании клиники и инструментальных методов у пациентки диагностировано нарушение мозгового кровообращения (инсульт). На 5–6 сутки количество тромбоцитов 63 × 10/9 л, АЧТВ 23 с, МНО — 2,5. Состояние пациентки тяжелое, обусловлено объемом выполненной операции и неврологическими нарушениями, пациентка получает антикоагулянтную, антибактериальную терапию и ноотропы. На 7–10 сутки отмечается повышение количества тромбоцитов — 103 × 10/9 л, АЧТВ 29 с, МНО — 2,5. На 11–14 сутки количество тромбоцитов периферической крови составляет 185 × 10/9 л, АЧТВ 29 с, МНО — 2,5. На 21-е сутки пациентка в удовлетворительном состоянии выписана из стационара. Клинический пример 3 Больная К., 49 лет, диагноз «хроническая ревматическая болезнь сердца. Митральный стеноз. Регургитация III степени. Легочная гипертензия I степени. Хроническая сердечная недостаточность 2а, второй функциональный класс». Выполнена операция протезирования митрального клапана. Длительность искусственного кровообращения составила 121 минуту, пережатия аорты — 95 минут, гипотермия — 34 °C, интраоперационная кровопотеря — 1 050 мл. Предоперационная подготовка, интраоперационное введение и ней44 трализация гепарина стандартны. В послеоперационном периоде эноксапарин с переходом на варфарин. При поступлении количество тромбоцитов в периферической крови составило 198 × 10/9 л. В первые сутки после оперативного вмешательства количество тромбоцитов 141 × 10/9 л, АЧТВ 67 с, МНО — 1,1. На вторые сутки количество тромбоцитов 136 × 10/ 9 л, АЧТВ 49 с, МНО — 1,3. На третьи сутки количество тромбоцитов 125 × 10/9 л, АЧТВ 56 с, МНО — 1,85. На четвертые сутки количество тромбоцитов 115 × 10/9 л, АЧТВ 45 с, МНО — 2,0. На пятые сутки количе ство тромбоцитов 79 × 10/9 л, АЧТВ 54 с, МНО — 2,3, антитромбин — 83 %, Д-димер — 3,2 мкг/мл. На пятые сутки послеоперационного периода в связи со снижением количества тромбоцитов в периферической крови проводится тест на ГИТ, результат: тест на ГИТ положительный (обнаружены иммуноглобулины G к гепарин-ТФ). На пятые сутки состояние пациентки тяжелое, тяжесть обусловлена дыхательной недостаточностью. На основании клинических, инструментальных (рентгенологических) и лабораторных данных выставлен диагноз «тромбоэмболия лёгочной артерии», эноксапарин отменен. На 6–7 сутки количество тромбоцитов 83 × 10/ 9 л, МНО — 2,3, антитромбин — 83 %, Д-димер — 4,5 мкг/мл. На 12–14 сутки отмечается незначительное повышение количества тромбоцитов до 109 × 10/9 л, МНО — 2,5, Д-димер — 2,7 мкг/мл. На 16–19 сутки количество тромбоцитов периферической крови составляет 156 × 10/9 л, МНО — 2,5, Д-димер — 1,8 мкг/мл. На 25-е сутки пациентка в удовлетворительном состоянии выписана из стационара. Полученные нами данные по частоте развития ГИТ у больных, получающих гепарин и низкомолекулярный гепарин, совпадают с данными других авторов [1, 4, 5, 7]. Однако, в отличие от результатов других исследований, в нашем случае тромбозы локализовались не только в венозном, но и в артериальном русле. Медицинский алфавит. Современная лаборатория 3 / 2013 По частоте развития бессимптомных ГИТ наши данные также совпадают с данными других авторов [1, 3, 5]. Отмечена особенность течения ГИТ: в течение нескольких недель она может протекать бессимптомно, а затем внезапно может осложняться кровотечением или тромбозом, которое может быть неправильно расценено врачами-клиницистами [1, 4, 5]. Использование наборов для качественного определения иммуноглобулинов G к комплексу гепарин-тромбоцитарный фактор 4 методом сухой иммунохроматографии позволяет диагностировать гепарин-индуцированную тромбоцитопению у кардиохирургических больных в раннем послеоперационном периоде, не требует специального дорогостоящего лабораторного оборудования и расходного материала, калибровки и поверки, специальной подготовки сотрудников клинической лаборатории. Примененный метод с тест-полосками STic Expert HIT® позволяет через 25–30 минут получить результат исследования для выбора дальнейшей тактики лечения кардиохирургических больных. Список литературы 1. Дементьева И. И., Чарная М. А., Морозов Ю. А. Система гемостаза при операциях на сердце и магистральных сосудах. Нарушения профилактика коррекция: руководство для врачей. — М.: Гэотар-Медиана, 2009. — 432 с. 2. Ahmad S., Unich B., Haas S. et al. Differential prevalence of anti-heparin PF4 immunoglobulin subtypes in patients treated with clivarin and heparin: implications in the HIT pathogenesis // Mol. Cell. Biochem. 2004. — Vol. 258 (1–2). — P. 163–170. 3. Amiral J., Peunaud-Debayle E., Wolf M. et al. Generation of antibodies to heparin — PF4 complex without thrombocytopenia in patients treated with unfractionated or low molecular weight heparin // Am. J. Haematol. — 1996. — Vol. 52. — P. 90–95. 4. Chong B. H. Heparin-induced thrombocytopenia / In Michelson A. D., ed. Platelets, Ins edn. — London: Academic Press, 2002. — P. 571–591. 5. Greinacher A. Heparin-induced thrombocytopenia // Wien Klin Wochenscher. — 1997. — Vol. 109 (10). — P. 343–345. 6. Sheridan D., Carter C., Kelton J. C. A diagnostic test for heparin-inducted thrombocytopenia // Blood. — 1986. — Vol. 67. — P. 27–30. 7. Wester J. P., Haas F. J., Biesma D. H. et al. Thrombosis and hemorrhage in heparininduced thrombocytopenia in seriously ill patients // Intensive Care Med. — 2004. — Vol. 30 (10). — P. 1927–1934. e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 45 Значение правильного выбора гематологического анализатора в диагностике изменений показателей крови у лиц старших возрастных групп В. А. Пичковская В. А. Пичковская, к. м. н., врач клинической лабораторной диагностики, зав. биохимической лабораторией Н. И. Сюч, д. м. н., проф., гл. специалист по клинической лабораторной диагностике, зав. лабораторным отделением Ю. В. Федечкина, биолог клинической лаборатории ФКУ «Медицинский учебно-научный клинический центр им. П. В. Мандрыка» Минобороны РФ, г. Москва Hematology analyzer selection for diagnostics of elderly patients blood changes V. A. Pichkovskaya, N. I. Syuch, Yu. V. Fedechkina Н. И. Сюч Резюме Исследовали образцы крови 269 пациентов, находившихся на стационарном лечении в многопрофильном стационаре ФКУ «МУНКЦ им. П. В. Мандрыка» МО РФ. Средний возраст пациентов составил 65 (± 17) лет. У пожилых пациентов наблюдается тенденция к снижению относительно референтных пределов процентного содержания лимфоцитов, уровня эритроцитов и гемоглобина (также параметров MCH, МСНС и RDW), среднего объема тромбоцитов и к повышению содержания моноцитов. Для проведения скрининга образцов крови у пациентов старших возрастных групп наиболее соответствующими являются гематологические анализаторы третьего класса. Высокая производительность и возможность полной автоматизации технологического процесса, широкий спектр получаемых параметров позволяют оптимально использовать приборы данного класса для лабораторной диагностики в геронтологии. Ключевые слова: пациенты старших возрастных групп, многопрофильный стационар, клинический анализ крови, гематологический анализатор. Summary We have studied blood samples of 269 patients who admitted to Medical Educational and Clinical Scientific Center n. a. P. V. Mandryka. Average age of patients was 65 (± 17) years. Elderly patients tend to have relatively lower reference percentage limits of lymphocytes, red blood cells, hemoglobin level, mean platelet volume and increasing of monocytes level. Third class hematology analyzers are most relevant for elderly patients blood samples screening. High performance and ability to fully automatic process, a wide range of derived parameters allows optimal use of this class of units for laboratory diagnostics in gerontology. Ю. В. Федечкина В Keywords: elderly patients, multi-hospital, clinical blood tests, blood analyzer. настоящее время люди пожилого возраста составляют абсолютное большинство пациентов стационаров. Лабораторный скрининг образцов крови у лиц пожилого возраста имеет свои особенности, поскольку в этом возрасте значительно изменяется значение многих лабораторных показателей и их следует рассматривать с точки зрения индивидуального прогноза для пациента. Если у пациентов среднего возраста лабораторное обследование призвано выявить болезнь и установить диагноз, то в пожилом возрасте речь идет о контроле здоровья пациента, оценке резервных функций 46 организма, изменений состояния его здоровья. Стандартом оценки, как правило, становятся исходные показатели самого пациента, иногда уже аномальные [2]. В гериатрии ограничено применение концепции «контрольных» значений. Зачастую в качестве контрольных значений для оценки результатов лабораторных тестов у пожилых пациентов используются значения, полученные у лиц среднего возраста, что приводит в итоге к неправильной интерпретации полученных данных. Лица пожилого возраста склонны к полипатии и это также усиливает важность оценки индивидуальной Медицинский алфавит. Современная лаборатория 3 / 2013 клинической картины пациентов. Поскольку понятие «полностью здоровый пожилой человек», как правило, не существует, гериатрические контрольные значения не должны обязательно совпадать с общепринятой «нормой». Важным, но не столь часто упоминаемым вопросом является «гериатрическая гематология». Речь идет о разных видах анемии и связанных с ней изменениях эритроцитов от мегалобластической анемии, гипохроматоза до пойкилоцитоза или телец Барра. Могут наблюдаться и лейкоцитозы (увеличение лейкоцитов до 40 тысяч), или появление промиe-mail: medalfavit@mail.ru елоцитов без повышения абсолютного числа лейкоцитов. Наиболее часто наблюдаются разнообразные проявления миелодиспластического синдрома (псевдопельгеровская аномалия, различные дисплазии лейкоцитов), а также остеомиелосклероз и лимфомы. Часто встречаются хронический лимфолейкоз, миелоидная лейкемия, заболевания, зачастую быстро развивающиеся у людей пожилого возраста, которые до этого считали себя здоровыми. По данным литературы, анемия легкой степени тяжести наблюдается у 26,3 % пациентов старческого возраста, количество гемоглобина при этом составляет 9,9 г/дл (у большинства 12,7 г/дл). Многофакториальный анализ показал, что снижение гемоглобина у больных с анемией определяется сопутствующей патологий. Конкретными патогенетическими причинами являются кровотечения, неопластические процессы, инъекции или недостаточное питание — причины, которые не всегда удается установить. Железодефицитные анемии наблюдаются преимущественно у мужчин [3]. На содержание гемоглобина у людей без анемии оказывают влияние наследственные факторы, женский пол, состояние питания. Пожилые люди отличаются повышенной восприимчивостью к инфекциям, особенно к вирусным (грипп), бактериальным (туберкулез, столбняк, легионеллез, сальмонеллез) и грибковым (кандидоз). Чаще всего поражаются легкие, мочевой пузырь, зубы и их придатки, кожа и слизистые. Инфекциям благоприятствуют пониженное питание, постельный режим, сердечно-сосудистые заболевания, неврологические поражения. Иногда инфекция служит признаком терминальной стадии заболевания. Наиболее часто наблюдаются cердечно-сосудистые заболевания, поражения сосудов головного мозга, легких, печени, желудочно-кишечного тракта, опухоли, заболевания крови [7]. Нередко причиной срочной госпитализации пожилых лиц являются побочные действия лекарственных средств. Наиболее часто отмечаются отрицательные реакция на один (46 %) или несколько (25 %) лекарственных e-mail: medalfavit@mail.ru препаратов или при приеме сердечно-сосудистых препаратов (48,4 %). Наиболее частые проявления — падения и постуральная гипотензия (24,1 %), сердечная недостаточность (16,9 %), делирий (14,5 %) [5]. Старение организма сопровождается значительной перестройкой тромбоцитов: нарушается энергетическое обеспечение функций кровяных пластинок, снижается их способность к депонированию биологически активных веществ, наблюдается ускоренный износ тромбоцитов. Значительные изменения происходят в гликокаликсе и мембранах кровяных пластинок. Изменения являются морфологической основой повышения агрегационной активности клеток и активации внутрисосудистого тромбообразования при старении, что способствует развитию сердечно-сосудистой патологии у лиц пожилого возраста [4]. У пожилых больных при эндогенной интоксикации наблюдается более длительная лихорадочная реакция по сравнению с молодыми. Концентрация моноцитов снижается быстро, а восстанавливается медленнее. Изменяется острая фаза реакции, включая начальную гиперреактивность и длительную воспалительную реактивность. У больных пожилого возраста с учетом полиморбидности заболевания, особенностей течения ИБС, влияющих на качество жизни и требующих индивидуализированной терапии, особенно повышается значение клинического анализа крови. Цель исследования Определить наиболее часто изменяемые параметры клинического анализа крови у пациентов пожилого и старческого возраста в многопрофильном стационаре и определить критерии выбора адекватного гематологического анализатора для решения проблем «гериатрической гематологии». Материалы и методы Исследовали образцы крови 269 пациентов, находившихся на стационарном лечении в многопрофильном стационаре ФКУ «МУНКЦ им. П. В. Мандрыка» МО РФ. Сред- ний возраст пациентов составил 65 (± 17) лет. Исследование проводили на гематологическом анализаторе CELL-DYN Ruby (Abbott Laboratories, США), предназначенном для диагностики in vitro и использования в клинических лабораториях. С целью соблюдения требований преаналитики для взятия образцов венозной крови использовали вакуумные системы (производство BD), содержащие антикоагулянт ЭДТА. Исследование проводили в режиме закрытого пробозабора. Аспирация образцов осуществлялась автозагрузчиком, позволяющим загрузить одновременно 50 пробирок с закрытыми крышками, что снижало вероятность контакта с кровью пациента. С помощью специального устройства автозагрузчика осуществлялось перемешивание крови и перемещение пробирок через аналитическую зону. В автоматическом режиме определяли 20 параметров общего анализа крови (ОАК): концентрацию лейкоцитов; абсолютную концентрацию и процентное содержание нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов; концентрацию, средний объем (MCV) и диапазон распределения (RDW) эритроцитов; гематокрит; концентрацию гемоглобина; среднее содержание гемоглобина в эритроците (MCH); среднюю концентрацию гемоглобина в эритроците (MCHC); концентрацию и средний объем (MPV) тромбоцитов. При направлении крови на исследование уровня ретикулоцитов определяли их абсолютную концентрацию и процентное содержание. Помимо рабочего бланка-ответа, программа данного прибора позволяет получить лабораторный бланк, позволяющий персоналу лаборатории просмотреть и проверить полученные данные. В лабораторном рабочем бланке находятся лейкоцитарная формула и дополнительные параметры, в рабочем окне бланка ответа только лейкоцитарная формула. Дополнительные параметры позволяют судить о разделении нейтрофилов, лимфоцитов и моноцитов на составляющие их компоненты (палочкоядерные лейкоциты, незрелые гранулоциты, бласты, моноциты расчетные, лимфоциты расчетные и лимфоциты вариантные). Медицинский алфавит. Современная лаборатория 3 / 2013 47 Рисунок 1. Структура патологии ОАК паци‑ ентов старших возрастных групп в многопро‑ фильном стационаре. Ретикулоциты являются промежуточными эритроцитами между эритроцитами, содержащими ядра, и зрелыми эритроцитами. В отличие от зрелых эритроцитов ретикулоциты содержат рибосомальную РНК. Эту РНК можно увидеть при прижизненном окрашивании катионными красителями, которые одновременно окрашивают и преципитируют на цитоплазматическом ретикулуме. В анализаторе используются тиозиновый краситель новый метиленовый синий N. Исследование ретикулоцитов происходит в оптическом лейкоцитарном канале анализатора. Статистическую обработку данных выполняли при помощи пакетов программ MS Excel 2007 и Statistica 5.0. Данные представляли в формате «медиана, 25–75-й процентиль». Вид распределения количественных признаков исследованных показа- телей не анализировали, поэтому для оценки значимости их различий у пациентов хирургических и терапевтических отделений использовали непараметрические критерии Краскела-Уоллиса и Манна-Уитни. Различия считали статистически значимыми при р < 0,05. Результаты и обсуждение В н е р е ф е р е н т н ы е з н ач е н и я параметров общего анализа крови (ОАК) выявлены у 218 (81 %) пациентов. Структура патологии, обнаруженной в данных образцах, представлена на рис. 1. Основную часть патологии ОАК представляют внереферентные результаты исследования лейкоцитарных показателей (57 %) и показателей эритроцитов и гемоглобина (42 %). Изменения тромбоцитов наблюдались у 1 % обследованных. Таблица 1 Результаты ОАК пациентов хирургических отделений Результаты ОАК пациентов отделений (медиана, 25–75-й процентиль) Показатель Эритроциты, 1012/л травмотологического (n = 18) урологического (n = 30) хирургического (n = 17) Критерий КраскелаУоллиса, Н р ж 4,56 (4,31–4,87) 3,98 (3,72–4,19) 4,7 (4,38–4,85) 4,6 (4,55–5,4) 4,6 (4,45–4,875) 3,6 0,46 м – 5,22 (4,78–5,32) 4,72 (3,87–4,89) 4,86 (4,14–5,2) 5,09 (4,98–5,17) 4,76 0,19 ж 133 (113–140) 113 (111–117) 135 (135–137) 133 (131–161) 126,5 (121,5–136) 7,33 0,12 м – 146,5 (130–155,5) 137 (110–145) 139 (109–153) 149 (147–160) 5,04 0,17 ж 0,418 (0,375–0,437) 0,366 (0,357–0,377) 0,427 (0,416–0,438) 0,420 (0,417–0,513) 0,407 (0,392–0,434) 7,99 0,09 м – 0,463 (0,411–0,481) 0,426 (0,349–0,447) 0,437 (0,352–0,474) 0,478 (0,448–0,489) 5,41 0,14 ж 90 (86,8–92,1) 92,7 (91,9–96,6) 91,9 (90,9–93,6) 91,6 (91,4–94,9) 89,1 (85,45–90,15) 10,96 0,027 м – 89,35 (86–90,1) 90,5 (84,6–93,1) 92 (88,5–94,7) 93,3 (88,6–96,1) 3,66 0,3 MCH, пг 28,5 (27,3–30,4) 28,6 (28,4–30,1) 28,8 (28,6–29,2) 29,3 (28,6–29,8) 27,7 (26,5–28,2) 6,55 0,16 MCHC, г/л 316 (310–323) 310 (309–310) 313 (307–321) 314 (313–320) 311 (308,5–313) 5,42 0,25 Гемоглобин, г/л Гематокрит, л/л MCV, фл 48 гинекологического кардиохирургического (n = 29) (n = 13) RDW, % 12,5 (12,1–13,3) 14,4 (14,3–14,7) 12,7 (12,3–13,5) 13,2 (11,5–13,3) 12,9 (12,65–13,35) 8,12 0,09 Лейкоциты, 109/л 6,97 (5,66–7,50) 6,95 (6,54–7,92) 8,45 (6,45–10,00) 7,08 (5,79–9,9) 7,34 (4,99–8,52) 5,14 0,27 Нейтрофилы, # 3,60 (2,77–4,43) 4,09 (3,24–5,68) 4,685 (3,90–6,70) 4,365 (3,12–5,85) 4,36 (2,84–5,13) 7,19 0,13 Лимфоциты, # 2,06 (1,72–2,64) 2,04 (1,13–2,27) 1,96 (1,75–2,57) 2,065 (1,61–2,39) 1,99 (1,62–2,27) 1,41 0,84 Моноциты, # 0,51 (0,36–0,63) 0,573 (0,489–0,603) 0,572 (0,48–0,70) 0,536 (0,428–0,711) 0,456 (0,419–0,534) 6,64 0,16 Эозинифилы, # 0,14 (0,11–0,21) 0,085 (0,057–0,13) 0,192 (0,10–0,28) 0,11 (0,066–0,185) 0,169 (0,115–0,224) 8,77 0,07 Базофилы, # 0,08 (0,06–0,10) 0,057 (0,042–0,066) 0,069 (0,06–0,08) 0,072 (0,049–0,082) 0,076 (0,054–0,092) 8,06 0,09 Нейтрофилы, % 57,90 (52,50–61,20) 62,7 (53,6–74,5) 61,85 (57,00–66,10) 58,85 (47,5–68,9) 57,6 (50,1–62,8) 4,49 0,34 Лимфоциты,% 32,00 (26,30–36,40) 22,1 (17,3–34,0) 26,85 (23,50–32,40) 29,55 (19,9–35,1) 29,1 (27–39,1) 5,27 0,26 Моноциты, % 7,38 (6,79–8,70) 8,09 (6,18–8,76) 7,845 (6,36–8,30) 7,125 (6,13–9,2) 6,79 (6,09–7,72) 1,35 0,85 Эозинифилы, % 2,10 (1,75–3,70) 1,25 (0,783–2,1) 1,855 (1,31–3,90) 1,49 (0,647–3,38) 2,18 (1,38–3,42) 7,16 0,13 Базофилы, % 1,03 (0,87–1,41) 0,778 (0,517–0,987) 0,883 (0,61–1,09) 0,861 (0,664–1,23) 1,1 (0,783–1,28) 9,81 0,044 Тромбоциты, 109/л 271 (227–302) 248 (210–303) 259,5 (213–325) 241 (198–287) 265 (223–314) 3,63 0,46 MPV, фл 6,96 (6,39–7,60) 6,85 (5,71–7,58) 7,145 (6,50–8,07) 7,12 (6,3–7,85) 7,35 (6,45–8,22) 2,02 0,73 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru Таблица 2 Результаты ОАК пациентов терапевтических отделений Результаты ОАК пациентов отделений (медиана, 25–75-й процентиль) Показатель Эритроциты, 1012/л Гемоглобин, г/л кардиологического неврологического (n = 43) (n = 30) офтальмологического терапевтического эндокринологического (n = 30) (n = 30) (n = 29) Критерий КраскелаУоллиса, Н р ж 4,58 (4,23–4,79) 4,74 (4,52–4,96) 4,6 (4,53–4,75) 4,495 (4,33–4,93) 4,79 (4,63–5,06) 5,59 0,23 м 4,67 (4,425–5,305) 5,04 (4,66–5,26) 4,665 (4,575–4,78) 5,015 (4,585–5,255) 4,725 (3,84–4,89) 4,50 0,34 ж 131 (121–135) 133 (126–136) 133 (129–134) 129,5 (121–137) 128 (111–140) 1,00 0,91 м 141 (131,5–151,5) 145 (119–154) 140 (133,5–146,5) 149 (136,5–155,5) 135 (124–148) 2,66 0,62 ж 0,399 (0,387–0,427) 0,414 (0,406–0,431) 0,412 (0,402–0,425) 0,405 (0,385–0,422) 0,410 (0,373–0,451) 1,57 0,81 м 0,439 (0,411–0,470) 0,455 (0,390–0,469) 0,431 (0,419–0,446) 0,449 (0,399–0,486) 0,424 (0,374–0,465) 1,98 0,74 ж 89,4 (87,4–91,1) 87,5 (85,2–91) 91,7 (86,3–92,7) 88,2 (85–92,3) 88,7 (78,2–89,1) 2,79 0,59 м 92,1 (88,25–97,4) 88,4 (85,9–91,7) 91,7 (90,4–92,9) 90,2 (87,4–93,7) 91,05 (88,2–93,2) 4,41 0,35 MCH, пг 28,6 (27,8–31,9) 27,9 (26,9–28,9) 29,05 (28,1–30,4) 28 (26,8–30,6) 27,7 (23,1–28,8) 6,71 0,15 MCHC, г/л 321 (311–329) 313 (308–317) 318,5 (313–328) 316,5 (314–323) 311 (297–317) 8,55 0,07 RDW, % 12 (11,8–12,7) 12,7 (12,2–12,9) 12,35 (11,9–13,2) 12,9 (12,1–13,5) 12,5 (12,2–15,2) 6,99 0,14 Лейкоциты, 109/л 6,54 (5,59–8,15) 7,31 (5,53–9,74) 7,42 (6,24–8,42) 6,085 (5,23–7,62) 6,22 (5,42–8,37) 7,43 0,11 Нейтрофилы, # 3,6 (2,75–4,35) 4,41 (3,1–6,4) 3,765 (3,2–4,95) 3,61 (2,7–4,18) 3,82 (2,57–4,72) 7,33 0,12 Лимфоциты, # 2,19 (1,6–2,55) 1,935 (1,61–2,69) 2,5 (1,88–2,92) 1,87 (1,56–2,39) 1,9 (1,72–2,31) 8,29 0,08 Моноциты, # 0,553 (0,455–0,66) 0,52 (0,42–0,60) 0,61 (0,537–0,723) 0,55 (0,42–0,604) 0,52 (0,398–0,696) 6,58 0,16 Эозинифилы, # 0,176 (0,09–0,306) 0,16 (0,11–0,22) 0,21 (0,14–0,31) 0,196 (0,104–0,247) 0,125 (0,095–0,224) 4,77 0,31 Базофилы, # 0,07 (0,053–0,089) 0,058 (0,039–0,073) 0,069 (0,06–0,083) 0,078 (0,053–0,096) 0,071 (0,043–0,095) 7,66 0,1 Нейтрофилы, % 53,9 (47,2–61,3) 60,6 (54,7–66,7) 53,65 (45,8–59,9) 54,6 (48,7–59,2) 55,4 (49,7–62,8) 10,00 0,04 Лимфоциты, % 32,0 (25–39,6) 28,95 (22,3–35,3) 33,35 (28,8–37,7) 32,15 (28,2–38,8) 32,6 (25–37,1) 5,10 0,28 Моноциты, % 8,03 (7,04–9,2) 6,795 (5,87–8,71) 8,375 (6,71–9,47) 8,115 (7,07–9,28) 7,86 (6,94–9,28) 7,30 0,12 Эозинифилы, % 2,81 (1,44–4,36) 2,195 (1,73–2,81) 2,84 (2,11–4,56) 2,845 (1,51–4,33) 2,33 (1,56–3,48) 3,27 0,51 Базофилы, % 1,04 (0,73–1,37) 0,801 (0,583–0,97) 0,928 (0,765–1,19) 1,215 (0,891–1,51) 0,947 (0,725–1,42) 18,69 <0,01 Тромбоциты, 109/л 231 (202–257) 232,5 (206–303) 222 (189–249) 224,5 (190–274) 243 (202–312) 3,61 0,46 MPV, фл 7,45 (6,75–8,07) 7,05 (6,86–8,05) 7,35 (6,45–8,42) 7,45 (6,5–8,21) 7,27 (6,64–7,78) 1,48 0,83 Гематокрит, л/л MCV, фл В шести образцах крови определяли концентрацию и процентное содержание ретикулоцитов: концентрация ретикулоцитов была превышена в двух образцах, в пяти — их процентное содержание. В ходе исследования сравнивали показатели ОАК пациентов хирургического и терапевтического профиля (табл. 1). У пациентов хирургического профиля статистически значимые различия результатов ОАК обнаружены в процентном содержании базофилов и объеме эритроцитов (MCV) у женщин. Остальные показатели не имели статистических значимых различий. В табл. 2 представлены результаты ОАК пациентов терапевтических отделений. Статистически значимые различия результатов ОАК пациентов данных отделений обнаружены e-mail: medalfavit@mail.ru только в процентном содержании нейтрофилов и базофилов. При сравнении результатов ОАК пациентов терапевтических и хирургических отделений (табл. 3), статистически значимые различия результатов ОАК пациентов хирургических и терапевтических отделений обнаружены в процентном содержании нейтрофилов, лимфоцитов, моноцитов, эозинофилов и концентрации тромбоцитов. У пациентов терапевтических отделений относительно пациентов хирургических отделений отмечено статистически значимое снижение процентного содержания нейтрофилов и концентрации тромбоцитов, повышение процентного содержания лимфоцитов, моноцитов и эозинофилов. Кроме того, в образцах крови пациентов хирургических и терапевтических отделений верхние границы интерквартильного интервала результатов исследования абсолютного и процентного содержания моноцитов находились на верхней границе или превышали референтный интервал данных показателей. Нижняя граница интерквартильного интервала результатов исследования процентного содержания лимфоцитов находилась на нижней границе или за пределами референтного интервала. Таким образом, у пациентов наблюдали тенденцию к повышению количества моноцитов и снижению количества лимфоцитов относительно референтных значений. При сравнении показателей ОАК пациентов терапевтических и хирургических отделений не обнаружено статистически значимых различий Медицинский алфавит. Современная лаборатория 3 / 2013 49 Таблица 3 Сравнение результатов ОАК пациентов терапевтических и хирургических отделений Показатель Референтный интервал Эритроциты, 1012/л Результаты ОАК пациентов отделений (медиана, 25–75-й процентиль) Критерий Манн-Уитни, U р 4,79 (4,38–5,09) * 8 459,5 0,74 135 (126–146) * 135 (116–148) * 8 098,5 0,36 0,370–0,520 0,422 (0,397–0,452) 0,425 (0,377–0,457) * 8 454,5 0,73 MCV, фл 80–99 90 (87,2–92,7) 90,5 (87,8–93,7) 8 076 0,34 MCH, пг 27–31 28,9 (27,8–30,2) * 28,8 (27,8–30,2) * 8 614,5 0,93 MCHC, г/л 300–370 320 (313–326) * 317 (312–325) * 8 100,5 0,36 RDW, % 11,5–14,5 12,3 (11,8–13,1) * 12,5 (11,9–13,6) * 7 646,5 0,10 Лейкоциты, 109/л 4,8–10,8 6,89 (5,58–8,37) 7,05 (5,79–8,81) 8 085,5 0,35 Нейтрофилы, # 1,4–6,5 3,74 (2,97–4,85) 4,09 (3,07–5,35) 7 669,5 0,11 Лимфоциты, # 1,2–3,4 2,05 (1,65–2,57) 2,04 (1,62–2,48) 8 315 0,57 Моноциты, # 0,1–0,6 0,552 (0,446–0,665) * 0,525 (0,42–0,664) * 7 911 0,23 Эозинифилы, # 0–0,7 0,173 (0,101–0,259) 0,139 (0,084–0,224) 7 546,5 0,07 Базофилы, # 0–0,1 0,069 (0,051–0,089) 0,072 (0,053–0,088) 8 171,5 0,43 Нейтрофилы, % 42,2–75,2 55,4 (48,9–62,4) 58,8 (52,5–66,7) 7 090 0,01 Лимфоциты, % 25–51,1 31,8 (25,4–37,2) * 29,3 (23,4–36,4) * 7 407 0,04 Моноциты,% 1,7–9,3 7,92 (6,71–9,26) * 7,38 (6,21–8,79) 7 373 0,04 Эозинифилы, % 0–5 2,56 (1,58–3,85) 1,97 (1,25–3,5) 7 216,5 0,02 Базофилы, % 0–3 0,963 (0,73–1,27) 0,983 (0,685–1,28) 8 306 0,56 Тромбоциты, 109/л 130–400 230 (199–269) 253 (212–303) 6 915,5 0,01 MPV, фл 7,4–10,4 7,41 (6,66–8,17) * 6,97 (6,37–7,85) * 7 474 0,06 терапевтических (n = 161) хирургических (n = 107) 4,20–6,10 4,69 (4,46–5,03) * Гемоглобин, г/л 120–180 Гематокрит, л/л * — результаты, находящиеся на границе или выходящие за референтный интервал показателя. Рисунок 2. Распределение внереферентных результатов исследования абсолютного коли‑ чества и процентного содержания клеток лейкоцитарной формулы. 50 Медицинский алфавит. Современная лаборатория 3 / 2013 исследованных параметров эритроцитов, гемоглобина, концентрации лейкоцитов и тромбоцитов. Однако нижние границы интерквартильного интервала результатов исследования концентрации эритроцитов и гемоглобина находились на нижней границе или за пределами референтного интервала данных показателей. Соответственно нижние границы интерквартильного интервала результатов исследования MCH, МСНС и RDW также находились на нижней границе соответствующих референтных интервалов. Это означает, что у пожилых пациентов часто снижена концентрация эритроцитов и уровень гемоглобина, а также наблюдается тенденция к снижению среднего объема эритроцитов (MPV). При исследовании параметров лейкоцитов внереферентные результаты наблюдались в концентрации лейкоцитов: абсолютном количестве e-mail: medalfavit@mail.ru клеток лейкоцитарной формулы и их процентном содержании, особенно в абсолютном и процентном содержании моноцитов, лимфоцитов и нейтрофилов (рис. 2). Снижение значений показателей эритроцитов и гемоглобина наблюдалось у 77 % пациентов. Внереферентные значения показателей MCV, MCH, MCHC и RDW выявлены в 58 % случаев (рис. 3). У пациентов пожилого возраста наиболее часто (38 % наблюдений) уменьшено насыщение эритроцитов гемоглобином. В 29 % наблюдений изменена ширина распределения эритроцитов по объему. Изменения со стороны тромбоцитов наблюдались в 1 % наблюдений, при этом они касались величины среднего объема кровяных пластинок (MPV). Таким образом, в пожилом возрасте изменяется диагностическое значение многих лабораторных параметров. Поэтому их следует рассматривать скорее с точки зрения индивидуального прогноза для пациента. Поскольку пациенты пожилого возраста, учитывая полиморбидность заболевания, получают комплексное медикаментозное лечение, необходимо учитывать его возможные терапевтические последствия. У пожилых пациентов наблюдается тенденция к снижению относительно референтных пределов процентного содержания лимфоцитов, уровня эритроцитов и гемоглобина (также параметров MCH, МСНС и RDW), тромбоцитарного параметра MPV и к повышению содержания моноцитов. По данным литературы, у пациентов старших возрастных групп нередко наблюдается гиперхромная В12-дефицитная анемия. С помощью гематологического анализатора возможно идентифицировать гиперхромные эритроциты, как сфероциты с увеличенным объемом и повышенным содержанием гемоглобина [6]. Автоматический анализ лейкоформулы помогает в проведении скрининга нормы и патологии, при динамическом контроле за содержанием нейтрофилов и лимфоцитов в рамках различных патологических состояний (лимфопролиферативные процессы, нейтропении) [1]. e-mail: medalfavit@mail.ru Рисунок 3. Распределение внереферентных результатов исследования параметров MCV, MCH, MCHC и RDW. Результаты ОАК пациентов терапевтических и хирургических отделений имеют статистически значимые различия в клеточном составе лейкоцитарной формулы и концентрации тромбоцитов. У пациентов терапевтических и хирургических отделений не обнаружено статистически значимых различий исследованных параметров эритроцитов, гемоглобина и концентрации лейкоцитов. В лабораторной диагностике заболеваний пожилого и старческого возраста требуется определенная диагностическая стратегия, требующая оценки лабораторных результатов с учетом гериатрических изменений. Важным шагом в решении этих задач является правильный выбор оптимального гематологического анализатора с учетом, помимо количества измеряемых параметров, производительности прибора, степени автоматизации, удобства системы предоставления информации. Исходя из полученных результатов исследования, выявившего внереферентные изменения всех показателей ОАК, наиболее соответствующими являются анализаторы третьего класса, позволяющие провести широкий скрининг образцов крови. Высокая производительность и возможность полной автоматизации технологического процесса позволяет использовать приборы данного класса для лабора- торной диагностики в геронтологии. Только сложные высокотехнологичные гематологические анализаторы способны проводить развернутый анализ крови, в том числе дифференцировку лейкоцитов на пять субпопуляций и дополнительный подсчет ретикулоцитов для широкого скрининга образцов крови. Список литературы. 1. Антонов В. С., Богомолова Н. В., Волков А. С. Автоматизация гематологического анализа // Справоник заведующего КДЛ // 2010. — № 5. — С. 20–28. 2. Лапин А. Лабораторная диагностика в гериатрии // Лабораторная медицина, 2003, № 6. — С. 14–20). 3. Воробьев П. Анемии в геронтологической практике // Врач, 2001, № 12. — С.22–24. 4. Гавриш А. С., Коркушко О. В., Лишневская В. Ю., Сергиенко О. В., Саркисов К. Г. Роль изменений ультраструктуры тромбоцитов в повышении их агрегационной активности у лиц пожилого возраста // Ж. Акад. мед. Наук Украины, 2001. 7. № 3. С. 584–592. 5. Chan M., Nicklason F., Vial G. N., Adverse drug events as a cause of a hospital admission in the elderly // Intern. Med. G., 2001, 31, № 4. — P. 199–205. 6. Kulter Dolphe, Coulon Nathalie, Stirn Fernand, Thoma Martine, Janecki Merzy. Demonstration and quantification erythrocytesby haematological analysers // Clin. Lab.,2002, 48, № 3–4. — Р.165–170. 7. R u m e a u P . , R a y n a u d - S i m o n A . , L e sourd B. La vulnerabilite aux infectionschezle sujet age // Rev. Geriart., 2001. — 26, № 7. — P.5–8. Медицинский алфавит. Современная лаборатория 3 / 2013 51 Алгоритм выявления носителей менингококка в очаге генерализованной формы менингококковой инфекции И. С. Королева, Т. А. Максина ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, г. Москва Резюме Представлен рациональный методический подход к выделению менингококка из носоглотки лиц, контактных с больным генерализованной формой менингококковой инфекции в очаге заболевания или при проведении обследований с целью выявления широты распространения носительства в коллективах различного типа. Ключевые слова: носительство менингококка, алгоритм лабораторной диагностики. И. С. Королева В Т. А. Максина ыявление носительства менингококка, подтверждение менингококкового назофарингита, обследование лиц, находившихся в тесном контакте с больным генерализованной формой менингококковой инфекции (ГФМИ), невозможно без достоверной лабораторной диагностики и этиологической расшифровки. Получение достоверных результатов исследования возможно только при наличии чистой культуры, полученной из исследуемого материала. При посеве и отборе материала необходимо исключать контаминацию материала и не допускать гибели возбудителя. В связи с этим важным является соблюдение всех правил забора, транспортировки, выделения и идентификации возбудителя. В рамках научно-практической работы «Определение особенностей менингококкового носительства в очагах менингококковой инфекции», выполненной совместно с управлением Роспотребнадзора по г. Москве, проводилось обследование контактных с больным лиц в очагах менингококковой инфекции на носительство менингококка. В рамках данного исследования после испытания нами существующих методик было подобрано оптимальное соотношение методов диагностики, и разработан алгоритм обследования на носитель52 Summary A rational methodical approach to allocation of meningococcal nasopharyngeal persons is presented. Persons who had a contact with a patient with generalized form of meningococcal disease at the focus or for surveys to identify the latitude distribution of carriage in groups of various types. Key words: meningococcal carriage, the algorithm laboratory diagnostics. ство менингококка с использованием комплекса наиболее информативных методов исследования. Предложенный алгоритм включил в себя следующие этапы: 1. Забор материала. Назофарингеальная слизь с задней стенки глотки берется натощак или через 3–4 часа после еды стерильным ватным тампоном. Материал берут с обязательным надавливанием шпателем на корень языка для наиболее полного открытия глоточного отверстия. Тампон вводят ватным концом кверху за мягкое небо в носоглотку и проводят 2–3 раза по задней стенке. При извлечении из носоглотки тампон не должен касаться окружающих тканей (зубы, слизистая щек, язык, небный язычок). Тампон с содержимым необходимо помещать в готовую транспортную среду, разрешенную к применению в Российской Федерации (Amies, «Био Мерье», Франция). 2. Доставка материала. Материал для исследований доставляется в бактериологическую лабораторию немедленно после отбора в специальных контейнерах, способных поддерживать температуру 37 °C. 3. Бактериологический посев проводится немедленно при поступлении в лабораторию на селективный пита- Медицинский алфавит. Современная лаборатория 3 / 2013 тельный шоколадный агар со смесью факторов роста PolyViteX и смесью VCAT3 для селективного выделения Neisseria gonorrhoeae и N. meningitidis («Био Мерье», Франция). Инкубация посевов осуществляется в течение 24 часов при 37 °C в присутствии 5 % СО2. Окончательное заключение по росту культуры следует давать через 48 часов. В носоглотке человека, кроме N. meningitidis, находится множество непатогенных нейсерий (N. subflava, N. perflava, N. flava, N. flavescens, N. sicca и др.), дифференциация с которыми сложна и трудоемка. Визуально также трудно отличить колонии N. meningitidis и B. catarrhalis. Селективный питательный шоколадный агар производства компании «Био Мерье» сбалансирован по питательным свойствам, обогащен ростовыми добавками и содержит вещества, ингибирующие рост других микроорганизмов, в том числе и непатогенных нейсерий, что позволяет достоверно выявить штаммы N. meningitidis. 4. Идентификация возбудителя. Материал из колоний, подозрительных на менингококк, подвергается обязательному бактериоскопическому изучению. Для улучшения дифференцировки с грамположительными кокками фиксированные мазки окрашивают по Граму. Культуральный мазок проe-mail: medalfavit@mail.ru сматривают под иммерсией при большом увеличении. В мазках из свежих культур, окрашенных по Граму, менингококки имеют вид лежащих беспорядочно полиморфных (по величине и окраске) грамотрицательных кокков (эффект «рассыпанного гороха»). Важнейшим этапом идентификации возбудителя, позволяющим дать окончательно заключение о принадлежности исследуемого штамма к N. meningitidis, является определение сахаролитической активности, полученной культуры. Для уточнения биохимических свойств оптимальным на данный момент является использование коммерческой тест-системы, разрешенной к применению в Российской Федерации, API NH производства «БиоМерье». Данная тест-система позволяет провести изучение ферментативной и метаболитической активности менингококков и в течение двух часов определить видовую принадлежность возбудителя. Для проведения идентификации в лунки вносится взвесь 18–20-часовой культуры исследуемого материала, доведенной до стандарта мутности 4 (по McFarland). Затем после двухчасовой инкубации в термостате при 37 °C отмечаются изменения цвета в лунках и определение индолообразования, а также ферментов пролинариламидазы (ProA) и гаммаглютамилтрансферазы (GGT) после внесения соответствующих реагентов. 5. Серогруппирование. После получения достоверных данных о принадлежности изучаемой культуры к N. meningitidis можно перейти к определению серогруппы микроорганизма. В связи с этим предлагается проведение реакции коагглютинации, которая является более специфичной, чем реакция агглютинации, и позволяет выявить менингококки серогрупп А, В, С, Х, Y, Z, W-135 и 29-E, а в качестве контроля возможно использовать реакцию латекс-агглютинации или ПЦР-тест-систему «Ампли Сенс Neisseria meningitidis серогрупп А, В, С» (ФБУН «ЦНИИЭ», Россия). Эти два метода позволяют определять менингококки только серогрупп А, В, С. Предложенный алгоритм исследования позволяет сократить срок получения ответа до двух дней (схема 1). e-mail: medalfavit@mail.ru Схема 1 Исследование мазков из носоглотки на носительство менингококка. Таким образом, применение хорошо себя зарекомендовавших стандартных коммерческих питательных сред и тест-систем обеспечило получение стандартных и сопоставимых результатов о наличии или отсут- ствии менингококка в носоглотке в кратчайший срок (два дня). Применение данного алгоритма позволило определить серогруппу у 85 % выделенных из носоглотки носительских штаммов менингококка. Медицинский алфавит. Современная лаборатория 3 / 2013 53 Лабораторный мониторинг профилактики рахита у детей по результатам исследований мочи Д. Ю. Соснин, д. м. н., доцент кафедры О. Ю. Ненашева, к. м. н., ассистент кафедры Кафедра клинической лабораторной диагностики ФПК и ППС ГБОУ ВПО «Пермская государственная медицинская академия им. акад. Е. А. Вагнера» Минздрава России, г. Пермь Laboratory monitoring of prevention of rickets in children on the research results of urine D. Yu. Sosnin, O. Yu. Nenasheva. State Medical Academy, Perm, Russia Д. Ю. Соснин Резюме У детей первых двух лет жизни (n = 66) изучено выделение кальция с мочой на фоне профилактики рахита. Пациент были разделены на две группы. В основную группу вошли дети (n = 32) с признаками рахита, не получавшие препараты витамина Д. Группу сравнения составили дети (n = 34), принимавшие препараты витамина Д. Сравнивали результаты двух лабораторных методов: пробы Сулковича и расчета кальций/ креатининового коэффициента (CaUrea/CreatUrea-коэффициент). Установлено, что проба Сулковича почти в 20 % дает неверное представление о выделении кальция с мочой. Более правильное представление о выраженности выделения кальция с мочой дает расчет CaUrea/CreatUrea-коэффициента. В основной группе его значение составило 0,24 ± 0,09, а в группе сравнения — 1,39 ± 0,80 (p < 0,001). Практическим клиникодиагностическим лабораториям следует рекомендовать замену устаревшей пробы Сулковича на расчет CaUrea/CreatUrea-коэффициента. Ключевые слова: рахит, кальциурия, витамин Д, проба Сулковича, кальций/креатининовый коэффициент. Summary In the first two years of life (n = 66) studied the excretion of calcium in the urine against the prevention of rickets. Patients were divided into two groups. The study group included children (n = 32) with signs of rickets, the untreated vitamin D group consisted of children (n = 34) taking drugs vitamin D. We compared the results of two laboratory methods: Sulkovich sample and calculating calcium/creatinine ratio (CaUrea/CreatUrea factor). It is established that the Sulkovich trial nearly 20 % of an incorrect interpretation of the allocation of calcium in the urine. A more accurate picture of the severity of calcium excretion in the urine gives a calculation CaUrea/CreatUrea factor. In the study group its value was 0,24 ± 0,09, and in the comparison group 1,39 ± 0,80 (p < 0,001). The practical clinical diagnostic laboratories should be encouraged to replace outdated Sulkovich sample the calculation CaUrea/CreatUrea. О. Ю. Ненашева «К Keywords: rickets, calcium excretion in the urine, vitamin D, Sulkovich trial, calcium / creatinine ratio. лассический» рахит остается весьма распространенным заболеванием [8]. Он поражает младенцев в период быстрого роста в возрасте от двух месяцев до двух лет с частотой 10–35 % [3]. Несмотря на проводимую практически поголовно специфическую профилактику рахита, частота его существенно не уменьшилась. В России распространенность рахита составляет 54–66 %. Следует учесть, что при этом фиксируются достаточно выраженные его клинические проявления. Опытный врач-педиатр практически у каждого трех-четырехмесячного ребенка обнаруживает два-три нерезко выраженных симптома рахита, квалифицируемых как I (легкая) его степень [2]. Доказано, что ведущей причиной развития рахита являются нарушения фосфорно-кальциевого обмена в результате дефицита витамина Д [4, 7]. Современные клинико-диагностические лаборатории (КДЛ) могут выполнить широкий спектр лабора- 54 торных исследований, позволяющих оценить обеспеченность организма витамином Д, в том числе определить в сыворотке крови концентрацию самого витамина Д и его активных метаболитов (1,25– (OH) 2–витамина Д и 25– (OH) –витамина Д) [6]. Однако эти исследования не получили широкого распространения в практике обычных лабораторий из-за высокой себестоимости реактивов. В своей практике лечащие врачи для контроля за терапией витамином Д обычно используют оценку выделения кальция с мочой. Известно, что дефицит витамина Д ведет к подавлению экскреции кальция (Ca) с мочой. Насыщение организма витамином Д приводит к увеличению всасывания Ca в желудочно-кишечном тракте. Избыток витамина Д сопровождается гиперкальциурией. Таким образом, косвенным признаком, позволяющим оценить адекватность содержания витамина Д в организме, является оценка степени выраженности кальцийурии. Медицинский алфавит. Современная лаборатория 3 / 2013 В практике КДЛ для оценки содержания Ca в моче широко используется проба Сулковича. Эту пробу особенно часто назначают педиатры, контролирующие терапию витамином Д. Однако оценка ее результатов является полуколичественной и субъективной, что и не позволяет надежно оценить динамику содержания Ca в моче при назначении препаратов витамина Д. По данным литературы, для оценки экскреции кальция с мочой могут использоваться и другие методики, прежде всего определение концентрации кальция в суточной моче [6]. Однако данная методика не может использоваться у детей первого года жизни, так как у них практически невозможно обеспечить сбор суточной мочи. Анализ содержания Ca в случайной порции мочи также недостаточно информативен, так как уровень этого соединения слишком зависит от степени концентрированности мочи. Соединением, конценe-mail: medalfavit@mail.ru трация которого может достаточно хорошо характеризовать процессы реабсорбции в почечных канальцах, является креатинин. Он может использоваться для стандартизации экскреции кальция с мочой. Цель исследования Оценка степени кальцийурии у детей первых двух лет жизни по результатам выполнении пробы Сулковича и расчета кальций/креатининового коэффициента в моче. Материалы и методы исследования Были исследованы образцы мочи детей (n = 66) первых двух лет жизни года жизни. Основную группу составили дети (n = 32), имевшие клинические признаки рахита и не получавшие препараты витамина Д. Группу сравнения составили дети (n = 34), которые получали препараты витамина Д. Средний возраст детей и соотношение в группах по полу были сопоставим. Объектом исследования служили порции утренней мочи. После центрифугирования в супернатанте определяли концентрацию креатинина и кальция. Исследование выполняли на биохимическом анализаторе Architect 8000 (Abbott) с использованием оригинальных реактивов фирмы производителя прибора. Результаты выражали в одних и тех же единицах, в ммоль/л, что позволило рассчитать кальций/креатининовый коэффициент (Ca/Сreat-коэффициент). Кроме этого, во всех пробах мочи выполняли пробу Сулковича [5]. Реактив Сулковича готовили следующим образом: в 50 мл дистиллированной воды растворяли 2,5 г щавелевой кислоты и 2,5 г оксалата аммония, добавляли 5 мл ледяной уксусной кислоты и доводили объем до 150 мл. Для выполнения пробы образец мочи (0,5 мл) смешивали с 0,5 мл реактива Сулковича. Через 1–2 минуты выполняли визуальную оценку степени помутнения смеси: 0 — отсутствие помутнения; 1 (+) — слабое помутнение; 2 (++) — умеренное помутнение; 3 (+++) — значительное помутнение [5]. Полученные результаты обрабатывали статистически с использование программы Statistica 7.0. Полученные данные представляли в виде средней e-mail: medalfavit@mail.ru Таблица 1 Содержание кальция и креатинина (ммоль/л) в моче обследованных Основная группа (пациенты, не получавшие витамин Д) (n = 32) Группа сравнения (пациенты, получавшие терапию витамином Д) (n = 34) 1 Средняя концентрация (М ± SD), ммоль/л 1,30 ± 0,65 5,64 ± 1,82 3,22 ± 3,44* 2,55 ± 2,29* 2 Min–Max, ммоль/л 0,5–2,45 1,63–8,37 0,5–17,5 0,6–8,91 3 Медиана концентрации, (Me; 25 и 75 перцентиль), ммоль/л 1,17 (0,74; 1,77) 5,66 (4,86; 6,96) 2,215 (1,13; 3,437) 1,56 (0,91; 3,37) Кальций/креатининовый коэффициент (M ± SD) 0,24 ± 0,09 1,39 ± 0,8* Кальций/креатининовый коэффициент (Me; 25 и 75 перцентиль) 0,26 (0,165; 0,305) 1,17 (0,69; 1,97) * Примечание: в числителе — концентрация кальция мочи, в знаменателе — концентрация креатинина. * — различие между группами достоверно (p < 0,01). арифметической (M) и стандартного отклонения (SD), а также медианы (Me) и 25 и 75 % перцентиля. При нормальном распределении результатов для дальнейшей обработки материала использовали методы параметрической статистики (t-критерий Стьюдента). При ненормальном распределении применяли методы непараметрической статистики (точный критерий Фишера). Для корреляционного анализа использовали расчет коэффициента корреляции Спирмерна [1]. Результаты и их обсуждение Концентрация креатинина в моче детей первого года жизни колебалась в широком диапазоне от 0,6 до 8,91 ммоль/л, что ниже значений, приводимых в литературе для взрослого человека [Тиц]. Это может быть связано с меньшим относительным содержанием мышечной ткани в организме ребенка и функциональной незрелостью нефронов почки. При исследовании концентрации креатинина между группами пациентов отмечены достоверные различия в его содержании (p < 0,001), что свидетельствует о выделении менее концентрированной мочи у пациентов группы сравнения (табл. 1). Содержание кальция в моче также колебалось в широких пределах от 0,5 до 17,5 ммоль/л. Его содержание в моче у детей, не получавших витамин Д (средняя концентрация и медиана), более чем в два раза было ниже по сравнению с группой сравнения (табл. 1). Различие между группами было достоверным (p < 0,001). При оценке корреляции между концентрацией креатинина и каль- ция в образцах мочи обнаружена лишь слабая положительная связь. Значение коэффициента корреляции Спирмена составило 0,25. При оценке результатов пробы Сулковича были получены следующие результаты (рис. 1). В основной группе подавляющее большинство результатов характеризовались либо отсутствием помутнения — 19 (59 %), либо слабым помутнением — 6 (19 %). Оставшиеся образцы при смешивании с реактивом Сулковича дали отчетливое помутнение — 7 (22 %). В группе пациентов, получавших витамин Д, результаты характеризовались еще большим разнообразием: У большинства обследованных результаты пробы характеризовались выраженным помутнением (на +++) в 13 (38 %) и (на ++) в 7 (21 %). В то же время помутнение в части образцов было незначительным — 10 (29 %), или даже отсутствовало — 4 (12 %). В целом степень помутнения обнаружила более тесную корреляцию с концентрацией кальция в моче (коэффициент корреляции Спирмена 0,91), чем с величиной кальций/ креатининового коэффициента мочи (CaUrea/CreatUrea) (коэффициент корреляции Спирмена 0,67). Это указывает, что результаты пробы Сулковича могут давать неправильное представление о выраженности кальцийурии при терапии препаратами витамина Д. В слабоконцентрированной моче результаты занижаются и могут ошибочно трактоваться как указание на недостаточную эффективность проводимой терапии, а в концентрированной моче завышаются. Медицинский алфавит. Современная лаборатория 3 / 2013 55 Рисунок 1. Результаты пробы Сулковича в моче детей. Более достоверные результаты были получены при исследовании кальций/креатининового коэффициента. В группе детей, имевших признаки дефицита витамина Д и не получавших терапии его препаратами, значения этого показателя находились на низком уровне 0,24 ± 0,09 (значения 10 и 90 перцентиля — соответственно 0,12 и 0,307). Терапия витамином Д сопровождалась увеличением данного коэффициента до 1,39 ± 0,80 (p < 0,001) (значения 10 и 90 перцентиля — соответственно 0,598 и 2,82). При этом области распределения полученных результатов практически не пересекались (рис. 2). Известно, что в организме человека из витамина Д в ходе двух реакций гидроскилирования образуются биологически активные соединения. Одним из наиболее активных является 1,25– (OH) 2–витамина Д или кальцитриол. Это соединение обладает разнообразными эффектами и на сегодняшний день рассматривается как гормонально активное соединение. Наиболее важным его эффектом является стимуляция в клетках тонкого кишечника синтеза белков — переносчиков Са. В результате такого действия усиливается усвоение кальция из продуктов питания и накопление его в тканях организма [4, 9]. Одновременно увеличивается выведение кальция из организма, что проявляется увеличением кальцийурии. Оценка ее интенсивности используется для контроля за терапией препаратами витамина Д. 56 Рисунок 2. Распределение результатов опре‑ деления кальций/креатининового коэффи‑ циента в основной группе (1) и в группе срав‑ нения (2). Показано, что широко применяемая для этого проба Сулковича почти у каждого пятого обследуемого дает неадекватные результаты, которые обусловлены субъективным характером оценки результатов и отсутствием учета степени концентрирования мочи в результате процессов канальной реабсорбции. Кроме того, данная проба не позволяет проводить четкий мониторинг кальцийурии, так как оценка результатов является полуколичественной. Более правильные результаты дает количественный анализ компонентов мочи: определение концентрации кальция в моче и расчет кальций/ креатининового коэффициента, позволяющего учесть степень концентрирования мочи при прохождении по канальцевому аппарату нефрона. Медицинский алфавит. Современная лаборатория 3 / 2013 У детей с признаками рахита и не получавших терапии витамином Д, 90 % всех результатов расчета CaUrea/CreatUrea (ммоль/ммоль) были ниже 0,307. Данное значение соответствует данным литературы [6], где приведена величина 0,4, соответствующая норме для людей, не получающих терапии препаратами кальция. Величина коэффициента более 0,57 характерна для гиперкальциемии, в том числе возникающей при избыточном введении лекарственных препаратов. В группе пациентов, получавших терапию витамином Д, 90 % всех значений превышали 0,598. Расчет CaUrea/CreatUrea-коэффициента дает не только более правильное представление об эффективности терапии рахита, но и позволяет проводить мониторинг применения препаратов витамина Д. Таким образом, высокое диагностическое значение кальций/креатининового коэффициента мочи (CaUrea/ CreatUrea) позволяет рекомендовать его использование как альтернативу пробы Сулковича для мониторинга терапии препаратов витамина Д. В то же время необходимы дальнейшие исследования, чтобы установить верхнюю границу нормы этого коэффициента при адекватной терапии, исключающей формирование гипервитаминоза Д. Список литературы 1. Боровиков В. Statistica. Искусство анализа данных на компьютере: Для профессионалов. 2-е изд. — СПб.: Питер, 2003. — 688 с.: ил. 2. Демин В. Ф. К вопросу о рахите // Педиатрия 2003. — № 4. С. 104–107. 3. Запруднов А. М., Григорьев К. И. Рахит у детей / Русский медицинский журнал, 1997. — № 19. С. 6. 4. Захарова И. Н., Коровина Н. А., Дмитриева Ю. А. Современный взгляд на патогенез и профилактику рахита у детей // Практика педиатра, 2012, — № 3. — С. 34–40. 5. Лабораторные методы исследования в клинике: Справочник /Меньшиков В. В., Делекторская Л. Н., Золотницкая З. П. и др.,: Под ред. В. В. Меньшикова В. В. // Справочник. М.: Медицина, 1987, — 368 с.: ил. 6. Тиц Н. У. Энциклопедия клинических лабораторных тестов /пер. с англ. под ред. В. В. Меньшикова М.: Лабинформ, 1997. — 960 с. 7. Paterson C. Vitamin D deficiency: a diagnosis often missed // Br. J. Hosp. Med. (Lond.). — 2011. — Vol. 72. — Iss. 8. — P. 456–8, 460–2. 8. Rajah J., Thandrayen K., Pettifor J. M. Clinical practice: diagnostic approach to the rachitic child. // Eur. J. Pediatr. — 2011. — Vol. 170. — Iss. 9. — P. 1089–96. 9. Ringe J. D. The effect of Vitamin D on falls and fractures // Scand. J. Clin. Lab. Invest. Suppl. — 2012. — Apr., 243. P. 73–8. e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 57 Иммуноферментная тест-система для серодиагностики герпеса II типа Г. В. Ковтонюк 1, Л. А. Ганова 1, К. А. Шепелин 2 1 2 Л. А. Ганова ЧАО «НПК «Диапроф-Мед», г. Киев, Украина ООО «Эпидбиомед-диагностика», г. Москва ELISA kit for Herpes simplex virus type 2 serodiagnosis G. V. Kovtonjuk, L. O. Ganova, K. A. Shepelin Резюме На основе рекомбинантного белка gG2 (JSC DiaprophMed) сконструирована тест-система для выявления иммуноглобулинов класса G к вирусу герпеса II типа и определения индекса их авидности. Данную тест-систему можно использовать как для подтверждения первичной инфекции, так и для дифференциации первичного заболевания от хронического инфекционного процесса и реактивации вируса. Таким образом, разработанная нами тест-система может быть дополнительным методом диагностики герпетической инфекции. Summary To reveal Herpes simplex virus 2 specific IgG and to determine their avidity ELISA kit was constructed using recombinant protein gG2 (JSC Diaproph-Med). Using this kit assessment of specific antibodies with different avidity indexes was investigated in practically healthy donor samples. It is possible to use mentioned ELISA kit for confirmation of primary infection and also for differentiation of primary infection, chronic disease and virus reactivation. Thus, this ELISA kit could be an additional tool in herpetic infection diagnosis. Ключевые слова: вирус герпеса II типа, инфекции. Keywords: herpes simplex virus , infection К. А. Шепелин И нфицирование вирусом простого герпеса II типа (ВПГ2) является причиной большинства случаев хронического и рецидивирующего генитального герпеса. Для данной инфекции характерны горизонтальный (от больного к здоровому половым путем) и вертикальный (от матери плоду) способы передачи [1]. Несмотря на высокую гомологию с родственным вирусом простого герпеса I типа, ВПГ2 является более опасным, поскольку характеризуется выраженным тропизмом к эпителиоцитам слизистых оболочек полового тракта, и длительная персистенция вируса может приводить к онкогенной трансформации зараженных клеток [2]. Инфекция, обусловленная ВПГ2, характеризуется более частыми рецидивами в сравнении с ВПГ1-инфекцией, и может быть причиной невынашивания беременности и развития врожденных патологий плода [3, 4]. Диагностическое значение при первичном инфицировании ВПГ2 имеют IgM, которые определяются в крови на 4–6 сутки после контакта с вирусом и достигают максимального значения на 15–20 сутки. С 10–14 суток начинается продукция специ- 58 Рисунок 1. Схематическое строение вируса простого герпеса. фических IgG, которые персистируют в органихме на протяжении всей жизни [5]. Поэтому серологические методы позволяют диагностировать заболевание как в период активации вируса, так и во время латентной инфекции. Антитела класса М к ВПГ2 выявляются в организме не только при первичной инфекции, но также и при реактивации вируса и реинфекции. В связи с этим при установлении факта первичного ин- Медицинский алфавит. Современная лаборатория 3 / 2013 фицирования обязательным является определение авидности специфичесикх антител класса G [6, 7]. Авидность — это показатель сродства активного центра антитела к антигенным детерминантам возбудителя, который пропорционален степени прочности иммунного комплекса. Высокоаффинные антитела имеют преимущество в реакции антиген-антитело благодаря формированию к более устойчивых связей, e-mail: medalfavit@mail.ru что обусловлено эффективными конформационными изменениями их активных центров. Антитела с высоким индексом авидности формируют высокоэнергетические иммунные комплексы с низкой тенденцией к диссоциации и, наоборот, антитела с низким индексом авидности образуют комплексы, для диссоциации которых необходимо меньше энергии. На этом свойстве базируется метод определения индекса авидности антител в присутствии хаотропных агентов (мочевина, гуанидина гидрохлорид, изотиоцианат натрия), низкие концентрации которых препятствуют возникновению иммунных комплексов, в состав которых входят только низкоавидные антитела. Специфические IgG с низкой авидностью определяются тлько на ранних этапах первичной герпетической инфекции, что и даёт возможность дифференцировать ёё от хронического рецидивирующего заболевания [8]. Перспективным направлением в серодиагностике ВПГ2 является разработка различных конструкций твердофазного ИФА. Использование типоспецифического рекомбинантного белка gG2 даёт возможность дифференцировать герпетическую инфекцию, вызванную ВПГ2, от заболеваний вызванных подобным вирусом ВПГ1, что имеет существенное прогностическое значение и определяет дальнейшую стратегию лечения [7, 9]. Материалы и методы Исследовали 510 образцов сывороток крови доноров, переданных областной станцией переливания крови Киевской области. Все образцы были подтверждены в тест-системе AMERICA Herpes 2 IgG Antibody ELISA Test Kit (IBL, США). Иммуноферментная тест-система для определения иммуноглобулинов класса G была сконструирована в формате непрямого твердофазного ИФА. Для приготовления иммуносорбента использовали 96-луночные планшеты PolySorp (NUNC, Дания), лунки которого были сенсибилизиe-mail: medalfavit@mail.ru Рисунок 2. Развитие иммунного ответа при герпетической инфекции. рованы очищенным рекомбнантным белком gG2 HSV2 производства ЧАО НПК «Диапроф Мед» (Киев, Украина). Данный рекомбинантный белок gG2, состоящий из 68 аминокислот, является антигенным аналогом иммунодоминантных участков поверхностного гликопротеина G ВПГ2. При конструировании продуцента рекомбинантного белка использовали плазмидный вектор pET28а (Novagen, США) и клеточную систему реципиентного штамма Esherichia coli BL21 (DE3). Постановку ИФА проводили двухэтапно. На первом этапе, при внесении в лунки планшета исследуемых сывороток, содержащиеся в них специфические антитела связывались с соответствующими антигенами иммуносорбента. На следующем этапе образованные иммунные комплексы выявляли с помощью пероксидазного конъюгата на основе мышиных моноклональных антител к IgG человека. В каче стве проявителя реакции использовали 0,03 % раствор 3,3’,5,5’-тетраметилбензидина в цитратном буфере, который содержал 0,016 % перекиси водорода (субстрат для фермента пероксидазы). Развитие цветной реакции останавливали 0,5 М серной кислотой. Оптическую плотность реакционной смеси в лунках определяли спектрофотометром Labsystems Multiskan (Финляндия) в двухволновом режиме 492 / 620 нм. Результат считали положительным, если его оптическая плотность (ОП) превышала граничное значение (cut off), которое рассчитывали как сумму среднего значения трёх негативных контролей с учетом коэффициента 0,2. В качестве негативного контроля использовали сыворотку крови человека, которая не содержала антител к ВПГ1, ВПГ2, вирусу гепатита С, T. pallidum, а также HBsAg вируса гепатита В. Для определения индекса авидности исследуемую положительную сыворотку инкубировали в двух параллельных лунках иммуносорбента, потом одну из них промывали в обычном режиме, а другую обрабатывали диссоциирующим раствором, который приводит к разрушению иммунных комплексов, образованных низкоавидными антителами. Индекс авидности рассчитывали как соотношение оптической плотности, полученной при выявлении специфических антител в присутствии диссоциирующего агента, к оптической плотности, полученной в результате анализа данного образца без обработки диссоциирующим раствором. Если индекс авидности был меньше 30 %, считали, что сыворока содержит низкоавидные антитела; больше 60 % — высокоавидные; а в диапазоне от 30 до 60 % — средний уровень авидности антител. Медицинский алфавит. Современная лаборатория 3 / 2013 59 Рис. 3. Распределение антител класса G, специфичных к ВПГ2, среди доноров: 1 — количество сывороток, не содержащих ан‑ титела к ВПГ2; 2 — количество сывороток, содержащих специфичные антитела с низ‑ ким индексом авидности; 3 — количество сывороток, содержащих специфичные ан‑ титела со средним индексом авидности; 4 — количество сывороток, содержащих специфичные антитела с высоким индексом авидности. Для разведения исследуемых образцов и конъюгата использовали фосфатный буфер с добавлением белка казеиновой фракции молока и детергента Tween 20 в качестве компонентов, которые блокируют неспецифические сигналы. Для промывания планшетов после каждого этапа использовали фосфатный буфер с добавлением детергента Triton-X100. Каждую сыворотку тестировали в четырёх повторах. Обработку полученных результатов проводили с учётом критерия Стьюдента [11]. Результаты и обсуждение Для определения качественных характеристик разработанной нами тест-системы, предназначенной для определения IgG к ВПГ2, было исследовано 510 сывороток крови доноров. Полученные результаты представлены на рис. 3. Среди проанализированных образцов в 96 (18,8 %) сыворотках выявлены специфические антитела класса G, а остальные 414 (81,2 %) были серонегативными. Такие данные соответствуют распространённости вируса в странах восточной Европы [12]. Определение индекса авидности специфических IgG основывается на способности связи антиген–антитело разрушаться под воздействием диссоциирующего раствора. Прочность иммунного комплекса определяется степенью сродства активного центра антитела с антигенными де60 терминантами вируса, что зависит от длительности и продуктивности заболевания. При тестировании доноров с помощью разработанной тест-системы в наших исследованиях антитела класса G с низким индексом авидности до 30 % были выявлены у восьми серопозитивных доноров. Это свидетельствует о первичном инфицировании ВПГ2, поскольку контакт с вирусом состоялся сравнительно недавно, и активные центры антител в процессе иммунного ответа еще не приобрели высокой степени сродства к антигену. Специфические IgG с высоким индексом авидности более 30 % были выявлены у 88 серопозитивных доноров (91,7 %), что указывает на инфекцию, перенесённую ранее. В пределах этой группы можно выделить подгруппу из 53 доноров (55,2 %), у которых индекс авидности составлял 60–100 %. Такие данные могут свидетельствовать о поздней стадии перенесённой первичной инфекции или инфекции, перенесённой в прошлом. Средний индекс авидности в интервале 30– 60 %, который наблюдается у 35 доноров (36 %), можно рассматривать как переходной этап развития иммунного ответа, а именно процесс формирования специфичности активного центра антител [13]. Известно, что динамика авидности иммуноглобулинов зависит от дозы антигена. При низкой вирусной нагрузке происходит более быстрое нарастание авидности, а большое количество вируса приводит к более медленному формированию авидности [14]. Таким образом, низкоавидные антитела продуцируются в течение первой стадии инфекции, когда содержание вирусных антигенов высокое. Также следует обратить внимание, что длительность периода циркуляции в организме низко- и среднеавидных антител может быть обусловлена индивидуальными особенностями функционирования иммунной системы. Поэтому окончательный вывод и интерпретацию полученных результатов можно сформулировать только после исследования динамики количества и индекса авидности антител, специфических к ВПГ2. Медицинский алфавит. Современная лаборатория 3 / 2013 Таким образом, разработанная нами тест-система для определения антител к ВПГ2 с определением индекса их авидности даёт возможность устанавливать длительность и стадию инфекционного процесса, что может оказаться решающим фактором при выборе стратегии лечения. Список литературы 1. Марієвський В. Ф., Руденко А. О., Щербинська А. М. Инфекционные болезни в Украине на рубеже двух столетий. // Современные инфекции. —1999. —№ 2. — С.18–23. 2. Кицак В. Я. Вирусные инфекции беременных: патология плода и новорожденных. — Кольцово, 2005. — 84 с. 3. Казимирчук В. Е., Мальцев Д. В. Клиника, диагностика и лечение герпесвирусных инфекций человека. — К.: Феникс, 2009. — 352 с. 4. Leyland B., Kennedy M. R., Wimberly Y. H., Levine B. J., Cherpes T. L. Serologic detection of herpes simplex virus type 2 antibodies among pregnant women using a point-of-care test from Focus Diagnostics. // Journal of Clinical Virology. — 2009. — Vol. 44, № 2. — P. 125–128. 5. Slomka M. J. Seroepidemiology and control of genital herpes: the value of type specific antibodies to herpes simplex virus. // Commun. Dis. Rep. CDR Rev. — 1996. — Vol. 1, № 6 (3). — Р. 41–45. 6. Brown E. L., Morrow R., Krantz E. M. at all. Maternal herpes simplex virus antibody avidity and risk of neonatal herpes. // Am. J. Obstet. Gynecol. — 2006. — Jul; 195 (1). — P. 4–6. 7. M o r r o w R . A . , F r i e d r i c h D . , K r a n t z E . , Wald A. Development and use of a typespecific antibody avidity test based on herpes simplex virus type 2 glycoprotein G. // Sex. Transm. Dis. — 2004. — Aug; 31 (8). — P. 508–515. 8. Hashido M., Inouye S., Kawana T. Differentiation of primary from nonprimary genital herpes infections by a herpes simplex virusspecific immunoglobulin G avidity assay. // Journal of Clinical Microbiology. — 1997. — Vol. 35, № 7. — Р.1766–1768. 9. Manservigi R., Cassai E. The glycoproteins of the human herpesviruses. // Comparative Immunology, Microbiology and Infectious Diseases. — 1991. — Vol. 14, № 2 — P. 81–95. 10. Tijssen P., Kustak E. Higly efficient and simle metods for the preparation of peroxidase and active peroxidase antibody conjuigates for enzyme immunoassays // Analytical Biochemistry. — 1984. — Vol. 136, № 2. — Р. 451–457. 11.Лапач С. Н., Губенко А. В., Бабич П. Н. Статистические методы в медико-биологических исследованиях с использованием Excel — К.: Морион, 2001. — 407 с. 12.Corey L. Challenges in genital herpes simplex virus management. // The Journal of Infectious Diseases. — 2002. — Vol. 15; 186 Suppl 1. — P. 29–33. 13.Скок М. В. Основи імунології. Курс лекцій — Київ: Фітосоціоцентр, 2002. — 152 с. 14.Meyers R. A. Immunology: from cell biology to disease. — Wiley-VCH, 2007. — 435 р. e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 61 Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии О. В. Тихомирова О. В. Тихомирова, д. м. н., зав. отделом клинической неврологии Е. В. Бутырина, врач-невролог, зав. отделением неврологии отдела клинической неврологии Н. Н. Зыбина, д. б. н., проф., зав. отделом лабораторной диагностики М. Ю. Фролова, к. б. н., зав. лабораторией клинической химии отдела лабораторной диагностики ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России, г. Санкт-Петербург Е. В. Бутырина Резюме В статье представлены результаты стандартизации протокола определения экскреции основного производного мелатонина и оценки клинической значимости этого параметра в диагностике психофизиологической инсомнии. Проведено исследование содержания 6-сульфатоксимелатонина (6-оксиМТ) в ночной и дневной порциях мочи 94 пациентов с инсомнией. Установлено, что определение содержания 6-оксиМТ в ночной порции мочи у пациентов с инсомнией имеет несомненное диагностическое значение, позволяет выделить подтип инсомнии, в развитии которого снижение синтеза ночного мелатонина играет важную патогенетическую роль. Показатель концентрации 6-оксиМТ в ночной порции мочи и отношение экскреции ночного 6-оксиМТ к дневному диагностически более значимы, чем экскреция 6-оксиМТ в ночной порции. Стандартизация преаналитического этапа определения метаболитов мелатонина в моче должна стать обязательной процедурой при использовании этого теста в диагностических целях. Ключевые слова: инсомния, полисомнография, 6-сульфатоксимелатонин, лабораторная диагностика. Н. Н. Зыбина Summary The goal of this study was to standardize the protocol of determination of main melatonin derivatives and evaluate the clinical significance of this parameter in diagnosis of psycho physiological insomnia. 6-Sulfatoxymelatonin (6-SMT) concentration in day and night portions of urine was defined in 94 patients with insomnia. We have found that the determination of 6-SМТ in the night portion of urine in patients with insomnia has the diagnostic value and the reduction of night melatonin synthesis plays an important pathogenetic role in development of specific subtype of insomnia. Index of concentration of 6-SMT in the night portion of urine and the ratio of night melatonin excretion to day melatonin excretion is diagnostically more significant than 6-SМТ excretion in the night portion. Standardization of preanalytical stage of the determination of melatonin metabolites in the urine should become mandatory when this test is used for diagnostic purposes. Keywords: insomnia, polysomnographia, 6-sulfatoxymelatonin, laboratory diagnostic. М. Ю. Фролова Введение Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции 62 постоянно и 25–29 % эпизодически принимают снотворные препараты. Нарушения качества сна увеличиваются с возрастом. Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Мелатонин синтезируется из незаменимой аминокислоты триптофана преимущественно в шишковидной железе (80 %) и частично гастроинтестинальном тракте [1]. Ритм его секреции носит четко выраженный циркадианный характер. Уровень Медицинский алфавит. Современная лаборатория 3 / 2013 указанного гормона в крови начинает повышаться в вечернее время, совпадая с уменьшением уровня освещенности, достигает максимума в середине ночи (в 2–3 часа), затем прогрессивно уменьшается к утру. В дневное время секреция мелатонина остается на очень низком уровне. Расстройства сна возникают тогда, когда секреция мелатонина десинхронизируется с циклом дня и ночи [25, 28]. Циркадианный ритм выработки мелатонина эпифизом задается супрахиазматическим ядром таламуса (СХЯ) в зависимости от уровня освещенности. В циркадной системе млекопитающих мелатонин выполняет e-mail: medalfavit@mail.ru функцию химического переносчика информации из циркадного водителя ритма. Центральные мелатониновые рецепторы МТ 1 и МТ 2 сосредоточены преимущественно в СХЯ, в котором мелатонин действует по принципу обратной негативной связи. Таким образом, мелатонин снижает активирующие свойства СХЯ и в результате приводит к наступлению сна. Период полужизни мелатонина в организме человека составляет, по разным данным, от 30 до 50 минут. Инактивация мелатонина происходит главным образом в печени, где под воздействием системы микросомальных окислительных ферментов он превращается в 6-оксимелатонин. Большая часть окисленного мелатонина выводится с мочой и калом в виде сульфатного коньюгата 6-сульфатоксимелатонина (6-оксиМТ). В настоящее время в клинической лабораторной диагностике существуют методы с аналитическими характеристиками, позволяющими определять как содержания мелатонина в плазме, так и его производного 6-оксиМТ в моче. В качестве референтного метода используется метод радиоиммунного анализа (РИА), однако он довольно редко применяется в широкой клинической практике в отличие от твердофазного иммуноферментного анализа, имеющего сходные с РИА аналитические характеристики. Сведения о диагностической значимости рассматриваемых показателей при нарушениях сна весьма противоречивы и фрагментарны. Снижение экскреции 6-оксиМТ в ночной порции мочи у пациентов с инсомнией по сравнению с контролем было выявлено в ряде исследований [5, 14, 25, 29], однако в других работах такой связи обнаружено не было [31, 34]. Сведения об эффективности использования мелатонина для лечения инсомнии также противоречивы. Так, в работах [7, 14, 23, 32, 35] не было выявлено значимых различий при использовании плацебо и различных доз мелатонина для лечения инсомнии, в других работах получены данные об эффективности использования мелатонина с целью улучшения каe-mail: medalfavit@mail.ru чества и эффективности сна [9, 10, 13, 21, 28, 30, 34, 36]. Имеются также исследования, показавшие эффективность использования с пищей продуктов, богатых триптофаном (предшественник серотонина и мелатонина): употребление с пищей 60 мг триптофана в день привело к увеличению экскреции 6-оксиМТ и улучшению сна. В подавляющем большинстве исследований при лечении первичной инсомнии мелатонином исходный уровень экскреции 6-оксиМТ и его динамика в процессе лечения не исследовались. Следует подчеркнуть, что, несмотря на общепринятое важное значение мелатонина в организации сна и наличия способов определения мелатонина в крови и его производных в моче, эти лабораторные показатели не используются в повседневной клинической практике при диагностике инсомнии, выборе терапии и контроле эффективности лечения. В национальном руководстве, рекомендациях, учебных пособиях по клинической лабораторной диагностике отсутствуют сведения о диагностической значимости и информативности мелатонина и его производных, их возможном использовании в диагностике каких-либо патологических состояний или заболеваний, рекомендации о методах определения, референтные интервалы. Все это существенно ограничивает возможности использования определения мелатонина и его производных в клинической практике. Противоречивость имеющихся в литературе данных, отсутствие стандартизации методов, отсутствие общепринятых показателей нормы, сведений о диагностической значимости лабораторных параметров при инсомнии определяют необходимость дальнейших исследований в этом направлении. Цель настоящего исследования заключалась в стандартизации протокола определения экскреции основного производного мелатонина, определении пределов референтных величин в рамках разработанного протокола и оценке клинической значимости этих лабораторных параметров в диагностике инсомнии. Материалы и методы В исследование было включено 94 пациента с хронической психофизиологической инсомнией в возрасте от 32 до 85 лет и 41 человек без субьективных нарушений сна в возрасте от 40 до 70 лет. Пациенты проходили обследование в клинике ВЦЭРМ им. А. М. Никифорова МЧС России. Диагноз хронической психофизиологической инсомнии был установлен на основании сбора анамнеза, результатов анкетирования, данных полисомнографического обследования. Среди обследованных пациентов с хронической психофизиологической инсомнией было 68 мужчин (72 %) и 26 женщин (28 %) в возрасте от 32 до 85 лет, средний возраст 51 год. Критериями включения пациента в исследование были: согласие больного на использование данных о его болезни в научных исследованиях, наличие жалоб на нарушения сна (нарушения инициации, поддержания, качества сна). Критериями исключения являлись значимые нарушения дыхания во сне (индекс апноэ / гипопноэ более 5), наличие синдрома беспокойных ног, обострения хронических заболеваний, наличие в анамнезе психического заболевания, прием препаратов, влияющих на экскрецию мелатонина, серотонина, качество сна (бета-блокаторы, нестероидные противовоспалительные средства, бензодиазепины, антидепрессанты, снотворные). Для субъективной оценки качества сна использовали общепринятую анкету балльной оценки субъективных характеристик сна. Максимальная суммарная оценка — 30 баллов, а 22 балла и более — это показатели, характерные для здоровых испытуемых, 19–21 балл — пограничные значения, а показатели менее 19 баллов — признак неблагополучия [2]. Для оценки выраженности дневной сонливости использовали шкалу Epworth. В норме суммарная оценка по шкале меньше либо равна 5 [16]. Степень выраженности тревоги и депрессии определяли с помощью госпитальной шкалы тревоги и депрессии (HADS), разрабо- Медицинский алфавит. Современная лаборатория 3 / 2013 63 Таблица 1 Сравнительная характеристика субъективных характеристик сна и эмоционально-волевых нарушений между группой контроля и пациентами с психофизиологической инсомнией (М [SD]) Группа Показатель T-критерий Р 17 (3,3) 10,7 < 0,001 6 (4,5) 8 (3,8) 2,2 < 0,05 5 (4,0) 9 (3,9) 6,1 < 0,001 4 (3,1) 7 (3,3) 4,3 < 0,001 Контроль Основная Анкета субъективных характеристик сна, балл 23 (2,4) Эпвортская шкала, балл Тревога, балл Депрессия, балл Таблица 2 Сравнительная характеристика объективных характеристик сна между контролем и основной группой по результатам полисомнографического обследования (M [SD]) Показатель Группа T-критерий Р Контроль Основная 422 (47,4) 348 (83,5) 6,1 < 0,001 TST/TIB 100, % 88 (6,2) 76 (13,0) 6,7 < 0,001 LPS, мин. 15 (12,4) 46 (54,3) 5 < 0,001 WDS, мин. 39 (25,9) 79 (46,2) 5,9 < 0,001 6,3 < 0,001 TST, мин. Стадия сна I стадия, % 3 (2,8) 10 (9,7) II стадия, % 57 (7,7) 59 (10,5) 1,1 – III стадия, % 19 (5,8) 17 (9,0) 1,4 – ФБС,% 21 (5,6) 16 (6,8) 4,2 < 0,001 Пробуждения, кол-во 16 (8,1) 20 (8,5) 2,3 < 0,05 Индекс активаций 4 (3,5) 6 (4,5) 2,5 < 0,05 танной А. Зигмандом и Р. Снейсом, адаптированной к отечественной практике М. Ю. Дробышевым [37]. Суммарные значения по шкале менее 8 баллов — отсутствие тревоги / депрессии, 8–10 баллов — субклинически выраженная тревога / депрессия, более 11 баллов — клинически выраженная тревога / депрессия. Полисомнографическое исследование проводили на приборе фирмы Nicolet One. При этом регистрировали восемь каналов электроэнцефалограммы, окулограмму, подбородочную электромиограмму, ЭКГ. Фиксировался также ороназальный поток, дыхательные движения грудной и брюшной стенок, сатурация крови, шум дыхания. Параллельно в течение всей записи ночного сна (восемь часов) проводилось видеомониторирование. Оценку фаз сна проводили по стандартной методике A. Rechtschaffen и A. Kales [27]. По данным полисомнографии оценивали латентность наступле64 ния устойчивого сна (LPS), общую продолжительность сна (TST) и его эффективность, время бодрствования внутри сна (WDS), длительность и процентное содержание отдельных фаз сна, общее количество активаций и их индекс (количество в час сна), индекс периодического движения конечностями и индекс апноэ / гипопноэ (количество эпизодов нарушения дыхания в час сна). Материалом для исследования содержания основного метаболита мелатонина 6-сульфатоксимелатонина (6-оксиМТ) служила моча обследованных лиц. К ночной порции мочи относили мочу, собранную во время ночных пробуждений, и утреннюю порцию мочи, к дневной порции — все остальные. 6-оксиМТ определяли методом твердофазного иммуноферментного анализа ELISA (Buhlmann Laboratories AG, Швейцария). Образцы мочи центрифугировали пять минут при 2 000 х g, надосадочную жидкость исполь- Медицинский алфавит. Современная лаборатория 3 / 2013 зовали для определения 6-оксиМТ. Аналитические характеристики наборов соответствуют требованиям, предъявляемым к реактивам, используемым для целей клинической лабораторной диагностики. Результаты выражали в нг/мл при определении концентрации 6-оксиМТ в ночной и дневной порциях мочи и в мкг для оценки экскреции: суточной, ночной и дневной. Также рассчитывали отношение ночной экскреции 6-оксиМТ к дневной. Результаты исследования По результатам анкетирования выявлены достоверные изменения всех исследуемых параметров у пациентов с инсомнией по сравнению с контролем: значимое ухудшение показателей сна, более выраженная дневная сонливость, тревога и депрессия (табл. 1). Длительность нарушений сна в основной группе чаще была более трех лет, в равной степени как у мужчин, так и у женщин. Однако мужчины чаще отмечали нарушения сна с частотой 3–4 раза в неделю, а женщины ежедневно. Пациенты с психофизиологической инсомнией в равной степени отмечали как нарушения инициации сна, так и трудности поддержания сна. Большая часть пациентов с психофизиологической инсомнией отмечала умеренно выраженную дневную сонливость, без разницы между мужчинами и женщинами. У пациентов с психофизиологической инсомнией преобладала умеренно выраженная тревога, чаще в сочетании с умеренно выраженной депрессией. Значимых гендерных различий по выраженности тревоги и депрессии выявлено не было. Сопоставление объективных характеристик сна по результатам полисомнографического обследования выявило достоверное нарушение большинства исследуемых показателей в основной группе по сравнению с контролем (табл. 2). Не было значимых различий только по длительности II и III фаз сна. Анализ полисомнограмм показал, что у большинства пациентов с хронической инсомнией была снижена эффективность сна за счет нарушения e-mail: medalfavit@mail.ru инициации сна (увеличение LPS) и, в большей степени, из-за нарушения поддержания сна (увеличение WDS). В структуре сна у пациентов с хронической инсомнией выявлялось уменьшение продолжительности REM сна. Характерным было снижением дельта сна ниже нормы, но различия по этому показателю с группой контроля были незначимыми. Оценка экскреции 6-оксиМТ была проведена у 37 пациентов основной группы и 41 пациента группы контроля. Сопоставление исследованных лабораторных показателей представлено в табл. 3 Из представленной таблицы видно, что содержание ночного 6-оксиМТ, соотношение содержания 6-оксиМТ в ночной и дневной порции мочи, экскреция 6-оксиМТ в ночной порции мочи и суточной моче были достоверно ниже у пациентов с психофизиологической инсомнией по сравнению с контролем, что подтверждало наличие связи между секрецией мелатонина ночью и качеством сна. Проведение корреляционного анализа также показало, что снижение экскреции мелатонина ночью коррелировало с уменьшением продолжительности глубокого дельта сна (r = 0,44, р < 0,05) и REM сна (r = 0,34, р < 0,05). Кроме этого увеличение концентрации дневного мелатонина коррелировало с уровнем дневной сонливости (r = 0,36, р < 0,05). Диапазон колебаний экскреции 6-оксиМТ в основной группе составил 1,4–33,4 мкг/ ночь, в контроле 1,6–79,4 мкг/ночь. Анализ значений экскреции 6-оксиМТ в ночной порции мочи показывает, что как в основной, так и в контрольной группе распределение отличается от нормального (рис. 1). Отмечены значительные индивидуальные колебания ночной экскреции 6-оксиМТ как в основной группе, так и в группе контроля; в последней выявлено наличие у ряда испытуемых низких значений экскреции мелатонина и высоких показателей у некоторых пациентов с инсомнией. Интересны значения экскреции 6-оксиМТ ниже 8 мкг за ночь, где отмечается достоверное преобладание пациентов основной группы (p < 0,05). e-mail: medalfavit@mail.ru Таблица 3 Сравнительная характеристика концентрации и экскреции 6-сульфатоксимелатонина (6-оксиМТ) в моче у пациентов с психофизиологической инсомнией и контрольной группой (M [SD]) Группа Показатель T-критерий Р 20 (15,5) 2,1 < 0,05 Контроль Основная Концентрация 6-оксиМТ в моче, ночь (нг/мл) 29 (21,2) Концентрация 6-оксиМТ в моче, день (нг/мл) 10 (8,9) 12 (14,8) 0,7 – Отношение концентрации 6-оксиМТ в моче ночь/день 9 (18,8) 3,45 (3,6) 2 < 0,05 Экскреция 6-оксиМТ, ночь (мкг/ночь) 17 (16,0) 11 (8,6) 2 < 0,05 Экскреция 6-оксиМТ, день (мкг/день) 10 (9,0) 16 (26,9) 1,3 – Отношение экскреции 6-оксиМТ ночь/день 3 (4,6) 2 (3,2) 1,1 – Суточная экскреция 6-оксиМТ, (мкг/24 часа) 26 (18,9) 18 (18,2) 2 < 0,05 Рисунок 1. Распределение пациентов с инсомнией и контрольной группы в зависимости от экскреции 6-оксиМТ в ночной порции мочи. Одной из задач исследования являлось определение диапазона нормативных значений для экскреции 6-оксиМТ. Как видно из представленных результатов, расчет диапазона нормативных показателей в пределах 1,5–2 стандартных отклонений невозможен. В связи с этим в качестве предварительных данных мы считали сниженными значения 6-оксиМТ соответствующие первой квартили контрольной группы. Распределение пациентов основной группы в зависимости от значений экскреции 6-оксиМТ, соответствующих квартилям контрольной группы, представлены в табл. 4. Результаты исследования показывают, что низкая ночная экскреция мелатонина (до 5,8 мкг) и концентрации ночного 6-оксиМТ (до 13,5 нг/мл), соответствующие первой квартиле контрольной группы, встречаются значительно чаще у пациентов с инсомнией (р < 0,01). При этом показатель концентрации и соотношение ночной экскреции к дневной имеют большую диагностическую значимость, чем показатель ночной экскреции. На основании полученных данных в качестве предварительных ориентиров для показателей нормативных значений можно использовать значение первой квартили контрольной группы. Сопоставление данных с использованием более дискретной шкалы (с шагом 12,5 %) показало, что в группе пациентов с инсомнией чаще встречаются показатели экскреции 6-оксиМТ в пределах 37,5 перцентиля контрольной группы, соответствующего значению 7,9 мкг/ночь. В этот диапазон попали 37,5 % пациентов Медицинский алфавит. Современная лаборатория 3 / 2013 65 Таблица 4. Распределение пациентов с инсомнией в зависимости от показателей 6-оксиМТ в моче по квартилям контрольной группы Концентрация ночного 6-оксиМТ (нг/мл) Квартиль Экскреция ночного 6-оксиМТ (мкг) Отношение экскреции ночного к экскреции дневного 6-оксиМТ Значение Количество Значение Количество Значение в группе пациентов в группе пациентов в группе контроля с инсомнией (%) контроля с инсомнией (%) контроля Количество пациентов с инсомнией (%) Q1 13,5 44* 5,8 35 0,72 43** Q2 20,9 15 10,9 24 1,58 13 Q3 38,6 31 21,3 27 3,18 22 Q4 88,7 10 79,4 14 20,1 22 Примечание: * (р < 0,001) — достоверность различий между частотой снижения экскреции и концентрации ночного 6-оксиМТ; ** (р < 0,001) — достоверность различий между частотой снижения экскреции и отношения экскреции ночного 6-оксиМТ к дневному. контрольной группы и 51 % пациентов с инсомнией (p < 0,05). Полученные данные позволяют предположить, что значения экскреции 6-оксиМТ в ночной порции мочи ниже 8 мкг являются значимыми для развития инсомнии. Для выявления возможной зависимости между уровнем секреции ночного мелатонина и возрастом было проведено сравнение показателей экскреции 6-оксиМТ у пациентов с инсомнией в возрасте до 55 и старше 55 лет. Показатели экскреции ночного мелатонина не отличались в выделенных группах и составили 12 (9,2) мкг и 11 (8,4) мкг соответственно. Достоверных различий между группами «сов» и «жаворонков» по экскреции 6-оксиМТ обнаружено не было. Для определения возможной связи между длительностью хронической инсомнии и уровнем секреции мелатонина было проведено сравнение показателей концентрации и экскреции 6-оксиМТ в зависимости от длительности инсомнии. При выделении подгрупп с длительностью заболевания до пяти лет и от пяти лет и более были получены достоверные различия между группами только по показателю концентрации мелатонина в ночной порции мочи: 35 (8,1) мкг и 15 (8,9) мкг соответственно, (p < 0,05). Экскреция 6-оксиМТ в ночной порции мочи у пациентов с инсомнией более пяти лет была ниже, но эти различия не достигли уровня значимости: 8 (5,1) и 12 (5,6), (p > 0,05). 66 Обсуждение результатов В настоящее время накопилось достаточно много экспериментальных данных и клинических наблюдений, указывающих на связь между синтезом ночного мелатонина и качеством сна [5, 14, 21, 25, 29]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [11, 33] доказало его эффективность в лечении инсомнии, а критерием включения во все исследования было наличие первичной инсомнии вне зависимости от уровня эндогенного мелатонина. Таким образом, до сих пор отсутствуют показания к назначению мелатонина, основанные на лабораторных данных о его снижении. Вследствие выраженных почасовых колебаний уровня мелатонина в крови и быстром распаде мелатонина (период полувыведения не более 50 минут), объективная оценка содержания мелатонина возможна только при постановке катетера и многократном в течение суток заборе крови, что не может быть рекомендовано для широкого применения в клинической практике. В связи с этим наиболее широко в настоящее время применяется оценка содержания основного метаболита мелатонина 6-сульфатоксимелатонина в моче. Учитывая выраженную зависимость синтеза мелатонина от времени суток, принято оценивать концентрацию или экскрецию 6-сульфатоксимелатонина отдельно в ночной и дневной порциях мочи. Анализ исследований, посвященных Медицинский алфавит. Современная лаборатория 3 / 2013 изучению экскреции мелатонина у пациентов с инсомнией, показал отсутствие стандартизации времени сбора ночной и дневной порций мочи. Так, в работах Lushington с соавт. [31, 34] ночную и дневную порции мочи собирали в периоды 20:00–08:00 и 08:00–20:00 соответственно. В результате исследований не было получено никаких различий между экскрецией 6-сульфатоксимелатонина у пациентов с инсомнией и контрольной группой. В противоположность этому, в работе Leger D. с соавт. [17], в которой представлены результаты обследования 517 пациентов с инсомнией в возрасте старше 55 лет, было выявлено значимое снижение экскреции 6-сульфатоксимелатонина в ночной порции мочи у пациентов с инсомнией по сравнению с контролем — 9,0 (8,3) и 18,1 (12,7) мкг за ночь соответственно (p < 0,05), при этом сбор ночной и дневной порций мочи осуществлялся в периоды 22:00–10:00 и 10:00–22:00. В проведенном нами исследовании получены аналогичные результаты, подтверждающие снижение синтеза ночного мелатонина у пациентов с инсомнией: 11 (8,6) и 17 (16) мкг/ ночь (p < 0,05). Особенностью предложенного нами способа сбора мочи являлось отнесение к ночной порции всех порций мочи во время сна и утренней порции мочи, а к дневной порции мочи — всех остальных порции вне зависимости от времени. Такой подход мы считаем принципиальным, так как в этом случае в ночную порцию мочи не может попасть часть мочи, собранная перед сном и отражающая секрецию мелатонина во второй половине дня. Данную модификацию преаналитического этапа метода мы предложили, основываясь на результатах Hajak с соавт. [25], которые при исследовании содержания плазменного мелатонина с интервалом в один час у пациентов с инсомнией и здоровых испытуемых показали, что у пациентов с инсомнией пиковое значение мелатонина отмечается рано вечером, а у здоровых испытуемых в середине ночи. Таким образом, значимым для инсомнии было не только снижение пикового значения синтеза мелатоe-mail: medalfavit@mail.ru нина, но и выраженный сдвиг этого пика с ночного на вечернее время. Следовательно, при сборе ночной порции мочи с 20:00 появляется риск получения нормальных показателей экскреции мелатонина за счет вечернего пика, что могло быть одной из причин отсутствия различий между пациентами с инсомнией и здоровым контролем в исследованиях Lushington с соавт. [31, 34]. Сложность в интерпретации полученных данных по экскреции мелатонина у пациентов с инсомнией связана также с большим разбросом индивидуальных значений как среди пациентов с инсомнией, так и среди контрольной группы. Наличие у ряда испытуемых контрольной группы низких значений экскреции мелатонина и высоких показателей у некоторых пациентов с инсомнией отмечали многие авторы [6, 31, 34]. Так, в исследовании R. Mahberg и D. Kunz (2007) авторы не получили каких-либо корреляций между полисомнографическими параметрами у пациентов с инсомнией и экскрецией 6-оксиМТ. Авторы делают вывод о неэффективности использования показателей экскреции 6-оксиМТ для оценки качества сна вследствие 20-кратных различий в индивидуальных колебаниях экскреции 6-оксиМТ, полученных в данном исследовании [18] В нашем исследовании также выявлены значительные индивидуальные колебания экскреции 6-оксиМТ у пациентов с инсомнией (от 1,4 до 33,4 мкг/ночь) и у здоровых испытуемых (от 1,6 до 79,4 мкг/ночь), а также значимые отличия распределения от нормального. Важным и сложным в связи с этим становится определение нормативных значений экскреции мелатонина. Единственным исследованием, где обсуждаются нормативные показатели для экскреции 6-оксиМТ, является работа Leger с соавт. [17] в которой предложено считать нормой диапазон от 2,5 до 97,5 перцентилей по логарифмической шкале, что составило от 8 до 56 мкг для пациентов старше 55 лет. Предложенные нами варианты нижней границы нормы по первой квартиле (6 мкг) или по 37,5 % e-mail: medalfavit@mail.ru перцентиле (8 мкг) сопоставимы с нормативным значением в работе Leger с соавт. (2004). Аналогичными оказались и значения медианы экскреции 6-оксиМТ у пациентов с инсомнией: 6,7 мкг/ночь в работе Leger с соавт. (2004) и 7,0 мкг/ночь в нашем исследовании. Определение референтных значений для экскреции 6-оксиМТ представляется важным, так как именно этот показатель позволит выделить пациентов с подтипом инсомнии, в развитии которой существенную роль сыграло снижение синтеза мелатонина. Указанные данные послужат основанием для определения дополнительных показаний к назначению мелатонина при лечении инсомнии. В нашем исследовании получены дополнительные данные, свидетельствующие о влиянии длительности заболевания на секрецию мелатонина. Была выявлена более низкая концентрация 6-оксиМТ в ночной порции мочи при длительности заболевания более пяти лет. Многочисленные исследования показали снижение синтеза мелатонина во время приема бета-блокаторов, противовоспалительных средств, бензодиазепинов, некоторых антидепрессантов [8, 20, 22, 23, 28, 36], которые часто назначаются пациентам с инсомнией в связи с имеющейся у них сопутствующей соматической патологией. У пациентов с сочетанием кардиоваскулярной патологии с инсомнией при использовании перечисленных выше препаратов диагностика экскреции 6-оксиМТ приобретает дополнительное значение, так как известно, что снижение синтеза мелатонина связано не только с развитием инсомнии, но и ассоциировано с риском развития сахарного диабета и артериальной гипертензии [17]. Диагностика снижения 6-оксиМТ у этих пациентов и назначение мелатонина в случае его снижения будут иметь значение как для лечения инсомнии, так и кардиоваскулярного заболевания. Таким образом, определение содержания 6-оксиМТ в ночной порции мочи у пациентов с инсомнией имеет несомненное диагностическое значение, позволяет выделить подтип инсомнии, в развитии которого снижение синтеза ночного мелатонина играет важную патогенетическую роль. Для уточнения параметров референтных значений экскреции 6-оксиМТ необходимы дальнейшие исследования с детальным анализом всех возможных факторов, влияющих на экскрецию мелатонина. Выводы 1. Определение содержания 6-оксиМТ в ночной порции мочи имеет важное диагностическое значение у пациентов с инсомнией. 2. Стандартизация преаналитического этапа определения метаболитов мелатонина в моче должна стать обязательной процедурой при использовании этого теста в диагностических целях. 3. При инсомнии целесообразно относить к ночной порции мочу, собранную во время ночных пробуждений, и утреннюю порцию мочи. 4. Ориентировочным показателем сниженного синтеза ночного мелатонина следует считать снижение экскреции 6-оксиМТ ниже 5,8 мкг, снижение концентрации 6-оксиМТ в ночной порции мочи ниже 13,5 нг/мл. 5. Показатель концентрации 6-оксиМТ в ночной порции мочи и отношение экскреции ночного 6-оксиМТ к дневному диагностически более значимы, чем экскреции 6-оксиМТ в ночной порции. Список литературы 1. Анисимов В. Н. Мелатонин роль в организме, применение в клинике / Спб.: Изд-во «Система». — 2007. — 40 с. 2. Левин Я. И. Нарушения сна. / Я. И. Левин // Справочник по диа­гностике и лечению заболеваний у пожилых [под общ. ред. Л.И Дворецкого и Л. Б. Лазебника]. — М., Оникс. — 2000. — С. 182–212. 3. Левин Я. И. Сон, инсомния и принципы ее лечения / Методические рекомендации. — М.: «Авентис Фарма». — 2010. — С.42. 4. Ковальзон В. М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / В. М. Ковальзо // М.: БИНОМ., Лаборатория знаний. — 2012. — С.239. 5. Case-stady of evening melatonin concentration in primary insomnia / M.E. J. Аttenburrow, B. A. Dowling, A. L. Sharpley, P. J. Cowen // Br. Med. J. — 1996. — Vol. 312. — P. 1263–1264. Медицинский алфавит. Современная лаборатория 3 / 2013 67 6. Daily rhitm in human urinary melatonin / H. L. Lynch, R. J. Wurtman, L. A. Moskowitz, M. G. Archer // Science. — 1975. — Vol.187. — P. 169–171. 7. Dawson D., Rogers N. L., Cameron J. Effect of a sustained nocturnal transbucal melatonin administration on sleep and temperature in elderly insomniacs // J. Biol. Rhythms. — 1998. — Vol. 13. — P. 532–538. 8. Effect of atenolol on nocturnal sleep and temperature in yang men: reversal by pharmacological doses of melatonin / C.J Van den Heuvel, K. J. Reid, D. Dawson // Physiol. Behav. — 1997. — Vol. 61. — P. 795–802. 17. Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. — 2004. — Vol.116. — P.91–95. 18.Mahberg R., Kunz D. Melatonin excrection levels and polysomnographic sleep parameters in healthy subjects and patients with sleep-related disturbances // Sleep Med. — 2007. — Vol.8. — P. 512–516. 19. Melatonin replacement therapy of elderly insomniacs / I. Haimov, P. Lavie, M. Laudon [et al] // Sleep. — 1995. — Vol. 18. — P. 598–603. 9. Effect of inducing nocturnal serum melatonin concentration in daytime on sleep, mood, body temperature, and performance / A. B. Dollins, I. V. Zhdanova, R. J. Wurtman [et al] // Proc. Natl. Acad. Sci. US. — 1994. — Vol. 91. — P. 1824–1828. 20.Melatonin secretion related to side — effects of beta-blockers from the central nervous system / K. B. Brismar, K. Hylander, S. Eliasson [et al] // Acta.Med. Scand. — 1988. — Vol. 223. — P. 525–530. 10. Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. —1996. — Vol.5. — P.61–65. 21.Morris M., Lack L., Barrett J. The effects of sleep/wake state on nocturnal melatonin exretion // J. Pineal Res. — 1990. —№ 9. — P.133–138. 11. F e r r a c i o l i O d a E . , Q a w a s m i A . , Bloch M. H. Meta–analysis: melatonin for the treatment of primary sleep disorders // Plos one. — 2013. — e63773 (in process). 12. Hughes R. J., Badia P. Sleep promoting and hypothermic effects of daytime melatonin administration in humans // Sleep. — 1997. — Vol. 20. — P. 124–131. 22.Murphy P., Myers B. L., Badia, P. Non-steroidal anti-inflammatory drugs alter body temperature and suppress melatonin in humans // Physiol. Behav. — 1996. — Vol. 59. — P.133–139. 23.Myers B. L., Badia P. Factors affecting endogenous melatonin levels // Sleep Res. — 1993. — Vol. 22. — P. 2. subjects / Los Angeles: Brain Information Service /Brain Research Institute, University of California at Los Angeles. —1968. 28.Shochat T., Haimov I., Lavie P. Melatonin — the key to the gate of sleep // AnnMed. —1998. — Vol. 30. — P.81–87. 29.Sleep disorders and melatonin rhythms in elderly people / I Haimov, M. Laudon, N. Zisapel [et al] // Br. Med. J. — 1994. — Vol. 309. — P. 167. 30.Sleep inducing effects of low doses of melatonin ingested in the evening / I. Zhdanova, R. J. Wurtman, H.J., Lynch [et al] // Clin. Pharmacol. Ther. — 1995. — Vol. 57. — P. 552–558. 31.6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55–80-year-old insomniacs / K. Lushington, L Lack, D. J. Kennaway, Rogers [et al] // Sleep Res. — 1998. — № 7. — P. 75–83. 32.The effect of chronic, small doses of melatonin given in the late afternoon on fatigue in man: a preliminary study / J. Arendt, A. A. Borbely, C. Franey, J. Wright // Neurosci. Lett. — 1984. — Vol. 45. — P. 317–321. 33.The Efficacy and Safety of Exogenous Melatonin for Primary Sleep Disorders. A MetaAnalysis /N. Buscemi, B. Vandermeer // Gen Intern Med. — 2005. — Vol. 20. — P.1151–1158. 24.N a v e R . , P e l e d R . , L a v i e P . M e l a t o nin improves evening napping // Euro. J. Pharm. —1995. — Vol. 275. — P. 213–216. 34.The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55–80 years // K. Lushington, D. Dawson, D. J. Kennaway, L. J. Lack // Sleep Res. — 1999. — № 8. — P. 57–64. 25.Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia / G. Hajak, A. Rodenbeck, J. Staedt [et al] // Pineal Res. — 1995. — Vol. 19. — P. 116–122. 35. Treatment of primary insomnia with melatonin: a double-blind, placebo-controlled, crossover study / G. Luis., M. Almeida, P. Marta [et al] // J. Psychiatry Neurosci. — 2003. — Vol. 28. — P.191–196. 15.James S. P., Sack R. L., Rosenthal N. E. Melatonin administration in insomnia // Neuropsychopharmacology. — 1990. — № 3. — P.19–23. 26.Reid K., van den Heuvel C., Dawson D. Daytime melatonin administration: Effects on core temperature and sleep onset latency // J. Sleep Res. — 1996. — № 5. — P. 1–5. 36.Treatment with adrenoceptor blockers reduces plasma melatonin concentration / P. J. Cowen, J. S. Bevan, B. Gosden, S. A. Elliot // J. Clin. Pharmacol. —1985. — Vol.19. — P. 258–260. 16.Johns M. W. A new method for measuring daytime sleepiness: the Epworth sleepiness scale // J. Sleep. — 1991. — Vol.14. — P.540–5455. 27.Rechtschaffen A., Kales A. A manual of standardized terminology, techniques and scoring system for sleep stages of human 37.Zigmond A. S., Snaith R. P. The Hospital Anxiety and Depression scale // Acta Psychiatr. Scand. — 1983. — Vol. 67. — P. 361–370. 13. Hughes R. J., Sack R. L., Lewy A. J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. — 1998. — Vol.21. — P.52–68. Пресс-релиз 14. Improvement of sleep quality in elderly people by controlled release melatonin / D. Garfinkel, M. Laudon, D. Nof, N. Zisapel // Lancet. — 1995. — Vol. 346. — P. 541–544. Всероссийское общество гемофилии радо проинформировать средства массовой информации о прибытии в Россию Криса Бомбардье. Крис Бомбардье — 27-летний американский альпинист, путеше‑ ственник и общественный деятель. Он входит в совет директоров меж‑ дународной благотворительной организации, помогающей больным гемофилией «Спаси одну жизнь» (Save One Life). В частности, он помог организовать лабораторию для исследования свертывающей системы крови и гематологический центр в Кении. При этом он сам страдает тяжелой формой гемофилии. В течение двух последних лет Крис начал осуществлять задачу по покорению высочайших вершин шести частей света. Если это 68 ему удастся, он станет первым больным гемофилией, совершив‑ шим подобное. Ему уже покорились Аконкагуа в Южной Америке и Килиманджаро в Африке. Своими достижениями он надеется привлечь интерес меж‑ дународной общественности к проблемам лечения гемофилии и заработать средства для своего фонда. Благодаря современным препаратам для лечения гемофилии пациенты с данным заболеванием могут вести активный образ жизни, это относится и к российским больным гемофилией. Так, в 2008 году группа подростков, страдающих тяжелой формой гемофилии, также совершила восхождение на Эльбрус. Руководитель информационного отдела Всероссийского общества гемофилии А. А. Егоренков Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 69 Основные преимущества использования вакуумных систем для взятия крови В. С. Лынёв 1, к. б. н., советник РАЕН, зав. клинико-диагностической лабораторией Ю. С. Косарева 2, зав. клинико-диагностической лабораторией 1 2 ГБУЗ «Городская клиническая больница № 71» департамента здравоохранения г. Москвы МУЗ «Клиническая больница № 7», г. Ярославль Резюме Проведена экономическая оценка целесообразности использования закрытых вакуумных систем для взятия венозной крови с учетом доли некачественных образцов и наиболее распространенных причин их получения. Исследование проведено по данным клинико-диагностических лабораторий, использующих различные способы взятия венозной крови. Анализ экономической составляющей бюджета лечебных учреждений при применении открытых систем для взятия крови и закрытых вакуумных систем был проведен с использованием программы Cost Calculator компании Frost & Sullivan по четырем аспектам: оплата труда персонала, стоимость реагентов и расходных материалов, стоимость лабораторных ошибок, затраты на обслуживание и ремонт анализаторов. Расчеты показали, что использование закрытых вакуумных систем не только не повышает, но, наоборот, снижает расходы стационаров с учетом общей стоимости лабораторных тестов, а не только прямых расходов на закупку систем для взятия крови. Ключевые слова: взятие крови, закрытая вакуумная система, клинико-диагностическая лаборатория, экономическая эффективность, расходные материалы, лабораторные тесты, преаналитические ошибки. В. С. Лынёв Summary Article describes an economic assessment of the feasibility using an enclosed vacuum system for thevenous blood draw by the proportion of low-quality samples, and the most common causes of their receipt. The study was conducted according to the clinical diagnostic laboratories, using different ways of taking venous blood. Analysis of economic component of the budget of medical institutions in the application of open systems for blood and closed vacuum systems was conducted with the using the program Cost Calculator company Frost & Sullivan in four areas: staff salaries, the cost of reagents and consumables, cost of laboratory errors, maintenance costs and repair analyzers. Calculations showed that the use of closed vacuum system is not only increases, but, on the conversely, reduces hospital costs, taking into account the total cost of laboratory tests, not only the direct cost of procurement systems for the blood draw. Key words: blood samples, closed vacuum system, clinical diagnostic laboratory, cost-effectiveness, supplies, laboratory tests, pre-analytical errors. С овременная клиническая лабораторная диагностика характеризуется увеличением количества проводимых анализов, усложнением методов исследований и автоматизацией лабораторного процесса в целом. При этом практически все методики исследований выполняются на принципах микроанализа с использованием минимального количества биологического материала. При такой организации работы качество взятой пробы имеет решающее значение для получения точных и воспроизводимых результатов лабораторных тестов. Преаналитический этап остается наиболее уязвимым звеном лабораторного процесса, с которым зарубежные источники связывают до 68 % всех лабораторных ошибок [1]. Это связано как со способом взятия крови, так и с уровнем профессиональной подготовки медицинского персонала, принимающего в нем участие. 70 В настоящее время в мировой практике наибольшее распространение получил закрытый способ взятия крови при помощи вакуумных систем (ВС), который на сегодняшний день, придя на смену открытому способу, стал «золотым стандартом» во всем мире. Все еще широко используемый в России и других странах мира открытый способ взятия крови с помощью иглы, шприца и многоразовой пробирки приводит к целому ряду сложностей. К ним относятся: тромбирование крови в игле; гемолиз, вызванный двукратным прохождением крови через иглу шприца; неточное соотношением кровь/реагент и отсутствие возможности получения качественных образцов с учетом централизации лабораторий и необходимости транспортировки проб крови. При необходимости взятия крови у пациента в несколько пробирок для разных видов лабораторных Медицинский алфавит. Современная лаборатория 3 / 2013 тестов также увеличивается и время, затрачиваемое на процедуру взятия крови. Помимо этого, открытый способ взятия крови сопровождается наибольшим риском контакта медицинского персонала с кровью пациента и, следовательно, приводит к значительному увеличению риска распространения гемоконтактных инфекций. Эти и многие другие проблемы преаналитического этапа решаются при использовании закрытых ВС. Данный способ взятия крови используется в мировой лабораторной практике с середины прошлого века, однако в России, несмотря на существующие рекомендации и нормативные документы по использованию закрытого способа взятия крови с помощью вакуумных пробирок [2–9], не применяется повсеместно по причине существующего ошибочного мнения руководителей ЛПУ о высокой стоимости одноразовых ВС. e-mail: medalfavit@mail.ru Материалы и методы С целью исследования качества пробоподготовки, а также экономической эффективности при использовании ВС для взятия крови нами был проведен анализ наиболее часто встречающихся причин выбраковки образцов, оценены финансовые потери на преаналитическом этапе, учтено влияние использования открытого и закрытого способов взятия крови на качество проб крови и длительность лабораторного процесса. Анализ проведен на основании результатов работы двух клинико-диагностических лабораторий (КДЛ): ГКБ № 71 (Москва) и КБ № 7 (Ярославль). Данные сопоставлялись с результатами, полученными в аналогичном исследовании, проведенном на базе 50 клинико-диагностических лабораторий в Индии [10, 16]. КДЛ ГКБ № 71 г. Москвы проводит обследование пациентов, находящихся на лечении в стационаре, городской поликлинике и филиале больницы (ранее именуемом МСЧ № 58). Данная больница несколько лет назад перешла на использование закрытой вакуумной системы BD Vacutainer® (Becton Dickinson, США) с открытого способа взятия крови с использованием игл, шприцов и многоразовых пробирок. За сутки в лабораторию ГКБ № 71 поступает более тысячи образцов крови и проводится более трех тысяч диагностических тестов. В КДЛ организован пункт приема биоматериала, в котором регистраторы и фельдшеры-лаборанты выявляют преаналитические ошибки, проводят выбраковку некачественных образцов. КДЛ КБ № 7 г. Ярославля использует открытый способ взятия крови с использованием игл, шприцов и многоразовых пробирок. За сутки лаборатория КБ № 7 анализирует около 300 образцов крови и осуществляет около 500 лабораторных тестов. И с с л ед о ва н и е п р о вод и л о с ь в период с мая по август 2013 года. В ГКБ № 71 (Москва) данные сопоставлялись до и после перехода на закрытые ВС; тогда как по КБ № 7 e-mail: medalfavit@mail.ru (Ярославль) представлено сравнение данных по взятию крови закрытым способом (в настоящее время) с перспективным прогнозом на использование закрытых ВС (в будущем). Для обработки и оценки полученных данных в работе использована программа Cost Calculator компании Frost & Sullivan [10]. Международная консалтинговая компания Frost & Sullivan уже более 40 лет занимается всесторонней экспертизой рынка, используя и внедряя различные инновационные стратегии. Оценка экономической эффективности (Cost Calculator) проводилась с учетом расходов на закупку материалов, оплаты труда персонала, стоимости преаналитических ошибок, сервисного обслуживания и затрат на ремонт анализаторов. Рисунок 1. Доля некачественных образцов. Результаты Преаналитический и медицинский анализ использования закрытых ВС Среди проанализированных образцов крови в ГКБ № 71, взятых с использованием шприца и иглы в пластиковые пробирки, было выявлено 2,90 % некачественных проб. В то же время при взятии образцов крови с использованием закрытых ВС обнаружено всего 0,27 % некачественных проб (рис. 1). В индийском исследовании были получены более высокие результаты по количеству некачественных образцов как при использовании открытого способа взятия крови, так и при использовании закрытых ВС [9], что может быть связано с недостаточным качеством работы персонала индийских клинических подразделений (процедурных сестер). Однако в обоих случаях использование закрытых ВС позволило снизить количество ошибок в 10,7 (по данным ГКБ № 71) и в 5,3 раза (по данным индийских коллег) по сравнению с использованием шприца, иглы и пластиковых пробирок. Для конкретизации ошибок преаналитического этапа был проведен анализ наиболее типичных причин выбраковки проб. Самой распространенной причиной отклонения Рисунок 2. Наиболее распространенные причины выбраковки некачественных образцов. пробы от исследования является гемолиз (рис. 2). Так, количество гемолизированных образцов крови, доставленных в КДЛ ГКБ № 71, составило 1,91 %. Это на 0,9 % больше, чем сумма всех остальных выбракованных образцов. Второй по значимости причиной отклонения пробы от тестирования был недостаточный объем доставленного материала или нарушение соотношения кровь/ антикоагулянт (0,69 %). 0,28 % доставленных в лабораторию образцов были разлиты в процессе транспортировки, а 0,04 % проб имели нити фибрина. В КДЛ Индии отмечается та же динамика, однако количество некачественных образцов существенно выше [16], чем в ГКБ № 71. Разница заключается в меньшей потере количества пробирок на разлив крови в Индии, чем в России, но большим количеством образцов, содержащих фибриновые нити и сгустки (рис. 2). Больший показатель в «разливе крови» связан в нашем случае Медицинский алфавит. Современная лаборатория 3 / 2013 71 Рисунок 3. Частота выбраковки гемолизиро‑ ванных образцов при использовании различ‑ ных способов взятия крови. Рисунок 4. Частота выявления образцов с не‑ достаточным объемом крови или нарушени‑ ем соотношения кровь/реагент при исполь‑ зовании различных способов взятия крови. Рисунок 5. Частота потерь / разливов образ‑ цов при использовании различных способов взятия крови. с необходимостью транспортировки материала в лабораторию из различных отделений (больница имеет девять корпусов), филиалов, а также от участковых врачей. Выявлена связь частоты выбраковки образцов в зависимости от способа взятия крови. Так, при взятии крови шприцем в пласти72 ковые пробирки гемолиз выявлялся наиболее часто, по сравнению с использованием закрытых ВС, как в Индии, так и в России (рис. 3). Подобная динамика объясняется повреждением клеток крови, возникающим вследствие тромбирования крови в игле, и гемолизом, вызванным двукратным прохождением крови через иглу. Использование гемолизированной пробы недопустимо не только с медицинской и аналитической точек зрения, но и с точки зрения экономической эффективности. Выраженный гемолиз является причиной отклонения проб для выполнения анализа либо получения недостоверных результатов лабораторных тестов. Неправильные результаты лабораторных исследований могут явиться причиной ошибочного диагноза и нанести вред здоровью пациента. Повторное же взятие крови, как правило, задерживает обследование пациента на один день и приводит к несвоевременному выставлению диагноза, дополнительным затратам на расходные материалы, на госпитализацию, а иногда и вовсе оказывается невозможным. Как было описано выше, второй по значимости причиной выбраковки образцов как в России, так и в Индии, является недостаточный объем пробы или нарушение соотношения кровь/реагент. При использовании открытых способов взятия крови реагенты добавляются вручную. Учитывая погрешности в количестве реагента и в объеме забираемой крови при использовании открытых методик взятия крови, получаем разницу в качестве проб до 0,5 % в сравнении с вакуумными пробирками с дозированным уровнем вакуума и точным количеством реагента. Данный показатель в Индии составляет разницу в 1,7 % (рис. 4). Немаловажную роль при этом играет фактор равномерного перемешивания крови, в результате нарушения которого также образуются сгустки и фибриновые нити. Переход на использование вакуумных пробирок в ГКБ № 71 позволил снизить количество некачественных образцов в 2,6 раза (c 2 194 Медицинский алфавит. Современная лаборатория 3 / 2013 до 608 образцов за год) по сравнению с использованием шприца, иглы и пластиковых пробирок. В индийском исследовании использование закрытых ВС снизило число выявленных некачественных образцов в 4,5 раза (рис. 4). Применение закрытых ВС в ГКБ № 71 позволило свести к нулю частоту образования нитей фибрина по сравнению с использованием шприца, иглы и пластиковых пробирок. В индийском исследовании также не выявлено образцов, содержащих фибрин, при взятии крови с помощью закрытых ВС. Это связано с тем, что процедура взятия крови с использованием закрытых ВС стандартизована, кровь в момент попадания в пробирку сразу же перемешивается с реагентом. При взятии же крови шприцем в пластиковые пробирки с антикоагулянтом большое влияние оказывает «человеческий фактор», связанный с работой процедурных сестер и пониманием ими важности соблюдения регламента процедуры. Как и в случае соблюдения правильного соотношения и добавления необходимого объема крови в пробирку, процедурные сестры не всегда успевают или вовсе забывают перемешать содержимое пробирки, что свидетельствует о том, что они недооценивают связанные с этим последствия. На следующем этапе исследования оценивалось количество разлившихся образцов (рис. 5). Причиной потери образцов или разлива проб может являться необходимость их транспортировки в лабораторию из удаленных пунктов взятия крови. При использовании шприца количество потерь таких пробирок от общего числа в ГКБ № 71 составляло 0,24 %, при этом в индийских КДЛ этот показатель оказался в два раза выше. Переход на использование ВС позволил снизить этот показатель в ГКБ № 71 до 0,04 % и до 0,1 % в Индии. Поскольку основная часть лабораторных исследований в КДЛ ГКБ № 71 проводится на автоматических анализаторах, в качестве носителя материала используются первичные e-mail: medalfavit@mail.ru вакуумные пробирки, под которые заранее откалиброваны приборы КДЛ. В этом случае минимизируется потребность во вторичных пробирках, снижается вероятность разлива пробы, а вероятные в дальнейшем недостоверные результаты лабораторных тестов определяются во многом преаналитическими ошибками, допускаемыми при подготовке пациента к лабораторным тестам (взятие крови после еды, после инъекций или рентгеновских исследований), либо допускаемыми в процессе взятия и транспортировки образца крови. Во всех остальных случаях использование вакуумных пробирок позволяет значительно сократить время от момента постановки реакции до получения результата. Использование открытого способа взятия крови, помимо увеличения времени подготовки перед постановкой в анализатор, приводило к увеличению ошибок за счет дополнительных манипуляций, связанных с использованием специальных пробирок для данного типа анализатора. Преимущественно недостоверные результаты отмечались в отношении общеклинических исследований крови (гематология), где, помимо всего вышеперечисленного, сказывался фактор разрушения форменных элементов крови за счет использования шприца. Немаловажным также является факт, что при переходе на использование закрытых ВС для взятия крови сводятся на нет потери крови при аликвотировании (при использовании плашечных методик), риск контаминации образцов, а также попадание крови на рабочую поверхность, руки сотрудника, загрязнение частей анализатора. Современная вакуумная система для взятия крови в сочетании с современным оборудованием позволяет также уменьшить объем кровопотери, связанный с взятием крови на анализы (особенно это важно у реанимационных больных). Так, в ГКБ № 71 при использовании анализатора Metrolab 2300 (биохимический анализатор, использующий для образцов пробирки типа эппендорф; UV–VIS Metrolab S. A., e-mail: medalfavit@mail.ru Аргентина), необходимо 2–100 мкл сыворотки (среднее количество 51 мкл) на один тест. При использовании анализатора того же типа Xpand (Siemens, Германия; использует пробирки BD Vacutainer ®) требуется 3–50 мкл сыворотки соответственно (среднее количество 26,5 мкл). Учитывая «мертвый объем» в размере 500 мкл, а также объем полученной сыворотки из пробирки на 8 мл (в среднем 4,0 мл = 4 000 мкл), количество возможных тестов на анализаторе Metrolab 2300 составляет 68, на анализаторе Xpand — 132 теста. Поскольку такое количество тестов пациенту одномоментно не назначается, то возможно использование одной и той же вакуумной пробирки и для других видов исследований (например, тесты на инфекции, гормоны, онкомаркеры и пр.). При использовании полуавтоматических анализаторов или ручных методик объемы исследуемого материала (крови) больше, как и используемых для этих целей реагентов. Количество различных ошибок также при этом также увеличивается. При отсутствии необходимости одновременного назначения различных видов исследований или небольшого количества одноименных (например, биохимическое исследование крови), возможно подобрать соответствующие объемы закрытых вакуумных пробирок, что также приведет к снижению затрат на расходные материалы. Кроме оценки зависимости числа преаналитических ошибок от систем взятия крови, исследовалась эффективность рабочего процесса при использовании вакуумных закрытых и открытых систем. Оценивалось время, затрачиваемое персоналом лаборатории на полную обработку 50 образцов крови, с момента получения проб в лаборатории до выдачи результатов в отделение. Установлено, что время, необходимое для проведения исследования в случае использования открытых систем, составило 390 минут (6,5 часов), а при использовании ВС — 240 минут (4 часа), что на 2,5 часа меньше. При использовании ВС технологический процесс более эффективен за счет сокращения общего количества этапов при взятии крови. Кроме того, при использовании закрытых ВС для проведения анализа возможно использование первичных пробирок, не требуется переливать пробы. Число этапов пробоподготовки уменьшается, исключается вероятность возникновения ошибок при обработке образца. Персонал, ранее занимавшийся пробоподготовкой, выполняет другие функции, что обеспечивает ускорение рабочего процесса и способствует более быстрой выдаче результатов исследований в клинические отделения. Отмечено значительное снижение числа поломок анализатора с четырех при использовании открытых систем до одной в год при использовании вакуумных систем. Установлено, что образцы, содержащие сгустки или нити фибрина, приводят к более частым поломкам аналитических систем. В большинстве случаев остановка работы анализатора может привести к отсроченному выполнению серии образцов, вызову инженерной службы и ремонту прибора. При невозможности своевременного исследования серии образцов повторяется взятие крови; при получении некачественных результатов повторяется их исследование. Все это сопровождается дополнительными расходами, повышая таким образом затраты и увеличивая срок выполнения работы. Сервисное обслуживание автоматических анализаторов — одна из самых затратных статей расходов лаборатории, особенно когда речь идет о замене каких-либо составных частей. Не всегда быстро находятся деньги на ремонт, либо необходимые запасные части отсутствуют в наличие. В результате исправное дублирующее оборудование (если оно есть) используется с повышенной нагрузкой, что в свою очередь ведет к дополнительным сервисным затратам. Обеспечение безопасности при работе с ВС Важной проблемой медицинских лечебных учреждений являются затраты, связанные с ненадлежащим Медицинский алфавит. Современная лаборатория 3 / 2013 73 Таблица 1 Анализ экономической целесообразности использования ВС (по данным расчетов Cost Calculator Frost & Sullivan в ГКБ № 71, Москва и КБ № 7, Ярославль) ГКБ № 71, Москва Расходы при использовании открытых систем, руб. Расходы при использовании закрытых ВС, руб. 22 068 714 20 734 474 Оплата труда персонала 5 110 560 3 470 688 Реагенты и расходные материалы 11 408 838 12 826 045 Преаналитические ошибки 144 079 22 350 Ремонт и обслуживание оборудования 5 405 237 4 415 390 Расходы при использовании открытых систем, руб. Прогнозируемые расходы при использовании закрытых ВС, руб. 3 469 800 3 294 538 Оплата труда персонала 596 544 336 960 Реагенты и расходные материалы 2 100 384 2 550 600 Преаналитические ошибки 49 007 6 978 Ремонт и обслуживание оборудования 723 865 400 000 КБ № 7, Ярославль обеспечением безопасности пациентов и медицинского персонала. Риск укола иглой, разбрызгивания и разлития крови при использовании открытых систем взятия крови значительно возрастает, и, следовательно, возрастает потенциальная возможность инфицирования. Подобные риски можно существенно снизить, применяя закрытые ВС в сочетании с безопасными иглами, сократив риск укола иглой, по некоторым данным, до нуля [11–13]. Использование высококачественных игл с ВС также повышает комфорт пациентов, что согласуется с передовой практикой взятия крови, методика которой подробно описана в рекомендациях ВОЗ и других зарубежных и отечественных нормативных и справочных материалах [4–8, 14–15]. В сочетании с безопасностью пациентов и персонала немаловажным положительным фактором является также технологичность и эстетика процедуры взятия крови при использовании закрытых ВС. Процедурные сестры удовлетворены результатами своего труда, меньше беспокоятся о возможности заражения гемоконтактными инфекциями, вследствие чего снижается текучесть кадров среднего медицинского персонала. 74 Экономический анализ использования закрытых ВС Анализ экономической составляющей бюджета лечебных учреждений при применении открытых систем для взятия крови и закрытых ВС был проведен с использованием программы Cost Calculator Frost & Sullivan. После определения частоты возникновения различных ошибок преналитического этапа оценивались расходы по четырем аспектам: оплата труда персонала, стоимость реагентов и расходных материалов, стоимость лабораторных ошибок, затраты на обслуживание и ремонт анализаторов. В табл. 1 представлены данные по каждой из статей расходов для двух типов стационаров. Расчеты показали, что использование закрытых ВС не только не повышает, но, наоборот, снижает расходы стационаров, правда только в том случае, если оценивается общая стоимость лабораторных тестов, а не только прямые расходы на закупку систем для взятия крови. Затраты на реагенты и расходные материалы — единственная увеличивающаяся статья расходов при переходе на использование вакуумных систем для взятия крови. Остальные составляющие стоимости лабораторных исследо- Медицинский алфавит. Современная лаборатория 3 / 2013 ваний — оплата труда персонала, затраты на исправление ошибок преаналитического этапа (повторное взятие и тестирование образцов), затраты на ремонт и обслуживание оборудования существенно снижаются. В результате затраты на лабораторные исследования в КДЛ ГКБ № 71 снизились на 6,1 %, в КБ № 7 Ярославля переход на использование закрытых ВС может привести к сокращению этих расходов на 5,1 %. Выводы Проведенный анализ использования открытого и закрытого способа взятия крови для лабораторных исследований в ГКБ № 71 (Москва) выявил существенное снижение числа преаналитических ошибок при переходе на закрытые ВС. Это позволило стандартизировать процедуру взятия крови в больнице, обеспечить возможность транспортировки, хранения, центрифугирования и анализа пробы в первичной пробирке, а также значительно снизить риск возникновения случайных уколов иглами и распространения гемоконтактных инфекций среди медицинских сестер. Проведенный анализ экономической составляющей бюджета ГКБ № 71 с использованием программы Cost Calculator Frost & Sullivan продемонстрировал, что использование закрытых ВС не только не увеличило, но, наоборот, снизило расходы больницы на проведение лабораторных исследований на 6,1 %. Это обусловлено сокращением количества лабораторных ошибок и, соответственно, повторных анализов, производимых из-за некачественного взятия крови, снижением затрат на покупку, мойку и стерилизацию дополнительных вторичных пробирок, а также снижением расходов на ремонт и внеплановое обслуживание центрифуг и анализаторов. Немаловажным при переходе на закрытые ВС также является двухкратное снижение объемов взятия крови для проведения лабораторных исследований. Кроме того, использование закрытой ВС делает e-mail: medalfavit@mail.ru процедуру взятия крови безопасной и удобной для медицинских сестер, комфортной для пациентов и формирует у них впечатление о лечебно-диагностическом учреждении, как об учреждении, использующем передовые методики обследования и лечения, то есть повышает престиж лечебного учреждения в целом. Список литературы и нормативных документов 1. M. Plebani and P. Carraro. Mistakes in a stat laboratory: types and frequency. Clinical Chemistry 43: 1348–1351 (1997). 2. ГОСТ Р 53079.4–2008. Национальный стандарт Российской Федерации. Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа. Утвержден и введен в действие Приказом Ростехрегулирования от 18 декабря 2008 г. № 554-ст. 3. ГОСТ Р ИСО 6710–2009. Национальный стандарт Российской Федерации. Контейнеры для сбора образцов венозной крови одноразовые. Утвержден и введен в действие Приказом Федерального агентства по техническому регулированию и метрологии от 3 июля 2009 г. № 232-ст. e-mail: medalfavit@mail.ru 4. СанПиН 2.1.7.2790–10 Санитарно-эпидемиологические требования к обращению с медицинскими отходами от 9 декабря 2010 г. № 163. 5. Правила и методы исследований и правила отбора образцов донорской крови, необходимые для применения и исполнения технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии. Постановление правительства РФ от 31.12.2010 № 1230. 6. Кишкун А. А., Гильманов А. Ж., Долгих Т. И., Грищенко Д. А., Скороходова Т. Г. Организация преаналитического этапа при централизации лабораторных исследований. Методические рекомендации. М.:2012. — 74 с. 7. Д о л г о в В . В . , Л у г о в с к а я С . А . , П о чтарь М. Е. Применение вакуумных систем BD Vacutainer® для лабораторного анализа. Методические рекомендации. М: Российская Медицинская Академия последипломного образования. — 2007. — 79 с. 8. CLSI (formerly NCCLS): Procedures for the collection of diagnostic blood specimens by venipuncture; Approved Standard — Sixth Edition. CLSI document H3-A6 (ISBN 1–56238– 650–6). Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087–1898 USA, 2007. 9. CLSI (formerly NCCLS): Tubes and Additives for Venous and Capillary Blood Specimen Collection; Approved Standard — Sixth Edition. CLSI document H01-A6 (ISBN 1–56238–740–5). Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087– 1898 USA, 2010. 10. Frost and Sullivan. Efficiency, Economics and Accuracy. Comparison of Different Blood Collection Systems Used in Laboratories. VS8080-G, 2009. 11. Hotaling M. A retractable winged steel (butterfly) needle performance improvement project. Jt. Comm. J. Qual. Patient Saf 2009;35:100–105. 12. Needlestick Injury Rates According to Different Types of Safety-Engineered Devices: Results of a French Multicenter Study. Infection control and hospital epidemiology 2010; 31:402–407. 13.Gauthier-David F., Miège C. Safety devices and training. The Experience of Annecy RGH in the prevention of NSIs. Proceedings of 20th Annual GERES Day, 2010. 14.WHO guidelines on drawing blood: best practices in phlebotomy. (ISBN 978–92– 4–159922–1) © World Health Organization 2010. 15. NIOSH Alert: Preventing Needlestick Injuries in Health Care Settings (NIOSH) Publication No. 2000–108. 16.Tester F. Ashavaid, Sucheta P. Dandekar, Bhamini Keny and Vishaal R. Bhambhwani. Influence of blood specimen collection method on various preanalytical sample quality indicators. Indian Journal of Clinical Biochemistry, 2008 / 23 (2) 144–149. Медицинский алфавит. Современная лаборатория 3 / 2013 75 Оборудование ЗАО «КРОНТ-М» для лабораторий ЗАО «КРОНТ-М» является ведущим производителем медицинского оборудования на территории Российской Федерации — уже более 20 лет на рынке медицинской техники. Все оборудование зарегистрировано на территории РФ, имеет сертификаты соответствия. Основным направлением деятельности предприятия является разработка и производство медицинского оборудования, и в первую очередь оборудования, направленного на борьбу с внутрибольничной инфекцией — актуальнейшей проблемой здравоохранения. География поставок предприятия обширна — от небольших больниц Крайнего Севера и Дальнего Востока до ведущих столичных клиник (институт им. Н. В. Склифосовского, госпиталь им. Н. Н. Бурденко, НИИ нейрохирургии им. акад. Н. Н. Бурденко, больница им. С. П. Боткина, НЦ сердечно-сосудистой хирургии РАМН и т. д.). Большой опыт работы позволяет предприятию выпускать целые комплексы оборудования для операционных блоков, эндоскопических кабинетов, процедурных кабинетов, родильных домов. Предприятие также выпускает оборудование, предназначенное для лабораторий. В любом помещении ЛПУ очень важным моментом для медицинского персонала является качества воздушной среды. В воздухе присутствуют микроорганизмы — источники заболеваний, передающиеся воздушно-капельным путем, а также пыль, которая является переносчиком различных микроорганизмов, и токсичные примеси химической природы (моющие, дезинфицирующие, стерилизующие средства, антибиотики, витамины, растворители, оксиды углерода СО и СО2 и азота NO2, альдегиды, спирты и т. п.). Для уничтожения вирусов, бактерий в медицинской практике уже много лет используются ультрафиолетовые облучатели — рециркуляторы воздуха для обеззараживания в присутствии людей. ЗАО «КРОНТ-М» является производителем рециркуляторов ОРУБ-«КРОНТ» (торговая марка «ДЕЗАР») с фильтрацией воздушного потока от частиц размером более 10 мкм (пыль, пыльца, аэрозоли лекарственных препаратов и т. д.). Рециркуляторы «ДЕЗАР» используются практически во всех ЛПУ России и зарекомендовали себя только с положительной стороны. В 2012 году наше предприятие завершило исследования, запатентовало и начало серийный выпуск модернизированный рециркуляторов «ДЕЗАР» с дополнительной функцией очистки воздуха от токсичных примесей химической природы. Фильтрация и очистка воздуха осуществляются при помощи легкосъемного фильтровального блока со сменными фильтрами, устанавливаемого на корпус рециркулятора посредством упругих защелок-фиксаторов без применения какого-либо инструмента. Сменные фильтры устанавливаются в защитную решетку рециркулятора посредством самофиксирующейся решетки-фильтродержателя. Для смены фильтры не требуется применения никакого инструмента. 76 Для фильтрации воздушного потока используется фильтр воздушный ФВС-«КРОНТ», для очистки воздуха от токсичных примесей — фильтр угольный ФВС-«КРОНТ» (характеристики фильтров подтверждены испытания, проведенными при получении сертификата соответствия № РОСС RU.АВ59.Н01093). Фильтр воздушный — нетканый синтетический фильтрующий материал класса G2 по ГОСТ Р 51251 «Фильтры очистки воздуха» российского производства. Фильтр угольный — комбинированный (трехслойный) композиционный материал, состоящий из активированного угленаполненного поглощающего волокна, армированного с двух сторон нетканым полотном, состоящим из полиэфирных неломающихся волокон. К достоинствам модернизированных рециркуляторов «ДЕЗАР» относятся: • надежность; • одновременное обеззараживание, фильтрация или очистка воздуха от вредных токсичных примесей химической природы; • возможность замены сменных фильтров медицинским персоналом; • повышенный класс электробезопасности; • малое потребление электроэнергии за счет применения электронного блока питания; • бесшумность работы; • простота проведения технического обслуживания и профилактических работ. ЗАО «КРОНТ-М» для лабораторной практики выпускает универсальный штатив для пробирок ШПУ-«КРОНТ» и укладки для транспортировки проб биологического материала в пробирках и флаконах УКП-01-«КРОНТ». Штатив ШПУ-«КРОНТ» рассчитан на размещение практически всех типов пробирок, используемых в лабораторной практике, отечественного и импортного производства, таких как пробирки ø 13 ÷ 17 мм и h = 75–170 мм, к которым относятся: цилиндрические, конические (в том числе центрифужные), моноветы, вакуумные; а также микропробирки ø 8 ÷ 11 мм и h = 40 мм, в том числе пробирки для иммунохемилюминесцентных биохимических анализаторов. Универсальность штатива достигнута за счет комбинированных отверстий на верхнем и среднем ярусах. Отверстия имеют форму восьмерок, образованных из двух отверстий различного диаметра 18 и 11,2 мм. Отверстия сориентированы таким образом, что при стандартных габаритных размерах штатива в нём можно разместить одновременно не только 50 пробирок того или иного типоразмера, но и до 100 пробирок двух различных типоразмеров в комбинации 50 + 50, что значительно уменьшает занимаемое штативами место на лабораторном столе. Эта конструктивная особенность штатива дает возможность размещать образцы крови от одного пациента в одном комбинированном отверстии в двух пробирках для проведения исследований различными методами. Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru Образец технического задания на ультрафиолетовые бактерицидные облучатели — рециркуляторы ОРУБ-3–3-«КРОНТ» и ОРУБ-3–5-«КРОНТ» Модель (наименование) Дезар-3, настенный (ОРУБн-3–3-«КРОНТ») Дезар-5, настенный (ОРУБн-3–5-«КРОНТ») Дезар-4, передвижной (ОРУБп-3–3-«КРОНТ») Дезар-7, передвижной (ОРУБп-3–5-«КРОНТ») Категория помещений II–V категории I–V категории Бактерицидная эффективность,% 99,0 99,9 Производительность, м 3/час 100 100 Требование к безопасности Электробезопасность в соответствии с требованиями ГОСТ Р 50267.0–92 для изделий класса II с двойной изоляцией. Повышенная безопасность персонала, не требующая соединения изделия с защитным заземляющим проводом стационарной проводки Фильтрация воздушного потока Частицы размером более 10 мкм: оседающая пыль, пыльца, споры растений, плесень, высохшие дезсредсва, аэрозоли, сажа. Комплект сменных воздушных фильтров для фильтровального блока:12 штук Очистка воздушного потока от токсичных примесей химической природы Анестезирующие газы, антибиотики, пары кислот и щелочей, моющие, дезинфицирующие и стерилизующие средства, аммиак, гормональные средства, формальдегиды, фенолы, оксиды углерода (СО), азота (NO), растворители (толуол, ксилол), спирты, альдегиды и другое Комплект сменных комбинированных угольных фильтров для фильтровального блока: 3 штуки Процедура замены сменных фильтров Сменные фильтры устанавливаются в фильтровальном блоке, закрепленном на корпусе изделия посредством упругих самофиксирующихся защелок Замена сменных фильтров производится медицинским персоналом без применения какого-либо инструмента. Санитарная обработка защитных воздушных решеток Дезинфекция воздушных решеток методом погружения в дезинфицирующий раствор или протирания. Снятие и установка защитных воздушных решеток производится медицинским персоналом без применения какого-либо инструмента (на защелках) Пуско-регулирующий аппарат Наличие блока питания с электронным ПРА с коррекцией коэффициента мощности, снижающего потребление электроэнергии и осуществляющего предварительный прогрев электродов УФ-ламп, обеспечивающего их «мягкий» пуск и увеличение срока службы Источник излучения (бактерицидная безозоновая ультрафиолетовая лампа) 15 × 3 15 × 5 Срок службы источников излучения 9 000 часов Фиксация отработанного времени Цифровой четырехразрядный счетчик часов работы источника излучения Усиление бактерицидной эффективности источников излучения Покрытие поверхности камеры облучения — зеркальное алюминиевое напыление с коэффициентом отражения не менее 86 % Сигнализация работоспособности Световая сигнализация работоспособности источников излучения и системы прокачки воздуха Защита от УФ-излучения 100 % предотвращение возможности выхода УФ-излучения за счет применения лабиринтных экранов и качества изготовления деталей корпуса Влажная общесанитарная обработка корпуса Выполнение корпуса изделия из ударопрочного химически стойкого пластика, допускающего санитарную обработку любыми разрешенными в РФ моющими и дезинфицирующими средствами Потребляемая электрическая мощность, Вт (ВА) 60 100 Напряжение / частота питающей электросети, В/Гц 220 ± 10 % / 50 Габаритные размеры в рабочем состоянии, мм 890 × 370 × 140 (настенные модели) 1 200 × 370 × 580 (передвижные модели) Уровень шума, Дб 40 Требование к документации по безопасной эксплуатации Наличие инструкции по применению, разработанной «ФГУН НИИ дезинфектологии» Роспотребнадзора или эквивалентного ей документа Качество Гарантийный срок: два года с даты изготовления. Срок службы пять лет Штатив изготавливается из химически стойкого ударопрочного пластика. Конструкция изделия позволяет выделить следующие преимущественные характеристики: • безопасность. Штатив имеет Z –образную форму, т. е. помимо основных верхнего и нижнего ярусов снабжен дополнительным промежуточным наклонным ярусом, связывающим всю конструкцию в жёсткое целое; • идентификация. По периметру верхнего яруса штатива имеется буквенно-числовая маркировка для обеспечения идентификации образцов в пробирках; • санитарная обработка. Цельнолитой штатив изготавливается из пластика, который позволяет выдерживать e-mail: medalfavit@mail.ru не только обработку всеми дезинфицирующими средствами, разрешенными к применению в РФ, но и стерилизацию паровым методом при температуре 121º С (автоклавирование). Универсальный штатив для пробирок ШПУ-«КРОНТ» предназначен для использования как самостоятельное изделие, так и для комплектации изделий «Укладка-контейнер полимерный для доставки проб биологического материала в пробирках и флаконах». Создание универсального штатива ШПУ-«КРОНТ» позволило предприятию провести модернизацию уже давно выпускаемых и широко известных укладок-контейнеров Медицинский алфавит. Современная лаборатория 3 / 2013 77 Образец технического задания на штатив универсальный для пробирок ШПУ-«КРОНТ» Наименование Штатив для пробирок универсальный ШПУ-01-«КРОНТ» Назначение Размещение пробирок различных типов: пробирки ø13–17 мм и h = 75–100 мм (цилиндрические, биологические, конические, моноветы, вакуумные пробирки; пробирки ø 8–11 мм и h = 40 мм (микропробирки) Конструкция Цельнолитой Z-образной формы Гнезда штатива Штатив имеет комбинированные отверстия в форме восьмерок, образованных из двух отверстий различного диаметра 18 и 11,2 мм Количество отверстий: 50 штук Безопасность Фиксация пробирок в трех уровнях Идентификация образцов биологического материала По периметру верхнего яруса штатива имеются буквенно-цифровая маркировка. Варианты использования Вариант 1: 50 пробирок ø13–17 мм и h = 75–170 мм Вариант 2: 50 пробирок ø 8–11 мм и h = 40 мм Вариант 3: 50 пробирок: 25 пробирок ø13–17 мм и h = 75–170 мм + 25 пробирок ø 8–11 мм и h = 40 мм Вариант 4: 100 пробирок: 50 пробирок ø 13–17 мм и высотой h = 75–170 мм + 50 пробирок ø 8–11 мм и высотой h = 40 мм Вкладываемость Штативы можно вкладывать друг в друга для компактного хранения Материал Ударопрочный, химически стойкий пластик, разрешенный для применения в изделиях медицинского назначения в РФ Габаритные размеры 260 × 136 × 70 мм Масса 0,25 кг Санитарная обработка Обработка паровым методом (автоклавирование) при температуре 121 ºС и любыми разрешенными в РФ моющими и дезинфицирующими средствами Качество Гарантийный срок: один год с даты продажи. Срок службы три года Образец технического задания на укладки-контейнеры для доставки проб биологического материала в пробирках и флаконах УКП-01-«КРОНТ» Наименование Модификации Укладка-контейнер для доставки проб биологического материала в пробирках и флаконах УКП-01-«КРОНТ» УКП-50-01 Назначение Конструкция Укладка представляет собой корпус с парой симметрично расположенных ручек и крышкой. Крышка фиксируется на корпусе при помощи замков. При необходимости есть возможность установить пломбу Комплектность Штатив ШПУ-01-«КРОНТ» Бокс Кассета для 2 флаконов 250 мл (банок) Варианты использования Материал Габаритные размеры (в скобках указана высота с поднятыми ручками) Масса 1 2 5 2 8 Вариант 1 — транспортировка 50 (100) пробирок Вариант 2 — 10 флаконов 250 мл (банок) Вариант 1 — транспортировка 100 (200) пробирок Вариант 2 — 16 флаконов 250 мл (банок) Составные части укладки изготавливаются из ударопрочного химически стойкого пластика. Ручки выполнены из полированной нержавеющей стали 435 × 215 × 195 (235) мм 410 × 350 × 215 (253) мм 1,35 кг 2,0 кг Санитарная обработка Обработка паровым методом (автоклавирование) при температуре 121 ºС и любыми разрешенными в РФ моющими и дезинфицирующими средствами Качество Гарантийный срок: один год с даты продажи. Срок службы три года УКП-01-«КРОНТ» и начать выпуск изделий, соответствующих всем современным требованиям, предъявляемым к медицинским изделиям, предназначенным для сбора и транспортирования биологических материалов (патент РФ). Укладки УКП-01-«КРОНТ» предназначены для транспортировки и переноса пробирок или флаконов вместимостью 250 мл (банок, емкостей для анализов) с биологическим материалом или физиологическими растворами внутри помещений и между отдельными корпусами ЛПУ или по назначению. Укладки представляют собой корпус с парой симметрично расположенных ручек с крышкой. Крышка надежно фиксируется на корпусе при помощи замков. При необходимости есть возможность установить пломбу. Ручки выполнены из нержавеющей стали. 78 УКП-100-01 Укладка предназначена для доставки проб биологического материала в пробирках, флаконах, емкостях для анализов внутри помещений и между отдельными корпусами ЛПУ или по назначению Укладки обеспечивают сохранность биологического материала от воздействия внешних факторов, а также предохраняют обслуживающий персонал от возможности инфицирования при случайном контакте с зараженным биологическим материалом. Укладки изготавливаются из пластика, который позволяет выдерживать не только обработку всеми дезинфицирующими средствами, разрешенными к применению в РФ, но и стерилизацию паровым методом при температуре 121 ºС (автоклавирование). ЗАО «КРОНТ-М» готово оказать консультации заказчикам и уполномоченным органам при подготовке технических заданий на проведение торгов по телефону 8 (495) 500-48-84 с 9:00 до 17:00 (время московское) или по электронной почте info@kront.com. Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 79 80 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 81 Подписка NEW! Заказ электронной версии журнала всего 50 рублей за номер, присылайте запрос на адрес medalfavit@mail.ru! БЛАНК-ЗАКАЗ на подписку на журнал 2013 год Название организации (или Ф.И.О.) ______________________________________________________________________________________________________ Адрес (с почтовым индексом) _________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________ Телефон:___________________________E-mail: ___________________________Контактное лицо: ________________________________________________________________ _________________________________________________________________________________________________________________________________________________________ □ «Медицинский алфавит. Стоматология» — 4 выпуска в год (1 200 руб. ) □ «Медицинский алфавит. Современная лаборатория» — 4 выпуска в год (1 000 руб. в год) Наш индекс в каталоге □ «Медицинский алфавит. Эпидемиология и гигиена» — 4 выпуска в год (1 000 руб. в год) «РОСПЕЧАТЬ» 36228 □ «Медицинский алфавит. Больница — все для ЛПУ» — 4 выпуска в год (1 000 руб. в год) □ «Медицинский алфавит. Неотложная медицина» — 4 выпуска в год (1 000 руб. в год) □ «Медицинский алфавит. Диагностическая радиология и онкотерапия» — 4 выпуска в год (1000 руб. в год) □ «Медицинский алфавит. Фармакотерапия» ― 2 выпуска в год (500 руб в год) □ «Медицинский алфавит. Кардиология» ― 2 выпуска в год (500 руб в год) □ «Медицинский алфавит. Гастроэнтерология» ― 2 выпуска в год (500 руб в год) НДС — 0 % Извещение Кассир Квитанция Кассир ООО «Альфмед» (наименование получателя платежа) 7716213348 (ИНН получателя платежа) Рс № 40702810738090108773 (номер счета получателя платежа) в Московский Банк Сбербанка России (наименование банка и банковские реквизиты) ОАО «СБЕРБАНК РОССИИ» г. МОСКВА К/с 30101810400000000225 бик 044525225 Годовая подписка на журнал «Медицинский алфавит. _______________________ _________________________________________________________» на 2013 год (наименование платежа) Дата______________ Сумма платежа_____________________ Плательщик (подпись) ________________ Адрес доставки: __________________ _____________________________________________________________________ ООО «Альфмед» (наименование получателя платежа) 7716213348 (ИНН получателя платежа) Рс № 40702810738090108773 (номер счета получателя платежа) в Московский Банк Сбербанка России (наименование банка и банковские реквизиты) ОАО «СБЕРБАНК РОССИИ» г. МОСКВА К/с 30101810400000000225 бик 044525225 Годовая подписка на журнал «Медицинский алфавит. _______________________ _________________________________________________________» на 2013 год (наименование платежа) Дата______________ Сумма платежа_____________________ Плательщик (подпись) ________________ Адрес доставки: __________________ _____________________________________________________________________ Как подписаться 1. Заполнить прилагаемый бланк-заказ и квитанцию об оплате. 2. Оплатить квитанцию. 3. Отправить бланк-заказ и квитанцию (или их копии) по почте по адресу: 129344, Москва, ул. Верхоянская, д.18 к. 2; или по факсу: (495) 616-48-00, 221-76-48, или по e-mail: medalfavit@mail.ru 82 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru e-mail: medalfavit@mail.ru Медицинский алфавит. Современная лаборатория 3 / 2013 83 84 Медицинский алфавит. Современная лаборатория 3 / 2013 e-mail: medalfavit@mail.ru