в Черноголовке РАН 23 июня 1997 г. Факс: (096) 515 3588
реклама
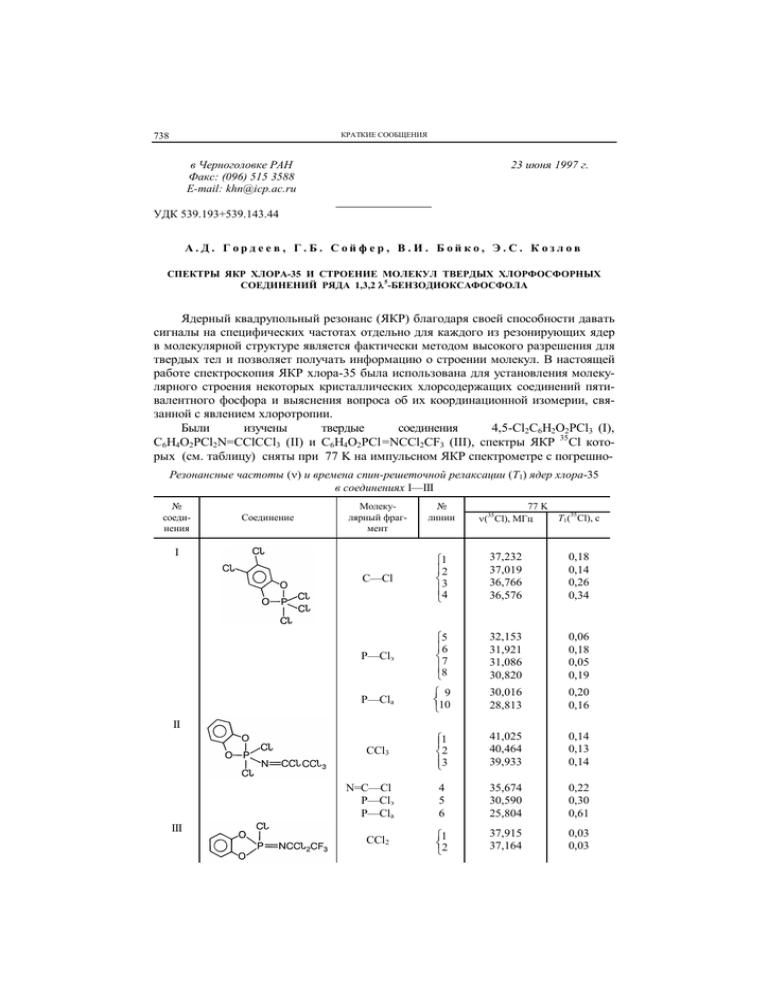
КРАТКИЕ СООБЩЕНИЯ 738 в Черноголовке РАН Факс: (096) 515 3588 E-mail: khn@icp.ac.ru 23 июня 1997 г. УДК 539.193+539.143.44 А.Д. Гордеев, Г.Б. Сойфер, В.И. Бойко, Э.С. Козлов СПЕКТРЫ ЯКР ХЛОРА-35 И СТРОЕНИЕ МОЛЕКУЛ ТВЕРДЫХ ХЛОРФОСФОРНЫХ СОЕДИНЕНИЙ РЯДА 1,3,2 5-БЕНЗОДИОКСАФОСФОЛА Ядерный квадрупольный резонанс (ЯКР) благодаря своей способности давать сигналы на специфических частотах отдельно для каждого из резонирующих ядер в молекулярной структуре является фактически методом высокого разрешения для твердых тел и позволяет получать информацию о строении молекул. В настоящей работе спектроскопия ЯКР хлора-35 была использована для установления молекулярного строения некоторых кристаллических хлорсодержащих соединений пятивалентного фосфора и выяснения вопроса об их координационной изомерии, связанной с явлением хлоротропии. Были изучены твердые соединения 4,5-Cl2C6H2O2PCl3 (I), C6H4O2PCl2N=CClCCl3 (II) и C6H4O2PCl =NCCl2CF3 (III), спектры ЯКР 35Cl которых (см. таблицу) сняты при 77 K на импульсном ЯКР спектрометре с погрешноРезонансные частоты () и времена спин-решеточной релаксации (T1) ядер хлора-35 в соединениях I—III № соединения Соединение Молекулярный фрагмент I № линии 77 K T1(35Cl), c (35Cl), МГц C—Cl 1 2 3 4 37,232 37,019 36,766 36,576 0,18 0,14 0,26 0,34 P—Clэ 5 6 7 8 32,153 31,921 31,086 30,820 0,06 0,18 0,05 0,19 P—Cla 9 10 30,016 28,813 0,20 0,16 CCl3 1 2 3 41,025 40,464 39,933 0,14 0,13 0,14 4 5 6 35,674 30,590 25,804 0,22 0,30 0,61 1 2 37,915 37,164 0,03 0,03 II N=C—Cl P—Clэ P—Cla III CCl2 КРАТКИЕ СООБЩЕНИЯ P—Cl 739 3 27,461 0,33 П р и м е ч а н и е . Clэ и Clа — атомы хлора в экваториальной и аксиальной связях пентакоординированного атома фосфора соответственно. Сопоставление спектров ЯКР 35Cl в связях P—Cl и C—Cl соединений 4,5-Cl2C6H2O2PCl3 (I), C6H4O2PCl2N=CClCCl3 (II) и C6H4O2PCl=NCCl2CF3 (III) со спектрами соединений C6H4O2PCl3 (A), 1,2,4,5-Cl4C6H2 (B), Cl2(O)PN=CClCCl3 (C) и Cl3P=NCCl2CF3 (D) (все спектры сняты при 77 K) стью измерения резонансной частоты не более 5 кГц, а времени ядерной квадрупольной спин-решеточной релаксации T1 около 10 %. Из результатов измерений, приведенных в таблице, видно как группируются линии ЯКР 35Cl в изученных соединениях. Демонстрируемое на спектрограмме (см. рисунок) сопоставление их спектров ЯКР 35Cl с известными из литературных источников ЯКР данными для соединений, взятых в качестве "опорных", позволяет сделать в кристаллах I—III отнесение резонансных частот к определенным молекулярным фрагментам и тем самым провести идентификацию строения молекул соответствующих соединений. В образце I резонансные частоты ядер хлора-35, относящихся к связям P—Cl, естественно сопоставить со спектром ЯКР 35Cl фосфорана C6H4O2PCl3 (спектр A на рисунке), в котором два более высоких по частоте резонансных сигнала относятся к атомам хлора в экваториальном положении при атоме фосфора, а один низкочастотный сигнал — к атому хлора в аксиальной позиции [ 1 ]. Двойное число линий ЯКР 35Cl соединения I по сравнению с числом атомов хлора в молекуле как для связей P—Cl, так и для C—Cl говорит о наличии двух неэквивалентных положений молекул в элементарной ячейке кристалла. Сгруппировать линии ЯКР 35 Cl связей P—Cl по неэквивалентным молекулам в этом двойном наборе можно следующим образом (см. таблицу): одна молекула — линии № 5, 6 и 9, другая — № 7, 8 и 10 (по признаку характерных областей резонансных частот для экваториальных (Clэ) и аксиальных (Clа) ядер хлора-35 с учетом величины расщеплений в выделенных указанным образом спектрах ЯКР неэквивалентных молекул и соотношения величин времени T1 в этих спектрах). Что касается линий ЯКР 35Cl связей C—Cl, то их отнесение к положению в бензольном кольце очевидно: в этом же частотном диапазоне наблюдается, например, спектр ЯКР 35Cl в 1,2,4,5-тетрахлорбензоле [ 2 ] (спектр B на рисунке). Соединения II и III могут существовать в двух формах с пента- и тетракоординированным атомом фосфора (хлоротропная таутомерия в триаде PNC): 740 КРАТКИЕ СООБЩЕНИЯ где X = Cl, F. Как следует из спектров ЯМР 31P, в растворах оба соединения находятся в двух приведенных выше формах [ 3 ], но в твepдoм состоянии можно ожидать лишь одну из возможных структур, зафиксированную при упорядочении молекул в кристаллической решетке. Спектры ЯКР 35Cl (см. таблицу) показывают, какой структурный изомер реализуется в кристалле в результате хлоротропного превращения при получении соединений II и III в твердом виде [ 3 ] (температуры плавления 85—87 и 75—78 С соответственно). В кристаллическом соединении II (использован образец, перекристаллизованный из гексана) в области частот ЯКР 35Cl, характерной для связей P—Cl пентакоординированного атома фосфора, наблюдаются два сигнала, из которых один принадлежит атому хлора в экваториальном положении Clэ, а другой — Clа в аксиальном (см. таблицу). Это отчетливо видно также из спектрограммы для связей P—Cl (см. рисунок) в сравнении спектра II с расположением линий ЯКР соединения C6H4O2PCl3 (спектр A). Вытекающее отсюда заключение о том, что фрагмент N=CClCCl3 находится в экваториальной позиции при атоме фосфора, объясняет и существенное понижение резонансной частоты аксиального хлора-35 в соединении II по сравнению с аналогичной частотой в фосфоране C6H4O2PCl3. Действительно, в соединениях пентакоординированного фосфора замещение экваториального атома хлора менее электроотрицательной атомной группой приводит к заметному понижению резонансной частоты хлора-35, находящегося в аксиальной позиции, что иллюстрируется спектрами ЯКР ряда соединений в Каталоге [ 4 ]. Однозначным является и отнесение линий ЯКР связей C—Cl в соединении II, как следует из сравнения соответствующей части спектра этого соединения со спектром ЯКР 35Cl соединения Cl2(O)PN=CClCCl3 [ 5 ] (спектр C на рисунке). Резонансные линии хлора-35 трихлорметильных групп в обоих соединениях лежат в одном частотном интервале, а линия ЯКР 35Cl фрагмента N=CCl в соединении II достаточно близка по частоте линии ЯКР аналогичного молекулярного фрагмента в соединении, взятом для сравнения [ 5 ]. Таким образом, спектры ЯКР 35Cl связей как P—Cl, так и C—Cl убедительно свидетельствуют о том, что соединение II имеет фосфорановую структуру a (см. приведенную выше схему таутомерного взаимопревращения). В отличие от соединения II в кристаллическом соединении III (образец также перекристаллизован из гексана [ 3 ]), где в состав заместителей у атома азота вместо группы CCl3 входит группа CF3, в области частот ЯКР 35Cl связей P—Cl наблюдается только одна резонансная линия (см. рисунок). В то же время находящийся в области резонансных частот связей C—Cl дублет говорит о наличии в соединении III двух однородных связей такого типа. Сравнение значений частот этого дублета с частотами ЯКР 35Cl связей C—Cl в фосфазосоединении Cl3P=NCCl2CF3 [ 6 ] (см. спектр D на рисунке) несомненно указывает на присутствие в соединении III атомной группировки NCCl2CF3 (а не N=CClCF3, как можно было бы ожидать по аналогии с соединением II). Сигнал ЯКР 35Cl одной связи P—Cl соединения III имеет, естественно, более низкую частоту, чем линии ЯКР группы PCl3 в спектре D, а двойной набор резо- КРАТКИЕ СООБЩЕНИЯ 741 нансных линий последнего спектра (см. рисунок) связан с кристаллографической неэквивалентностью молекул в образце Cl3P=NCCl2CF3 [ 6 ]. Итак, в целом спектр ЯКР 35Cl соединения III вполне определенно характеризует его молекулярное строение в твердом состоянии как структуру б (в форме фосфазосоединения) в рассмотренной выше схеме хлоротропной таутомерии в триаде PNC. Следует подчеркнуть, что изученные нами ранее трихлорфосфазосоединения Cl3P=NCCl2CCl3 и Cl3P=NCCl2CF3 в твердом виде, как и в растворах, имели структуры с тетракоординированным атомом фосфора без каких-либо указаний на хлоротропию. Явление хлоротропии в случае соединений II и III объясняется стабилизацией фосфорановой структуры пятичленным циклом, который стереохимически особенно подходит для аксиально-экваториального расположения. Повышение электроотрицательности заместителя у атома азота (соединение III), однако, смещает равновесие в сторону фосфазосоединения, что и приводит к наблюдаемому различию структур соединений II и III в кристаллическом состоянии. Этот эффект хорошо известен в ряду трихлорфосфазосоединений, которые самопроизвольно димеризуются, т.е. переходят в циклическую дифосфорановую структуру при наличии у атома азота донорных алкильных групп. Если же у атома азота находятся акцепторные группы, то стабилизируется структура фосфазосоединения с тетракоординированным атомом фосфора [ 7 ]. В заключение отметим, что значения времени спин-решеточной релаксации T1 ядер хлора-35 в соединениях I—III находятся в согласии с их структурами, установленными по частотам ЯКР: ядра хлора в структурно более подвижных молекулярных фрагментах имеют при 77 K более короткие времена T1 (см. таблицу). Имеются в виду структурно обусловленные различия в характере либрационных колебаний, обеспечивающих соответствующий релаксационный механизм [ 8 ], что проявляется в неодинаковых величинах T1 хлора-35 разных молекулярных фрагментов в пределах одного и того же соединения. Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 95-03-08580а). СПИСОК ЛИТЕРАТУРЫ 1. Hart R.M., Whitehead M.A. // J. Chem. Soc. A. – 1971. – N 11. – P. 1738 – 1741. 2. Bray P.J., Barnes R.G., Bersohn R. // J. Chem. Phys. – 1956. – 25, N 5. – P. 813 – 818. 3. Бойко В.И., Самарай Л.И., Мельниченко Н.В. и др. // Журн. общей химии. – 1996. – 66, № 10. – С. 1715 – 1719. 4. Кюнцель И.А., Сойфер Г.Б. Каталог спектров ЯКР 35Cl соединений фосфора, содержащих связь P—Cl. Ч. 2. – Пермь: Изд-во Томск. ун-та, Пермск. отд-ние, 1991. – 60 с. (Препринт Пермск. ун-та). 5. Мокеева В.А., Изместьев И.В., Кюнцель И.А., Сойфер Г.Б. // Радиоспектроскопия. – Пермь: Пермск. ун-т, 1976. – Вып. 10. – С. 44 – 46. 6. Козлов Э.С., Гайдамака С.Н., Поволоцкий М.И. и др. // Журн. общей химии. – 1978. – 48, № 6. – С. 1263 – 1266. 7. Цветков Е.Н., Коркин А.А. // Теор. и эксперим. химия. – 1985. – 21, № 5. – С. 536 – 543. 8. Chihara Н., Nakamura N. // Advances in Nuclear Quadrupole Resonance. – L.: Heyden, 1980. – 4. – P. 1 – 69. Пермский государственный университет Институт органической химии НАН Украины Статья поступила 25 января 1996 г.




