1 Лабораторная работа №3 Цель работы: Исследование
реклама

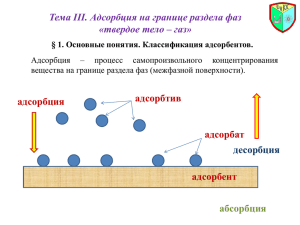
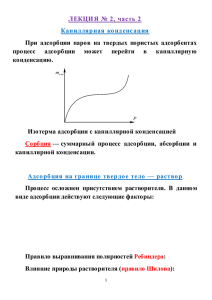
Лабораторная работа №3 Цель работы: Исследование процесса адсорбции на границе раздела твердой и жидкой фаз. Приборы: − титратор DL15 Mettler Tolledo; − электрод DG 115-SC Mettler Tolledo; − бюретка на 20 мл; − принтер; − магнитная мешалка; − фильтровальная установка; − стаканчики для титратора, 100 мл; − мерные колбы, 100 мл; − конические колбы, 100 мл; − мерная пипетка; − аналитические весы, 0,0001 Реактивы: − уксусная кислота; − гидроксид натрия, − адсорбент – активированный уголь. Ход работы: 1. Приготовить серию растворов уксусной кислоты 0,1н, 0,075н, 0,05н, 0,025н, 0,01н в мерных колбах на 100 мл. Проверить концентрацию каждого раствора титрованием 0,1н NaOH. Для этого в три стаканчика для титрования отобрать пипеткой на 10 мл три аликвоты фильтрата уксусной кислоты. Провести титрование. 2. В конические колбы на 100 мл отобрать по 50 мл каждого раствора, добавить приблизительно 1,5 г активированного угля, предварительно измельченного и взвешенного с точностью до 0,0001. 3. Смесь выдержать 10 минут, постоянно взбалтывая. 4. Собрать установку для фильтрования. Отфильтровать активированный уголь. 5. Определить концентрацию фильтрата титрованием 0,1н NaOH (см.пункт 1). 6. Рассчитать средний объем NaOH, затраченный на титрование каждого из растворов заданной концентрации. 7. Рассчитать нормальность кислоты 8. Экспериментальные данные занести в таблицу. 1 Средний объем, Vср Исходная концентрация, С1, моль/л Адсорбированное Концентрация после адсорбции, число молей, С2, моль/л x = С1 - С2 Адсорбция, Г = х/m х – число молей уксусной кислоты, адсорбированной активированным углем; m – масса адсорбента, г Нормальность кислоты до и после адсорбции рассчитывается по формуле: C кислоты = C щелочи Vср Vкислоты 9. По полученным данным построить изотерму адсорбции. 10. Сделать выводы. 2 Примерные контрольные вопросы 1. В чем проявляются особенности поверхностного слоя на границе раздела фаз? 2. Поверхностная энергия и поверхностное натяжение. 3. Поверхностно-активные и поверхностно-инактивные вещества. Правило ДюклоТраубе. 4. Дайте определение понятий: сорбция, абсорбция, адсорбция, десорбция, удельная адсорбция, величина адсорбции и ее размерность. 5. Адсорбция на границе раздела жидкость-газ и жидкость-жидкость. Уравнение Гиббса. 6. Адсорбция на поверхности твердых тел, природа адсорбционных сил, зависимость адсорбции от различных природных факторов (природы адсорбента, адсорбтива, температуры, концентрации, удельной поверхности адсорбента). 7. Молекулярная адсорбция из растворов. гидрофильной и гидрофобной поверхности. Влияние растворителя. Понятие 8. Правило уравновешивания полярностей Ребиндера. 9. Уравнения изотерм адсорбции Ленгмюра. Фрейндлиха, их анализ и применение. 10. Избирательная адсорбция. Биологическое значение избирательной адсорбции. 11. Адсорбция из растворов электролитов. 12. Ионообменная адсорбция: эквивалентная, обменная, специфическая. Иониты. 13. Роль адсорбции в биологических процессах. 3