ЛЕКЦИЯ № 2, часть 2 Капиллярная конденсация При адсорбции
реклама
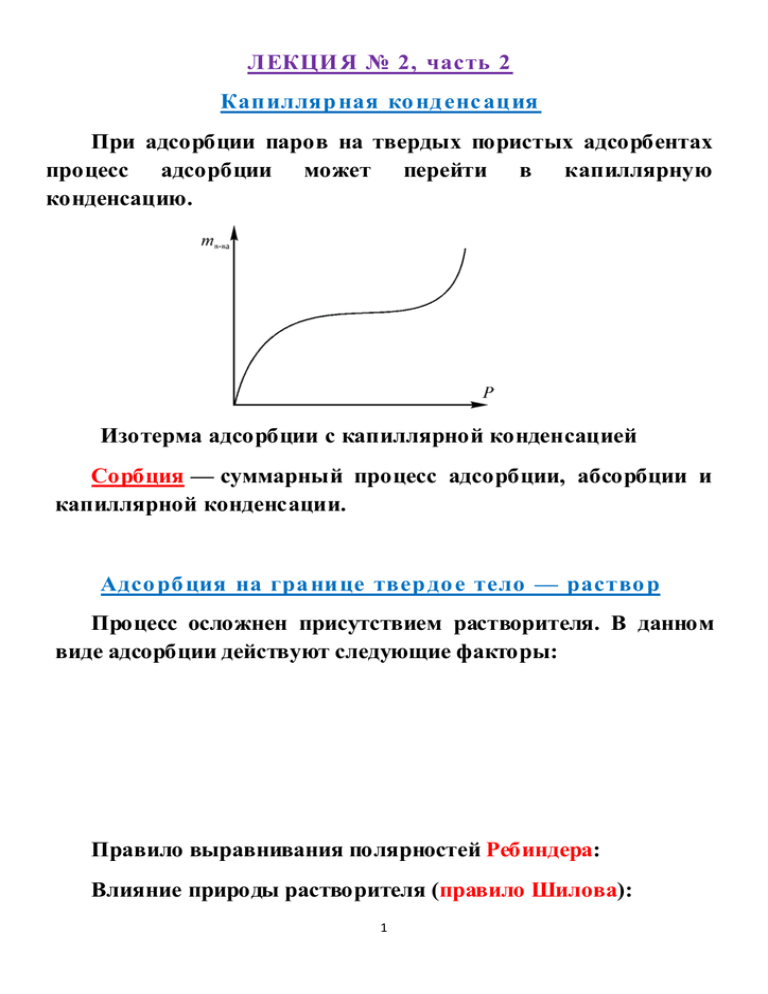
ЛЕКЦИ Я № 2, часть 2 Капилляр ная ко нд енс ация При адсорбции паров на твердых пористых адсорбентах процесс адсорбции может перейти в капиллярную конденсацию. Изотерма адсорбции с капиллярной конденсацией Сорбция — суммарный процесс адсорбции, абсорбции и капиллярной конденсации. Адсо рб ция на гра нице твер до е тело — раство р Процесс осложнен присутствием растворителя. В данном виде адсорбции действуют следующие факторы: • молекулы растворителя могут конкурировать с молекулами адсорбата за адсорбционные центры; • молекулы адсобрата взаимодействуют с растворителем; • возможно электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если последний является электролитом. Правило выравнивания полярностей Ребиндера: Влияние природы растворителя (правило Шилова): 1 Виды а дсо рб ции на гра нице твердо е тело —раство р Молекулярная адсорбция Ионная адсорбция — – эквивалентная –– – обменная адсорбция — – избирательная адсорбция — Правило избирательной адсорбции (Фаянса—Панета) Адсорбционная способность ионов зависит от их заряда и радиуса в гидратированном состоянии: Li+ > Na+ > K+ > Rb+ > Cs+ уменьшение радиуса гидратированного иона Лиотропный ряд адсорбции однозарядных катионов: катион Cs+ Rb+ NH4+ K+ Na+ Li+ радиус, Å 1,68 1,48 1,43 1,33 0,95 0,6 увеличение радиуса гидратированных катионов уменьшение адсорбции Лиотропный ряд адсорбции однозарядных анионов: анион радиус, Å NO3– I– 2,5 Br– Cl– F– 2,16 1,36 1,81 1,36 увеличение радиуса гидратированных анионов уменьшение адсорбции 2 Ио ноо б менная адсо рб ция Адсорбенты, способные к обмену ионами, называются ионитами. Иониты — Иониты имеют сетчатую структуру. С сеткой ковалентно связаны группы атомов R±, несущие положительный или отрицательный заряд (фиксированные ионы). Этот заряд компенсируется противоионами (М+ или А–). Фиксированные ионы вместе с противоионами (R–M+ или R+А–) называют ионогенными группировками. По типу ионогенных групп иониты делят на катиониты R– M+ (кислотные иониты, обменивающие катионы) и аниониты R+А– (основные иониты, обменивающие анионы). Ионообменные реакции: для катионита: R–H+ + Na+ для анионита: R+OH– + Cl– R–Na+ + H+ R+Cl– + OH– Активность ионитов — поглощающая характеризуется обменной емкостью (ОЕ) — способность Применение в фармации: умягчение жесткой, опреснение засоленной воды, для извлечения из анализируемых смесей различных компонентов. 3 Смач ивание Смачивание — это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другим жидким телом при наличии одновременного контакта этих двух несмешивающихся фаз с третьей фазой — газом (чаще всего воздухом). В системе имеются три поверхности раздела фаз: твердое тело—газ, жидкость—газ, жидкость—твердое тело с соответствующими поверхностными натяжениями: σтг, σтж, σгж. Линия пересечения всех трех поверхностей раздела –– линия смачивания; замкнутая линия смачивания образует периметр смачивания. Угол θ между поверхностями жидкость—газ и твердое тело—жидкость –– краевой угол смачивания. Смачивание Несмачивание 4 Уравнение Юнга: σтг = σтж + σжг cosθ или cosθ = σ тг - σ тж σ жг • если cosθ > 0 –– «ограниченное смачивание»; • если cosθ < 0 –– «плохое смачивание»; • если равновесный краевой угол устанавливается, — «полное смачивание» растекание. Характеристика явления — энтальпия смачивания: не или ΔН = Hтг –Нтж Отношение энтальпий смачивания твердых поверхностей водой (Нв) и углеводородом (Hу) — характеристика гидрофильности поверхности —коэффициент гидрофильности. Для гидрофильных поверхностей β = Нв > 1, Hу для гидрофобных — β < 1. Для активированного угля β ൎ 0,4 (гидрофобная поверхность), для кварца β ൎ 2 (гидрофильная поверхность), для крахмала β ൎ 20 (сильно гидрофильная поверхность). В фармацевтической практике изменение смачивания применяется для регулирования гигроскопичности фармацевтических порошков. 5 ПРИЛОЖЕНИЕ К ЛЕКЦИЯМ № 1, № 2,.ч 1 и №2, ч.2 Величины, характеризующие поверхностные явления Величина Поверхностная энергия Поверхностное натяжение Поверхностная активность Адсорбция на твердой поверхности Адсорбция на жидкой границе Символ или формула GS σ g a Коэффициент гидрофильности Размерность в СИ Дж Дж/м2 = Н/м Дж⋅м⋅моль–1 моль/м2*; моль/кг** Γ моль/м2*** H в**** β= Hy безразмерная величина (доли единицы) Примечание: * Если известна поверхность адсорбента, количество адсорбированного вещества относится к единице поверхности адсорбента. ** Если не известна поверхность адсорбента, количество адсорбированного вещества относится к единице массы адсорбента. *** Количество адсорбированного вещества относится к единице поверхности раздела фаз. **** Hв и Hу — энтальпии смачивания твердой поверхности водой и углеводородом, соответственно. 6











