Презентация "ТЭД"
реклама

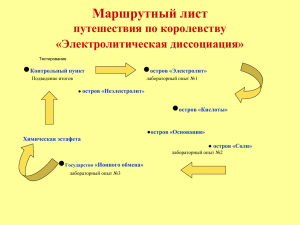
Тема урока: 1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы 0 Na + Na Cl2 NaCl Cl Ионы – положительно или отрицательно заряженные частицы, в которые превращаются атомы, отдавая или принимая электроны Na0 – 1e →Na+ Cl20 + 2e → 2Cl SO42 NO3 NH4+ простые ионы сложные ионы 3. Под действием электрического тока положительные ионы движутся к катоду, отрицательные – к аноду Na+ , NH4+ ClSO42- NO3- Катионы - Анионы - В растворе сумма «-» зарядов равна сумме «+» зарядов (р-р электронейтрален) 4. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Ассоциация – процесс, обратный диссоциации HNO2 ↔ + H + NO2 5. Не все электролиты одинаково диссоциируют на ионы По степени диссоциации электролиты делят на слабые и сильные ? ? 6. Химические свойства растворов определяются свойствами тех ионов, которые образуются при диссоциации Различают 3 типа электролитов: Кислоты Основания Соли Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка HCl = H+ + Cl HNO3 = H+ + NO3Многоосновные кислоты диссоциируют ступенчато: 1 ступень 2 ступень H3PO4 ↔ H+ + H2PO4H2PO4- ↔ H+ + HPO42- Основания – электролиты, которые диссоциируют на катионы металла и гидроксид-ионы OH NaOH + Na OH = + 2+ Ca(OH)2 = Ca + 2OH Соли– электролиты, которые диссоциируют на катионы металла (или аммония NH4+) и анионы кислотного остатка K3PO4 + 3K + = PO4 + NH4Cl = NH4 + Cl 3-