Тематическое планирование
реклама
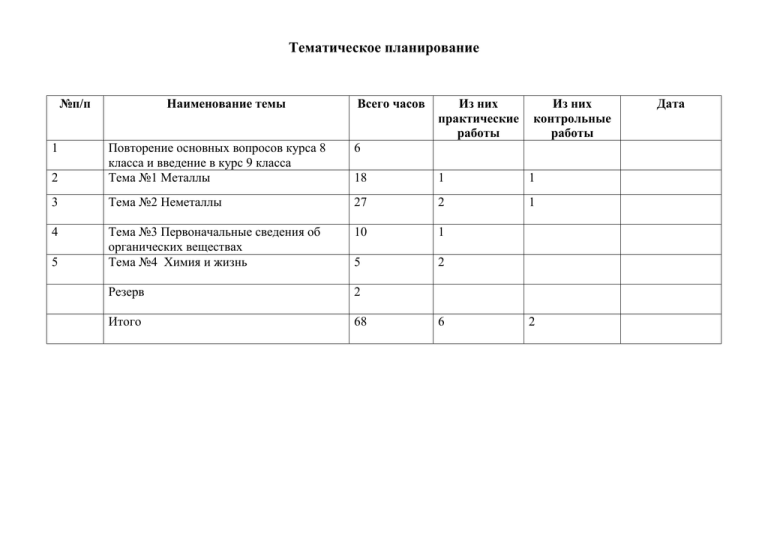
Тематическое планирование №п/п Наименование темы Всего часов Из них практические работы Из них контрольные работы 6 2 Повторение основных вопросов курса 8 класса и введение в курс 9 класса Тема №1 Металлы 18 1 1 3 Тема №2 Неметаллы 27 2 1 4 Тема №3 Первоначальные сведения об органических веществах Тема №4 Химия и жизнь 10 1 5 2 Резерв 2 Итого 68 1 5 6 2 Дата Поурочное планирование Повторение основных вопросов курса 8 класса и введение в курс 9 класса (6 часов) №п/п Тема урока 1-2 Периодический закон и периодическая система химических элементов Д.И.Менделеева 3-4 Характеристика химического элемента на основании его положения в периодической системе Д.И.Менделеева. 5-6 Свойства основных классов неорганических веществ. Обязательные результаты обучения: знать/понимать законы химии: Дидактические единицы Федерального компонента государственного стандарта Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Строение электронных оболочек первых 20 элементов периодической системы Д.И.Менделеева. Периодический закон и периодическая система химических элементов Д.И.Менделеева. . Строение атома. Строение электронных оболочек первых 20 элементов периодической системы Д.И.Менделеева. Свойства простых веществ, оксидов, кислот, оснований. Свойства простых веществ, оксидов, кислот, оснований. Демонстрации Получение и изучение характерных свойств основного и кислотного оксидов, основания и кислоты на примерах MgO и CO2; Mg(OH)2 и H2SO4 Характерные свойства основного и кислотного оксидов, основания и кислоты Лабораторные опыты Дата периодический закон Д.И. Менделеева, уметь называть: соединения изученных классов, объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп, характеризовать: химические элементы (от водорода до кальция) на основе их положения в П.С.Х.Э. Д.И. Менделеева и особенностей строения их атомов, составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов ПСХЭ Д.И. Менделеева. Тема №1 Металлы (18 часов) №п/п Тема урока 1 Металлы: положение в периодической системе химических элементов Д.И.Менделеева, строение атомов. 2 Общие физические свойства металлов Дидактические единицы Федерального компонента государственного стандарта Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Строение электронных оболочек первых 20 элементов периодической системы Д.И.Менделеева. Типы химической связи (металлическая). Типы Демонстрации Лабораторные опыты Знакомство с образцами металлов Дата 3 Общие химические свойства металлов 4 5 Электрохимический ряд напряжений металлов Способы получения металлов 6 Сплавы 7 Щелочные металлы 8 Соединения щелочных металлов 9 Щелочноземельные металлы. 10 Соединения щелочноземельных металлов. 11 Алюминий, его физические и химические свойства. Соединения алюминия. Амфотерность оксида и гидроксида. 12 кристаллических решеток (металлическая). Свойства простых веществ. Свойства простых веществ (металлов). (работа с коллекциями) Растворение цинка и железа в соляной кислоте Свойства простых веществ (металлов). Свойства простых веществ (металлов). Знакомство с образцами сплавов (работа с коллекциями). Строение атомов. Свойства Взаимодействие натрия простых веществ (металлов). с водой Свойства оксидов, оснований, солей щелочных металлов. Качественные реакции на ионы в растворе. Консерванты пищевых продуктов (поваренная соль). Строение атомов. Свойства Взаимодействие простых веществ (металлов). кальция с водой Свойства оксидов, оснований, солей щелочноземельных металлов. Качественные реакции на ионы в растворе. Химические вещества как строительные и поделочные материалы (мел, мрамор, известняк). Строение атомов. Свойства простых веществ (металлов). Свойства простых веществ (металлов). Амфотерность оксида и гидроксида. Ознакомление с образцами природных соединений щелочных металлов. Распознавание катионов калия, натрия. Ознакомление с образцами природных соединений кальция. Распознавание катионов кальция, бария. Ознакомление с образцами природных соединений алюминия 13 Железо. Строение атомов. Свойства простых веществ (металлов). 14 Соединения железа: оксиды, гидроксиды и соли железа Практическое занятие № 1 « Решение экспериментальных задач по теме «Получение соединений металлов и изучение их свойств». Проведение расчетов на основе уравнений реакций Оксиды, гидроксиды и соли железа 15 16 17 18 Проведение расчетов на основе уравнений реакций: вычисление количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции. Обобщение по теме «Металлы». Контрольная работа по теме «Металлы». Обязательные результаты обучения: знать/понимать химическую символику: знаки химических элементов — металлов; важнейшие химические понятия: атом, ион, окислитель и восстановитель, окисление и восстановление, уметь называть: соединения щелочных и щелочноземельных металлов; алюминия, железа (оксиды II и III), характеризовать: химические элементы ( Li, Na, Mg, А1, К, Ca ) на основе их положения в ПСХЭ Д.И. Менделеева и особенностей строения их атомов; Вытеснение меди железом из раствора соли Знакомство с рудами железа. связь между составом, строением и свойствами металлов; химические свойства металлов и их соединений (оксидов и гидроксидов), составлять: уравнения химических реакций взаимодействия Na и К с Н2, Сl2, S; уравнения химических реакций взаимодействия Са с О2, S, CI2, Н2; уравнения химических реакций взаимодействия Mg с О2, S, С12; уравнения химических реакций взаимодействия железа с НС1, H2SO4 (разб.), CuCI2, CuSO4; уравнения химических реакций взаимодействия К2О, Na2О, СаО с водой; уравнения химических реакций взаимодействия MgO и СаО с кислотами НС1, H2SO4; уравнения химических реакций взаимодействия NaOH, КОН, Са(ОН )2 с кислотами HCl, H2SO4; солями CuSO4, CuCl2, объяснять: закономерности изменения свойств щелочных и щелочноземельных металлов в пределах главных подгрупп, обращаться: с химической посудой и лабораторным оборудованием, использовать приобретённые знания в практической деятельности и безопасного повседневной жизни для: обращения с веществами и материалами (щёлочи). Тема №2 Неметаллы (27 часов). №п/п 1 Тема урока Общая характеристика неметаллов. Дидактические единицы Федерального компонента государственного стандарта Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Строение электронных оболочек первых 20 элементов периодической системы Д.И.Менделеева. Свойства простых веществ (неметаллов). 2 3 4 Водород Общая характеристика галогенов. Хлороводород. Соляная кислота и ее соли. 5 Кислород, его физические и химические свойства, получение и применение. 6 Сера. Сероводородная кислота и ее соли. Водород. Получение газообразных веществ. Периодическая система химических элементов Д.И.Менделеева. Строение атома. Строение электронных оболочек первых 20 элементов периодической системы Д.И.Менделеева . Галогены. Галогеноводородные кислоты и их соли. Качественные реакции на ионы в растворе. Получение газообразных веществ. Кислород, озон. Получение газообразных веществ. Сера. Сероводородная кислота и её соли. Демонстрации Лабораторные опыты Образцы неметаллов. Получение, собирание и распознавание водорода Образцы галогенов. Получение хлороводорода и его растворение в воде. Распознавание хлориданионов. Знакомство с образцами природных соединений хлора Получение, собирание и распознавание кислорода. Аллотропия серы. Знакомство с образцами природных соединений серы Дата (сульфидами ). 7 8 Оксиды серы. Сернистая кислота и ее соли. Серная кислота и ее соли. Окислительные свойства концентрированной серной кислоты. 9 Азот, его свойства. 10 Аммиак, его свойства. 11 Соли аммония. 12 Оксиды азота ( II и IV) 13 Азотная кислота и ее свойства 14 Соли азотной кислоты. 15 Фосфор, его свойства. 16 Оксид фосфора (V). Ортофосфорная кислота и её соли. 17 18 Углерод, его физические и химические свойства. Аллотропные модификации углерода. Оксиды углерода ( II и IV ). Оксиды серы. Сернистая кислота и ее соли. Серная кислота и ее соли. Окислительновосстановительные реакции. . Качественные реакции на ионы в растворе. Азот. Окислительновосстановительные реакции. . Аммиак. Получение газообразных веществ. Соли аммония. Свойства солей. Качественные реакции на ионы в растворе. Оксиды азота. Свойства оксидов. Азотная кислота. Свойства кислот. Окислительновосстановительные реакции. Знакомство с образцами природных соединений серы (сульфатами ). Распознавание сульфатанионов. Получение аммиака Распознавание катиона аммония. Знакомство с образцами природных соединений азота (нитратами ). Соли азотной кислоты. Фосфор. Свойства простых веществ. Оксид фосфора. Ортофосфорная кислота и её соли. Углерод. Свойства простых веществ. Угарный газ. Углекислый Модели кристаллических решёток алмаза графита. и Получение, собирание Угарный газ. 19 Угольная кислота и её соли. 20 Кремний, его свойства. 21 газ. Получение газообразных веществ. Угольная кислота и её соли. Качественные реакции на ионы в растворе 23 Кремниевая кислота. Силикаты. Практическое занятие №2 . Решение экспериментальных задач по теме „ Получение соединений неметаллов и изучение их свойств» Практическое занятие №3 Получение , собирание и распознавание газов 24 25 Решение расчетных задач Обобщение по теме: «Неметаллы». Знакомство с образцами природных соединений неметаллов (карбонатами). Распознавание карбонат- анионов. Кремний. Свойства простых веществ. Оксид кремния (IV), кремниевая кислота. Силикаты. 22 и распознавание углекислого газа. Проведение расчетов на основе уравнений реакций: вычисление количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции. Решение задач и упражнений. Подготовка к контрольной работе. Знакомство с образцами природных соединений неметаллов (силикатами ). 19 26 27 Контрольная работа №2 по теме «Неметаллы ». Анализ контрольной работы по теме «Неметаллы». Обязательные результаты обучения: знать/понимать химическую символику: знаки химических элементов - неметаллов; формулы простых веществ (галогены, кислород, сера, водород, азот, фосфор, углерод, кремний); формулы сложных веществ - оксидов азота (II и I V ) , серы (VI), фосфора (V), углерода (II и IV), кремния (IV), аммиака; формулы водородных соединений (галогеноводородов, аммиака); формулы кислот (азотной, серной, соляной, ортофосфорной, угольной, кремниевой); формулы5 солей (хлоридов, сульфатов, нитратов, фосфатов, карбонатов, силикатов, солей аммония); химические понятия: химический элемент, атом, молекула, ион, относительная атомная и молекулярная массы, окислитель и восстановитель, окисление и восстановление, уметь называть: химические элементы — неметаллы, соединения изученных классов. объяснять: строение атомов неметаллов I — III периодов ПСХЭ Д.И. Менделеева; характеризовать: связь между составом, строением и свойствами простых веществ-неметаллов; химические свойства простых веществ и их соединений; составлять: уравнения химических реакций взаимодействия неметаллов с кислородом, водородом,металлами; уравнения химических реакций взаимодействия оксидов с водой,щелочами; уравнения химических реакций взаимодействия кислот с основаниями, основными оксидами, металлами, солями. распознавать опытным путем: кислород, водород, углекислый газ, аммиак; хлорид-,сульфат-, карбонат-ионы; вычислять: количество вещества, массу или объем по количеству вещества, массе или объему одного из реагентов или продуктов реакции; использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: безопасного обращения с веществами (кислотами, аммиаком, угарным газом); обращаться: с химической посудой и лабораторным оборудованием. Тема №3 Первоначальные сведения об органических веществах (10 часов) №п/п 1 Тема урока Первоначальные сведения о строении органических веществ Углеводороды: метан, этан. 2 3 4 Химические свойства предельных углеводородов Углеводороды: этилен. Представление о полимерах на Дидактические единицы Федерального компонента государственного стандарта Первоначальные сведения о строении органических веществ Демонстрации Модели молекул органических веществ Углеводороды: метан, этан Углеводороды: метан, этан Углеводороды: этилен. Представление о полимерах Горение углеводородов и обнаружение продуктов их горения Качественная реакция на этилен. Образцы изделий из Лабораторные опыты Дата 5 6 примере полиэтилена. Практическое занятие №4 .Изготовление моделей молекул углеводородов. Природные источники углеводородов. Нефть и природный газ, их применение. 7 Спирты(метанол, этанол, глицерин). 8 Карбоновые кислоты(уксусная, стеариновая) как представители кислородсодержащих органических соединений. 9 Биологически важные вещества: жиры, углеводы. 10 Биологически важные вещества: белки. на примере полиэтилена. полиэтилена. Природные источники углеводородов. Нефть и природный газ, их применение. Проблемы безопасного использования горючих и взрывоопасных веществ. Спирты(метанол, этанол, глицерин). Карбоновые кислоты(уксусная, стеариновая) как представители кислородсодержащих органических соединений. Уксусная кислотаконсервант пищевых продуктов. Биологически важные вещества: жиры, углеводы. Калорийность белков, жиров и углеводов Биологически важные вещества: белки. Образцы нефти, каменного угля и продуктов их переработки. Образцы этанола и глицерина. Образцы уксусной и стеариновой кислот. Качественные реакции на белки. Тема №4 Химия и жизнь(5 часов) №п/п 1 Тема урока Человек в мире веществ, материалов и химических реакций Дидактические единицы Федерального компонента государственного стандарта Химия и пища .Химические вещества как строительные и поделочные материалы. Демонстрации Образцы строительных и поделочных Лабораторные опыты Дата Химия и здоровье. материалов. Образцы лекарственных препаратов. 2 3 4 5 Лекарственные препараты и Практическое занятие № 5. проблемы, связанные с их Знакомство с образцами лекарственных препаратов. применением. Химическое загрязнение Химическое загрязнение окружающей среды и его окружающей среды и его последствия. последствия. Проблемы безопасного Токсичные, горючие и использования веществ и взрывоопасные вещества. химических реакций в повседневной Бытовая химическая жизни. грамотность. Практическое занятие №6. Знакомство е образцами Знакомство с образцами химических средств химических средств санитарии и санитарии и ; гигиены. гигиены. Образцы упаковок пищевых продуктов с консервантами. Обязательные результаты обучения: знать/понимать: проблемы безопасного использования веществ и химических реакций в повседневной жизни. уметь: использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: безопасного обращения с веществами; оценки влияния химического загрязнения окружающей среды на организм человека; критической оценки информации о веществах, используемых в быту.



