РОССИЙСКАЯ ФЕДЕРАЦИЯ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ Федеральное государственное бюджетное образовательное учреждение
реклама

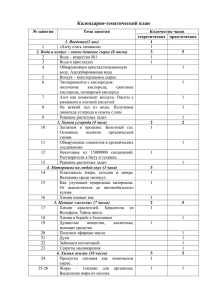
РОССИЙСКАЯ ФЕДЕРАЦИЯ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ «УТВЕРЖДАЮ»: Проректор по учебной работе _______________________ /Волосникова Л.М./ _________ _____________ 2011 г. ТЕОРЕТИЧЕСКАЯ КРИСТАЛЛОХИМИЯ Учебно-методический комплекс. Рабочая программа для студентов направления 020100.68 « Химия» Магистерская программа «Химия фторидных, сульфидных соединений металлов в макро-, мезо- и наносостояниях» Форма обучения очная «ПОДГОТОВЛЕНО К ИЗДАНИЮ»: Автор работы ______________/Хритохин Н.А./ «16» мая 2011 г. Рассмотрено на заседании кафедры неорганической и физической химии 19 мая 2011 года. Протокол № 12 Соответствует требованиям к содержанию, структуре и оформлению. «РЕКОМЕНДОВАНО К ЭЛЕКТРОННОМУ ИЗДАНИЮ»: Объем 14 стр. Зав. кафедрой ____________________/Андреев О.В./ «19» мая 2011 г. Рассмотрено на заседании УМК химического отделения ИМЕНИТ _____________ 2011года. Протокол № _____ Соответствует ФГОС ВПО и учебному плану образовательной программы. «СОГЛАСОВАНО»: Председатель УМК _________________/Глухих И.Н./ «____»_____________2011 г. «СОГЛАСОВАНО»: Зав. методическим отделом УМУ_____________/Федорова С.А./ «____»_____________2011 г. РОССИЙСКАЯ ФЕДЕРАЦИЯ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Химическое отделение ИМЕНИТ Кафедра неорганической и физической химии Хритохин Н.А. ТЕОРЕТИЧЕСКАЯ КРИСТАЛЛОХИМИЯ Учебно-методический комплекс. Рабочая программа для студентов направления 020100.68«Химия» Магистерская программа «Химия фторидных, сульфидных соединений металлов в макро-, мезо- и наносостояниях» Форма обучения очная Тюменский государственный университет 2011 Хритохин Н.А. Теоретическая кристаллохимия. Учебнометодический комплекс. Рабочая программа для студентов направления 020100.68 «Химия», магистерская программа «Химия фторидных, сульфидных соединений металлов в макро-, мезо- и наносостояниях», форма обучения очная. Тюмень, 2011, 14 стр. Рабочая программа составлена в соответствии с требованиями ФГОС ВПО с учетом рекомендаций и ПрООП ВПО по направлению подготовки. Рабочая программа дисциплины «Теоретическая кристаллохимия» опубликована на сайте ТюмГУ: http://www.utmn.ru [электронный ресурс] / Режим доступа: http://www.umk3.utmn.ru свободный. Рекомендовано к изданию кафедрой неорганической и физической химии. Утверждено проректором по учебной работе Тюменского государственного университета. ОТВЕТСТВЕННЫЙ РЕДАКТОР: заведующий кафедрой неорганической и физической химии Андреев О.В. © Тюменский государственный университет, 2011. © Хритохин Н.А., 2011. 1. Пояснительная записка Дисциплина «Теоретическая кристаллохимия», в соответствии с ФГОС ВПО по направлению подготовки 020100.68 «Химия», входит в вариативную часть профессионального цикла ООП подготовки магистра. Цель обучения: формирование у студентов представления о строении и свойствах атомов и ионов, составляющих кристаллы, о строении кристаллов, а также о связи его со свойствами кристаллов и природой химического взаимодействия. Задачи обучения: формирование у студентов представления о свойствах атомов и ионов, а также о связи между ними в кристаллах; представления об описании кристаллических структур; умения работать с моделями идеальных кристаллических структур и их элементарных ячеек; навыков исследования кристаллов и их теоретического описания. 1.1. Место дисциплины в структуре ООП бакалавриата «Теоретическая кристаллохимия» является дисциплиной вариативной части профессионального цикла для направления 020100.68 «Химия». Дисциплина осваивается во 2 семестре. Содержание курса базируется на знании общих курсов «Общая химия», «Неорганическая химия» и «Кристаллохимия». Материал, излагаемый в курсе «Теоретическая кристаллохимия», может быть полезен для изучения материаловедческих курсов, таких как «Современные материалы на основе макро- и нанотехнологий», «Химия конструкционных и функциональных материалов», «Наноструктурированные материалы» и др. 1.2. Компетенции выпускника ООП бакалавриата, формируемые в результате освоения данной дисциплины В соответствии с ФГОС ВПО данная дисциплина направлена на формирование следующих компетенций: - общекультурных: ОК-6 – использование основных законов естественнонаучных дисциплин в профессиональной деятельности, применение методов математического анализа и моделирования, теоретического и экспериментального исследования; - профессиональных: ПК-1 – понимание сущности и социальной значимости профессии, основных перспектив и проблем, определяющих конкретную область деятельности; ПК-3 – способность применять основные законы химии при обсуждении полученных результатов, в том числе с привлечением информационных баз данных; ПК-4 – владение навыками химического эксперимента, основными синтетическими и аналитическими методами получения и исследования химических веществ и реакций; ПК-5-умение логически верно, аргументировано и ясно строить устную и письменную речь ПК-6 – владение навыками работы на современной учебнонаучной аппаратуре при проведении химических экспериментов; ПК-7 – наличие опыта работы на серийной аппаратуре, применяемой в аналитических и физико-химических исследованиях; ПК-10 – способность работать с информацией в глобальных компьютерных сетях. В области воспитания личности целью подготовки является формирование социально-личностных качеств студентов: целеустремленности, организованности, коммуникативности. В результате освоения дисциплины студент должен: - знать основы рентгенографии и других методов изучения кристаллов; уметь обрабатывать и анализировать результаты рентгенографического исследования кристаллов, решать задачи теоретического описания кристаллов, пользоваться научной и справочной литературой по теоретической кристаллохимии и смежным направлениям; - владеть основными понятиями теоретической кристаллохимии и методами дифрактометрического анализа. 2. Структура и трудоемкость дисциплины. Основной материал курса и методы решения задач изучаются и осваиваются в ходе лабораторных занятий, где раскрывается содержание основных понятий, детально рассматриваются теоретические аспекты общей и систематической кристаллохимии, проводятся рентгенографические исследования неорганических систем и текущий контроль самостоятельной работы. Контроль развития перечисленных знаний, навыков и умений осуществляется с помощью нескольких форм. Для текущего контроля предусмотрены контрольные опросы, задачи на лабораторных занятиях, защита отчетов по лабораторным работам. Итоговый контроль осуществляется посредством семестрового зачёта (письменного или устного). Общая трудоёмкость дисциплины составляет 6 зачётных единиц (з.е.), 216 часов. 3.Тематический план Таблица 1 Наименование темы Модуль 1 1. Атомы и ионы на теоретическом уровне 2. Атомы, ионы, координация, химические связи в кристаллах, свойства Всего Модуль 2 1. Гомо- и гетеродесмические структуры 2. Исследование и описание кристаллических структур Всего Модуль 3 1. Морфотропия 2. Структурные типы Всего Итого (часов) Из них часов в интерактивной форме Нед ели семе стра Лаборат Лекции орные (кол-во занятия часов) (кол-во часов) Самосто Из них в ятельная интерактив Формы работа ной форме контроля (кол-во (кол-во часов) часов) 1-2 - 10 14 10 Задачи 3-4 - 10 14 10 Опрос - 20 28 20 - 10 14 10 Опрос 20 28 20 Защита отчетов - 30 42 30 - 20 28 20 Опрос - 20 28 20 Опрос - 40 90 56 126 40 90 90 5-6 710 1114 1518 Планирование самостоятельной работы студентов Таблица 2 Виды СРС № Темы обязательные Неделя Объем дополнител семестр часов а ьные 1.1 Атомы и ионы Работа с учебной Работа со на литературой справочн теоретическом ой уровне литератур ой 1.2 Атомы, ионы, Работа с учебной Работа со координация, литературой справочно химические й связи в литератур кристаллах, ой свойства Всего по модулю 1: 2.1 Гомои Работа с учебной Работа со гетеродесмичес литературой справочн кие структуры ой литератур ой 2.2 Исследование и Работа с Работа со описание рентгенограммами структурн кристаллически ыми х структур базами данных Всего по модулю 2: 3.1 Морфотропия Работа с учебной Работа со литературой справочн ой литератур ой 3.2 Структурные Работа со Работа с типы структурными учебной моделями литератур ой Всего по модулю 3: ИТОГО: 1-2 14 3-4 14 5-6 28 14 7-10 28 11-14 42 28 15-18 28 56 126 4. Разделы дисциплины и междисциплинарные обеспечиваемыми (последующими) дисциплинами № п/п 1 2 3 связи с Темы дисциплины необходимые для изучения обеспечиваемых (последующих) дисциплин Кристалличес Теоретические Наименование обеспечиваемых Атомы и кая структура аспекты общей и (последующих) дисциплин ионы в систематической кристаллах кристаллохимии Современные материалы на основе макро- и нанотехнологий Химия конструкционных и функциональных материалов Наноструктурированные материалы - + + - + + + + + 5. Содержание дисциплины Модуль 1 Тема 1. Атомы и ионы на теоретическом уровне Электронное строение, пространственные и энергетические характеристики атомов и ионов и периодическая система элементов Д.И. Менделеева. Поляризационные свойства атомов и ионов. Правила Фаянса. Кислоты и основания на теоретическом уровне. Теории Льюиса, Лукса – Флуда, Усановича и Пирсона (ЖМКО). Ионные потенциалы и силовые характеристики (Годовиков). Тема 2. Атомы, ионы, координация, химические связи в кристаллах, свойства Ионная связь и ионные структуры. Энергия ионных решеток (Борн, Ланде). Константы Маделунга. Уравнения Борна – Ланде и Борна – Майера. Уравнение Капустинского. Цикл Борна – Габера. Степень ионности. Ионные радиусы. Вычисление ионных радиусов: метод Ланде. Таблицы кристаллохимических радиусов. Поправки Гольдшмидта. Диаграммы электронной плотности. Соотношение радиусов катиона и аниона в бинарных ионных структурах. Правило Магнуса – Гольдшмидта. Карты структурных полей и прогнозирование ионных структур. Химические связи в кристаллах. Координационное число (КЧ) и координационный многогранник (КМ). Структуры простых веществ неметаллической природы. Правило Юм-Розери. Металлическая связь. Зонная теория. Структуры простых веществ металлической природы. Влияние ковалентной составляющей. Межмолекулярные взаимодействия. Молекулярные структуры. Общие представления об особенностях разных типов химической связи и их взаимосвязи в кристаллах. Модуль 2 Тема 1. Гомо- и гетеродесмические структуры Типы гетеродесмических структур: островные, цепочечные и ленточные, слоистые, каркасные. Символика записи гомодесмических структур и фрагментов. Тема 2. Исследование и описание кристаллических структур Кристаллическая структура. Трансляция. Группы трансляций. Кристаллическая решетка, базис. Параллелограммы и параллелепипеды повторяемости. Симметрия кристаллической решетки. Голоэдрические группы. Особые направления в решетке. Кристаллографические системы координат, правила выбора. Координатный крест. Параметры решетки. Элементарная ячейка, проекция. Сингония. Кристаллографические точечные группы. Способы размещения узлов в элементарной ячейке. Типы Бравэ. Основные структурные типы кубических решеток. Число формульных единиц в элементарной ячейке. Индексы узлов, узловых рядов и плоскостей. Межплоскостные расстояния. Вычисление параметров решетки. Пространственные группы. Дифракция рентгеновских лучей на кристаллах (Лауэ). Представление о рентгеноструктурном и рентгенофазовом анализе. Рентгенометрическая картотека дифрактометрических данных. Рентгеновская плотность кристаллов. Шаровые кладки и упаковки. Мотивы упаковки. Пустоты в шаровых кладках и упаковках. Многослойные плотнейшие шаровые упаковки (ПШУ). Слойность ПШУ. Способы записи ПШУ. Параллелоэдры Е.С. Федорова. Области Дирихле – Вороного. Многогранники Делоне. Сфеноиды. Модуль 3 Тема 1. Морфотропия Изоморфизм и полиморфизм (Митчерлих). Аллотропия. Представление о термодинамической теории фазовых равновесий. Фазовые превращения в кристаллических системах. Фазы переменного состава. Твердые растворы, типы: замещения, внедрения, вычитания. Параметры решетки твердых растворов. Правило Вегарда. Условия проявления изоморфизма. Правило Руайе. Антиизоморфизм. Морфотропия и автоморфотропия. Политипия. Изотопная морфотропия. Изовалентный и гетеровалентный изоморфизм. Закон диагональных рядов Ферсмана. Разрыв смешиваемости в гетеровалентных изоморфных системах (Хлопин-Никитин). Изоморфизм с заполнением пространства. Фазы внедрения. Тема 2. Структурные типы Структурные мотивы. Структурные типы. Кристаллохимия простых веществ. Металлы, основные структурные типы и аномальные структуры. Неметаллы. Интерметаллиды. Электронная концентрация. Электронные соединения (Юм-Розери). Фазы Лавеса. Бинарные соединения. Структуры в рамках теории шаровых кладок и упаковок. Ажурные структурные мотивы (структуры островные, цепочечные и ленточные, слоистые, координационные). Тройные соединения. Перовскит. Шпинели (нормальные и обращенные). Коэффициент обращения в шпинелях. Ионные и ковалентные структуры. Правила Полинга. Фактор толерантности. Правило Гримма – Зоммерфельда. Диаграммы Музера – Пирсона. Правила Партэ. Числовые законы Н.В. Белова. 6. Темы лабораторных работ 1. Электронное строение, пространственные и энергетические характеристики атомов и ионов и периодическая система элементов Д.И. Менделеева 2. Теория кислотно-основных взаимодействий 3. Ионы и ионные структуры 4. Металлы и металлические структуры 5. Гомодесмические структуры 6. Гетеродесмические структуры 7. Описание кристаллической решетки 8. Симметрия кристаллической решетки 9. Рентгенография 10. Шаровые кладки и упаковки 11. Изоморфизм 12. Полиморфизм 13. Фазовые превращения в кристаллических системах 14. Твердые растворы 15. Теоретическая кристаллохимия простых веществ 16. Теоретическая кристаллохимия бинарных соединений 17. Теоретическая кристаллохимия тройных соединений 18. Карты устойчивости структурных типов 7. Учебно-методическое обеспечение самостоятельной работы студентов. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины. В качестве домашнего задания, для самостоятельной подготовки студенты получают индивидуальные задания. ВОПРОСЫ К ЗАЧЕТУ 1. Составить схему цикла Борна – Габера для заданного бинарного ионного соединения и вычислить его энтальпию образования. 2. Пользуясь справочными данными, вычислить энергию кристаллической решетки заданного бинарного ионного соединения для случаев с известной и неизвестной кристаллической структурой. 3. Обсудите изменение пространственных и энергетических характеристик атомов и ионов химических элементов по вертикальным, горизонтальным и диагональным рядам периодической системы элементов Д.И. Менделеева. 4. Пользуясь справочными таблицами, предскажите структуры галогенидов и халькогенидов заданного ряда химических элементов. Обсудите причины возможной неадекватности прогноза. 5. Обсудите изменение растворимости в воде и термической стабильности гидроксидов, карбонатов, сульфатов и перхлоратов заданного ряда химических элементов. 6. Используя справочные таблицы и подход Борна, оцените возможность образования кристаллических фторида калия (II) и хлорида кальция (I). 7. Не обращаясь к справочным таблицам, расположите в порядке возрастания энергии кристаллической решетки оксид магния, фторид лития и хлорид натрия. 8. Обсудите изменение растворимости в воде и термической стабильности галогенидов заданного элемента. 9. Сравните устойчивость NaH и NaHe. 10. В кристаллической структуре, содержащей атомы элементов А и В, атом А располагается в начале кристаллографической координатной системы. Известны тип решетки и координаты нескольких атомов В. Нарисовать проекцию элементарной ячейки, установить простейшую формулу соответствующего химического соединения и число формульных единиц в элементарной ячейке. 11. Определить тип решетки по заданному виду примитивного параллелепипеда повторяемости и нарисовать проекцию элементарной ячейки. 12. Определить тип решетки, возникающей при растяжении заданной структуры вдоль заданного направления, и нарисовать проекцию элементарной ячейки. 13. По заданному кратчайшему межатомному (межионному) расстоянию в заданной структуре данного вещества, кристаллизующегося в кубической сингонии, вычислить плотность последнего. 14. По заданному параметру решетки данного вещества (кубическая сингония, структурный тип известен) вычислить плотность последнего. 15. Известна плотность некоторого кристаллического соединения двух заданных элементов, образующих между собой несколько соединений с известной кристаллохимией (тип и параметры решетки, число формульных единиц в элементарной ячейке). Установить, плотность которого соединения дана. 16. Известны плотность данного кристаллического вещества и его структурный тип (решетка кубическая). Вычислить параметр решетки. 17. Известен брэгговский угол данного рефлекса на рентгенограмме некоторого кристаллического вещества, полученной на данном излучении (длина волны известна). Чему равен этот угол, если съемку вести на другом излучении (длина волны известна)? 18. Известен параметр решетки некоторого вещества, кристаллизующегося в кубической сингонии. Вычислить брэгговский угол, отвечающий отражению заданного порядка рентгеновского излучения (длина волны известна) от серии узловых плоскостей с заданными индексами Миллера. 19. Определить слойность ПШУ по заданной комбинации мотивов упаковки. 20. Известно описание кристаллических структур некоторого химического соединения в рамках теории ПШУ. Установить формулу соединения. 21. Сколько пустот в ячейке заданного структурного типа? 22. Известны плотность и структурный тип данного металла. Вычислить его металлический радиус. 23. Какая ПШУ отличается по симметрии от остальных? 1. АВАВА 2. АВСАВ 3. АВСВА 4. АВСВС 24. Постройте карты структурных полей для соединений АВ 2Х4. Пользуясь этими картами, предскажите структурный тип для MgCr2O4, BeAl2O4, FeCr2O4, Mn3O4, Fe3O4, Pb3O4, K2MgF4. 25. Постройте карты структурных полей для соединений АВХ4. Пользуясь этими картами, предскажите структурный тип для MgSO4, CaSO4, SrSO4, CdSO4, YPO4, PbCrO4, PbMoO4, PbWO4, ThSiO4, MnO2, TiO2, ZrO2. 26. Которое из соединений имеет структуру обращенной шпинели? 1. Co3O4 2. FeCr2O4 3. Fe3O4 4. Mn3O4 27. Которое из соединений имеет структуру нормальной шпинели? 1. CuFe2O4 2. FeCr2O4 3. Fe3O4 4. NiFe2O4 Для самостоятельного изучения теоретического материала студентами используются учебники и учебные пособия в приведённом ниже списке литературы. Трудоёмкость самостоятельного изучения теоретического материала составляет 126 часов. 8. Образовательные технологии В соответствии с требованиями ФГОС, при реализации различных видов учебной работы в процессе изучения дисциплины «Теоретическая кристаллохимия» используются следующие активные и интерактивные формы проведения занятий: лабораторные работы; дополнительные консультации. Кроме того используются дополнительные формы обучения по отдельным темам: текущая проверка знаний; взаимоконтроль студентов; отработка пройденного материала на практических задачах; взаимообмен заданиями. обмен знаниями между студентами в малых группах. 9. Учебно-методическое дисциплины и информационное обеспечение 9.1. Основная литература 1. Кемпбелл Дж. Современная общая химия. В 3-х т. – М.: Мир, 1975. 2. Веснин Ю.И. Вторичная структура и свойства кристаллов. – Новосибирск: ИНХ СО РАН. 1997. – 102 с. 3. Ормонт Б.Ф.. Введение в физическую химию и кристаллохимию полупроводников. – М.: Высшая школа. 1982. – 528 с. 4. Бокий Г.Б.. Кристаллохимия. – М.: Наука. 1971. – 400 с. 5. Полинг Л., Полинг П.. Химия. – М.: Мир. 1978. – 683 с. 6. Уэллс А. Структурная неорганическая химия: В 3-х т. – М.:Мир. 1987. 7. Партэ Э. Некоторые главы структурной неорганической химии. – М.: Мир. 1993. – 144 с. 8. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. – М.: Химия. 1987. – 696 с. 9. Урусов В.С. Теоретическая кристаллохимия. – М.: Изд-во МГУ. 1987. – 275 с. 10.Мюллер У. Структурная неорганическая химия. – Долгопрудный: Издательский дом «Интеллект». 2010. – 352 с. 9.2. Дополнительная литература 1. Зоркий П.М.. Симметрия молекул и кристаллических структур. – М.: Изд-во МГУ. 1986. – 229 с. 2. Порай-Кошиц М.А.. Основы структурного анализа химических соединений. – М.: Высшая школа. 1982. – 151 с. 3. Шаскольская М.П. Очерки о свойствах кристаллов. – М.: Наука. 1987. – 176 с. 4. Шрайвер Д., Эткинс П. Неорганическая химия: В 2-х томах. – М.: Мир. 2004. 9.3. Методические указания 1. Порай-Кошиц М.А., Ходашова Т.С. Методические разработки по кристаллохимии. М.: Изд-во МГУ, 1974. 10. Технические средства и материально-техническое обеспечение дисциплины Аудитория с мультимедийным оборудованием и лаборатория для проведения практических занятий. Рабочая программа пересмотрена и одобрена на заседании кафедры неорганической и физической химии «19» мая 2011 г., протокол № 12. Заведующий кафедрой___________________/Андреев О.В./