Ход урока - Земля и Вселенная
реклама
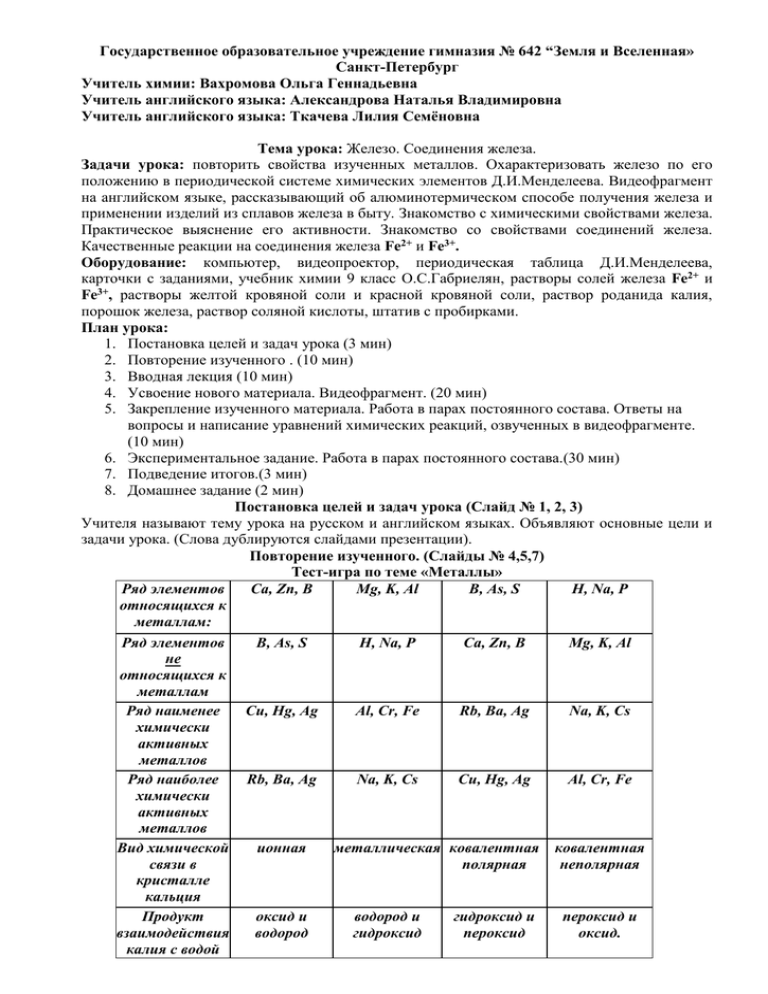
Государственное образовательное учреждение гимназия № 642 “Земля и Вселенная» Санкт-Петербург Учитель химии: Вахромова Ольга Геннадьевна Учитель английского языка: Александрова Наталья Владимировна Учитель английского языка: Ткачева Лилия Семёновна Тема урока: Железо. Соединения железа. Задачи урока: повторить свойства изученных металлов. Охарактеризовать железо по его положению в периодической системе химических элементов Д.И.Менделеева. Видеофрагмент на английском языке, рассказывающий об алюминотермическом способе получения железа и применении изделий из сплавов железа в быту. Знакомство с химическими свойствами железа. Практическое выяснение его активности. Знакомство со свойствами соединений железа. Качественные реакции на соединения железа Fe2+ и Fe3+. Оборудование: компьютер, видеопроектор, периодическая таблица Д.И.Менделеева, карточки с заданиями, учебник химии 9 класс О.С.Габриелян, растворы солей железа Fe2+ и Fe3+, растворы желтой кровяной соли и красной кровяной соли, раствор роданида калия, порошок железа, раствор соляной кислоты, штатив с пробирками. План урока: 1. Постановка целей и задач урока (3 мин) 2. Повторение изученного . (10 мин) 3. Вводная лекция (10 мин) 4. Усвоение нового материала. Видеофрагмент. (20 мин) 5. Закрепление изученного материала. Работа в парах постоянного состава. Ответы на вопросы и написание уравнений химических реакций, озвученных в видеофрагменте. (10 мин) 6. Экспериментальное задание. Работа в парах постоянного состава.(30 мин) 7. Подведение итогов.(3 мин) 8. Домашнее задание (2 мин) Постановка целей и задач урока (Слайд № 1, 2, 3) Учителя называют тему урока на русском и английском языках. Объявляют основные цели и задачи урока. (Слова дублируются слайдами презентации). Повторение изученного. (Слайды № 4,5,7) Тест-игра по теме «Металлы» Ряд элементов Ca, Zn, B Mg, K, Al B, As, S H, Na, P относящихся к металлам: Ряд элементов B, As, S H, Na, P Ca, Zn, B Mg, K, Al не относящихся к металлам Ряд наименее Cu, Hg, Ag Al, Cr, Fe Rb, Ba, Ag Na, K, Cs химически активных металлов Ряд наиболее Rb, Ba, Ag Na, K, Cs Cu, Hg, Ag Al, Cr, Fe химически активных металлов Вид химической ионная металлическая ковалентная ковалентная связи в полярная неполярная кристалле кальция Продукт оксид и водород и гидроксид и пероксид и взаимодействия водород гидроксид пероксид оксид. калия с водой -2При выборе правильного ответа появляется буква на поле таблицы. Из букв правильных ответов должно получиться название минерала алюминия, обладающего очень высокой твердостью. Усвоение нового материала. I. Вводная лекция. (Слайды № 7, 8, 9, 10, 11) II. Показ видеофрагмента www.periodicvideos.com на английском языке, подготовленного педагогами-экспериментаторами Ноттингемского университета (Англия). Выполнение заданий на английском языке. I. Read the new words: 1. a thermite reaction [Ɵə:maɪt] – термическая реакция 2. iron ['aɪən] - железо 3. aluminium - алюминий 4. sulfur - сера 5. acid - кислота 6. powder ['pauds] - порошок 7. a particle ['pa:tɪkl] - частица 8. redox reaction – окисление-восстановление 9. oxide - оксид 10. to weld - сваривать 11. a loop [lu:p] - петля 12. a tram - трамвай 13. set off - начать 14. rails, tracks - рельсы 15. wheels - колеса 16. equipment - оборудование 17. racking – стояк, вешалка 18. blood - кровь 19. wire ['waɪə] - проволока 20. stainless steel – нержавеющая сталь 21. rust [rʌst] - ржавчина 22. solid – твердый, целый II. Complete the sentences with the new words: 1. A … reaction is the reaction of metal aluminium with iron oxide. 2. This reaction is a kind of … 3. Black particles of iron oxide are mixed with aluminium 4. Some students played a 5. Some of the students get off the … 6. The wheels of the tram were … to the rails. 7. We can find iron in human … 8. The iron wire is covered with iron … . … reaction. … . joke on a tram. through another door, forming a … . . The scientist made iron sulfide using metal iron and … . Answer the questions: 1. What did scientists get as a result of thermite reaction of aluminium powder with iron oxides? 9. III. 2. What kind of reaction is it? 3. How was it shown in the film that the temperature of the reaction was very high? 4. Where can we find iron? 5. What was the result of the practical joke that some students played on a tram using a thermite reaction? 6. The iron wire was show in the film. Why is the top layer of the wire darker than the wire inside? 7. What smell is produced when we put some acid on iron sulfide? -3Закрепление изученного материала. Работа в парах постоянного состава. Ответы на вопросы и написание уравнения химической реакции. (Слайд № 12) I. Составьте уравнения реакций, озвученных в видеофрагменте: 1. Взаимодействие термита с порошком алюминия. 2. Окисление железа на воздухе до смешанного оксида железа. Воспользуйтесь учебником химии (О.С.Габриелян, 9 класс, § 14). 3. Взаимодействие сульфида железа (II) с соляной кислотой. II. Экспериментальное задание. Работа в парах постоянного состава. (Слайды № 13, 14, 15) Воспользуйтесь учебником химии (О.С.Габриелян, 9 класс, § 14). 1. Ознакомьтесь с инструкцией по технике безопасности. 2. Опыт № 1. Взаимодействие железа с соляной кислотой. Оборудование и реактивы: штатив для пробирок, пробирка, шпатель, порошок железа, соляная кислота. 1. Поместить порцию порошка железа в пробирку. Прилить 10 капель соляной кислоты. 2. Какой газ выделяется? 3. Какая соль железа образуется в результате реакции? 4. Составить уравнение наблюдаемой реакции. 5. Вывод: Какова химическая активность железа. 3. Опыт № 2. Качественные реакции на ионы Fe2+и Fe3+ . Оборудование и реактивы: штатив для пробирок, пробирки, раствор сульфата железа(II), раствор хлорида железа(III), раствор красной кровяной соли, раствор желтой кровяной соли, раствор роданида калия. 1. Накапайте в пробирку 7-10 капель раствора сульфата железа(II). 2. Прикапайте 2-3 капли раствора красной кровяной соли. 3. Какого цвета осадок выпал при этом взаимодействии? 4. Накапайте в пробирку 7-10 капель раствор хлорида железа(III). 5. Прикапайте 2-3 капли раствора желтой кровяной соли. 6. Какого цвета осадок выпал при этом взаимодействии? 7. Накапайте в пробирку 7-10 капель раствор хлорида железа(III). 8. Прикапайте 2-3 капли раствора роданида калия. 9. Какое окрашивание при этом наблюдается. 10. Вывод: Что показывают качественные реакции? Подведение итогов 1. Выставление оценок по химии за выполнение задания на повторение изученного. 2. Выставление оценок по английскому языку. 3. Учащиеся сдают на проверку решения экспериментального задания. Домашнее задание.(Слайд № 16) 1. Какова масса железной руды, содержащей 80% оксида железа (III), которая понадобится для получения 5,6 кг железа алюминотермическим способом? 2. Заполнить таблицу. Перевод на английский язык областей использования соединений железа. Воспользуйтесь учебником химии (О.С.Габриелян, 9 класс, § 14). Формула Название вещества Название Класс вещества Использование вещества природного русский соединения (english) Fe железо Самородное Простое Сердечники железо вещество электромагнитов (magnets) Fe Сталь - сплав Fe3O4 Fe2O3 2Fe2O3· 3H2O кристаллогидрат … FeS2 пирит, железный колчедан FeSO4· 7H2O кристаллогидрат … FeCl3 Fe2(SO4)3·7H2O кристаллогидрат …

