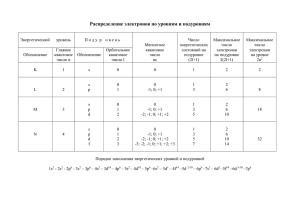
Распределение электронов по уровням и подуровням
реклама
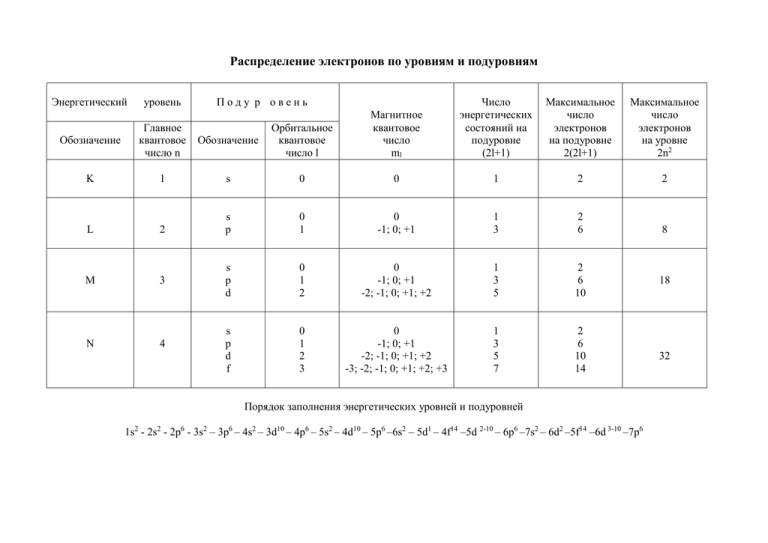
Распределение электронов по уровням и подуровням Энергетический уровень Поду р овень Число энергетических состояний на подуровне (2l+1) Максимальное число электронов на подуровне 2(2l+1) Максимальное число электронов на уровне 2n2 Обозначение Главное квантовое число n Обозначение Орбитальное квантовое число l Магнитное квантовое число ml K 1 s 0 0 1 2 2 L 2 s p 0 1 0 -1; 0; +1 1 3 2 6 8 M 3 s p d 0 1 2 0 -1; 0; +1 -2; -1; 0; +1; +2 1 3 5 2 6 10 s p d f 0 1 2 3 0 -1; 0; +1 -2; -1; 0; +1; +2 -3; -2; -1; 0; +1; +2; +3 1 3 5 7 2 6 10 14 N 4 Порядок заполнения энергетических уровней и подуровней 1s2 - 2s2 - 2p6 - 3s2 – 3p6 – 4s2 – 3d10 – 4p6 – 5s2 – 4d10 – 5p6 –6s2 – 5d1 – 4f14 –5d 2-10 – 6p6 –7s2 – 6d2 –5f14 –6d 3-10 –7p6 18 32 Задачи по теме «Строение атома. Химическая связь» 1. Какие значения может принимать орбитальное квантовое число, если главное квантовое число равно а)5? b)6? 2. Какие значения может принимать магнитное квантовое число, если главное квантовое число равно а)4? b)5? 3. Каковы значения главного, орбитального и магнитного квантовых чисел внешнего электрона атома рубидия в нормальном состоянии? 4. Каковы значения главного, орбитального и магнитного квантовых чисел электронов, расположенных на внешнем энергетическом уровне атома алюминия в нормальном состоянии? 5. Каковы значения главного, орбитального и магнитного квантовых чисел внешнего электрона атома серы в нормальном состоянии? 6. Каковы значения главного, орбитального и магнитного квантовых чисел внешнего электрона атома хлора в нормальном состоянии? 7. Какой из подуровней в атомах заполняется раньше: а) 4d или 5s b) 4d или 5p c) 5p или 6s d) 4f или 5p 8. Как объяснить, что в четвертом периоде имеются 10 элементов, с которых начинаются В-группы? 9. Для атома с электронной структурой1s22s22p3 впишите в таблицу значения четырех квантовых чисел, определяющих каждый из электронов в нормальном состоянии. Номер электрона n l ml ms 1 2 3 4 5 6 10. Сколько свободных d-орбиталей содержится в атомах Sc, Ti, V? Напишите электронные формулы атомов этих элементов. 11. Атому какого формул: a) b) c) d) e) из элементов отвечает каждая из приведенных ниже электронных 1s22s22p63s23p5 1s22s22p3 1s22s22p63s23p63d34s2 1s22s22p63s23p63d104s1 1s22s22p63s23p63d104s24p64d105s25p65d16s2 Укажите порядковый номер элемента, его название и к какой группе он относится. 12. Электронная формула атома химического элемента: а) …3d104s24p4 b) …3d24s2 c) …4d105s1 d) …3s23p6 e) …3d104s24p2 f) …4d105s25p4 Определить порядковый номер элемента и его название. К какой группе он относится? 13. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n=3, l=0, ml=0. Атомы каких элементов имеют такой электрон? 14. Напишите электронные формулы для атомов натрия, меди, железа, аргона, цинка. 15. Пользуясь правилом Хунда , распределите электроны по орбиталям, отвечающим низшему энергетическому состоянию атомов: азота, кислорода, кремния, марганца, брома. 16. Для атома углерода возможны два различных электронных состояния. Написать их электронные формулы. Как называют эти состояния атома? Как перейти от первого состояния ко второму? 17. Порядковый номер элемента равен 25. Определить его наивысшую степень окисления. 18. Порядковый номер элемента равен 34. Определить его наивысшую степень окисления. 19. Атом элемента имеет следующую электронную формулу: 1s22s22p63s23p63d54s2. Укажите а)порядковый номер элемента в периодической системе; b) число завершенных энергетических уровней; с)максимальную степень окисления, которую может иметь рассматриваемый элемент. 20. Атомам каких элементов и каким состояниям этих элементов отвечают следующие электронные формулы: a) 1s22s2 b) 1s22s12p1 c) 1s22s22p1 d) 1s22s12p2 21. Пользуясь правилом Хунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов: фосфора, алюминия, кремния, серы, хлора, ванадия. 22. Пользуясь правилом Хунда, распределите электроны по орбиталям для следующих ионов: Zn2+; Mn2+; Se2-; P3-23. Напишите все квантовые числа для электронов атомов: лития, бериллия, бора, углерода, азота, кислорода, фтора, неона. 24. Напишите значения магнитного и спинового квантовых чисел для тех 14 электронов, у которых главное и орбитальное квантовые числа соответственно равны 4 и 3. 25. Представьте электронную конфигурацию атома хлора и укажите, сколько электронных пар в атоме хлора и какие орбитали они занимают? Сколько неспаренных электронов в атоме хлора? 26. Среди приведенных ниже электронных конфигураций укажите невозможные и объясните причину невозможности их реализации: a) 1p3 b) 3p6 c )3s2 d) 2s2 e) 2d5 f) 5d2 g) 3f12 h) 2p4 i) 3p7 27. Сколько вакантных 3d-орбиталей имеют возбужденные атомы хлора, ванадия, марганца? 28. Перечислите электронные аналоги среди элементов a) VIА группы b)VА группы c)IА группы периодической системы элементов. Напишите в общем виде электронные формулы валентных электронных подуровней атомов этих элементов. 29. Имеется шесть изотопов кальция с массовыми числами 40, 42, 43, 44, 46 и 48. Сколько протонов и нейтронов в ядрах этих изотопов? 30. Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назовите элемент, изотопом которого является данный атом. Приведите запись его символа с указанием заряда ядра и массового числа. 31. Природный магний состоит из изотопов 24Mg, 25Mg, 26Mg. Вычислите среднюю атомную массу природного магния, если содержание отдельных изотопов соответственно равно 78,6%, 10,1% и 11,3%. 32. Изобразите электронно-графические формулы (в виде схемы распределения электронов по квантовым ячейкам) для следующих атомов: a)бора; b)фтора; c)алюминия и d)калия. 33. Изобразите электронно-графические формулы для следующих ионов: a)K+; b)Cl-; c)Ca2+; d)O2-; e)Al3+; f)H-. 34. Напишите электронные конфигурации следующих атомов и ионов: Na+; Mg2+; Si; P; S; S2-; Ar. 35. Напишите электронную формулу и покажите распределение электронов по орбиталям для элемента, атом которого содержит в основном состоянии на 2рподуровне один электрон. 36. Напишите электронную конфигурацию каждого из приведенных ионов и для каждого из них назовите изоэлектронный благородный газ: Li +, N3-, Be2+, K+, S2-, Zn2+. 37. Какую ковалентность может проявлять сера в своих соединениях? Изобразите структуру атома серы в нормальном и возбужденном состояниях. 38. Почему углерод в большинстве своих соединений четырехвалентен? 39. Объясните, почему максимальная ковалентность фосфора может быть равной пяти, а у азота такое валентное состояние отсутствует. 40. Какая из связей: Ca-H, C-S, I-Cl является наиболее полярной? К какому из атомов смещено молекулярное электронное облако? 41. Расположите в порядке возрастания степени ионности связи B-Cl, Na-Cl, Ca-Cl, Be-Cl. 42. В каком из приведенных соединений: LiF, BeF2, BF3, CF4 связь Э-F будет больше всего приближаться к ковалентной? 43. Как изменяется прочность химических связей в молекулах следующих веществ: HF, HCl, HBr, HI? 44. Какие типы связей представлены в молекуле NH4Cl? 45. В какой из молекул, формулы которых приведены ниже, есть две неподеленные пары электронов: a)NH3, b)CH4, c) H2O, d)H2? 46. Укажите элементы, которые могут проявлять валентность, равную номеру группы: а)углерод, b)азот, с)кислород, d)сера. 47. В каждой из приведенных пар соединений выберите вещество, которое, по Вашему мнению, имеет бóльшую температуру кипения: a) C2H5OH и C2H6; b) CH3CH2NH2 и CH3CH2OH; c)HF и НBr . Объясните Ваш выбор. 48. Покажите механизм образования связей в ионе гидроксония Н3О+. Какую валентность имеет кислород в этом ионе? 49. Покажите механизм донорно-акцепторного взаимодействия между молекулами NH3 и AlF3. Какое соединение при этом образуется? Чему равна валентность азота и алюминия в полученном соединении? 50. Изобразите схематически водородные связи а) в жидком этаноле; b) в растворе этанола в воде; с) в жидком аммиаке. Сколько водородных связей может образовать одна молекула воды? Одна молекула аммиака?