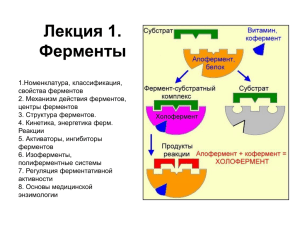
Ферменты План лекции 1.Общие свойства катализаторов 2.Классификация и номенклатура ферментов. 3.Строение ферментов. Механизм действия ферментов. 4. Регуляция активности ферментов. 5. Применение ферментов в медицине. Что такое катализаторы? • Катализаторы - это вещества, которые изменяют скорость химической реакции, но в ходе этой реакции не расходуются. • Ферменты (энзимы) - это высокоспецифичные белки, выполняющие функции биологических катализаторов. Скорость реакции Общие свойства катализаторов Не влияют на энергетический итог реакции. Не влияют на направленность обратимой реакции, которая определяется только соотношением концентраций исходных веществ (субстратов) и конечных продуктов; не влияют на положение равновесия обратимой реакции, а только ускоряют его достижение. Катализаторы сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает и без них. Особенности ферментов как биологических катализаторов 1. Высокая эффективность действия. Ферменты могут ускорять реакцию в 108-1012 раз. 2. Высокая избирательность ферментов к субстратам и к типу катализируемой реакции. 3. Высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды : а) температура, б) рН, в) ионная сила раствора и т.д. Номенклатура ферментов Первоначально ферментам давали названия, образуемые путем добавления окончания – аза к названию субстрата, на который данный фермент действует. Пример: крахмал (амилон -греческого) – фермент амилаза жиры (липос) - фермент липаза белки (протеины) – протеиназы. Тривиальные названия (исторически сложившиеся названия) – пепсин, трипсин, химотрипсин Современная номенклатура, введённая Международным биохимическим союзом • Ферменты называют и классифицируют по типу катализируемой реакции и её механизмом Классы Катализируемая реакция Подклассы 1. Оксидоредуктазы окислительновосстановительные реакции оксидазы и оксигеназы : гидроксилазы дегидрогеназы 2. Трансферазы переноса химических групп с молекулы одного вещества на молекулу другого вещества. - аминотрансферазы - фосфотрансферазы - метилтрансферазы - ацилтрансферазы 3. Гидролазы разрушения химических связей с участием воды. пептидазы гликозидазы эстеразы (фосфоэстеразы – фосфатазы) 4. Лиазы разрушения химических связей без участия воды. по типу разрываемой связи: – С–С–, –С–О–, –C–N–лиазы 5. Изомеразы реакции изомерных превращений. цис-транс-изомеразы; рацемазы, эпимеразы 6. Лигазы (синтетазы) реакции синтеза. образование новых связей с использованием. АТФ. Строение фермента Строение ферментов • Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента. (Субстрат – вещество вступающие в реакцию с ферментом) • Активный центр фермента образован из ограниченного количества остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Активный центр Активный центр образуется на уровне третичной структуры белка-фермента на активный центр приходится относительно малая часть объёма фермента (5-10 аминокислотных остатков). Роль остальных аминокислот, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную конформацию для оптимального протекания химической реакции Активный центр – это сложная трёхмерная структура, в образовании которой принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка Активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата. Строение активного центра Активный центр участок связывания каталитический участок обеспечивает комплементарное связывание субстрата химическое превращение субстрата Строение фермента ферменты Простые или однокомпонентные Сложные или двухкомпонентные Однокомпонентные (простые) – состоят только из остатков аминокислот. Например гидролитические реакции, катализируемые пищеварительными ферментами( пепсин, трипсин,) Лизоцим – находится в слюне и обладает бактерицидным действием Двукомпонентные – состоят из белковой части (апофермент) и коферментов. холофермент апоферменет кофермент Кофермент может быть связан с апоферментом ковалентными или нековалентными связями. коферменты Неорганические молекулы (кофакторы) Ковалентные связи Органические молекулы Нековалентные связи Металлы, как кофакторы ферментов необходимы для проявления каталитических функций следующих ферментов: Fe2+ и Fe3+ Цитохромоксидаза Cu2+ - Mg2+ Цитохромоксидаза Тирозиназа Карбангидраза ДНК-полимераза, алкогольдегидрогеназа, Альдолаза Гексокиназа АТФ-аза Пируваткиназа Фосфатаза Mn 2+ Аргиназа Se 2+ Глутатионпероксидаза Ni2+ Уреаза К+ Пируваткиназа АТФ-аза Нитратредуктаза Zn2+ Мо Каталаза Пероксидаза Роль коферментов • Коферменты являются переносчиками различных групп на промежуточных стадиях метаболизма. • . Коферменты – производные витаминов и АМФ. Важнейшие коферменты и простетические группы ферментов Наименование Никатинамидадениндинуклеотид (NAD, NADР) Участвующий витамин Группы, подлежащие переносу Никотинамид, витамин РР Атомы водорода (электроны) Флавинмононуклеотид, рибофлавинфосфат Рибофлавин, (FMN, FAD) витамин В2 Атомы водорода (электроны) Коэнзим А (СоА) Пантотеновая кислота Ацильные, ацетильные и др. группы Тетрагидрофолиевая кислота (ТГФ) Фолиевая кислота Метильные, метиленовые, формильные группы или фориминогруппы (одноуглеродные остатки) Биоцитин Биотин, витамин Н Двуокись углерода (активная форма СО2) Тиаминдифосфат (TDP) Тиамин, (витамин В1 ) Альдегиды и кетоны Пиридоксаль-5-фосфат (P5P) Пиридоксин, (витамин В6) Аминогруппы, карбоксильные группы Дезоксиаденозил- и (метил)-кобаламин (В12 - витамин В12 коферменты) Атомы водорода, протоны и электроны К коферментам относят также такие соединения, как 1) гемы, являющиеся простетической группой ферментов (цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы) 2) нуклеотиды - доноры и акцепторы остатка фосфорной кислоты; 3) убихинон (кофермент Q) - это липофильная молекула с окислительно-восстановительными свойствамии, участвующая в переносе электронов и протонов в ЦПЭ; 4) фосфо-аденозил-фосфо-сульфат, участвующий в переносе сульфата; 5)S-аденозил-метионин (SAM) - донор метильной группы; 6) глутатион, участвующий в окислительновосстановительных реакциях. Механизм действия ферментов I – этап:; сближения и ориентации субстрата в активном центре фермента II- этап : узнавание фермента своего субстрата; III – этап: образование активного ферментсубстратного комплекса в каталитическом центре; IV- образование продуктов и десорбция фермента в неизменном виде Теории соответствия фермента и субстрата • Аллостерический центр - участок молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит - обратимо) с теми или иными веществами (лигандами). такое связывание приводит к конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу. Такие вещества называются аллостерическими активаторами или аллостерическими ингибаторами данного фермента. 4. Регуляция активности фермента Аллостерическая регуляция 1. ингибирование Аллостерическая регуляция В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. В регуляции синтеза холестерола ингибитором ключевого фермента этого процесса гидроксиметилглутарил-КоАредуктазы выступает сам холестерол, что быстро и точно регулирует его количество в клетке. Регуляция активности ферментов Ограниченный (частичный) протеолиз проферментов Примером служит активация протеолитических ферментов желудочнокишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывания крови, лизосомальных ферментов (катепсины). 3. Ковалентная (химическая) модификация Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии 4. Белок-белковое взаимодействие 5. • ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ФЕРМЕНТОВ ВИДЫ СПЕЦИФИЧНОСТИ • абсолютная – способность фермента катализировать превращение только одного субстрата. • Например ферменты аргиназа и уреаза. • относительная или групповая – способность ферментов катализировать превращение группы веществ имеющих сходное строение. Это сродство к типу связи. • Например, относительной специфичностью обладают протеолитические ферменты желудочно-кишечного тракта пепсин и трипсин, участвующие в переваривании белков и гидролизующие пептидные связи, липаза, гидролизующая сложноэфирные связи. • Стереоспецифичность – способность ферментов катализировать превращение только одного из стереоизомеров: D или L, цис- или –транс-изомеров. термолабильность • V • Мкмоль/мин max Каталитическая активность снижается 40 t0С Зависимость активности фермента от рН среды • V • Мкмоль/мин max Каталитическая активность снижается 2 7 10 рН Пепсин трипсин щелочная фосфатаза Зависимость скорости ферментативной реакции от концентрации субстрата. Vmax 1/2Vmax Km [S] Уравнение Михаэлиса-Ментена Медицинская энзимология – это раздел биохимии, изучающий применение ферментов в медицине. В области медицинской энзимологии выделяют три основных направления исследований: 1. энзимодиагностика, 2. энзимопатология 3. энзимотерапия. Принципы энзимодиагностики основаны на следующих позициях: • при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток; • количество высвобождаемого фермента достаточно для его обнаружения; • активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений; • ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность); • существуют различия во внутриклеточной локализации ряда ферментов. Определение в крови активности органоорганеллоспецифических ферментов и изоферментов широко используется в клинической диагностике: Инфаркт миокарда Панкреатит АСТ, АЛТ, КФК МВ, ЛДГ1,2 Панкреатическая амилаза, γ-глутамилтранспептидаза, липаза Гепатит АЛТ, АСТ, ЛДГ4,5, γ-глутамилтранспептидаза, глутаматдегидрогеназа Органоспецифические ферменты ИЗОФЕРМЕНТЫ Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату. Например, димерный фермент креатинкиназа представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 состоит из субъединиц типа B, локализуется в головном мозге, креатинкиназа-2 – по одной М и В субъединице активна в миокарде, креатинкиназа-3 –две М-субъединицы, специфична для скелетной мышцы. Также существует пять изоферментов лактатдегидрогеназы (ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2) Благодаря этому различию, в скелетных мышцах, несущих ЛДГ-5, часть энергии (особенно в бескислородных условиях) образуется при превращении глюкозы через пируват в лактат. Миокард не образует лактат, зато может использовать для получения энергии молочную кислоту, захватываемую из крови, но только в аэробных условиях. Аналогично лактат используется нервной системой. Энзимопатии • Заболевания, которые возникают при отсутствии или нарушении активности ферментов. Энзимопатии первичные (наследственные) вторичные (приобретённые) Наследственные энзимопатии по типу нарушений метаболизма делят на: 1. нарушения обмена аминокислот: фенилкетонурия, альбинизм, алкаптонурия и др.; 2. нарушения углеводного обмена: галактоземия, наследственная непереносимость фруктозы, гликогенозы; 3. нарушения липидного обмена: липидозы; 4. нарушения обмена нуклеиновых оснований: подагры, синдрома Леш-Нихана и др.; 5. нарушение обмена в соединительной ткани: мукополисахаридозы, хондродистрофия и др.; 6. дефекты ферментов в ЖКТ: муковисцидоз, целиакия, непереносимость лактозы и др. 7. нарушения обмена стероидов и т.д. фенилпировиноградная олигофрения – наследственное заболевание, приводящее в раннем детстве к гибели ребенка или к развитию тяжелой умственной отсталости. Молекулярный дефект заключается в блокировании превращения незаменимой аминокислоты Фен в Тир: Пример: H2 C H C O2 COOH Фен-4-гидроксилаза H2 C HO NH2 Фен H C NH2 Тир COOH Аллиментарные энзимопатии – это стойкие нарушения активности ферментов, связанные с характером питания: - отсутствием или снижением в пище количества белка; - дефицитом в пище витаминов, макро- и микроэлементов, некоторых низкомолекулярных биологически активных веществ; -нарушением соотношения в пище белков, жиров и углеводов; Энзимотерапия – это использование ферментов в качестве лекарственных средств. Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и т.п.), используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте. Тканевой фермент гиалуронидаза используется организмом для обратимого изменения проницаемости межклеточного вещества. Лекарственную форму гиалуронидазы – лидазу – вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом. Основные ферменты, которые используются в клинической диагностике • Аспартатаминотрансфераза (ACT) У млекопитающих наиболее высокая активность и концентрация ACT отмечена в печени, нервной ткани, скелетной мускулатуре и миокарде • Аланинаминотрансфераза (АЛТ) АЛТ присутствует во многих • органах: печени, почках, скелетных мышцах, миокарде, поджелудочной железе Амилаза Определение активности α-амилазы в сыворотке крови - наиболее распространенный тест диагностики острого панкреатита • Креатинкиназа (КК)- при мышечной дистрофии, инфаркте миокарда, после хирургических операций • Лактатдегидрогеназа (ЛДГ) после приступа стенокардии, при гепатите, гипоксии печени (включая застой крови в печени вследствие сердечной недостаточности), лекарственной интоксикации, циррозе, опухолях и травме. • Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Энзимодиагностика заключается в постановке диагноза заболевания или синдрома на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях: 1. При повреждении клеток в биологических жидкостях увеличивается концентрация внутриклеточных ферментов поврежденных клеток; 2. Количество высвобождаемого фермента достаточно для его обнаружения; 3. При повреждении клеток активность ферментов в биологических жидкостях стабильна в течение длительного времени и отличается от нормальных значений; 4. Ряд ферментов являются органо- и органелоспецифичными Современные подходы к диагностике заболеваний При любых заболеваниях всегда имеет место нарушения различных звеньев обмена веществ, вызванные изменениями активности ферментов. В зависимости от того, какой фермент изменяет свою активность, нарушается соответствующее звено обмена, что приводит к формированию соответствующего патологического процесса. Такой подход к становлению болезни, к сожалению пока не имеет место в клинической практике. Чаще всего для диагностики используются данные об изменении активности органо-специфичных ферментов. Этот подход позволяет только указать место сформировавшегося патологического процесса, не вскрывая механизма его становления. Стратегия функциональной диагностики только что формирующегося патологического процесса, должна строиться из определения статуса конкретных звеньев метаболизма путем выбора соответствующей группы ферментов подлежащих изучению. В этой связи необходимо четко представлять все метаболические пути и ферменты этих путей и своевременно проводить их определение. Большинство ферментов, имея четыре уровня структурной организации, состоят из нескольких субъединиц (протомеров). Вследствие этого ферментам присуща множественность форм субъединичной их молекулярной организации. Один и тот же фермент может быть построен из разного набора субъединиц, формирующих изоэнзимный (изоферментный) ряд. Изоферменты - это генетически детерминированая физико-химическая разновидность молекулярных форм фермента, катализирующих одну и ту же реакцию. Например, лактатдегидрогеназа имеет пять изоформ (ЛДГ1-5) Наиболее изучены изоферменты лактатдегидрогеназы (ЛДГ). К ним относятся ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5 имеющих разную локализацию по тканям и органам, т.е. изоферменты органоспецифичны Каждый орган имеет характерный для него набор ферментов, которые при развитии в этом органе патологического процесса выходят в кровь. Например в сердце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2. В печени, скелетной мускулатуре преобладают ЛДГ5 и ЛДГ4. С целью диагностики в сыворотке крови определяют активность нескольких органоспецифических ферментов (так называемый ферментный спектр), характерных для данного органа, ткани. Так, при инфаркте миокарда определяют активность ЛДГ1, аспартатаминотрансферазы, креатинфосфокиназы, бэта-гидроксибутиратдегидрогеназы. При поражении печени (болезни Боткина) определяют активность ЛДГ4, ЛДГ5, аланинаминотрансферазы (АЛТ), сорбитдегидрогеназы. По увеличению активности в сыворотке крови клеточных, органоспецифических ферментов можно судить о локализации патологического процесса. Аминотрансферазы. Локализуются в митохондриях, обеспечивают взаимопревращения аминокислот и кетокислот. АСТ много в миокарде, по убыванию меньше в печени, скелетной мускулатуре, ЦНС, почках, семенниках. Активность в сыворотке крови 6-25 МЕ/л. АЛТ много в печени, поджелудочной железе, миокарде, скелетной мускулатуре. Активность в сыворотке крови 626МЕ/л. Активность обеих трансаминаз в сыворотке крови возрастает в десятки раз при инфаркте миокарда (АСТ>АЛТ), при остром инфекционном гепатите (АЛТ>АСТ), а также при циррозе печени, мышечной дистрофии. Ферменты как лекарственные средства фермент использование Лечения лейкозов аспарагиназа уреаза Удаление мочевины из организма в аппаратах» искуственная почка» гиалуронидаза Рассасывание рубцов Стрептокиназа, урокиназа Предотвращение тромбообразования при операциях Трипсин, химотрипсин Рибонуклеаза, дезоксирибонуклеаза Обработка гнойных ран Нарушения пищеварения Противовирусные препараты для лечения герпетических кератитов, аденовирусных конъюктивитов Энзимотерапия • • • • • • I). Лекарственные препараты на основе ферментов. В качестве лекарственных препаратов наиболее широко используются протеолитические ферменты. 1). Протеолитические ферменты применяются при нарушении пищеварения. Например: а). Экстракты слизистой оболочки желудка, основным действующим веществом которых является пепсин. Это препараты абомин и ацидинпепсин, их в основном используют для коррекции секреторной дисфункции желудка. б). Панкреатические энзимы, представленные амилазой, липазой, трипсином и химотрипсином. Это препараты панкреатин, мезим-форте, панцитрат, креон, их используются для коррекции нарушений процесса пищеварения, а также для регуляции функций поджелудочной железы. в). Комбинированные ферменты, содержащие панкреатин в комбинации с компонентами желчи, гемицеллюлозой. Это препараты дигестал, фестал, панзинорм-форте, энзистал. Их назначают при недостаточной внешнесекреторной функции поджелудочной железы, в сочетании с патологией печени, желчевыводящей системы, при нарушении жевательной функции, малоподвижном образе жизни, кратковременных погрешностях в еде. . Иммобилизованные ферменты Это ферменты закрепленные на полимерной основе. Такие ферменты имеют ряд преимуществ: – дополнительные ковалентные связи делают их более устойчивыми к действию повреждающих факторов (температуры, протеолитических ферментов) – можно обеспечить высокую локальную концентрацию в зоне применения – за счет подбора носителя можно добиться избирательности действия. -Тромболитические ферменты, предназначенные для борьбы с сердечнососудистыми заболеваниями. Так, в отечественную клиническую практику внедрен препарат «стрептодеказа», содержащий стрептокиназу -- активатор предшественника протеиназы плазмина, предотвращающий образование тромба в кровеносной системе. -Ферменты, разрушающие некоторые незаменимые аминокислоты (например, аспарагиназа), используют для борьбы со злокачественным ростом опухолей. -Протеолитические ферменты (трипсин, химотрипсин, субтилизин, коллагеназа), иммобилизованные на волокнистых материалах (целлюлоза, полиамидные волокна, декстран и др.), применяют для эффективного лечения ран, язв, ожогов, абсцессов, а их белковые ингибиторы -- в заместительной терапии для лечения эмфиземы и панкреатитов.