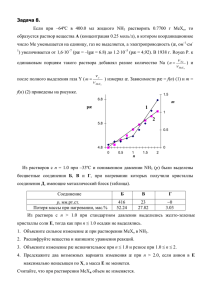
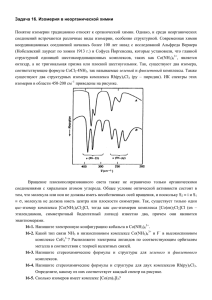
11. 12.Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в воде или при плавлении. Диссоциация на ионы происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость (Схема электролитической диссоциации). Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы. Классическая теория электролитической диссоциации Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа: Константа диссоциации Kd определяется активностями катионов недиссоциированных молекул следующим образом: , анионов и Значение Kd зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения: Слабые электролиты Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе. К слабым электролитам относятся: 1) почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2) некоторые неорганические кислоты (H2CO3, H2S и др.); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4) вода. Они плохо (или почти не проводят) электрический ток. + СH3 3COO + H + Cu(OH)2 + OH- (первая ступень) 2+ [CuOH]+ + OH- (вторая ступень) + H2CO3 + HCO- (первая ступень) + HCO3 + CO32- (вторая ступень) 13.Сурьма́ — элемент главной подгруппы пятой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 51. Обозначается символом Sb (лат. Stibium). Простое вещество сурьма (CAS-номер: 7440-36-0) — металл (полуметалл) серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма) [1]. Конфигурация внеш. электронной оболочки атома 5s25p3; степени окисления +3 и +5, редко — 3; Висмут- Конфигурация внеш. электронной оболочки 6s26p3; степени окисления +3, +5 и — 3, очень редко + 1 и + 2; Мышья́к — химический элемент с атомным номером 33 в периодической системе, обозначается символом As. Представляет собой хрупкий полуметалл стального цвета. онфигурация внеш. электронной оболочки 4s24p3; степени окисления — 3, + 3 и +5; 2Sb + 6H2SO4 = Sb2(SO4)3 + 3SO2 + 6H2O. 3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O С фтором сурьма образует пентафторид SbF5. При его взаимодействии с плавиковой кислотой HF возникает сильная кислота H[SbF6]. Сурьма горит при внесении её порошка в Cl2 с образованием смеси пентахлорида SbCl5 и трихлорида SbCl3: 2Sb + 5Cl2 = 2SbCl5, 2Sb + 3Cl2 = 2SbCl3. С бромом и иодом Sb образует оригалогениды: 2Sb + 3I2 = 2SbI3. 14.Серни́стая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Химическая формула По первой ступени H2SO3 диссоциирует как кислота средней силы, по второй - как слабая кислота. Сернистая кислота - сильный восстановитель: а) окисляется кислородом воздуха в серную кислоту: 2H2SO3 + O2 = 2H2SO4 б) взаимодействует с водными растворами галогенов: H2SO3 + Br2 + H2O = H2SO4 + 2HBr При взаимодействии с сильными восстановителями сернистая кислота проявляет свойства окислителя: а) окисляет сероводородную воду: H2SO3 + 2H2S = 3S + 2H2O Кислые соли сернистой кислоты - гидросульфиты, средние - сульфиты. Соли сернистой кислоты - восстановители: а) медленно окисляются кислородом: 2Na2SO3 + O2 = 2Na2SO4 б) обесцвечивают бромную и иодную воду: K2SO3 + Br2 + H2O = K2SO4 + 2HBr в) обесцвечивают подкисленный раствор пермарганата калия: K2SO3 + KMnO4 + H2SO4 = K2SO4 + MnSO4 + H2O г) сульфиты щелочных металлов при прокаливании диспропорционируют: 4Na2SO3 = Na2S + 3Na2SO4 д) восстановительные свойства сульфита натрия проявляются в образовании тиосульфита натрия: Na2SO3 + S = Na2S2O3 - при кипячении Тиосульфат натрия содержит серу в степенях окисления -2 и +6: Серни́стая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Химическая формула . Химические свойства Кислота средней силы: Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена): Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2. Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи): и средние — сульфиты (в избытке щёлочи): Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями: При взаимодействии с ещё более сильными восстановителями может играть роль окислителя: Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия: 15.Аммиакаты — продукты взаимодействия солей с аммиаком, комплексные соединения. Их получают либо взаимодействием солей с NH3 в водном растворе, либо действием газообразного или жидкого NH3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции: Cu2+ + 4NН3 → [Cu(NH3)4]2+ Аммиакаты различаются как по составу [Ag(NH3)2]+, [Ni(NH3)4]2+, так и по устойчивости в водных растворах, используются в аналитической химии для обнаружения и разделения ионов металлов. Аммиакаты – это комплексные соединения, в которых функции лигандов выполняют молекулы аммиака NH3. Более точное название комплексов, содержащих аммиак во внутренней сфере – аммины; однако молекулы NH3 могут находиться не только во внутренней, но и во внешней сфере соединения – аммиаката. Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком: AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2O NiSO4 + 6 NH3 . H2O = [Ni(NH3)6]SO4 + 6 H2O CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2 В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака: AlCl3(s) + 6 NH3(ж) = [Al(NH3)6]Cl3(s) Химическая связь молекул аммиака с комплексообразователем устанавливается через атом азота, который служит донором неподеленной пары электронов. Образование амминокомплексов в водных растворах происходит путем последовательного замещения молекул воды во внутренней сфере аквакомплексов на молекулы аммиака: [Cu(H2O)4]2+ + NH3 . H2O [Cu(H2O)3(NH3)]2+ + 2 H2O; [Cu(H2O)3(NH3)]2+ + NH3 . H2O [Cu(H2O)2(NH3)2]2+ + 2H2O Самые устойчивые среди аммиачных комплексов: 3+ . 35 3)6] 6 = 1,6 10 ), [Cu(NH3)4]2+ 4 = 7,9 . 1012), 2+ . 9 3)4] 4 = 4,2 10 ) и некоторые другие. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Ni(NH3)6]Cl2 = NiCl2 + 6 NH3(г) [Cu(NH3)4]SO4 + 6 Br2 = CuSO4 + 12 HBr + 2 N2(г) [Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4 [Cu(NH3)4](OH)2 + Na2S + 4 H2O = CuS + 2 NaOH + 4 NH3 . H2O