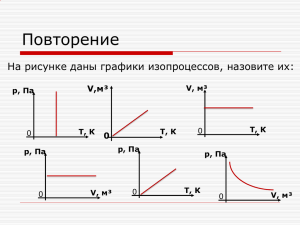
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Тульский государственный университет» В.В. ЖИГУНОВ, К.В. ЖИГУНОВ, С.Е. КАЖАРСКАЯ, Л.В. МУРАВЛЕВА Рекомендовано УМО РАЕ по классическому университетскому и техническому образованию в качестве учебного пособия для студентов высших учебных заведений, обучающихся по направлениям подготовки и специальностям: 04.03.01 – Химия, 06.03.01 – Биология, 08.03.01 – Строительство, 09.03.01 – Информатика и вычислительная техника, 12.03.01 – Приборостроение, 13.03.02 – Электроэнергетика и электротехника, 15.03.01 – Машиностроение, 19.03.01 – Биотехнология, 21.03.02 – Землеустройство и кадастры, 21.05.04 – Горное дело, 22.03.01 – Материаловедение и технология материалов Тула Издательство ТулГУ 2017 УДК 53(075.8) ББК 223я73 Ж 68 Рецензенты: д-р физ.-мат. наук, проф. Ю.В. Бобылёв (профессор кафедры общей и теоретической физики ТГПУ им. Л.Н. Толстого); д-р физ.-мат. наук, проф. Д.М. Левин (профессор кафедры физики ТулГУ) Жигунов В.В., Жигунов К.В., Кажарская С.Е., Муравлева Л.В. Задачи по молекулярной физике и термодинамике с решениями: учебное пособие. Тула: Изд-во ТулГУ, 2017. – 221 с. ISBN 978–5–7679–3910–7 В учебное пособие включены теоретические сведения из второго модуля курса физики – термодинамика и молекулярнокинетическая теория, дополненные примерами применения этих сведений для решения задач. Пособие предназначено для формирования у студентов первого курса, обучающихся по техническим направлениям бакалаврской подготовки, представлений об основных законах этого раздела вузовского курса физики и способах их использования при решении тестов и задач. ISBN 978–5–7679–3910–7 © В.В. Жигунов, К.В. Жигунов, С.Е. Кажарская, Л.В. Муравлева, 2017 © Издательство ТулГУ, 2017 ПРЕДИСЛОВИЕ Учебное пособие включает в себя методические указания по решению задач, задания для аудиторной и самостоятельной работы, а также краткое изложение теоретического материала разделов "Термодинамика" и "Молекулярная физика", позволяющее напомнить основные физические законы, которые, как предполагается, были предварительное изучены при работе с учебниками и учебными пособиями по курсу общей физики [1-3]. Содержание и структура данного учебного пособия соответствуют рабочим программам по дисциплине "Физика" для технических направлений бакалаврской подготовки, составленным в согласии с ФГОС ВПО третьего поколения. Это пособие должно способствовать овладению студентами нефизических специальностей основными представлениями термодинамики и молекулярной физики и призвано способствовать рациональной организации и активизации самостоятельной учебной их работы. Задачи подобраны в основном из задачников [4-9] и дополнены оригинальными заданиями. Авторы выражают благодарность рецензентам книги профессору Ю.В. Бобылёву и профессору Д.М. Левину за ряд замечаний и ценных советов. ОГЛАВЛЕНИЕ 8 ВВЕДЕНИЕ ОСНОВЫ ТЕРМОДИНАМИКИ 1. Уравнение состояния идеального газа. Адиабатический и политропический процессы 10 Примеры решения задач 19 Задания для аудиторной и самостоятельной работы 33 Работа и теплообмен при термодинамических процессах 38 Примеры решения задач 41 Задания для аудиторной и самостоятельной работы 53 3. Внутренняя энергия. Первое начало термодинамики 57 Примеры решения задач 60 Задания для аудиторной и самостоятельной работы 69 4. Теплоёмкость 75 Примеры решения задач 79 Задания для аудиторной и самостоятельной работы 92 5. Коэффициент полезного действия. Цикл Карно 96 Примеры решения задач 103 Задания для аудиторной и самостоятельной работы 124 6. Энтропия. Второе начало термодинамики 128 Примеры решения задач 133 Задания для аудиторной и самостоятельной работы 144 7. Реальные газы. Уравнение Ван-дер-Ваальса 150 Примеры решения тестов и задач 160 Задания для аудиторной и самостоятельной работы 174 ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ 8. Барометрическая формула. Распределение Больцмана. Распределение Максвелла 177 Примеры решения задач 186 Задания для аудиторной и самостоятельной работы 9. Явления переноса в газах Примеры решения задач Задания для аудиторной и самостоятельной работы БИБЛИОГРАФИЧЕСКИЙ СПИСОК ПРИЛОЖЕНИЯ 192 199 204 213 219 220 ВВЕДЕНИЕ Для исследования физических свойств тел, состоящих из очень большого числа структурных элементов (например, молекул, атомов, ионов и электронов), находящихся в непрерывном хаотическом движении, применяют два качественно различных метода: термодинамический и молекулярно-кинетический. Термодинамика – это раздел физики, в котором рассматривают свойства тел, находящихся в состоянии термодинамического равновесия, и общие закономерности процессов перехода между этими состояниями, сопровождающихся превращениями энергии. Термодинамика оперирует величинами, характеризующими изучаемое тело (систему) в целом, устанавливает связи между этими величинами, но при этом какая-либо определенная модель строения системы не используется. В основу термодинамики положены три фундаментальных принципа, называемые началами термодинамики, которые являются обобщением многочисленных наблюдений и выполняются независимо от конкретной природы тел. По этой причине закономерности и соотношения между физическими величинами, которые получают из этих принципов методами математического анализа, имеют универсальный характер. 8 Однако, позволяя находить большое количество соотношений между различными свойствами тел, термодинамический метод не даёт, как правило, возможности количественно охарактеризовать эти свойства без привлечения экспериментальных данных. Кроме того, термодинамический метод исключает рассмотрение механизмов изучаемых процессов. Молекулярно – кинетическая теория, напротив, позволяет анализировать механизмы явлений на основании создаваемых для каждого конкретного тела моделей его строения. В молекулярной физике свойства тел и протекающие в них процессы рассматривают как суммарный результат совокупного движения и взаимодействия составляющих его частиц (молекул). При этом оперируют не с характеристиками каждой частицы, а со значениями величин, усреднёнными по всем частицам с использованием методов теории вероятностей. Молекулярно-кинетическая теория и термодинамика, применяемые к одним и тем же объектам, позволяют получать результаты, дополняющие друг друга. 9 Термодинамика – это единственная физическая теория общего содержания, относительно которой я убеждён, что в рамках применимости её основных понятий она никогда не будет опровергнута А. Эйнштейн ОСНОВЫ ТЕРМОДИНАМИКИ. 1. Уравнение состояния идеального газа. Адиабатический и политропический процессы Предметом изучения термодинамики являются термодинамические системы. Термодинамическая система – это макроскопический объект или совокупность макроскопических объектов, каждый из которых состоит из очень большого числа частиц (например, атомов и молекул), находящихся в хаотическом движении. Нижний предел числа частиц в термодинамической системе обычно принимают равным 1018. Если термодинамическая система может взаимодействовать, обмениваясь энергией и веществом с внешней средой, т.е. с телами, не входящими в эту систему, то её называют открытой. Для закрытых систем имеет место обмен энергией с окружением, но нет обмена веществом. Изолированные системы не обмениваются с окружающей средой ни энергией, ни веществом. 10 Согласно первому исходному положению термодинамики каждая изолированная термодинамическая система самопроизвольно переходит в состояние термодинамического равновесия, т.е. в состояние, в котором она может оставаться сколь угодно долго и из которого может выйти только при внешнем воздействии. Если любая термодинамическая система выведена из состояния равновесия, то в ней самопроизвольно развиваются внутренние процессы, называемые релаксационными, благодаря действию которых система стремится перейти в равновесное состояние. Для описания свойств термодинамических систем, находящихся в равновесном состоянии, используют физические величины, называемые термодинамическими параметрами, которые характеризуют состояния макроскопических тел в целом, без учёта их молекулярного строения. Каждый параметр системы, находящийся в равновесном состоянии, не изменяется с течением времени. Различают экстенсивные параметры, которые прямо пропорциональны массе системы или числу частиц, например, объём V, и интенсивные, которые не зависят от массы системы или числа частиц, например, давление p. Параметры делят на внешние и внутренние. Значения внешних параметров определяются положением тел, с которыми данная система взаимодействует, но которые в неё не входят. Значения внутренних параметров зависят от координат и импульсов частиц, образующих систему. Каждый из параметров является мерой определённого свойства системы. Так объём V – мера свойства занимать пространство; давление p – мера свойства сопротивляться 11 внешнему изменению объёма. Давлением называют физическую величину, определяемую выражением dF p n dS где dFn – модуль нормальной силы, действующей на малый участок поверхности тела площадью dS . Второе исходное положение термодинамики вводит в рассмотрение интенсивный термодинамический параметр, называемый температурой. Температура служит для количественной оценки степени нагретости тела, его теплового состояния, которое на качественном уровне характеризуют словами "холодный", "теплый", "горячий". Температура, является мерой интенсивности теплового движения частиц, образующих систему. Во всех частях системы, находящейся в состоянии теплового равновесия, температура всегда имеет одно и то же значение. В состоянии равновесия внутренние параметры системы являются функциями внешних параметров и температуры. Уравнение, связывающее внутренний параметр с внешними параметрами и с температурой, называют термическим уравнением состояния термодинамической системы. Запишем это уравнение для идеализированной термодинамической системы, называемой идеальным газом. Идеальный газ – это математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия частиц, составляющих газ, можно пренебречь по сравнению с их кинетической энергией; частицы имеют исчезающе малые собственные размеры; соударения частиц друг с другом и со стенками сосуда абсолютно 12 упруги. Параметры состояния идеального газа связаны между собой уравнением m pV RT , M которое называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Уравнению состояния идеального газа можно придать другой вид: m 1 N pV RT p k N AT k A T nkT , M V Vмоль m N NA – количество молей, n – число молеM V V R кул газа в единице объёма (концентрация молекул), k NA где – постоянная Больцмана, N A – число Авогадро. Если с течением времени состояние термодинамической системы изменяется, что сопровождается изменением её термодинамических параметров, то это означает, что в системе происходит термодинамический процесс. Идеализированный процесс, который протекает так, что система проходит через последовательный ряд бесконечно близких равновесных состояний, называют равновесным. Более близким к реальности является представление о квазиравновесных процессах, в ходе которых неравновесности, возникающие в системе при протекании термодинамических процессов, обусловленные конечной скоростью распространения изменений состояния, в значительной степени нивелируются релаксационными процессами. Для 13 того чтобы неравновесностями можно было пренебречь, квазиравновесные процессы должны быть квазистатическими, т.е. очень медленно развивающимися. Изопроцессами называют такие термодинамические равновесные процессы в идеальном газе, при которых масса газа и один из его параметров не изменяются. К изопроцессам относят изохорический, изобарический и изотермический процессы. 1. Изохорический процесс – это процесс, протекающий при постоянном объёме. Уравнение процесса имеет p вид const . T 2. Изобарический процесс – процесс, в ходе которого не меняется давление. Изобарический процесс описывается V const . уравнением T 3. Изотермический процесс – это процесс, который осуществляется при постоянной температуре: T = const. Изотермическому процессу соответствует уравнение pV const . Адиабатический процесс Адиабатическим называют процесс, происходящий в системе, теплоизолированной от внешней среды. Другими словами, при адиабатическом процессе отсутствует теплообмен системы с окружающей средой. Уравнения адиабатического процесса могут быть записаны в виде: TV1 const , Tp 1 const , pV const . Уравнение адиабатического процесса, записанное в 14 форме pV const , обычно называют уравнением Пуассона. В приведённых выше уравнениях величина – это показатель адиабатического процесса, который, как это будет показано далее, равен i2 , i здесь i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы, т.е. i n пост n вращ 2n кол . Числом степеней свободы изучаемого объекта (в рассматриваемом случае – молекулы или атома) называют наименьшее число независимых скалярных величин, которые нужно задать для того, чтобы однозначно определить его положение в пространстве. Молекула одноатомного газа рассматривается как материальная точка, поэтому её положение в пространстве полностью определяется заданием трёх координат, т.е. одноатомная молекула обладает тремя степенями свободы, все из которых являются поступательными. Молекулу, атомы в которой не могут совершать колебательного движения, называют жёсткой. В случае двухатомной жёсткой молекулы газа, число степеней свободы равно пяти, при этом число поступательных степеней свободы такой молекулы равно nпост = 3, а число вращательных степеней свободы равно nвращ = 2 (рассматривается вращение вокруг двух взаимноперпендикулярных осей, ортогональных оси, проходящей через центры атомов). Вращение молекулы вдоль оси, проходящей через атомы, не учитывается. 15 Это объясняется тем, что, как показано в квантовой механике, энергия, необходимая для возбуждения вращательного движения вокруг некоторой оси, обратно пропорциональна моменту инерции молекулы относительно этой оси. Момент инерции двухатомной молекулы относительно оси, проходящей через центры атомов, настолько мал, что для возбуждения вращения вокруг этой оси требуются температуры в несколько тысяч градусов, при которых двухатомная молекула перестаёт существовать, распадаясь на атомы, которые, в свою очередь, могут диссоциировать на ионы и электроны. Молекула, состоящая из N атомов, которые могут участвовать в колебательном движении, имеет 3N поступательных, вращательных и колебательных степеней свободы. Для двухатомной нежёсткой молекулы, атомы которой могут совершать колебания вдоль прямой, соединяющей эти атомы, число колебательных степеней свободы определяют по формуле n кол 3N n пост n вращ 3 2 5 1 . Тогда число i для двухатомной молекулы, в которой возможно колебательное движение составляющих её атомов, будет равно i n пост n вращ 2 n кол = 7, так как n пост 3; n вращ 2; n кол 1 . Многоатомные молекулы, число атомов в которых N 3 , делят на линейные и нелинейные. В линейных молекулах атомы расположены вдоль одной прямой, поэтому многоатомная жёсткая линейная молекула имеет, как и двухатомная жёсткая молекула, три поступательные и две вра- 16 щательные степени свободы, т.е. всего пять степеней свободы. Примером линейной многоатомной молекулы является молекула углекислого газа (СО2). Многоатомная жёсткая нелинейная молекула имеет шесть степеней свободы ( n пост 3; n вращ 3 ). Многоатомные нежёсткие нелинейные молекулы, состоящие из N атомов, имеют всего 3N степеней свободы, из них – 3 поступательных, 3 вращательных и 3N – 6 колебательных степеней свободы. У многоатомной нежёсткой линейной молекулы существуют две степени свободы вращательного и три поступательного движения при общем числе степеней свободы 3N, поэтому для нее число колебательных степеней свободы n кол 3N 5 . Например, четырехатомная молекула аммиака, атомы в которой находятся в вершинах тетраэдра, характеризующаяся шестью жесткими связями, имеет 6 степеней свободы (из них 3 поступательные и 3 вращательные). Число i равняется 6. Предположим, что при повышении температуры становится возможным колебательное движение атомов в этой молекуле. Тогда у неё будет 3 4 12 степеней свободы (из них 3 поступательных, 3 вращательных и 3 4 6 6 колебательных). В этом случае число i 3 3 2 6 18 . Число степеней свободы молекулы зависит от температуры. В первом приближении можно считать, что при Т<102 К молекула обладает только поступательными степе- 17 нями свободы, при 102 K T 103 K она имеет поступательные и вращательные степени свободы, а выше 103 K дополнительно включаются колебательные степени свободы. Политропический процесс Политропическим называют процесс, при протекании которого теплоёмкость газа остаётся постоянной. Теплоёмкость системы – это физическая величина, численно равная количеству теплоты, которое необходимо сообщить этой системе для её нагревания на 1 градус по шкалам Кельвина или Цельсия. Уравнения политропического процесса имеют вид 1n n pV const ; TV const или T p const , где n называют показателем политропического процесса. Изопроцессы в идеальном газе являются частными случаями политропического процесса. Действительно, уравнение политропического процесса переходит в уравнение изобарического процесса при n 0 ; n 1 соответствует изотермическому процессу; при n будем иметь адиабатический процесс, а при n получим изохорический процесс. n n 1 18 Примеры решения задач 1. В вертикальном, закрытом с обоих торцов цилиндре, находится массивный поршень, по обе стороны которого имеется по одному молю воздуха. При T = 300 K отношение верхнего объёма к нижнему n = 4. При какой температуре газа это отношение станет равно k = 3? Дано Решение Отметим, что как при отношении объT = 300 K ёмов равном n, так и при отношении объёV1 n4 мов, равном k, система находится в состояV2 нии равновесия, когда сумма сил, действуюV1 k 3 щих на поршень, равна нулю. V2 T2 – ? На рисунке показаны действующие на поршень силы V при 1 n . Видим, что сила давления, действующая на V2 поршень со стороны газа, находящегося в объёме V2 , F2 p2 S уравновешивается суммой силы давления со стороны газа, находящегося в объёме V1 , F1 p1 S и силы тяжести поршня G mg . p2S p1S mg или p2S p1S mg . 19 (1) При изменении соотношения между величинами объёмов силы давления также должны измениться, и условие равновесия поршня запишется в виде F1 F2 mg 0 , где F1 p1 S , а F2 p2 S . Тогда p2S p1S mg . (2) Сравнивая (1) и (2), имеем p2 p1 p2 p1 . (3) Запишем уравнение Менделеева-Клапейрона для газа, находящегося в объёме V1 , и для газа в объёме V2 , и после преобразований получим p1V1 RT1 1 1 RT1 n 1 , (4) p2 p1 RT1 p2V2 RT1 V1 V2 V1 V где учтено, что V2 1 . n Составим систему уравнений Менделеева-Клапейрона, описывающих состояния газов в объёме над и под V поршнем при 1 k и T T2 . После их преобразований буV2 дем иметь p1V1 RT2 RT2 k 1 p2 p1 p2V2 RT2 V1 Из сравнения (3), (4) и (5) получаем RT1 RT n 1 2 k 1 , V1 V1 откуда при учёте, что n 4 и k 3 , следует 20 (5) 3T1 2T2 . V1 V1 (6) Соотношение между V1 и V1 получим из очевидного равенства, отражающего факт постоянства объёма всего цилиндра, V1 V2 V1 V2 . V1 V V1 1 или 4 3 15V1 V1 . (7) 16 Учитывая выражение (7), из (6) будем иметь 3T1 2T2 16 45 T2 T1 . V1 15 V1 32 После подстановки численных значений получаем окончательный результат 45 T2 300 422 K 32 Ответ: T2 = 422 K Тогда V1 2. В первом сосуде находится водород при температуре t1 = 107ºC и давлении p1 = 6·105 Па, а во втором сосуде азот при температуре t2 = 37 и давлении p2 = 106 Па. Объёмы сосудов соответственно V1 = 0,5 м3 и V2 = 0,8 м3. Сосуды соединяют друг с другом. При этом устанавливается температура t = 54ºC. Определить давление смеси газов, предполагая, что теплообмен с окружающей средой отсутствует. 21 Дано t1 = 107ºC p1 = 6·105 Па t2 = 37ºC p2 = 10·105 Па t = 54ºC V1 = 0,5 м3 V2 = 0,8 м3 p–? Решение При решении задачи используем закон Дальтона, согласно которому давление смеси химически не взаимодействующих идеальных газов равно сумме их парциальных давлений. Парциальным давлением называют давление, которое производит на стенки сосуда данный компонент смеси. Если смесь состоит из n газов, а парциальное давление i-ой компоненты равно pi , то давление смеси газов, согласно закону Дальтона, можно записать в виде n p pi . i 1 Если парциальное давление водорода обозначить как p1 , а парциальное давление азота – как p2 , то давление смеси водорода и азота, которое требуется определить в этой задаче, будет равно p p1 p2 . Таким образом, решение задачи сводится к нахождению парциальных давлений водорода и азота. Для их определения запишем уравнения состояния этих газов до и после смешивания. Тогда p1V1 1RT1 p1V1T p1 , p1 V1 V2 1RT T1 V1 V2 p2 V2 2 RT2 p2 V2T p2 . p2 V1 V2 2 RT T2 V1 V2 Окончательно для давления смеси газов имеем 22 pV p V T . p p1 p2 1 1 2 2 T2 V1 V2 T1 Подставив численные значения величин, получим 6 105 0,5 10 105 0,8 327 p 8, 48 105 Па 310 380 0,5 0,8 Ответ: p = 8,48·105 Па 3. Гелий массой m = 231 г, находившийся первоначально при температуре t1 = 20ºC и давлении p1 = 105 Па, сжимают адиабатически до давления p2 = 107 Па. Определить объём газа в конце сжатия. Дано Решение Запишем уравнение адиабатического i=3 процесса в виде уравнения Пуассона для m = 231 г начального и конечного состояний t1 = 20ºC 5 (1) p1V1 p2V2 , p1 = 10 Па 7 p2 = 10 Па где – показатель адиабатического проV2 – ? цесса, который равен i2 . i Для одноатомных газов, примером которых является 5 гелий, число i равно трём, поэтому в данном случае . 3 Преобразуя (1), получим выражение для объёма в конце сжатия 1 p V2 V1 1 . p2 23 (2) Начальное значение объёма V1 определяем из уравнения состояния идеального газа (уравнения Менделеева-Клапейрона) m m RT1 . (3) p1V1 RT1 V1 M M p1 Подставив выражение (3) в уравнение (2), получим 1 m RT1 p1 V2 . M p1 p 2 Учитывая численные значения, приведённые в усло1 3 вии задачи, а также то, что 0,6 , будем иметь 5 231103 8,31 293 1 V2 3 105 100 4 10 0,6 0,089 м3 Ответ: V2 0,089м3 4. Двухатомный идеальный газ, находившийся первоначально при t1 = 0ºC, адиабатически сжимают так, что его объём уменьшается в 10 раз. Определить, до какой температуры (в оС) нагревается газ вследствие сжатия. Считать, что в ходе процесса колебательные степени свободы молекул газа не возбуждаются. Дано Решение Анализ данных задачи показывает, t1 = 0ºC что в этом случае уравнение адиабатичеV1 V2 10 ского процесса следует записать в виде t2 – ? TV1 const , что позволяет установить связь параметров начального и конечного состояний 24 T1V11 T2V21 , (1) показатель адиабатического процесса, равный i2 . Для газа, молекула которого состоит из двух ато i мов, при отсутствии колебательных степеней свободы i = 5, 5 2 поэтому 1, 4 . После преобразования выражения 5 (1) будем иметь где T2 V1 T1 V2 1 1 V T2 T1 1 . (2) V2 Подставив в (2) приведённые в задаче численные данные, получим T2 273 101,41 273 100,4 685 K . Тогда t 2 685 273 412 C . Ответ: t2 = 412 ºC 5. Некоторое количество одноатомного идеального газа сжимают адиабатически до тех пор, пока давление не превзойдёт первоначальное в 10 раз. Затем газ расширяется изотермически до первоначального объёма. Во сколько раз конечное давление газа p3 превысит начальное давление p1? Дано Решение Запишем уравнения состояния идеi=3 ального газа для начального состояния 1 p n 2 10 RT1 p1V1 , (1) p 1 p3 –? p1 для состояния 2, соответствующего окончанию адиабатического процесса, RT2 p2V2 , (2) 25 и для конечного состояния 3: RT2 p3V1 . (3) При записи третьего уравнения учтено, что в ходе изотермического процесса температура остаётся постоянной и равной Т2, а объём при завершении этого процесса по условию задачи равен первоначальному его значению. Разделив левую и правую части уравнения (3) на левую и правую части уравнения (1), получим p3 T2 (4) . p1 T1 При выполнении аналогичного действия с уравнениями (1) и (2) будем иметь T2 p 2 V2 . (5) T1 p1V1 С учётом (5) уравнение (4) примет вид p3 p 2V2 . (6) p1 p1V1 Так как первое и второе состояния соответствуют началу и завершению адиабатического процесса, для них уравнение Пуассона можем записать в виде (7) p1V1 p 2V2 . где – показатель адиабатического процесса. Так как в случае одноатомного идеального газа i = 3, показатель адиабатического процесса принимает значение, равное i2 5 . i 3 1 V p Из (7) следует, что 2 1 , и выражение (6) преV1 p 2 образуем к виду 26 1 p3 p 2 p1 . p1 p1 p 2 (8) p2 n , из (8) имеем p1 p3 n n 1 3 5 n 2 5 n 0,4 . p1 n n Так как n = 10, то p3 100,4 2,51 . p1 Учитывая, что Ответ: 2,51 6. Воздух расширяется в ходе политропического процесса, при этом его объём увеличивается в семь раз. После расширения его давление равно p2 = 2,3·105 Па, а температура T2 = 333 K. Определить первоначальную температуру воздуха, если показатель политропы n = 1,32. Дано Решение 5 Установим связь между параметp2 = 2,3·10 Па T2 = 333 K рами начального p1,V1 ,T1 и конечn = 1,32 ного p2 ,V2 ,T2 состояний воздуха, V2 7 для чего воспользуемся уравнением V1 Менделеева-Клапейрона T1 – ? p1V1 RT1 p1V1 RT1 (1) p2V2 RT2 p2 7V1 RT2 Разделив друг на друга левые, а затем и правые части полученных уравнений, будем иметь p1 T p 1 T1 T2 1 . (2) 7p 2 T2 7p 2 Чтобы найти связь между начальным p1 и конечным 27 p 2 давлениями, воспользуемся уравнением политропического процесса, которое запишем в виде pVn const . Тогда p1V1n p2V2n p1V1n p2 7V1 и n p 7V (3) p1 2 n 1 7 n p 2 . V1 Подставив выражение (3) в (2), получим T 7n T1 2 T2 7n 1 . 7 Учитывая, что T2 333 К, а n = 1,32, окончательно буn дем иметь T1 333 70,32 620,7 (К) Ответ: T1 = 620,7 К 7. Воздух массой 2,7 кг, находившийся при температуре 207ºС и давлении p1 = 7,2·105 Па (точка 1 на рис.) расширяется адиабатически (процесс 1-2). Затем эта же масса воздуха расширяется изотермически (процесс 3-2). Определить объём и давление, соответствующие пересечению адиабаты и изотермы (в точке 2), если известно, что p3 = 4,2·105 Па, а объём V1 = 0,516 м3. 28 Дано i=5 p1 = 7,2·105 Па m = 2,7 кг p3 = 4,2·105 Па V1 = 0,516 м3 p2 – ? V2 – ? Решение Запишем уравнение адиабатического процесса 1-2 (уравнение Пуассона) (1) p1V1 p2V2 и уравнение изотермического процесса 3-2 (закон Бойля-Мариотта). (2) p3V1 p2V2 После деления друг на друга левых, а затем и правых частей уравнений (1) и (2), получим p1 1 (3) V1 V21 , p3 i2 – показатель адиабатического процесса. Воздух i – это смесь газов, в которой содержание азота и кислорода, имеющих двухатомные молекулы, достигает в сумме 98 – 99%, поэтому можно считать, что воздух состоит из двухатомных молекул. Если не оговорено специально, что необходимо учитывать колебательные степени свободы, молекулу считают жёсткой, поэтому число i для молекул воздуха в данном случае с достаточной степенью точности можно 5 2 1, 4 . принять равным 5. Тогда 5 Из (3) следует где 1 p 1 V2 1 V1 . (4) p3 Подставив численные значения, получим значение объёма в точке пересечения адиабаты и изотермы 29 2,5 7, 2 V2 0,516 1,985 м3 . 4, 2 Из уравнения (2) следует, что давление в точке 2 равно pV p2 3 1 . V2 После вычислений имеем 4, 2 105 0,516 p2 1,09 105 Па . 1,985 Ответ: p2 = 1,09·105 Па, V2 = 1,985 м3. 8. В ходе некоторого политропического процесса кислород был сжат от объёма V1 = 10 л до объёма V2 = 5 л. При этом давление возросло от p1 = 105 Па до p2 = 5·105 Па. Определить показатель политропического процесса n. Дано Решение –3 3 Уравнение политропического V1 = 10·10 м процесса V2 = 5·10–3 м3 5 p1V1n p2V2n , p1 = 10 Па p2 = 5·105 Па преобразуем к виду n n–? p1 V2 . p 2 V1 После логарифмирования будем иметь p V n 1 n n 2 . p2 V1 Тогда p n n 1 p2 V n 2 . V1 30 После подстановки численных значений получим n 0, 2 n 2,32 n 0,5 Ответ: 2,32 9. Найти максимально возможную температуру одного моля идеального газа в процессе p = pо – aV2, где pо = 3·105 Па, a = 109 Па/м6. Дано Решение Найдём функциональную зависиν = 1 моль 2 мость температуры от объёма, воспользоp = pо – aV pо = 3·105 Па вавшись для этого уравнением состояния a = 109 Па/м6 идеального газа pV RT , Tmax – ? в которое, для исключения давления, подставим уравнение процесса p = pо – aV2: p – aV V RT . 2 о (1) Тогда зависимость температуры от объёма можно записать в виде 1 T po V aV3 . (2) R Температура примет экстремальное значение при выdT 0 . Найдём первую производную по полнении условия dV объёму от функции, описываемой выражением (2), dT 1 po 3aV 2 , dV R и приравняем её к нулю 1 (3) po 3aVo2 0 . R 31 Из (3) можно найти объём Vo , соответствующий состоянию с экстремальной температурой po . (4) 3a Найденный экстремум является максимумом, так как d 2T 6aV вторая производная 0. 2 dV R Формулу для нахождения максимальной температуры получим, заменив в выражении (2) переменный объём V на объём Vo , который идеальный газ занимает при максимальVo ной температуре 3 1 1 po po 2 2po po 3 Tmax poVo aVo R po 3a a 3a 3R 3a . R Подставив численные значения, будем иметь Tmax 2 3 105 3 105 2 105 102 240 K 3 1 8,31 3 109 8,31 Ответ: Tmax = 240 К 32 Задания для аудиторной и самостоятельной работы 1.1. Идеальный газ расширяется по закону pV2 const . Найти первоначальную температуру газа Т1, если при увеличении его объёма в 3 раза температура оказалась равной 150 К. Ответ: Т1 = 450 К 1.2. Как и во сколько раз изменится объём газа, если увеличить его давление в 2 раза в таком процессе, при котором соотношение между давлением и температурой газа описывается уравнением p3T const ? Ответ: уменьшится в 16 раз 1.3. Идеальный газ совершает процесс 1 2 , изображённый на диаграмме V-p, где p2 4p1 , V1 3V2 . Чему равна конечная температура газа Т2 при таком процессе, если начальная температура Т1 = 300 К. Ответ: Т2 = 400 К 1.4. Три идеальных газа – одноатомный, двухатомный и многоатомный – имеют одинаковое начальное давление ро и объём Vо и совершают процесс адиабатического расширения. Кривые этих процессов показаны на (p,V)-диаграмме. Какая кривая соответствует расширению одноатомного газа? Ответ обосновать. Ответ: кривая 3 33 1.5. В результате адиабатического расширения угарного газа (СО) объём увеличился в два раза. Как изменилось при этом его давление? Ответ: уменьшилось в 2,64 раза 1.6. В вертикальный закрытый с обоих торцов цилиндр, помещён массивный поршень, по обе стороны которого находится по одному молю воздуха. При T1 = 180 K отношение верхнего объёма к нижнему n = 3. Чему будет равно это отношение при температуре T2 = 320 K? Ответ: 2 1.7. Двухатомный идеальный газ, находившийся первоначально при t1 = 0ºC, подвергается сжатию, в результате чего давление газа увеличивается в 10 раз. Считая процесс сжатия адиабатическим, определить, до какой температуры (в оС) нагреется газ при сжатии? Ответ: t2 = 254ºC 1.8. Гелий массой m = 0,2 кг, находившийся первоначально при температуре t1 = 16ºC и занимавший объём 0,1 м3, сжимают адиабатически до давления p2 = 107 Па. Определить температуру газа в конце сжатия. Ответ: T2 = 674,9 K 1.9. Неон и кислород находятся в разных сосудах при одинаковой температуре и занимают одинаковые объёмы. Газы сжимают адиабатически так, чтобы объём каждого из них уменьшился в три раза. Во сколько раз температура неона больше температуры кислорода? Ответ: Тнеон Ткислород 1,34 1.10. Угарный газ (СО), находящийся в некотором сосуде под давлением p1 = 200 кПа, один раз сжимают изотермически, а другой раз – адиабатически. В результате как первого, так и второго процессов давление газа изменяется до 34 p2 = 400 кПа. Найти, во сколько раз объём газа после адиабатического сжатия больше объёма газа после изотермического сжатия. Ответ: в 1,22 раза 1.11. В начальном состоянии давление газа равно p1 = 100 кПа, а температура t1 = 27°С. Найти давление p2 и температуру Т2 газа после политропического сжатия, в результате которого объём газа уменьшился в 5 раз. Показатель политропы принять равным 1,2. Ответ: p2 = 690 кПа; Т2 = 414 К 1.12. В результате политропического сжатия водорода его объём уменьшился в пять раз, а давления увеличилось с p1 = 100 кПа до p2 = 1 МПа. Определить показатель политропического процесса. Ответ:1,43 1.13. При адиабатическом сжатии давление азота было увеличено от р1= 50 кПа до р2= 0,5 МПа. Затем при неизменном объёме температура воздуха была понижена до первоначальной. Определить давление газа в конце процесса. Ответ: 259 кПа 1.14. Газ расширяется адиабатически так, что его давление падает от p1 = 600 кПа до p2 = 300 кПа. Потом газ нагревается при постоянном объёме до первоначальной температуры. При этом его давление возрастает до p3 = 366 кПа. Найти для этого газа показатель адиабатического процесса γ. Ответ: 1,4 35 1.15. На рисунке показан равновесный переход кислорода из состояния 1 в состояние 2. Процесс 1-3 изотермический, 3-2 адиабатический. В исходном состоянии V1 = 1 л, p1 = 3·105 Па, в конечном состоянии p2 = 1,33·105 Па, V2 = 2 л. Вычислить объём газа в точке 3. Ответ: V3 = 1,48 10-3 м3 1.16. Углекислый газ (СО2), находившийся при температуре Т1 = 300K и давлении p1 = 5·105 Па и занимавший объём V1 = 0,5 м3 (точка 1), расширяется адиабатически (процесс 1-2). Одновременно такая же масса углекислого газа расширяется из состояния p3 = 2·105 Па и V1 = 0,5 м3 изотермически (процесс 3-2). Определить объём, давление и температуру газа в точке 2, соответствующей пересечению адиабаты и изотермы. Ответ: V2 = 4,94 м3, p2 = 0,2 105 Па, Т2 = 120 K 1.17. В цилиндре под поршнем находится водород при температуре t1 = 27°С и давлении p1 = 100 кПа. Водород в результате адиабатического расширения увеличил свой объём в пять раз, а затем был сжат изотермически до первоначального объёма. Найти температуру и давление газа в конце изотермического сжатия. Ответ: p3 = 52,5 кПа; Т3 = 157,6 К 1.18. Газ занимает объём V1, при давлении p1 и температуре Т1. Этот газ при постоянном объёме нагревают до 36 температуры Т2 = 2T1, после чего сжимают его при постоянV ном давлении до объёма V2 1 Из получившегося состоя4 ния газ возвращают в начальное (p1, V1, Т1), причем так, что во время этого процесса pVn = const. Определите показатель степени n. Ответ: n = 0,5 1.19. Найти максимально возможную температуру двух молей идеального газа в процессе p = pоe–βV, pо = 105 Па, β = 10 м–3. Ответ: Tmax = 221 K 1.20. Определить наименьшее возможное давление двух молей идеального газа в процессе T = Tо + aV2, где Tо = 400 K, a = 104 K/м6. Ответ: pmin = 66,48·кПа 37 2. Работа и теплообмен при термодинамических процессах Энергию термодинамической системе можно передать двумя способами, которые называют работой и теплообменом. Работа – это способ изменения энергии системы, связанный с упорядоченным воздействием на неё. Количество энергии, передаваемой этим способом, также называют работой. При совершении работы всегда происходит изменение внешних параметров системы. Элементарная работа против сил внешнего давления при изменении объёма на величину dV определяется выражением A pdV . Если в системе протекает равновесный процесс, описываемый уравнением p p(V) , то работа будет равна определённому интегралу вида V2 A p V dV . V1 В соответствии с геометрическим смыслом определённого интеграла работа, совершаемая в ходе 2 p равновесного процесса, равна площади фиA 1 гуры на p-V диаграмме (в масштабе графика p p(V) ), которая ограничена осью V, верV2 V V1 тикалями V1 и V2, а также графиком процесса 1-2. Рассмотрим, как вычисляется работа идеального газа при различных равновесных процессах. 1. Изохорический процесс. Так как при протекании этого процесса объём газа не изменяется, то есть V = const, 38 то dV = 0 и A pdV 0 . Это означает, что при изохорическом процессе газ работы не совершает. 2. При изобарическом процессе давление постоянно, поэтому оно может быть вынесено из-под знака интеграла, определяющего работу: V2 V2 V1 V1 A pdV p dV p(V2 V1 ) pV . 3. Изотермический процесс – процесс при постоянной температуре: T = const, а р = р (V). Найдём явный вид функциональной зависимости р от V, пользуясь уравнением состояния идеального газа: m 1 p RT , M V тогда V 2 m dV m V A RT RT ln 2 . M V M V1 V1 4. При адиабатическом процессе работа может быть определена из выражений i m A R T1 T2 ; 2M i A p1V1 p 2V2 ; 2 1 p1V1 V1 1 , A 1 V2 справедливость которых будет доказана в дальнейшем. Работа, совершаемая системой (А), и работа, совершаемая внешними силами над системой ( A ), имеют противоположные знаки ( A A ). Например, при сжатии газа ра39 бота внешних сил положительна, а совершаемая газом работа отрицательна. Действительно, так как давление – величина положительная, то работа, совершаемая газом при сжатии, при котором происходит уменьшение его объёма, отрицательна. Очевидно, что при расширении работа газа положительна. Теплообмен – это самопроизвольный процесс передачи энергии, происходящий между телами с разной температурой. При реализации этого способа внешние параметры системы не изменяются. Количество энергии, передаваемой этим способом, часто называют теплотой. При теплообмене передача энергии происходит на микроскопическом уровне при столкновении молекул, поэтому теплообмен – это способ изменения энергии системы, связанный с неупорядоченным воздействием на неё. Количество теплоты, сообщённое системе Q , и количество теплоты, переданное системой в окружающую среду Q , имеют противоположные знаки Q Q . Если, например, при изотермическом сжатии газа полученное им количество теплоты отрицательно, то отданное газом количество теплоты положительно. 40 Примеры решения задач 1. Гелий массой m = 0,3 кг, находившийся первоначально при температуре t1 = 27ºC и давлении p1 = 105 Па сжимают адиабатически до давления p2 = 107 Па. Считая процесс сжатия равновесным, определить работу, совершенную газом. Дано Решение 3 Исходя из приведённых в М = 4 10 кг/моль условии задачи данных, для выm = 0,3 кг числения работы при адиабатичеt1 = 27ºC ском процессе следует выбрать p1 = 105 Па формулу p2 = 107 Па i m i=3 A R T1 T2 . (1) 2M A– ? Видим, что для расчёта численного значения работы по этой формуле необходимо только определить температуру газа Т2, соответствующую завершению процесса его адиабатического сжатия. Для нахождения этой температуры воспользуемся уравнением адиабатического процесса, записанным в виде T1p1 1 T2p2 1 , i2 . Так как для одноатомной молекулы i = 3, то i 5 1 3 2 5 1 3 2 3 0, 4 . 5 3 3 35 3 Тогда из (2) будем иметь где 41 (2) 0,4 0,4 p1 105 T2 T1 T2 300 7 1893 K . 10 p2 Из выражения (1) следует, что 3 0,3 A 8,31 300 1893 1, 49 106 Дж 3 2 4 10 Ответ: A = – 1,49 МДж 2. Некоторую массу азота сжали один раз адиабатически, а другой раз изотермически, так что и в том и в другом случае объём уменьшался в 5 раз. Начальное состояние газа в обоих случаях было одинаковым. Найти отношение работы, совершаемой газом при его адиабатическом сжатии А1, к работе изотермического сжатия А2. Дано Решение Работу, совершённую азотом при V1 n; n 5 адиабатическом сжатии, найдём по форV2 муле A1 A 2 – ? 1 p1V1 V1 p1V1 1 n 1 , 1 A1 1 V2 1 (1) i2 где . Молекула азота состоит из двух атомов, поi этому i = 5 и показатель адиабатического процесса равен 5 2 1, 4 . 5 Работу при изотермическом сжатии можно определить из выражения 42 V A 2 RT1 n 2 , (2) V1 преобразовав его с учётом уравнения состояния идеального газа p1V1 RT1 к виду V A 2 p1V1 n 2 . (3) V1 Разделив выражения (1) и (3) друг на друга, получим A1 A2 1 n 1 1 50,4 1, 4 V2 1 1 n 1, 4 1 n 5 V1 Ответ: 1,4 3. При изотермическом расширении 2 кг водорода, первоначально находившегося при давлении p1 = 6·105 Па и объёме V1 = 8,31 м3, была совершена работа А = 5,47 МДж. Определить конечные параметры водорода, если после изотермического расширения газ был сжат адиабатически, причём при сжатии была совершена такая же по модулю работа, что и при расширении. Дано Решение i=5 p 3 m = 2 кг 1 M = 2·10-3 кг/моль p1 = 6·105 Па 2 V1 = 8,31 м3 А = 5,47 МДж 0 V1 V3 V2 V T3 – ? V3 – ? p3 – ? 43 Прежде всего найдём температуру Т3 водорода после адиабатического сжатия. Для этого необходимо вычислить температуру Т1 изотермического процесса 1-2, которая одновременно является начальной температурой T2 адиабатического сжатия 2-3 данного газа. Температуру T1 , при которой протекал процесс изотермического расширения, найдём из уравнения состояния: m M p1 V1 . p1V1 RT1 T1 M mR Вычисления показывают, что 2 103 6 105 8,31 T1 600 K , 2 8,31 следовательно, так как процесс 1-2 изотермический, то T2 T1 600 K . Чтобы найти температуру T3 водорода после завершения адиабатического сжатия, используем формулу для определения работы при этом процессе i m 2A 23M . A 23 R T2 T3 T3 T2 2M imR После подстановки значений физических величин с учётом того, что работа газа при его сжатии отрицательна, будем иметь T3 600 2 5, 47 106 2 103 5 2 8,31 863 K . Чтобы найти объём водорода V3 после адиабатического сжатия 2-3, необходимо предварительно определить его объём перед началом этого процесса (V2), который одновременно является конечным параметром изотермического расширения 1-2 данного газа. 44 Для вычисления объёма водорода V2 воспользуемся формулой для работы, совершаемой при изотермическом процессе V m (1) A12 RT1 n 2 . M V1 Из (1) следует, что V A M n 2 12 . V1 mRT1 Подставив известные численные значения, получим V 5, 47 106 2 103 n 2 1,1 . 2 8,31 600 V1 После потенцирования этого выражения будем иметь V2 (2) e1,1 . V1 Так как e1,1 3 , из (2) следует, что V2 3V1 24,9 м3 . Объём V3 найдём из уравнения адиабатического процесса, записанного в виде T2V21 T3V31 . 1 1 T 1 V T Тогда 3 2 и V3 V2 2 , T3 V2 T3 i 2 52 7 1, 4 . где i 5 5 После вычислений получим 600 V3 24,9 863 2,5 45 10 м3 . Давление p 3 определим из уравнения состояния идеального газа m R T3 m R T3 . p3 M M V3 Подставив значения физических величин, будем иметь 2 8,31 863 p3 7,17 105 Па 3 2 10 10 Ответ: T3 = 863 K; V3 = 10 м3; p3 = 7,17·105 Па p3V3 4. При некотором политропическом процессе объём одного моля аргона увеличился в 4 раза, а давление уменьшилось в 8 раз. Найти работу, совершённую газом, если его начальная температура была равна T1 = 300 K. Дано Решение Работу, совершённую аргоном при ν = 1 моль политропическом расширении, найдём, V2 V1 4 воспользовавшись формулой p1 p2 8 V2 A p(V)dV , T1 = 300 K A– ? (1) V1 где давление р(V) – это некоторая функция объёма V. Явный вид функциональной зависимости давления от объёма получим из уравнения политропического процесса, записанного в виде p1V1n pVn . p1V1n Тогда p n , и после подстановки этого выражения V в (1) будем иметь V2 dV p1V1n 1n V2 p1V1n 1n V V2 V11n . (2) n V 1 V 1 n 1 n V1 A p1V1n 46 Преобразуем формулу (2) так, чтобы можно было использовать уравнение Менделеева-Клапейрона для замены неизвестных р1 и V1 известными величинами и Т1: 1n p V V 1n p1V1n V11n V2 1 1 1 2 1 . (3) A 1 n V1 1 n V1 С учётом того, что p1V1 RT1 , формула (3) приобретёт вид RT1 V2 1 . A (4) 1 n V1 Чтобы найти показатель политропического процесса n, вновь вернёмся к уравнению этого процесса и используем приведённые в условии задачи сведения об изменениях в результате протекания процесса давления и объёма 1n n p V p V p2V 1 2 8 4n 23 22n n 1,5 . p2 V1 n 1 1 n 2 Подставив известные и вычисленные значения в выражение (4), будем иметь 1 8,31 300 11,5 4 1 2493 Дж A 1 1,5 Ответ: A = 2493 Дж 5. Некоторое количество водорода расширяется от V1 = 20 л до V2 = 50 л так, что процесс на диаграмме p,V имеет вид прямой линии (см. рис.). Исходное давление p1 = 105 Па, конечное p2 = 2·105 Па. Найти работу, совершенную газом. 47 Дано Решение V1 = 20 л V2 = 50 л p1 = 105 Па p2 = 2·105 Па A–? p 2 p2 p1 1 0 V1 V2 V Задачу можно решить двумя способами. Графический способ. V2 Интеграл A pdV численно равен площади под граV1 фиком процесса, т.е. площади трапеции V1-1-2-V2. Эта плоp p щадь равна A 1 2 V2 V1 . Вычисляя, получим 2 5 10 2 105 A 50 103 20 103 4,5 103 Дж 2 Аналитический способ. Согласно условию задачи график процесса представляет собой прямую линию, поэтому уравнение процесса – это уравнение прямой, которое в данном случае запишем в виде p po V . Тогда V2 V2 V2 V1 V1 V1 A pdV p o V dV p o dV V 2 V12 VdV po V2 V1 2 . 2 V1 V2 48 (1) Из (1) следует, что для вычислений необходимо предварительно определить коэффициенты и p o , для чего запишем уравнения, связывающие параметры начального ( p1 , V1 ) и конечного p2 , V2 состояний p1 po V1 p2 p1 p2 po V2 V2 V1 po p1 V1 p1 p V V1 p2 p1 V1 p2 p1 V1 1 2 V2 V1 V2 V1 (2) (3) p1V2 p1V1 p2 V1 p1V1 p1V2 p 2 V1 . V2 V1 V2 V1 Расчёты по формулам (2) и (3) позволяют определить численные значения и p o , которые равны 3,33 106 Па/м3; po 3,33 104 Па . Воспользовавшись формулой (1), будем иметь 3,33 106 A 3,33 104 30 103 25 4 104 4,5 103 Дж 2 Ответ: A = 4,5 кДж 6. Два моля кислорода совершают процесс, в ходе которого его температура изменяется по закону Т = V2, где = 103 К/м6. Найти работу, совершенную газом при увеличении объема от V1 = 3 м3 до V2 = 5 м3. Дано Решение Для определения работы исполь = 2 моль 3 зуем формулу V1 = 3 м V2 = 5 м3 Т = V2 = 103 К/м6 A–? A pdV . (1) Чтобы найти зависимость давления от объёма, используем уравнение 49 состояния идеального газа (2) pV RT и уравнение процесса (3) T V2 . Заменив в (2) температуру в соответствии с (3), получаем (4) pV R V2 p R V . После подстановки (4) в (1) имеем V2 V2 V 2 V12 . A RVdV R R 2 2 V 2 V1 V2 (5) 1 Вычисления показывают, что 25 9 A 2 8,31103 133 103 (Дж) 2 Ответ: 133 кДж 7. Некоторый идеальный газ совершает процесс, в ходе которого давление изменяется по закону p p0 exp (V V0 , где p0 = 6·105 Па, α = 0,2 м–3, V0 = 2 м3. Найти работу, совершённую газом при его расширении от V1 = 3 м3 до V2 = 4 м3. Дано Решение Работу вычислим по формуле p p0 exp (V V0 A pdV , (1) p = 6·105 Па 0 α = 0,2 м–3 V0 = 2 м3; V1 = 3 м3 V2 = 4 м3 A–? для чего в (1) подставим заданную зависимость давления от объёма p p0 exp (V V0 : V2 A p0 e V1 50 V V0 dV . (2) Преобразуя выражение (2) и вычисляя интеграл, будем иметь V2 V2 p eV0 V2 V1 V0 V0 V A p0 e e dV p0 e eVdV 0 e e . V1 V1 Выполнив вычисления, получим 6 105 e0,4 0,8 0,6 A e e 4, 45 105 Дж 0, 2 Ответ: A = 445 кДж 8. Некоторое количество газа нагревают от температуры T1 = 300 К до температуры Т2 = 400 К. При этом объём газа изменялся пропорционально квадрату температуры. Начальный объем газа Vl = 3 дм3. Давление, измеренное в конце процесса, оказалось равным р2 = 105 Па. Какую работу совершил газ в этом процессе? Дано Решение Работу определим по формуле V const T2 A pdV . T1 = 300 К Т2 = 400 К Vl = 3·10–3 м3 р2 = 105 Па A–? (1) Чтобы иметь возможность использовать приведённые в задаче данные, получим выражение для дифференциала объёма dV из уравнения процесса, которое по условию задачи имеет вид V V const T 2 2 const . (2) T Продифференцировав (2) по температуре, будем иметь T 2 dV dT 2VT 0. T4 Приравняв числитель к нулю, будем иметь 51 VdT . T Подставив выражение для дифференциала объёма в (1), получим V (3) A 2 p dT . T Из уравнения состояния идеального газа следует, что pV RT , поэтому (3) можно переписать в виде TdV 2VdT dV 2 T2 A 2 RdT 2R T2 T1 . (4) T1 Чтобы вычислить значение R , запишем уравнение состояния идеального газа в виде p2V2 RT2 , из которого следует, что pV (5) R 2 2 . T2 Найдём значение объёма V2, для чего воспользуемся уравнением данного процесса V2 V1 T22 V V . (6) 2 1 T22 T12 T12 Подставив (6) в (5), будем иметь p VT (7) R 2 12 2 . T1 С учётом (7) выражение для работы (4) приобретает p VT следующий вид: A 2 2 12 2 T2 T1 . T1 После вычислений имеем 2 105 3 103 400 A 400 300 266,7 Дж 2 300 Ответ: А = 266,7 Дж 52 Задания для аудиторной и самостоятельной работы 2.1. Диаграмма замкнутого процесса, совершаемого идеальным одноатомным газом, p,кПа представлена на рисунке. Найти 4 отношение работы, совершён3 ной газом при его расширении, к 2 работе, совершённой за цикл. 1 3 0 1 2 3 4 5 6 V,м Ответ: 1,8. 2.2. Идеальный газ совершил циклический процесс 1-2-3-1, где 3-1 – адиабатический процесс. Площадь S2 фигуры 1-2-3 в масштабе графиков процессов равна 10 Дж. На участке 1-2 газ совершил работу 30 Дж. Какую работу совершил газ в ходе адиабатического сжатия 3-1? Ответ: – 20 Дж 2.3. Идеальный газ, занимавший объём V1 = 5 л и находившийся под давлением p1 = 2·105 Па при температуре T1 = 290 K, был нагрет при постоянном объёме, а затем расширился изобарически. Работа расширения газа оказалась равной А = 400 Дж. На сколько нагрелся газ в изобарическом процессе? Ответ: ΔT = 116 К 2.4. При изотермическом расширении 0,5 моль некоторого газа при температуре 300 К давление уменьшилось в 4 раза. Найдите работу, совершённую газом. Ответ: 1728 Дж 2.5. В результате изотермического расширения двух молей газа при температуре T = 250 К им была совершена работа A = 3 кДж. 53 Определить, во сколько раз изменился объём газа при его расширении. Ответ: 2,06 2.6. Какой газ подвергался изотермическому сжатию при температуре 27ºC, если давление двух килограммов этого газа в конце сжатия увеличилось в три раза и работа, затраченная на сжатие, оказалась равной 1,37 МДж? Ответ: гелий 2.7. В первом случае некоторое количество кислорода сжимают до половины объёма изотермически, а во втором случае – изобарически. Найти отношение совершённых в первом и втором случаях работ, если начальные условия были одинаковы. Ответ: 1,39 2.8. Азот массой 2 г, имевший температуру 300 К, был сжат в ходе адиабатического процесса так, что его объём уменьшился в 10 раз. Определите работу газа при его сжатии. Ответ: – 673 Дж 2.9. Метан (СH4), занимавший объём V1 = l л под давлением р1 = 1,2 МПа, адиабатно расширился до объёма V2 = 10 л. Определить работу газа при расширении. Колебательные степени свободы молекул метана не учитывать. Ответ: А = 1,93 кДж 2.10. При адиабатическом расширении 88 граммов углекислого газа, была совершена работа, равная 2078 Дж. Как и на сколько изменилась температура газа в этом процессе? Ответ: уменьшилась на 50 К 2.11. Некоторое количество метана (CH4), который в данных условия можно считать идеальным газа с жёсткими молекулами, перешло адиабатически из состояния с температурой T1 = 250 K в состояние с параметрами p2 = 2·105 Па, V2 = 25 л, T2 = 300 K. Какую работу совершил при этом газ? Ответ: A = – 2500 Дж 54 2.12. Два идеальных газа, которые находились при одинаковых начальных условиях, подвергают адиабатическому сжатию так, что объём каждого газа уменьшился в три раза. Найти отношение совершённых работ А1/А2, если первый газ одноатомный, а второй двухатомный. Ответ: 1,18 2.13. Один моль двухатомного газа, находящегося при нормальных условиях, сжимают до объёма V2 = 5,6 л. На сколько работа, совершённая при адиабатическом сжатии, отличается от работы, совершённой при изотермическом сжатии этого газа. Ответ: 1005 Дж 2.14. В цилиндре под поршнем находится водород массой m = 0,02 кг при температуре t = 30°С. Водород сначала расширялся адиабатно, увеличив свой объём в пять раз, а затем был сжат изотермически, причём объём газа уменьшился в пять раз. Найти работу А, совершенную газом при этих процессах, и температуру Т2 в конце адиабатического расширения. Ответ: Т2 = 159 К; А = 8,6 кДж 2.15. Три моля двухатомного газа адиабатически расширяются так, что давление уменьшается в четыре раза, а затем изотермически сжимаются до первоначального давления. Температура газа в исходном состоянии была равна 450 К. Найти количество теплоты, полученное газом. Ответ: – 10465 Дж 2.16. Два моля аргона совершают политропический процесс с показателем n = 1,5. При расширении газа приращение его температуры оказалось равным ΔT = – 26 K. Найти работу, совершённую газом. Ответ: А = 864 Дж 2.17. В результате политропического сжатия азота объёмом 20 м3 от давления 100 кПа до давления 1 МПа его объём уменьшился в пять раз. Определить работу, совершённую 55 при сжатии азота. Ответ: 4,64 МДж 2.18. Два моля угарного газа (СО) расширяются по закону p = αV, где α – положительная постоянная. Первоначальная температура газа T1 = 300 K. В результате расширения объём увеличился в 2,5 раза. Найти работу, совершённую газом. Ответ: A = 13,09 кДж 2.19. Три моль двухатомного идеального газа расширяются от объёма V1 2м3 до объёма V2 6м3 так, что темпе2,5 V ратура изменяется по закону T T1 , где T1 = 450 K. V1 Найти работу, совершенную газом в этом процессе. Ответ: 65,46 кДж 2.20. В ходе процесса, описываемого уравнением V T3 , два моля многоатомного идеального газа расширяются от объёма V1 1 м3 до объёма V2 27 м3 . Найти работу, совершённую газом в этом процессе, если 8 109 м/К3. Ответ: 49,86 кДж 2.21. Найти работу, совершённую тремя молями кисло рода, в ходе процесса, описываемого уравнением V , если T температура газа увеличилась на 250 K. Ответ: A = – 6,23 кДж 2.22. Три моля идеального газа нагревают в цилиндре под поршнем от первоначальной температуры Т1 = 200 К до конечной температуры Т2 = 400 К так, что температура изменяется прямо пропорционально квадрату давления. Определите работу, совершённую газом в этом процессе. Ответ: 2493 Дж 56 3. Внутренняя энергия. Первое начало термодинамики. При изучении изменений свойств системы в ходе какого-либо процесса используют метод функций. При этом различают функции состояния и функции перехода (функции процесса). Значения функций перехода зависят и от параметров состояния системы, и от вида процесса, при протекании которого это состояние получено. Примерами функций перехода являются работа и количество теплоты, которые зависят не только от параметров начального и конечного состояний, но и от вида процесса перехода системы из начального в конечное состояние. По этой причине малые их изменения нельзя считать дифференциалами и следует обозначать как A и Q . Функцией состояния называют такую функцию параметров системы, изменение которой не зависит от вида процесса перехода системы из одного состояния в другое, а определяется только параметрами начального и конечного состояний. Одной из функций состояния является внутренняя энергия системы. Внутренней энергией системы называют сумму средней кинетической энергии хаотического движения частиц, составляющих систему, и потенциальной энергии взаимодействия этих частиц. Если в качестве частиц рассматривать молекулы, то во внутреннюю энергию кроме кинетической энергии движения молекул и потенциальной энергии их взаимодействия могут включать энергию внутримолекулярных движений и взаимодействий. Во внутреннюю энергию не входят ни кинетическая, ни потенциальная энергии термодинамической системы как 57 целого. Получим выражение для внутренней энергии идеального газа. Вследствие того, что молекулы идеального газа на расстоянии не взаимодействуют, потенциальная энергия взаимодействия молекул равна нулю и внутренняя энергия такого газа будет складываться только из энергий движения отдельных молекул. В молекулярной физике показано, что средняя энергия одной молекулы равна i = kT , 2 R где k – постоянная Больцмана, R – универсальная гаNA зовая постоянная, NA – число Авогадро; i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы. Внутренняя энергия U идеального газа равна произведению числа молекул N на среднюю энергию одной молекулы : i i N m i U N NkT RT RT. 2 2 NA M2 Из этой формулы видно, что внутренняя энергия данной массы идеального газа зависит только от одного параметра состояния – температуры. Так как внутренняя энергия является функцией состояния, элементарное её приращение является дифференциалом и обозначается как dU. Для увеличения внутренней энергии системы необходимо, чтобы ей было сообщено некоторое количество теплоты Q , и (или) чтобы над системой внешними телами была совершена работа δA´: dU = δQ + δA´. 58 Если вместо работы внешних сил ввести в рассмотрение работу самой системы над внешними телами δA = – δA´, то получим первое начало термодинамики в дифференциальной форме: dU Q A . Отметим, что Q прибавляют, если теплота сообщается системе, и вычитают, если она забирается у неё. В интегральной форме первое начало термодинамики записывается в виде U Q A . Часто ему придают следующую форму: Q U A , т.е. количество теплоты, сообщённое системе, идёт на изменение её внутренней энергии и совершение системой работы над внешними телами. Замкнутый термодинамический процесс, при завершении которого система возвращается в исходное состояние, называют круговым процессом или циклом. Для термодинамического цикла начальные и конечные параметры системы (давление, объём, температура) совпадают. Термодинамические циклы используют для моделирования процессов, происходящих в реальных тепловых двигателях, предназначенных для превращения теплоты в механическую работу. При завершении цикла изменение внутренней энергии системы равно нулю ( U 0 ), поэтому первое начало термодинамики в случае круговых процессов приобретает вид Q A . Отсюда следует, что невозможно создать такое устройство, называемое вечным двигателем первого рода, которое бы совершало за цикл работу большую, чем полученное им при этом количество теплоты. 59 Примеры решения задач 1. Сероводород (H2S) массой 6 кг, занимавший объём V1 = 3 м3 при температуре t1 = 27ºC, сжали адиабатически так, что его давление увеличилось в 2 раза. Определить изменение внутренней энергии газа. Дано Решение Чтобы вычислить изменение i=6 внутренней энергии, воспользуm = 6 кг –3 M = 34·10 кг/моль емся формулой i m V1 = 3 м3 U R T2 T1 . (1) 2M t1 = 27ºC Анализ исходных данных поp2 2 казывает, что выражение (1) содерp1 жит неизвестную величину Т2. ΔU – ? Найдём её из уравнения адиабатического процесса, записанного в виде Tp 1 const , (2) i2 – показатель адиабатического процесса. В случае i 4 1 1 62 4 3 0, 25 . . Тогда трёхатомного газа 4 6 3 3 Запишем уравнение (2) для начального и конечного состояний газа где 0,25 1 T1 p T2 p 0,25 2 p T2 T1 1 p2 60 0,25 . Тогда 0,25 1 T2 300 356,76 K . 2 Подставив значение Т2 в выражение (1), будем иметь 6 6 8,31 356,76 300 U 249,7 103 Дж 249,7 кДж 2 34 103 Ответ: 249,7 кДж 2. Один моль кислорода расширяется по закону p = aV, где а – положительная постоянная. Первоначальная температура газа T1 = 300 K. В результате расширения объём увеличился в 2 раза. Чему равно приращение внутренней энергии газа? Дано Решение Чтобы найти изменение внутренней i=5 энергии по формуле ν = 1 моль i p = aV U R T2 T1 , (1) 2 T1 = 300 K следует предварительно определить конечV2 2 ную температуру Т2. Для этого воспользуV1 емся уравнением состояния идеального газа ΔU – ? RT pV , в котором давление выразим через объём в соответствии с уравнением процесса p = aV. Тогда для начальных и конечных значений объёма и температуры будем иметь RT1 aV12 , (2) RT2 aV22 . (3) Разделив левую и правую части уравнения (3) соответственно на левую и правую части уравнения (2), будем иметь 61 2 T2 V2 4 T2 4T1 . T1 V1 Подставляем выражение для Т2 в (1) i i (4) U R 4T1 T1 R 3T1 . 2 2 Проводя вычисления по формуле (4), получим 5 U 1 8,31 3 300 18697,5 Дж 2 Ответ: 18697,5 Дж 3. Некоторое количество водорода расширяется от V1 = 20 л до V2 = 50 л так, что процесс на диаграмме p,V имеет вид прямой линии. Исходное давление p1 = 105 Па, конечное p2 = 2·105 Па. Найти количество теплоты, поглощенное газом. Дано Решение i=5 V1 = 20 л V2 = 50 л p1 = 105 Па p2 = 2·105 Па Q–? Для определения количества теплоты воспользуемся первым началом термодинамики (1) Q U A . Изменение внутренней энергии найдём по формуле i U R T2 T1 , (2) 2 которую преобразуем с помощью уравнения состояния иде62 ального газа, записав его для начального и конечного состояний, RT1 p1V1 i (3) U p2V2 p1V1 . RT2 p2V2 2 Как известно, на p-V диаграмме работа равна площади фигуры, образованной графиком процесса p p V , осью V и прямыми V V1 и V V2 . В данном случае для определения работы необходимо найти площадь трапеции V1-1-2-V2 p p A 1 2 V2 V1 . (4) 2 Учитывая формулы (1), (3) и (4), будем иметь i p p (5) Q p2V2 p1V1 1 2 V2 V1 . 2 2 Подставив в формулу (5) заданные численные значения величин, получим 5 Q 2 105 50 103 105 20 103 2 105 2 105 50 20 103 24500 Дж 2 Ответ: 24,5 кДж 4. Объём трёх молей водорода изменяется по закону V . Найти количество теплоты, сообщённое газу, если T его температура возрастает от T1 = 300 K до T2 = 500 K. 63 Дано i=5 ν = 3 моля T1 = 300 K T2 = 500 K Q–? Решение Количество теплоты определим, пользуясь первым началом термодинамики (1) Q U A . Исходные данные позволяют вычислить изменение внутренней энергии по формуле i i (2) U R T2 T1 R T , 2 2 поэтому задача сводится к вычислению работы. Известно, что A pdV , (3) однако, чтобы иметь возможность применить эту формулу, необходимо от переменных p и V перейти к переменной Т. Для этого сначала воспользуемся уравнением состояния идеального газа, RT RT pV p (4) V а затем уравнением данного процесса V T 2 RT RT p . (5) V Чтобы выразить дифференциал объёма через температуру, продифференцируем по температуре уравнение процесса dV 2 dV 2 dT (6) dT T T Подставим (5) и (6) в формулу (3) и проинтегрируем полученное выражение 64 RT 2 dT R T2 T1 RT . T2 T1 T2 A (7) С учётом (1), (2) и (7) будем иметь i i (8) Q R T R T 1 R T . 2 2 Подставив в (8) численные значения величин, приведённые в условии задачи, получим 5 Q 1 3 8,31 500 300 7479 Дж 2 Ответ: 7,479 кДж 5. В ходе процесса p/V2 = const три моль идеального двухатомного газа нагревают от температуры Т1 = 200 К до Т2 = 500 К. Определить количество теплоты, сообщённое газу при нагревании. Дано Решение Количество теплоты, поглощённой i =5 газом, найдём с помощью первого начала ν = 3 моль термодинамики Т1 = 200 К (1) Q U A . Т2 = 500 К 2 p/V = const Определим изменение внутренней энергии по формуле ΔU – ? iR A– ? U T2 T1 . Q–? 2 Расчёты показывают, что 5 U 3 8,31 500 200 18697,5 Дж . 2 Работу вычислим по формуле A pdV , 65 (2) преобразовав подынтегральное выражение. Для этого сначала продифференцируем по объёму уравнение состояния идеального газа pV RT : d d dp dT pV RT V p R , dV dV dV dV тогда (3) Vdp pdV R dT . Затем продифференцируем по объёму уравнение проp цесса 2 const : V dp 2 V p 2V dV 0 V 2 dp 2pV dV 0, 4 V или (4) Vdp 2pdV . Воспользовавшись соотношением (4), заменим в левой части уравнения (3) V dp на 2pdV : 3pdV RdT pdV RdT . 3 (5) Подставив (5) в (2), получим R R dT T2 T1 . 3 3 T1 T2 A (6) Вычислив, будем иметь 3 8,31 A 500 200 2493 Дж . 3 Количество теплоты рассчитаем по формуле (1): Q 18697,5 2493 21190,5 Дж . Ответ: Q = 21190,5 Дж 66 6. Три моля идеального газа, находящегося при температуре T1 = 273 K, изотермиче- p T T2 1 ски расширили в 5 раз, а затем p1 1 3 изохорически нагрели так, что давление стало равным первона2 чальному. За весь процесс газу p 2 T1 сообщили количество теплоты V1 V2 5V1 V Q = 80 кДж. Найти показатель адиабаты γ для этого газа. Дано Решение Если известно число степеней своν = 3 моля боды молекулы газа, то показатель адиабаT1 = 273 K тического процесса γ можно рассчитать по V2 = 5V1 Q = 80 кДж формуле i2 γ–? , (1) i Для определения значения величины i, найдём выражение для количества теплоты, полученной в ходе изотермического и изохорического процессов V Q Q12 Q 23 RT1 n 2 U 3 U 2 V1 (2) V2 iR RT1 n (T2 T1 ). 2 V1 При записи первого начала термодинамики в (2) учтено, что в ходе изотермического расширения изменение внутренней энергии U 2 U1 равно нулю, а при изохорическом процессе равна нулю совершаемая газом работа A 23 . Чтобы найти число степеней свободы i из выражения (2), необходимо предварительно определить температуру Т2 67 газа в точке 3 (см. рис.). Для этого запишем уравнение состояния газа для точек 3 и 1: RT2 p1 5V1 T2 5 T2 5T1 . RT1 p1 V1 T1 V T С учётом того, что 2 2 5 , выражение (2) можно V1 T1 переписать в виде Q RT1 2i n 5 . Тогда i 1 Q n 5 2 RT1 (3) Проводя вычисления по формуле (3), получим 1 80 103 i 2 5 2 1, 4 . i n 5 5 и i 5 2 3 8,31 273 Ответ: 1,4 68 Задания для аудиторной и самостоятельной работы 3.1. Какому процессу в идеальном газе U (изохорическому, изобарическому, адиабатическому, политропическому) соответствует график, изображённый на рисунке? Ответ T обосновать. Ответ: соответствует всем перечисленным процессам 3.2. На рисунке изображены изотермы P A АВ и DC. Сравните количества теплоты Q1 и 1 D Q2, поглощаемые идеальным газом в процесB 2 С сах 1 и 2, и приращения внутренней энергии V ΔU1 и ΔU2 этого газа. Ответ: ΔU1 = ΔU2, Q2 > Q1 3.3. На рисунке представлен график процесса в идеальном газе, состоящий из P A B адиабаты и изотермы. Какая площадь на С S1 S2 графике соответствует модулю изменения V внутренней энергии в процессе АВС? Ответ обосновать. Ответ: S2 . 3.4. Чему равна внутренняя энергия углекислого газа (СО2), находящегося в сосуде объёмом 2 литра под давлением 3 105 Па. Газ считать идеальным, колебательным движением атомов в молекуле пренебречь? Ответ: U = 1500 Дж 3.5. В результате протекания некоторого процесса водород, занимавший объём 2 литра и находившийся при давлении 6 105 Па, перешёл в состояние с давлением 3 105 Па и объёмом 4 литра. Определить, на сколько изменилась внутренняя энергия газа. Ответ: ΔU = 0 69 3.6. Найдите отношение приращения внутренней энергии при изобарном расширении идеального многоатомного газа, при котором его объём увеличился в два раза, к приращению внутренней энергии этого газа при адиабатическом расширении с таким же изменением объёма. Начальные параметры процессов одинаковы. Ответ: – 4,9 3.7. Кислород массой m = 0,32 кг нагрели на ΔT = 100 К, сообщив ему количество теплоты Q = 30 кДж. Найти совершённую им работу A. Ответ: 9225 Дж 3.8. Какая доля ω1 количества теплоты, подводимого к идеальному многоатомному газу при изобарном процессе, расходуется на увеличение внутренней энергии газа, и какая доля ω2 – на работу расширения? Ответ: 1 = 3/4; 2 = 1/4 3.9. Одноатомному идеальному газу в результате изобарического процесса сообщено количество теплоты ΔQ. Какая доля этой теплоты расходуется на увеличение внутренней энергии данного газа? Ответ: 0,6 3.10. В закрытом сосуде находятся водород массой m1 = 12 г и гелий массой m2 = 4 г при одинаковой температуре. Найти приращение внутренней энергии ΔU этой смеси при изменении её температуры на ΔT = 52 К. Ответ: 7,13 кДж 3.11. В первом сосуде находится водород при температуре t1 = 107ºC и давлении p1 = 6·105 Па, а во втором сосуде азот при температуре t2 = 37ºC и давлении p2 = 106 Па. Объёмы сосудов V1 = 0,5 м3, V2 = 0,8 м3. Сосуды соединяют друг 70 с другом. Определить температуру смеси газов, предполагая, что теплообмен с окружающей средой отсутствует. Ответ: Т = 326 K 3.12. Два моля идеального газа, взятого при температуре T1 = 300 K, охладили изохорически, вследствие чего его давление уменьшилось в 2 раза. Затем газ изобарически расширился так, что в конечном состоянии его температура стала равна первоначальной. Найти количество теплоты, поглощённой газом в этом процессе. Ответ: 2493 Дж 3.13. При температуре t1 = 17ºC и давлении p1 = 2·105 Па 4,4 кг двуокиси углерода (CO2) были адиабатически сжаты до давления p2. После сжатия газ изотермически расширился. Определить температуру и объём газа в точке 2, если приращение внутренней энергии в адиабатическом процессе 108 кДж равно количеству теплоты, сообщенному в изотермическом процессе. Ответ: Т2 = 330 K, V2 = 0,81 м3 3.14. При адиабатическом сжатии кислорода массой m = 20 г его внутренняя энергия увеличилась на ΔU= 8 кДж, а температура возросла до Т2 = 900 К. Найдите: 1) изменение температуры кислорода ΔТ; 2) конечное давление газа р2, если начальное давление р1 = 200 кПа. Ответ: ΔТ = 616,1 К; р2 = 1,13 107 Па 3.15. Некоторое количество гелия, находящегося в сосуде, закрытом подвижным поршнем, имеет давление p1 = 105 Па. В результате нагревания его объём меняется от 71 V1 = 10 л до V2 = 20 л. Определить полученное газом количество теплоты. Какое количество теплоты потребуется для такого же увеличения объёма, если процесс проводить изотермически? Начальные параметры газа в этих процессах одинаковы. Ответ: 2,5 кДж; 693 Дж 3.16. Один моль идеального газа, имеющего первоначально температуру T1 = 290 K, расширяется изобарически до тех пор, пока его объём не возрастет в 2 раза. Затем газ охлаждается изохорически до первоначальной температуры. Определить полученное газом количество теплоты. Ответ: 2410 Дж 3.17. При изобарическом нагревании от 0ºС до 100ºC один моль идеального газа поглощает количество теплоты 3,35 кДж. Определить приращение внутренней энергии газа, совершаемую работу и показатель адиабаты γ для этого газа. Ответ: ΔU = 2493 Дж; A = 857 Дж; γ = 1,33 3.18. Сто молей газа, находящегося при температуре T1 = 300 К, охлаждаются изохорически, вследствие чего давление уменьшается в 1,5 раза. После этого газ расширяется изобарически так, что в конечном состоянии его температура становится равной первоначальному значению. Найти совершённую газом работу А и количество теплоты Q, сообщённой газу в этих процессах. Ответ: A = Q = 83,1·кДж 3.19. Один моль двухатомного газа адиабатически расширяется так, что давление уменьшается в четыре раза, и затем изотермически сжимается до первоначального давления. Температура в исходном состоянии T1 = 450 К. 72 Найти приращение внутренней энергии ΔU газа и количество теплоты Q, полученное газом. Ответ: ΔU = – 3057,5 Дж; Q = – 3488,3 Дж 3.20. Найти молярную массу газа, при изобарическом нагревании 0,5 кг которого на ΔT = 10 K требуется на 1,48 кДж теплоты больше, чем при изохорическом нагревании. Ответ: M = 28·10–3 кг/моль 3.21. Двухатомный газ из некоторого начального состояния сжимается адиабатически до объёма в пять раз меньшего начального. Определить, во сколько раз возрастёт в результате этого процесса внутренняя энергия газа? Ответ: 1,9 3.22. Кислород массой m = 200 г занимает объём V1 = 100 л и находится под давлением р1 = 200 кПа. При нагревании газ расширился при постоянном давлении до объёма V2 = 300 л, а затем его давление возросло до р3 = 500 кПа при неизменном объёме. Найти изменение внутренней энергии ΔU газа, совершенную работу A и теплоту Q, переданную газу. Ответ: ΔU = 325 кДж; A = 40 кДж; Q = 365 кДж 3.23. Двухатомный идеальный газ, занимавший при давлении p1 = 3·105 Па объём V1= 4 л, расширяют до объёма V2 = 6 л, при этом давление падает до значения p2 = 105 Па. Процесс происходит сначала по адиабате, затем по изохоре. Определить работу газа, изменение его внутренней энергии и количество поглощённой теплоты при этом переходе. Ответ: А = 450 Дж; ΔU = –1500 Дж; Q = –1050 Дж 3.24. Один моль аргона расширился в результате протекания политропического процесса с показателем n = 1,5. 73 При этом температура газа уменьшилась на 26 K. Найти количество теплоты, полученное газом, работу газа и изменение его внутренней энергии. Ответ: А = 432 Дж; ΔU = – 324 Дж; Q = 108 Дж 3.25. В состоянии А некоторая масса кислорода занимает объём V1 = 3 л при температуре t1 =27°С и давлении p1 = 820 кПа. В состоянии В кислород имеет параметры V2 = 4,5 л и p2 = 600 кПа. Найти отношение количества теплоты Q2, полученного газом при переходе из состояния А в состояние В в ходе процесса ADB, к количеству теплоты Q1, полученному газом при переходе из состояния А в состояние В в ходе процесса AСB. Q Ответ: 2 1,22 Q1 74 4. Теплоёмкость Теплоёмкость является характеристикой интенсивности теплообмена. Если система получила элементарное количество теплоты Q , и её температура при этом изменилась на dT, то теплоёмкость этой системы будет равна Q . dT Так как количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний, но и от вида процесса перехода между ними, то и теплоёмкость тела в общем случае зависит от вида процесса, при котором осуществляется теплообмен. В то же время существуют процессы, в ходе которых теплоёмкость остаётся неизменной. Эти процессы называют политропическими. В том случае, когда теплоёмкость постоянна или её изменением в ходе процесса можно пренебречь, теплоёмкость можно определить как физическую величину, численно равную количеству теплоты, которое нужно сообщить телу, чтобы увеличить его температуру на 1 градус (по шкале Цельсия или Кельвина). Теплоёмкость 1 моля вещества называют молярной: c 1 Q , dT где ν – число молей. Молярную теплоёмкость измеряют в Дж/(моль·К). C 75 Если в качестве системы рассматривается единица массы вещества, то теплоёмкость называют удельной (суд). В СИ удельную теплоёмкость измеряют в Дж/(кг·К). Получим выражения для теплоёмкости идеального газа, участвующего в различных процессах. 1. Изохорический процесс. Как было показано ранее, при изохорическом процессе работа не совершается, поэтому первое начало термодинамики для него запишется в виде: Q = ΔU. Так как изменение внутренней энергии идеального газа равно U m iR T , а количество теплоты, сообщёнM 2 ной при этом процессе m M молям газа, равно m CV T , то молярная теплоёмкость идеального газа M при изохорическом процессе CV определяется из выражения Q iR , 2 где i – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы одной молекулы, а R – универсальная газовая постоянная. Напомним, что для одноатомных газов i = 3; для газов, молекулы которых состоят из двух атомов, не совершающих колебательного движения, i = 5; такое же значение принимает число i и для газов, молекулы которых состоят из трех CV 76 и более атомов, расположенных вдоль прямой линии, если атомы не участвуют в колебательном движении; для газов, молекулы которых состоят из трех и более атомов, не лежащих на одной прямой, и не участвующих в колебательном движении, i = 6. 2. Изобарический процесс. Первое начало термодинамики для этого процесса запишем в виде Q d U A Тогда для молярной теплоёмкости при изобарическом процессе будем иметь: Cp Q dU A pdV . CV dT dT dT Уравнение состояния идеального газа, записанное для одного моля, имеет вид pdV = RdT. Тогда получаем, что Cp = CV + R. Уравнение Майера iR , из уравнения Майера следует, 2 что молярная теплоёмкость идеального газа при изобарическом процессе равна Учитывая, что CV Cp iR i2 R R. 2 2 Отметим, что у жидкостей и твёрдых тел C V и C p очень близки по величине, поэтому на практике их обычно не различают и рассматривают, как правило, только C V , называя её "теплоёмкостью вещества". 77 3. Изотермический процесс. В этом случае T = const, следовательно dT = 0. В то же время Q 0 , поэтому молярная теплоёмкость при изотермическом процессе Q . dT 4. Адиабатический процесс. Молярная теплоёмкость в CT Q 0 , так как при этом процессе отdT сутствует теплообмен и Q 0 , а температура изменяется и этом процессе Cадиаб dT 0 . 5. Политропический процесс. Молярная теплоёмкость равна C где n C Cp C CV nCV Cp n 1 , – показатель политропического процесса. 78 Примеры решения задач 1. При некотором политропическом процессе угарный газ (СО) был сжат от начального объёма V1 = 12 л до объёма V2 = 3 л. При этом давление газа возросло от p1 = 105 Па до p2 = 6∙105 Па. Найти молярную теплоёмкость угарного газа при этом процессе. Колебательные степени свободы молекулы угарного газа не учитывать. Дано Решение Молярную теплоёмкость при поV1 12 103 м3 литропическом процессе найдём по форV2 3 103 м3 муле 5 p1 = 10 Па nCV Cp . (1) C p2 = 6∙105 Па n 1 С–? Из этой формулы следует, что для вычисления молярной теплоёмкости необходимо определить показатель политропического процесса n, для чего запишем уравнение этого процесса в виде n p1V1n p 2V2n p2 V1 . p1 V2 (2) Логарифмируя выражение (2), будем иметь p n 2 p (3) n 1. V1 n V2 Подставив численные значения давлений и объёмов, приведённые в условии задачи, получим, что n = 1,29. Молярные теплоёмкости при изохорическом и изобаiR рическом процессах соответственно равны CV и 2 79 i2 R , где i для двухатомной молекулы угарного газа, 2 в которой не происходят колебания атомов, равняется 5. Вычислив молярные теплоёмкости при изохорическом и изобарическом процессах, определим молярную теплоёмкость при данном политропическом процессе по формуле (1) 1, 29 5 8,31 7 8,31 Дж 2 2 C 7,88 1, 29 1 K моль Обращает на себя внимание знак теплоёмкости. Обычно теплоёмкость положительна, но она, как показано в данной задаче, может быть и отрицательной. Это наблюдается в двух случаях: 1) при получении теплоты система охлаждается; 2) при отдаче теплоты система нагревается. В первом случае газ производит большую работу расширения A 0 , чем количество теплоты , которое подвоCp дится к газу в процессе расширения Q 0 , т.е. A Q . В этом случае на производство работы помимо теплоты, подведенной к газу, расходуется и некоторое количество его внутренней энергии, а уменьшение внутренней энергии газа dU 0 ведет к снижению температуры. Во втором случае газ сжимают. Производимая газом работа над окружающими телами A и работа A , совершаемая внешними телами над газом, связаны соотношением A A . Если системой получено количество теплоты Q , то количество теплоты, которое отдаётся системой Q Q . Тогда первое начало термодинамики можно переписать в виде: 80 Q dU A Q dU A или dU A Q . Работа, производимая над газом при его сжатии A , в рассматриваемом случае оказывается большей, чем количество отданного им тепла. Внутренняя энергия системы увеличивается, а, значит, ее температура растет, несмотря на то, что газ отдает теплоту. Такой процесс характерен для звезд, в которых гравитационные силы, сжимающие её, совершают работу большую, чем количество излучаемой ею теплоты. В результате звезда одновременно излучает и разогревается. Отметим, что теплоёмкость отрицательна для следующего диапазона значений показателя политропического процесса n: 1 n , i2 где – показатель адиабатического процесса. В расi смотренной задаче i = 5 и 1, 4 , а n 1, 29 . Дж Ответ: С = – 7,88 . K моль 2. Молярная теплоёмкость двухатомного идеального газа в ходе некоторого процесса изменяется по закону Дж b Дж С а , где a 20 , b 500 . Найти работу, моль K Т моль совершаемую одним молем этого газа при изменении температуры от T1 = 200 K до T2 = 544 K. 81 Дано i=5 ν = 1 моль Саb Т Дж a 20 моль K b 500Дж моль T1 = 200 K T2 = 544 K A–? Решение Работу определим из первого начала термодинамики (1) Q A U A Q U . Изменение внутренней энергии вычислим по формуле i (2) U R T2 T1 . 2 Расчёты показывают, что 5 U 1 8,31 544 200 7146,6 Дж . (3) 2 Найдём количество теплоты, сообщённой газу T2 T2 T b Q CdT a dT a T2 T1 b n 2 . (4) T T1 T1 T1 После вычислений имеем 544 Q 1 20 544 200 1 500 n 7380,3 Дж . 200 Из (1), (3) и (5) получаем A Q U 7380,3 7146,6 233,7 Дж (5) Ответ: 233,7 Джъ 3. Определить работу политропического сжатия трёх молей азота, если температура газа изменилась на 250 К, а показатель политропического процесса n = 1,43. Дано Решение Из уравнения политропического 3 моль процесса, записанного в виде n = 1,43 A–? 82 T1V1n1 T2V2n1 , следует, что при n 1 сжатие газа V2 V1 сопровождается ростом температуры T2 T1 , поэтому изменение температуры положительно и равно T = 250 К. Для нахождения работы, совершённой в ходе данного политропического процесса, воспользуемся первым началом термодинамики (1) Q U A A Q U , m где количество сообщённой газу теплоты Q C T , а изM m i m RT CV T . менение его внутренней энергии U M2 M С учётом этих выражений для Q и U формула (1) для определения работы приобретёт вид m A T C CV . (2) M После подстановки в (2) выражения для молярной теплоёмкости газа при политропическом процессе nC Cp будем иметь C V n 1 C Cp nC Cp m m A T V CV T V . (3) M n 1 M n 1 Из уравнения Майера Cp CV R следует, что CV Cp R , поэтому выражению (3) можно придать вид m R T . (4) M n 1 В результате вычислений будем иметь 3 250 8,31 A 14494 Дж 1, 43 1 Ответ: A 14,49 кДж A 83 4. Кислород, который можно рассматривать как идеальный газ, расширяется так, что выполняется условие pV3 = const. Найти молярную теплоёмкость газа для рассматриваемого процесса. Дано Решение Молярная теплоёмкость определяi=5 ется по формуле pV3 = const 1 Q . (1) C С–? dT В соответствии с первым началом термодинамики (2) Q dU A , где дифференциал внутренней энергии равен iR dU dT , (3) 2 а элементарная работа равна (4) A p dV . Тогда из (2), (3) и (4) имеем iR Q dT p dV . (5) 2 Разделив левую и правую части выражения (5) на dT, получим Q iR dV . (6) p dT 2 dT С учётом (1) и (6), будем иметь i 1 dV . (7) C R p 2 dT dV Преобразуем выражение p , для чего воспользуdT емся уравнением данного процесса (8) pV3 , 84 где const . Из (8) следует, что (9) p 3. V Подставим выражение (9) в уравнение состояния идеального газа (10) RT pV RT 3 V RT 2 . V V Продифференцировав по температуре левую и правую части уравнения RT 2 , будем иметь V 2V dV 2 dV R 4 R 3 . (11) V dT V dT Из (11) получаем выражение для производной от объёма по температуре dV RV3 . (12) dT 2 Сравнивая (7), (9) и (12), будем иметь 3 i R 1 R V iR R R C i 1 . 3 2 V 2 2 2 2 8,31 Дж C 5 1 16,62 2 K моль Дж Ответ: С 16,62 моль К 5. Определить функциональную зависимость молярной теплоёмкость идеального многоатомного газа от его объёма, если он совершает процесс по закону p = pо·eαV, где = 2 м–3. Построить график зависимости C = C(V) для диапазона объёмов от 0,2 м3 до 1,2 м3. 85 Дано i=6 p = pо·eαV α = 2 м–3 C = C(V) – ? Решение Преобразуем формулу для молярной теплоёмкости 1 Q (1) C dT с учётом первого начала термодинамики (2) Q dU A , где дифференциал внутренней энергии равен (3) dU CV dT , а элементарная работа равна (4) A p dV , к виду 1 CVdT 1 dV 1 dV . (5) C p CV p dT dT dT Чтобы найти производную от объёма по температуре dV , в уравнении состояния идеального газа pV RT dT заменим давление в соответствии с уравнением процесса p poeV : poeV V RT , (6) а затем левую и правую части уравнения (6) продифференцируем по температуре dV V dV po eV V e R . dT dT Тогда dV R . V dT poe 1 V (7) Используя уравнение процесса p poeV и выражение 86 (7), из (5) будем иметь 1 R 1 i C CV p0eV R , V p0e 1 V 2 1 V (8) где учтено, что молярная теплоёмкость при постоянном объiR ёме CV . 2 Подставляя численные значения величин, получим 1 C 8,31 3 . 1 2V График этой зависимости в заданном интервале объёмов имеет следующий вид С, Дж / моль К 31,0 30,5 30,0 29,5 29,0 28,5 28,0 27,5 27,0 0,2 0,4 0,6 0,8 1,0 1,2 3 V, м 1 i Ответ: C R . 2 1 V 6. Два моля трёхатомного идеального газа совершает процесс при котором объём зависит от температуры по закону V = a/T. Определить молярную теплоёмкость газа для указанного процесса. 87 Дано i=6 ν = 2 моль V = a/T C–? Решение Молярная теплоёмкость по определению равна 1 Q . (1) C dT В соответствии с первым началом термодинамики Q dU A , (2) где дифференциал внутренней энергии dU и элементарную работу A вычисляют по формулам dU CV dT , (3) (4) A p dV , поэтому выражение для молярной теплоёмкости приобретает вид 1 CVdT 1 dV 1 dV i R 1 dV . (5) C p CV p p dT dT dT 2 dT dV dT Производную найдём, продифференцировав уравнение процесса: a dV a 2 . (6) T dT T Выразим давление через температуру, воспользовавшись уравнением состояния идеального газа и уравнением процесса, RT RT 2 pV RT p p (7) V a Подставив (6) и (7) в формулу (5), получим выражение для молярной теплоёмкости в указанном процессе V 88 i R 1 RT 2 a i i R R R 1 . 2 2 a T 2 2 После подстановки численных значений будем иметь 6 Дж C 8,31 1 16,62 2 моль K Дж Ответ: С 16,62 моль K C 7. При некотором политропическом процессе объём моля аргона был увеличен в 9 раз. Давление при этом уменьшилось в 27 раз. Найти молярную теплоёмкость аргона, если его начальная температура T1 = 300 K. Дано Решение Предположим, что формула для опреν = 1 моль деления молярной теплоёмкости при поV2 V1 9 nCV Cp p1 p2 27 литропическом процессе ( C ) n 1 i=3 нам неизвестна. Для её получения прежде С–? всего запишем определение молярной теплоёмкости 1 Q C . (1) dT Элементарное количество теплоты выразим из первого начала термодинамики, записанного в дифференциальной форме (2) Q dU A . iR Учитывая, что dU dT , а A p dV , преобра2 зуем (2) к виду 89 iR (3) dT p dV . 2 Как видно из выражения (1), чтобы определить теплоёмкость, необходимо разделить на dT выражение для элементарного количества теплоты (3): Q iR dV . (4) p dT 2 dT Дальнейшее решение задачи сводится к нахождению dV такого выражения для p , в которое бы входили заданdT ные в условии задачи величины. Для этого запишем уравнение политропического процесса, связывающее начальное состояние, параметры которого обозначены индексом 1, с произвольным состоянием, параметры которого не имеют индекса, (5) p1V1n pVn . Q Из (5) получим выражение для давления p Vn (6) p 1 n1 , V которое подставим в уравнение состояния идеального газа p Vn V RT pV RT 1 1n RT p1V1n V1n . (7) V Продифференцировав левую и правую части уравнения (7) по температуре, получим dV R p1V1n 1 n V n . dT Тогда dV RV n . (8) dT p1V1n 1 n 90 Подставив выражения (4), (6) и (8) в (1), будем иметь i p Vn RV n 1 i C R 1 n1 C R . (9) n 2 V p1V1 1 n 2 1 n Преобразовав выражение (9) с учётом того, что iR i2 CV ; C p R , получим 2 2 nCV Cp . (10) C n 1 Чтобы определить значение теплоёмкости в данном политропическом процессе, необходимо вычислить показатель этого процесса n, для чего запишем уравнение процесса, связав параметры начального (индекс 1) и конечного n p V (индекс 2) состояний p V p 2V 1 2 . p2 V1 n 1 1 n 2 Подставив исходные данные, будем иметь 27 9n 33 32 n n 1,5 . Значение молярной теплоёмкости можно вычислить и по формуле (9), и по формуле (10). Проведём вычисления по формуле (9): 1 3 Дж C 8,31 4,16 . K моль 2 1 1,5 Ответ: C 4,16 91 Дж K моль Задания для аудиторной и самостоятельной работы 4.1. Молярные теплоёмкости углекислого газа, рассматриваемого как идеальный газ, в процессах 1→2 и 1→3 равны С1 и С2 соответственно. Чему равно отношение С1/С2? Молекула СО2 имеет линейную структуру. Учесть колебательное движение атомов в молекуле. Ответ: 0,87 4.2. Молярная теплоёмкость идеального одноатомного газа в процессе 1→2 равна С1, а молярная теплоёмкость идеального двухатомного газа в процессе 1→3 равна С2. Найти разность молярных теплоёмкостей С2 и С1? Атомы в молекулах двухатомного газа участвуют в колебательном движении. Ответ: 24,93 Дж/моль∙К 4.3. На сколько градусов будут нагреты 40 г кислорода, при поглощении 628 Дж теплоты в ходе изобарного процесса? Ответ: t 17,3 C 4.4. При адиабатическом сжатии газа его объём уменьшился в 10 раз, а давление увеличилось в 21,4 раза. Определить отношение молярных теплоемкостей Ср/Сv этого газа. Ответ: Ср/Сv = 1,33 4.5. Идеальный газ расширяется адиабатически так, что его давление падает от p1 = 200 кПа до р2 = 100 кПа. Затем он нагревается при постоянном объёме до первоначаль- 92 ной температуры, причём его давление становится равным р = 122 кПа. Найти отношение Ср/Сv для этого газа. Ответ: Ср/Сv = 1,4 4.6. Найти показатель адиабаты γ для смеси газов, содержащей 10 г гелия и 4 г водорода. Ответ: 1,51 4.7. Идеальный газ совершает процесс 1–2–3. График зависимости его теплоёмкости от температуры приведён на рисунке. Во сколько раз количество теплоты, полученное газом на участке 1–2, отличается от количества теплоты, полученного на участке 2–3. T1 = 200 К; T2 = 800 К; Т3 = 1200 К. С1 = 2 Дж/К; С2 = 5 Дж/К, С3 = 9 Дж/К. Ответ: 1,18 раза 4.8. Теплоёмкость некоторого тела зависит от температуры по закону C = a + bT + cT2. Определить количество теплоты полученного телом при нагревании от 200 K до 300 K, если a = 10 Дж/K, b = 2·10–2 Дж/K2, c = 3·10–5 Дж/K3. Ответ: 1690 Дж 4.9. При протекании некоторого процесса молярная теплоёмкость газа изменяется в зависимости от темпераДж туры по закону C T 4 , где 7,5 1010 . В ходе моль К5 данного процесса температура трёх молей этого газа возросла с T1 300 К до T2 600 К, и им была совершена работа 25 кДж. На сколько при этом изменилась внутренняя энергия газа? Ответ: 8,9 кДж 4.10. Кислород массой 40 г нагревают от t1 = 20ºC до t2 = 44ºC. В этом процессе газ поглощает 623,3 Дж теплоты. Определить, каким способом (при постоянном объёме или при постоянном давлении) нагревали газ. Ответ: V = const 93 4.11. Азот совершает политропический процесс, молярная теплоёмкость которого равна С = 2,5R, где R – универсальная газовая постоянная. Как изменяется объём газа в таком процессе? Ответ: ΔV = 0 4.12. В ходе некоторого политропического процесса аммиак (NH3) был сжат от объёма V1 = 10 л до объёма V2 = 5 л. При этом давление возросло от p1 = 105 Па до p2 = 5·105 Па. Определить молярную теплоёмкость газа для этого процесса. Колебательные степени свободы молекулы аммиака не учитывать. Дж Ответ: C = 18,63 K моль 4.13. Три моля идеального четырёхатомного газа в ходе политропического процесса с теплоёмкостью C 35 Дж / К совершили работу, равную 850 Дж. На сколько при этом увеличилась температура газа? Ответ: 28,1 К 4.14. Теплоёмкость одного моля идеального двухатомного газа зависит от температуры по закону C exp T , где = 3 Дж/моль∙К; 2 103 K 1 . Найти работу, совершенную двумя молями газа, при изменении температуры газа от T1 400 К до T2 800 К. Ответ: –8438 Дж 4.15. Теплоёмкость идеального газа при некотором поR литропическом процессе равна С СV . Найти значение 5 показателя политропы n для этого процесса. Ответ: n = – 4 4.16. Определить функциональную зависимость молярной теплоёмкости идеального многоатомного газа от объёма, если он совершает процесс, в ходе которого температура изменяется по закону T = T0·eαV. Ответ: C CV R V 94 4.17. Одноатомный идеальный газ расширяется по закону p = αV, где α – положительная постоянная. Определить молярную теплоёмкость газа для рассматриваемого процесса. Ответ: С 16,62 Дж / моль·К 4.18. Идеальный трёхатомный газ в процессе нагрева совершает процесс pV4 = const. Определить молярную теплоемкость газа при таком нагревании. Ответ: С = 22,16 Дж/моль·К 4.19. При изменении температуры двух молей углекислого газа (СО2) он расширяется по закону V b T , где b = const. Определить молярную теплоёмкость газа при этом процессе. Ответ: С = 20,78 Дж/моль∙К 4.20. Идеальный газ совершает процесс, при котором его объём изменяется с ростом температуры Т по закону V bT3 , где b – const. Найти молярную теплоёмкость такого процесса. Молярная теплоёмкость этого газа при постоянном объёме равна C V = 24,93 Дж/К. Ответ: С = 49,86 Дж/моль∙К 95 5. Коэффициент полезного действия. Цикл Карно Экспериментально установлено, что преобразование энергии механического движения макроскопических тел в энергию хаотического движения микрочастиц, т.е. превращение работы в теплоту, ничем не ограничено, при этом всю работу можно превратить в теплоту. При обратном процессе превращение теплоты в работу всегда происходит не полностью. Закон, позволяющий указать направление теплового потока в изолированных системах, и устанавливающий предел превращения теплоты в работу в тепловых машинах, – это второе начало термодинамики. Сформулируем его в виде ряда постулатов, для чего рассмотрим особенности превращения теплоты в работу, осуществляемого в тепловых машинах. Любая тепловая машина должна работать циклично, т.е. рабочее тело, совершая за определённый промежуток времени ряд процессов расширения и сжатия, должно возвращаться в исходное состояние. Рабочее тело в термодинамике – это материальное тело (газ или пар), которое, расширяясь при подводе к нему теплоты и сжимаясь при его охлаждении, выполняет работу по перемещению рабочего органа теплового двигателя (поршня в цилиндре). Как правило, в дальнейшем будут рассматриваться случаи, когда рабочее тело представляет собой идеальный газ. Для функционирования тепловых машин кроме рабочего тела необходимы, как впервые показал Карно, источник теплоты (нагреватель), который имеет более высокую температуру Т1, и приёмник теплоты (холодильник), характеризующийся более низкой температурой Т2. Часто функцию холодильника выполняет окружающая среда. 96 Цикл с протеканием процессов по часовой стрелки называется прямым. Это цикл тепловых двигателей. Тепловые двигатели (газовые турбины, двигатели внутреннего сгорания, реактивные двигатели, и др.) предназначены для получения полезной работы за счёт теплоты, выделяемой вследствие сгорания топлива, ядерных превращений, нагрева солнечными лучами или по другим причинам. Схема работы теплового двигателя (а) и соответствующий термодинамический цикл (б) представлены на рисунке. Развивая идеи Карно, Кельвин сформулировал второе начало термодинамики в виде следующего постулата: невозможно построить такой периодически действующий тепловой двигатель, который, получив извне некоторое количество теплоты при любой температуре, полностью превращал бы её в механическую работу и при этом возвращался бы в исходное состояние. В соответствии с постулатом Кельвина, тепловой двигатель не может полностью превратить всю полученную за цикл от нагревателя теплоту Q1 в работу А, и должен часть этой теплоты передать холодильнику (что можно трактовать как процесс получения от него теплоты с обратным знаком). 97 Если Q2 0 – теплота, полученная рабочим телом от холодильника, то отданное рабочим телом холодильнику количество теплоты можно представить как Q2 . Тогда работа теплового двигателя, совершившего некоторый цикл, будет равна A Q1 Q2 Q1 Q2 , напомним, что Q2 0 . Коэффициентом полезного действия (КПД) теплового двигателя называют отношение работы, совершённой рабочим телом за цикл, к сообщённому ему при этом количеству теплоты: Q A Q1 Q2 1 2 . Q1 Q1 Q1 Тепловой двигатель, который работал бы только от одного источника теплоты, называют вечным двигателем 2-го рода. Так как Q2 = 0, его КПД должен бы быть равен 100%, Согласно постулату Оствальда, являющемуся частной формулировкой второго начала термодинамики, вечный двигатель 2-го рода невозможен. Наибольший КПД при заданных значениях температур нагревателя ( T1 ) и холодильника ( T2 ) имеет идеальный тепловой двигатель, совершающий в процессе работы обратимый круговой процесс, называемый циклом Карно. Процесс перехода системы из одного состояния в другое называют обратимым, если возвращение этой системы в исходное состояние через те же промежуточные состояния, что и в прямом процессе, но в обратной последовательности, можно осуществить без каких бы то ни было изменений в окружающих внешних телах. Всякий равновесный 98 процесс является обратимым. Все реальные (естественные) процессы необратимы. Цикл Карно, изображённый на рисунке, состоит из двух изотермических (1-2 и 3-4) и двух адиабатических процессов (2-3 и 4-1). p1V1T1 Q Цикл, совершаемый теп1 1 ловым двигателем, происходит 2p V T 2 2 1 по часовой стрелке (в направa б лении 12б34а1). При этом про4 3p V T p4V4T2 цесс изотермического расши3 3 2 рения (1-2) совершается при Q2 температуре нагревателя, а процесс изотермического сжатия (3-4) – при температуре холодильника. Следует отметить, что при адиабатическом расширении (2-3) температура уменьшается от Т1 до Т2, а при адиабатическом сжатии (4-1) она увеличивается от Т2 до Т1. Установлено, что КПД теплового двигателя, совершающего цикл Карно, не зависит от природы рабочего тела и определяется только температурами нагревателя и холодильника, то есть T T K 1 2 . T1 При одинаковых температурах нагревателя и холодильника коэффициент полезного действия реального теплового двигателя всегда меньше КПД идеального двигателя, работающего по циклу Карно. Тепловую машину, совершающую обратный цикл, которая потребляет механическую энергию, отнимает теплоту у тела с меньшей температурой и передаёт теплоту более нагретому телу, называют холодильной машиной. 99 Схема работы холодильной машины (а) и её термодинамический цикл (б) представлены на рисунке. Существуют две разновидности холодильных машин: холодильная установка и тепловой насос. Холодильная установка предназначена для поддержания в холодильной камере температуры, которая ниже температуры окружающей среды. В качестве рабочего тела в них обычно используют пары легкокипящих жидкостей (например, фреона). В холодильной установке на участке цикла 1б2 рабочее тело расширяется, получая теплоту Q2 от охлаждаемого тела с температурой Т2. На участке 2а1 внешние тела совершают работу A над рабочим телом, обычно за счет электрической энергии, в результате чего происходит сжатие рабочего тела и передача теплоты Q1 тепловому резервуару, в качестве которого, как правило, выступает окружающая среда с температурой Т1 > Т2. Эффективность холодильной установки характеризуют холодильным коэффициентом Q k хол 2 , A который может быть больше 1. 100 Тепловой насос – это устройство, которое используется для отопительных целей. Эффективность его работы оценивается коэффициентом перекачки теплоты (коэффициентом трансформации энергии) Q k пт 1 . A Если пренебречь потерями энергии в тепловом насосе, будем иметь Q1 Q2 A , т.е. количество теплоты Q1, передаваемое обогреваемому помещению, оказывается больше, чем внешняя работа A , определяемая энергией, полученной от электрической сети. В связи с этим тепловой насос, при использовании которого на нагрев помещений идёт не только преобразованная в теплоту электроэнергия, но и теплота, отобранная от окружающей среды, имеет существенное преимущество над обычными электрическими нагревателями. Если идеальная холодильная установка работает по обратному циклу Карно, то холодильный коэффициент равен T2 , k хол T1 T2 где T2 – температура охлаждаемого тела, T1 – как правило, температура окружающей среды ( Tос > T2 , следовательно окружающая среда – высокотемпературный резервуар теплоты). Коэффициент перекачки теплоты идеального теплового насоса, работающего по циклу Карно, определяют по формуле 101 k пт T1 , T1 T2 где T1 – температура потребителя теплоты (обогреваемого помещения), T2 – обычно температура окружающей среды ( Tос < T1 , следовательно в данном случае окружающая среда – низкотемпературный резервуар теплоты). Коэффициент перекачки теплоты всегда больше единицы. Анализируя обратный цикл Карно, приходим к выводу о том, что передать теплоту от холодного тела к горячему возможно только при затрате работы или при протекании другого компенсационного процесса. Другими словами, теплота сама собой может переходить только от более нагретых тел к холодным, обратный процесс самопроизвольно не происходит. Это утверждение составляет содержание постулата Клаузиуса, являющегося ещё одной частной формулировкой 2-го начала термодинамики: невозможны такие процессы, единственным конечным результатом которых был бы переход теплоты от тела менее нагретого к телу более нагретому. 102 Примеры решения задач 1. Водород совершает цикл Карно. Найти КПД цикла, если при адиабатическом расширении объём газа увеличивается в 2 раза. Считать, что молекула водорода жёсткая. Дано Решение V3 2 V2 –? Запишем уравнение процесса адиабатического расширения в виде T1V21 T2V31 или T2 V2 T1 V3 1 . (1) Так как коэффициент полезного действия цикла Карно определяется только температурами нагревателя и холодильника, то T T T (2) 1 2 1 2 . T1 T1 Подставив выражение (1) в (2), будем иметь 1 V 1 2 . (3) V3 Показатель адиабатического процесса выразим через число i: i2 . i 103 По условию задачи молекула жесткая, поэтому колебательные степени свободы отсутствуют. Тогда для двухатомной молекулы водорода i n пост n вращ , где n пост 3 – число поступательных степеней свободы, а n вращ 2 – число вращательных степеней свободы, т.е. в данном случае i = 5, а = 1,4. Подставив известные величины в выражение (3), получим, что 0,4 1 1 0, 24 . 2 Чтобы выразить КПД в процентах, умножим на 100%. Ответ: 24% 2. У теплового двигателя, работающего по циклу Карно, температура нагревателя в 1,6 раз больше температуры холодильника. За один цикл двигатель производит работу A 12 кДж . Какая работа за цикл затрачивается на изотермическое сжатие рабочего тела? Дано Решение T1 1,6 T2 A 12 кДж A34 – ? С одной стороны, коэффициент полезного действия идеального теплового двигателя, работающего по циклу 104 Карно, вычисляется по формуле T2 . (1) T1 С другой стороны, из общего определения для КПД теплового двигателя, имеем A . (2) Q1 Сравнивая выражения (1) и (2), получаем A T A . (3) 1 2 Q1 T2 Q1 T1 1 T1 1 Работа, совершаемая тепловым двигателем за цикл, равна A Q1 Q2 , (4) поэтому, учитывая (3) и (4), будем иметь AT1 AT2 A . Q2 Q1 A A T1 T2 T1 T2 T1 1 T2 Внутренняя энергия системы при изотермическом процессе не изменяется, поэтому в согласии с первым началом термодинамики работа внешних сил A34 , затраченная на сжатие рабочего тела идеального теплового двигателя, равна количеству теплоты, которое система отдала окружающей среде Q 2 , т.е. A34 Q2 A T1 1 T2 . Подставив численные значения, будем иметь 105 A34 12 20 (кДж) 1,6 1 Ответ: 20 кДж 3. Рабочим телом идеального теплового двигателя, работающего по циклу Карно, служит двухатомный идеальный газ. Объём газа в состояниях 1 и 2 равен соответственно V1 102 м3 и V2 2 102 м3 . Работа, совершаемая за цикл, равна 7200 Дж . Вычислить работу, совершаемую рабочим телом, на участке 4-1. Колебательные степени свободы молекул газа не возбуждены. Дано Решение i5 V1 102 м3 V2 2 102 м3 A 7200 Дж A 41 – ? Участок 4-1 цикла Карно соответствует адиабатическому сжатию рабочего вещества. Совершаемая газом в ходе этого процесса работа A 41 равна убыли внутренней энергии: i i A 41 U 4 U1 R T2 T1 R T1 T2 , (1) 2 2 где T1 – температура нагревателя, а T2 – температура холодильника. Чтобы найти разность температур T1 T2 , представим 106 работу теплового двигателя за цикл как сумму работ, совершаемых на отдельных его участках A A 12 A 23 A 34 A 41 , где A12 – работа, совершаемая газом при изотермическом расширении, которая равна V A12 RT1 n 2 ; (2) V 1 A 23 – работа, совершаемая газом при адиабатическом расширении, равная убыли внутренней энергии i A 23 U 2 U3 R T1 T2 ; (3) 2 A 34 – работа, совершаемая газом при изотермическом сжатии, которая равна V V A34 RT2 n 4 RT2 n 3 . (4) V4 V3 Сравнение выражений (1) и (3) показывает, что A 23 = – A 41 , поэтому V V (5) A A12 A34 R T1 n 2 T2 n 3 V V 1 4 V V Установим связь между отношениями объёмов 2 и 3 , V4 V1 для чего запишем уравнение адиабатического процесса 2-3 в виде T1V21 T2V31 , (6) а уравнение адиабатического процесса 4-1 представим как T1V11 T2V41 . (7) Преобразуя (6) и (7), получим 107 1 1 T 1 T 1 V3 V2 1 и V4 V1 1 . T2 T2 Сравнение этих выражений показывает, что V3 V4 V V 3 2. V2 V1 V4 V1 Из (5) с учётом (8) будем иметь V A R T1 T2 n 2 . V1 Тогда T1 T2 (8) (9) A . После подстановки этого выра V2 R n V1 жения в (1) получим i A 41 R 2 A i A . V2 2 V2 R n n V1 V1 5 7200 A 41 25969 Дж 2 102 2 n 2 10 Ответ: – 25969 Дж 4. Найти КПД цикла, состоящего из двух изохор и двух адиабат, если в пределах цикла объём изменяется в 10 раз. Рабочим телом является азот. Колебательные степени свободы не возбуждены. 108 Дано Решение V2 10 V1 i5 –? Коэффициент полезного действия теплового двигателя определяется по формуле Q 1 2 , Q1 где Q1 – количество теплоты, полученное за цикл рабочим телом теплового двигателя от нагревателя, а Q 2 – количество теплоты, отданное за цикл холодильнику. Так как при совершении адиабатических процессов теплообмен отсутствует, то Q23 Q41 0 , поэтому в данном случае тепловой двигатель может отдавать и получать теплоту только при изохорических процессах. p const , Из уравнения изохорического процесса T следует, что рост температуры за счёт получения теплоты извне должен сопровождаться увеличением давления. Это соответствует процессу 1-2. При снижении температуры в результате отдачи теплоты холодильнику происходит уменьшение давления, что соответствует изохорическому процессу 3-4. Т.е. при протекании процесса 1-2 рабочее тело теплового двигателя получает количество теплоты Q12 , в ходе процесса 3-4 отдаёт количество теплоты Q34 . Тогда 109 формула для определения коэффициента полезного действия может быть записана в виде Q (1) 1 34 . Q12 Количество теплоты, получаемое на участке 1-2 цикла, равно 5 (2) Q12 CV T2 T1 R T2 T1 , 2 i где CV R – молярная теплоёмкость рабочего вещества (в 2 данном случае – азота, для которого i = 5). Количество теплоты Q34 , получаемое рабочим телом на участке 3-4 цикла, найдём по формуле 5 (3) Q34 R T4 T3 . 2 Количество теплоты Q34 , отдаваемое на участке 3-4 цикла, равно 5 5 Q34 Q34 R T4 T3 R T3 T4 2 2 Подставив (2) и (3) в (1), получим 5 2 R T3 T4 T3 T4 1 (4) . 1 5 T T 2 1 R T2 T1 2 Найдём разность температур T3 T4 , для чего запишем уравнения адиабатических процессов 2-3 и 4-1: 1 1 T2V 1 2 T3V V T3 T2 1 V2 110 1 (5) 1 V (6) T V T4 V T4 T1 1 . V2 С учётом (5) и (6) разность температур T3 T4 будет равна 1 1 1 1 2 1 V (7) T3 T4 T2 T1 1 . V2 Подставив выражение (7) для разности температур T3 T4 в (4), получим 1 V T2 T1 1 1 1 V2 V1 V2 1 1 1 . T2 T1 V2 V1 Так как для газа с двухатомными молекулами, каким является азот, показатель адиабатического процесса V C i 2 5 2 p 1, 4 , и по условию задачи 2 10 , то V1 CV i 5 1 100,4 100% 60,2% Ответ: 60,2 % 5. Тепловой двигатель работает по циклу, состоящему из двух изобар и двух адиабат. Температура при завершении изобарического расширения T2 630 K , а температура после изобарического сжатия T4 293 K . Отношение давления при изобарическом расширении к давлению при p изобарическом сжатии 1 6 . Рабочим телом является воp4 дород. Определить КПД цикла. Колебательные степени свободы в молекуле водорода не учитывать. 111 Дано Решение i5 T4 = 293 K T2 = 630 K p1 n6 p4 –? Коэффициент полезного действия теплового двигателя выразим через количество теплоты, полученное за цикл рабочим телом от нагревателя Q1 , и количество теплоты, отданное за цикл холодильнику Q 2 : Q2 . Q1 Так как при совершении адиабатических процессов теплообмен отсутствует, то в данном случае тепловой двигатель может отдавать и получать теплоту только при изобарических процессах. Причём, как следует из уравнения изоV const , при протекании процесса барического процесса T изобарического расширения (1-2) температура рабочего тела теплового двигателя (водорода) увеличивается и, следовательно, происходит получение рабочим телом количества теплоты Q1 Q12 , а на участке 3-4 происходит сниже 1 ние температуры, поэтому двигатель отдаёт количество теплоты Q2 Q34 . Тогда формула для определения коэффициента полезного действия может быть записана в виде Q 1 34 . (1) Q12 112 При этом количества теплоты, полученные при изобарном расширении и изобарном сжатии, описываются соответственно выражениями Q12 Cp T2 T1 (2) и Q34 Cp T4 T3 . (3) Подставляем (2) и (3) в (1), учитывая, что Q34 Q34 . Это позволяет записать коэффициент полезного действия в виде C T3 T4 T3 T4 (4) 1 p 1 . C T T T T p 2 1 2 1 Найдём температуры T3 и T1 , для чего воспользуемся уравнениями адиабатических процессов 2-3 и 4-1. Запишем уравнение процесса 2-3: 1 1 T2 p T3 p 1 4 p T3 T2 1 p4 1 . (5) p T1 T4 4 , p1 (6) Для процесса 4-1 имеем: T4 p 1 4 1 1 T1 p 1 где – показатель адиабатического процесса, равный для водорода i2 52 1, 4 . i 5 Тогда 1 1 1, 4 0, 286 . Из (5) и (6) имеем 1, 4 T3 630 60,286 377,4 K , 113 0,286 1 T1 293 489,1 K . 6 Подставив в (4) значения температур Т3 и Т1, будем иметь 377, 4 293 1 100% 40% . 630 489,1 Ответ: 40 % Эта задача может быть решена и в том случае, когда температуры Т1 и Т4 не заданы (см. задачу 5.10). 6. Идеальный газ совершает цикл, состоящий из изохоры, адиабаты и изотермы. Изотермический процесс происходит при минимальной температуре цикла. Найти КПД цикла, если температура в пределах цикла изменяется в 5 раз. Дано Решение T2 5 T1 –? p 2 T2 1 T1 V1 3 V2 V Чтобы определить коэффициент полезного действия, необходимо найти количество теплоты, сообщаемое системе за цикл, и количество теплоты, отдаваемое ею. По определению в ходе адиабатического процесса 2-3 теплообмен не совершается, т.е. Q23 0 . В ходе изотермического процесса 3-1 внутренняя энергия не изменяется, поэтому в соответствии с первым началом 114 термодинамики, получаем, что количество теплоты Q31 , сообщённое газу при его сжатии, равно работе A31 , совершённой газом над окружающими его телами Q31 A31 Q31 R T1 n V1 . V2 (1) Тогда теплота Q31 , передаваемая при изотермическом сжатии от рабочего тела тепловой машины к холодильнику, равна V (2) Q31 Q31 R T1 n 2 . V1 При изохорическом процессе 1-2 давление растёт, значит температура газа, как это следует из уравнения данного проp цесса ( const ), увеличивается. Это происходит за счёт поT лучаемой тепловой машиной от нагревателя теплоты i Q12 CV T2 T1 R T2 T1 (3) 2 Коэффициент полезного действия в данном случае равен Q 1 31 . (4) Q12 Подставив в (4) выражения (2) и (3), будем иметь V V RT1 n 2 n 2 V1 1 V1 . 1 (5) T2 i i T2 RT1 1 1 2 2 T1 T1 V2 , для чего запишем V1 уравнение адиабатического процесса 2-3 в виде Найдём отношение объёмов 115 T2V11 T1V21 , (6) преобразуя которое, получим T2 V2 T1 V1 1 1 V T 1 2 2 . V1 T1 (7) Подставим (7) в (5) 1 1 T 2 T n 1 T1 n 2 1 1 T1 1 i T2 i T2 1 1 2 T1 2 T1 (8) i2 2 1 i 1 . Тогда окончаi i 1 2 тельно будем иметь T n 2 T (9) 1 1 . T2 1 T1 и учтём, что В результате расчётов по формуле (9) получим n 5 1 100% 59,8% . 5 1 Ответ: 59,8 % 7. Идеальный двухатомный газ совершает круговой процесс, состоящий из двух изотерм и двух изохор. Изотермические процессы протекают при температурах T1 400 K , 116 T2 300 K . Отношение объёмов, соответствующих изохоV2 e , где e – основание натуральных V1 логарифмов. Найти КПД цикла. Колебательные степени свободы не учитывать. Дано Решение рическим процессам, T1 400 K T2 300 K V2 V1 e i=5 –? Для вычисления коэффициента полезного действия воспользуемся формулой A , (1) Q1 где A Q1 Q2 – работа, совершённая за цикл, Q1 Q12 Q23 – общее количество теплоты, полученной газом за цикл, Q2 Q34 Q41 – общее количество теплоты, отданной газом за цикл. При этом количество теплоты, сообщённое газу при изохорном повышении температуры, равно i Q12 CV T1 T2 R T1 T2 . (2) 2 Количество теплоты, полученное газом при изотермическом его расширении, определяется по формуле 117 V (3) Q23 RT1 n 2 . V1 Количество теплоты, отданное газом в окружающую среду при изохорном понижении температуры, найдём из выражения i (4) Q34 R T1 T2 . 2 Количество теплоты, отданное газом в окружающую среду при изотермическом сжатии, вычисляем по формуле V Q41 RT2 n 2 . (5) V1 Сравнивая выражения (2) и (4), приходим к выводу о том, что Q12 Q34 . Отсюда следует, что V A Q12 Q23 Q34 Q41 Q23 Q41 R T1 T2 n 2 . V1 Это выражение для работы, совершённой за цикл, можно упростить, если учесть, что по условию задачи V V2 e , поэтому n 2 n e 1 . Тогда V1 V1 A R T1 T2 . (6) Из (2) и (3) следует, что общее количество теплоты, полученной газом за цикл, равно Q1 Q12 Q23 V i R T1 T2 RT1 n 2 . 2 V1 118 (7) V Так как n 2 1 , то V1 i i (8) Q1 R T1 T2 RT1 R T1 T2 T1 . 2 2 Подставляем (6) и (8) в (1) и получаем R T1 T2 T1 T2 . (9) i i T1 T2 T1 R T1 T2 T1 2 2 Вычисления по формуле (9) позволяют определить значение коэффициента полезного действия в рассматриваемом случае 400 300 100% 15, 4% 5 400 300 400 2 Ответ: 15,4 % 8. Одноатомный идеальный газ совершает цикл, состоящий из адиабаты, изобары и изохоры. Найти КПД цикла, если при адиабатическом процессе объём идеального газа увеличивается в 2 раза. Дано Решение i3 V2 2 V1 –? Анализ показывает, что система получает теплоту 119 Q12 при изохорическом росте давления и температуры, а отдаёт теплоту Q31 в ходе изобарического сжатия, сопровождающегося уменьшением температуры. При адиабатическом процессе теплообмен отсутствует ( Q23 0 ). Таким образом, количество теплоты, сообщённое за цикл газу от нагревателя Q1 Q12 , а количество теплоты, отданное газом холодильнику Q2 Q31 .Тогда коэффициент полезного действия следует находить по формуле Q Q 1 2 1 31 . Q1 Q12 (1) Получим выражение для количества теплоты Q12 , воспользовавшись при преобразованиях уравнением состояния идеального газа: Q12 CV T2 T1 p i i RT2 RT1 p1V1 2 1 . (2) 2 2 p1 Количество теплоты Q31 , сообщённое газу в ходе изобарического сжатия, равно i2 i2 Q31 Cp T R(T1 T3 ) p1 (V1 V2 ) . (3) 2 2 Количество теплоты Q31 0 , переданное газу в ходе изобарического сжатия, связано с количеством теплоты Q31 , отданным газом при этом процессе, очевидным соотношением Q31 Q31 , поэтому из (3) получаем Q31 V i2 i2 p1 V2 V1 p1V1 2 1 2 2 V1 Подставив (2) и (4) в (1), будем иметь 120 (4) V V i2 V1 p1 2 1 i 2 2 1 2 V1 1 V1 . 1 p2 p2 i V1 p1 1 i 1 2 p1 p1 Установим связь между отношением объёмов (5) V2 и отV1 p2 , используя уравнение Пуассона для p1 адиабатического процесса 2-3: ношением давлений p V p 2V p1V 2 2 . p1 V1 1 2 (6) С учётом (6) выражение (5) приобретает следующий вид V i 2 2 1 V1 , (7) 1 V i 2 1 V1 i2 где – показатель адиабатического процесса. i После вычислений по формуле (7), имеем 3 2 2 1 100% 23, 4% 1 53 3 2 1 Ответ: 23,4 % 9. Тепловую машину, работающую по циклу Карно с К.П.Д. равным η = 10%, используют при тех же тепловых 121 резервуарах как холодильную машину. Найти ее холодильный коэффициент. Дано Решение По определению холоη = 0,1 дильный коэффициент Q равен k хол 2 , kхол – ? A где Q2 – теплота, получаемая от охлаждаемого тела, а A – работа, совершаемая внешними телами над рабочим телом. В данном случае холодильная машина будет работать по обратному циклу Карно (см. рисунок). Полная работа, совершенная за цикл рабочим телом холодильной машины, равна A = – Q1х+ Q2х, где Q2х – количество тепла, полученного рабочим телом от холодильника, Q1х – количество тепла, переданного окружающей среде. Очевидно, что A A Q1x Q2x . Для цикла Карно получение теплоты происходит при изотермическом расширении рабочего тела (процесс 2-3), а передача теплоты осуществляется при изотермическом сжатии (процесс 4-1). При этом m V (1) Q2x Q23 RT2 n 3 , M V2 m V (2) Q1x Q41 RT1 n 4 . M V1 V V Установим связь между отношениями объёмов 3 и 4 , V2 V1 для чего запишем уравнения адиабат для процессов 1-2 и 3-4 122 T1V11 T2V21 ; (3) T4V41 T3V31 . (4) Учитываем, что T1=T4 и T2=T3, поэтому после деления левой и правой частей выражения (3) соответственно на левую и правую части выражения (4) получаем, что V4 V3 . V1 V2 Тогда m V RT2 n 3 Q T2 M V2 k хол 2 . (5) A m R n V3 T T T1 T2 1 2 M V2 Так как коэффициент полезного действия тепловой машины T T равен 1 2 , то будем иметь T1 T2 T1 (1 ) , T1 T2 T1 Подставляя в (5) выражения (6), получим T2 T (1 ) 1 k хол 1 . T1 T2 T1 Расчёт показывает, что 1 0,1 k хол 9. 0,1 (6) Ответ: 9 123 Задания для аудиторной и самостоятельной работы 5.1. Идеальный газ совершает цикл 1-2-3-1. Известно, что 3-1 – это изотермический процесс. Площадь S2 фигуры 1-2-3 в масштабе графика равна 10 Дж, а площадь S1 фигуры 1-3-В-А равна 15 Дж. Чему равна в цикле 1-2-3-1 разность количества теплоты, полученного от газом нагревателя, и количества теплоты, отданного холодильнику? Ответ: 10 Дж 5.2. Идеальный газ совершает цикл Карно. Газ получил от нагревателя 5 кДж теплоты и совершил работу 1 кДж. Чему равно отношение температур нагревателя и холодильника? Ответ: Тн/Tх.= 1,25 5.3. КПД цикла Карно равен 40%. Чему станет равным КПД, если на 20% уменьшить температуру нагревателя и на 20% увеличить температуру холодильника? Ответ: 10% 5.4. На диаграмме (p,V) изображён цикл Карно для идеального газа. Каково соотношение между работой адиабатического расширения газа A 23 и модулем работы А 41 , совершаемой им при адиабатическом сжатии? Ответ: A 23 = А 41 124 5.5. Идеальная тепловая машина работает по циклу Карно. Температура нагревателя Т1=600 К. Температура холодильника Т2=400 К. Определить работу А1 рабочего вещества при изотермическом расширении, если при изотермическом сжатии совершена работа A2=60 Дж? Ответ: 90 Дж 5.6. Азот совершает цикл Карно. Найти КПД цикла, если при адиабатическом расширении давление газа уменьшается в 2 раза. Считать, что молекула азота в рассматриваемом диапазоне температур не является жёсткой. Ответ: 14,3% 5.7. Многоатомный идеальный газ совершает цикл Карно, при этом в процессе адиабатического расширения объем газа увеличивается в 4 раза. Определите КПД цикла. Ответ: 36,7% 5.8. Газ совершает цикл Карно. Определить работу газа при изотермическом сжатии, если работа изотермического расширения А = 8 Дж. КПД цикла Карно η = 0,4. Ответ: – 4,8 Дж 5.9. Идеальный тепловой двигатель работает по циклу Карно. В качестве рабочего тела используется идеальный газ с двухатомными жёсткими молекулами. Первоначально газ занимает объём V1 = 2 л. После изотермического расширения его объём стал равным V2 = 5 л, а после адиабатического расширения объём достиг значения V3 = 8 л. Найти КПД цикла. Ответ: 17,1 % 5.10. Найти КПД цикла, состоящего из двух изобар и двух адиабат, если в пределах цикла давление изменяется в 5 раз. Рабочим телом является кислород. Ответ: 36,9% 125 5.11. Определить КПД теплового двигателя, работающего по циклу, состоящему из изохоры, адиабаты и изобары. Давление в пределах цикла изменяется в 2 раза. Рабочим телом является азот. Ответ: 10,3% 5.12. Идеальный газ совершает цикл, состоящий из изобары, адиабаты, изотермы. Изотермический процесс происходит при минимальной температуре цикла. Найти КПД цикла, если температура в пределах цикла меняется в 4 раза. Ответ: 53,8% 5.13. Тепловой двигатель работает по циклу, состоящему из изотермического, изобарического и адиабатического процессов. При изобарическом процессе рабочее тело – идеальный газ нагревается от температуры Т1 = 200 К до Т2 = 600 К. Во сколько раз коэффициент полезного действия данного теплового двигателя меньше КПД двигателя, работающего по циклу Карно, происходящего между максимальной и минимальной температурами данного цикла? Ответ: K 1,49 5.14. Первый тепловой двигатель работает по циклу 1-3-4-1, а второй – по циклу 1-2-3-1. В обоих двигателях рабочим телом является идеальный одноатомный газ. Найдите отношение КПД первого двигателя к КПД второго. Ответ: 126 1 23 2 21 5.15. Рассчитать КПД тепловой машины, использующей в качестве рабочего тела идеальный многоатомный газ и работающей по циклу, изображенному на рисунке. Ответ: 10,5% 5.16. Найти К.П.Д. цикла, состоящего из двух изохор и двух изотерм, если в пределах цикла объем изменяется в 2 раза, а абсолютная температура – в 3 раза. Рабочим веществом является идеальный многоатомный газ. Ответ: 17,2% 5.17. Цикл состоит из изотермы, изобары и изохоры (см. рисунок). Отношение V2/V3 = 4. Рабочим веществом является одноатомный идеальный газ. Определить КПД цикла. Ответ: 25,3% 5.18. Тепловую машину, работающую по циклу Карно с коэффициентом полезного действия η = 35%, начинают использовать при тех же условиях как холодильную машину. Найти количество теплоты, которое эта машина может перенести за один цикл от холодильника к нагревателю, если к ней за каждый цикл подводится механическая работа, равная 250 Дж. Ответ: 464,3 Дж 127 6. Энтропия. Второе начало термодинамики Сформулируем второе начало термодинамики в общем виде. Для этого рассмотрим произp вольный обратимый цикл, в ходе Q1i ,T1i которого система вступает в теплоi обмен с нагревателем и холодильником, обладающими конечной теплоQ 2i ,T2i ёмкостью. Разобьём этот обратимый цикл на элементарные циклы Карно так, как это показано на рисунке, и V рассмотрим один из них, имеющий номер i. Сравнивая общее выражение для КПД Q1i Q2i ( i ), с выражением для КПД i-го цикла Карно Q1i ( Ki T1i T2i ) получаем следующее равенство: T1i Q1i Q2i T1i T2i , Q1i T1i из которого следует, что: Q1i Q2i 0. T1i T2i Если вместо отдаваемого рабочим телом холодильнику количества теплоты Q2i ввести получаемое рабочим телом от холодильника количество теплоты Q2i Q2i , то предыдущее равенство приобретает вид Q1i Q2i 0. T1i T2i 128 Отношение количества теплоты, полученного системой от какого-либо тела, к температуре этого тела называют приведённым количеством теплоты. Вместо теплообмена рабочего тела отдельно с нагревателем и отдельно с холодильником будем на равных правах рассматривать положительные и отрицательные приведённые теплоты. Тогда для всего рассматриваемого обратимого цикла сумма приведённых количеств теплоты окажется равной Qi 0. пообр. Ti циклу В пределе для элементарных количеств теплоты δQ вместо суммы будем иметь интеграл приведённых теплот по обратимому циклу, который называют интегралом Клаузиуса Q обр T 0 . Из равенства нулю интеграла Клаузиуса следует, что интеграл приведённых теплот по некоторому незамкнутому об2 Q ратимому процессу не зависит от вида этого проT 1 обр цесса, и, следовательно, представляет собой приращение функции состояния, которую называют энтропией. Энтропия – это функция состояния системы, дифференциал которой равен отношению бесконечно малого количества теплоты, сообщённого системе в элементарном обратимом процессе, к абсолютной темпераQобр . туре системы, т.е. dS T 129 Конечное изменение энтропии при обратимых процессах равно: 2 Q S S2 S1 . T 1 обр При обратимом адиабатическом процессе δQобр = 0, следовательно S = const, поэтому такой процесс называют изоэнтропийным. Установлено, что при протекании необратимых процессов в системе изменение её энтропии больше интеграла приведённых теплот: 2 Q S2 S1 . T 1 необр Объединяя с выражением для обратимых процессов, получим: 2 Q S2 S1 . T 1 Если система адиабатно изолирована, все Q в этом выражении будут равны нулю, поэтому математическая формулировка второго начала термодинамики приобретает вид: S 0 . Итак, согласно второму началу термодинамики, энтропия изолированной системы может только возрастать (если в системе протекает необратимый процесс), либо оставаться постоянной (если в системе протекает обратимый процесс). Второе начало термодинамики указывает направление 130 протекания естественных процессов, которые всегда необратимы: естественные процессы в изолированных системах развиваются в направлении роста энтропии. Q может быть использована для выT 1 2 Формула S числения изменения энтропии только в случае обратимого процесса, поэтому для определения приращения энтропии в ходе необратимого процесса следует применять особые приёмы. Например, учитывая, что изменение энтропии, являющейся функцией состояния, не зависит от вида процесса перехода системы из состояния 1 в состояние 2, заменяют данный необратимый процесс 1 2 суммой двух или нескольких обратимых процессов 1 1 2 . Тогда изменение энтропии S12 можно определить по формуле 1 2 обр обр Q Q S12 S11 S1 2 . T 1 T 1 Другой приём связан с ведением понятия локального квазиравновесия. В этом случае систему, в которой протекает неравновесный процесс, разбивают на малые части так, чтобы можно было считать, что в пределах каждой из них реализуется квазиравновесное состояние, когда релаксационные процессы протекают значительно быстрее процесса, порождающего отклонения от равновесия. Для определения энтропии каждой элементарной части системы можно испольQ зовать формулу dS , а для вычисления энтропии всей T системы полагают, что она равна сумме энтропий её частей. 131 Для определения энтропии молей идеального газа по различным парам заданных параметров равновесного состояния используют следующие формулы: при заданных параметрах p,V S Cp nV CV n p const ; для равновесного состояния с параметрами p,T имеем S Cp nT R n p const ; в равновесном состоянии с параметрами n,T , где n – концентрация, энтропия определяется выражением S CV nT R n n const ; если же параметрами равновесного состояния идеального газа являются температура и объём, энтропию находят по формуле S R nV CV n T const . Вычислив значения энтропии начального S1 и конечного S2 равновесных состояний, приращение энтропии идеального газа определяют как S S2 S1 . 132 Примеры решения задач 1. Найти приращение энтропии 40 г гелия при его нагревании от 200 К до 540 К, если нагревание происходит: а) при постоянном объёме; б) при постоянном давлении. Дано Решение Приращение энтропии гелия m 40 103 кг при переходе из начального состояM 4 103 кг моль ния 1 в конечное состояние 2 определяем по формуле T1 200K 2 Q T2 540K S . (1) T 1 SV – ? Sp – ? Из первого начала термодинамики следует, что элементарное количество теплоты равно Q dU A , m i R dT – дифференциал внутренней энергии; где dU M2 A pdV – элементарная работа при равновесном процессе. Тогда m iR Q dT pdV . (2) M 2 Подставив (2) в (1), получим T2 V i mR dT 2 pdV . 2 M T T T1 V1 S (3) Рассмотрим случай (а), когда газ переходит из начального в конечное состояние в результате нагревания при постоянном объёме. 133 Так как V const и dV 0 , то формула (3) преобразуется к виду T2 i mR dT i mR 2 dT i mR n . (4) 2 M T 2 M T 2 M T1 T1 T1 Подставив численные значения в (4), будем иметь 3 8,31 40 103 540 SV n 124 (Дж/К). 2 4 103 200 Перейдём к случаю (б), при котором гелий переходит из начального в конечное состояние в результате нагревания при постоянном давлении. Считаем, что гелий является идеальным газом. Преобразуем второй интеграл в уравнении m RT (3), подставив выражение для давления p , полуM V ченное из уравнения состояния идеального газа. Тогда T2 T SV T2 V i mR dT 2 m RT dV . 2 M T M V T T1 V1 Sp После интегрирования будем иметь T m V m iR Sp n 2 R n 2 . M 2 T1 M V1 (5) Уравнение изобарного процесса можно записать в V V V T виде 1 2 или 2 2 , поэтому выражение (5) можно T1 T2 V1 T1 переписать в виде T i m Sp 1 R n 2 . (6) 2 M T1 134 Подставив в (6) численные значения, приведённые в условии задачи, получим 3 Sp 1 10 8,311 207 (Дж/К) 2 Ответ: SV 124 (Дж/К); Sp 207 (Дж/К) 2. Теплоёмкость некоторого тела изменяется по закону C aT3 , где a 3 104 Дж/К3. Определить приращение энтропии этого тела при изменении температуры от Т1 = 100 К до Т2 = 200 К. Дано Решение Подставив в формулу для опреa 3 104 Дж/К3 деления приращения энтропии T1 100K 2 Q S T2 200K T 1 S – ? выражение для элементарного количества теплоты Q C dT Q aT3dT , C aT3 получим aT3 dT a T2 T1 . S T 3 T1 3 T2 3 В результате расчёта будем иметь 3 104 (8 1) 106 S 700 (Дж/К) 3 Ответ: S 700 (Дж/К) 135 3. В результате некоторого обратимого процесса объём двух молей идеального газа увеличился в 2 раза, а давление уменьшилось в 3 раза Найти приращение энтропии, если показатель адиабаты этого газа 1,3 . Дано Решение Изменение энтропии при протекании обра 2моля тимого процесса определяют по формуле 1,3 Q , T T1 T2 S V2 2 V1 (1) где, в соответствии с первым началом термодинамики, Q dU A . Подставив в (1) выражения для дифференциала внутренней ΔS – ? i энергии dU R dT и элементарной ра2 боты при равновесном (обратимом) процессе A pdV , будем иметь p1 3 p2 T2 V i dT 2 dV . S R p 2 T V1 T T1 (2) Преобразуем подынтегральную функцию во втором интеграле, воспользовавшись уравнением состояния идеального газа: p R pV RT . (3) T V Тогда для приращения энтропии получим T V 2 2 i dT dV . S R R 2 T1 T V V1 После вычисления интегралов будем иметь 136 i T V S R n 2 n 2 . T1 V1 2 Отношение температур T2 T1 (4) найдём из уравнения Кла- пейрона p1V1 p2V2 T pV 2 2 2. T1 T2 T1 p1V1 Тогда i p V V (5) S R n 2 2 n 2 . p1V1 V1 2 Учитываем, что i2 2 i 1 . 1 i i 2 1 Это позволяет записать (5) в виде 1 p V V (6) S R n 2 2 n 2 . p1V1 V1 1 Подставив в формулу (6) численные значения, будем иметь 1 2 Дж S 2 8,31 n n 2 10,9 3 K 1,3 1 Ответ: – 10,9 Дж/K 4. Атомарный водород массой 20 г расширился от объёма V1 = 1 л до объёма V2 = 3 л адиабатически, а затем его изобарически сжали до первоначального объёма. Найти суммарное приращение энтропии, считая все процессы обратимыми. 137 Дано m 20·10–3 кг M 10–3 кг / моль i3 V1 10–3 м3 V2 3·10–3 м3 S – ? Решение Обозначим процесс адиабатического расширения как процесс 1-2, а процесс изобарического сжатия – как процесс 2-3. Тогда суммарное изменение энтропии будет равно S S12 S23 . Приращение энтропии в ходе обратимого адиабатического процесса 1-2 найдём по формуле Q . T 1 2 S12 Так как для адиабатического процесса Q 0 , получаем, что (1) S12 0 . Приращение энтропии при изобарическом процессе 2-3 определяем из выражения Q dU A , T T 2 T 2 2 3 3 S23 3 (2) где учтено, что Q dU A (первое начало термодинамики). i Так как dU R dT , а A pdV , из (2) будем иметь 2 3 S23 3 i dT p dV . R 2 T 2 T 2 Из уравнения состояния идеального газа получаем, что p R . pV RT T V 138 (3) Тогда (3) можно преобразовать к виду T V 3 1 i dT dV . S23 R R 2 T V T2 V2 После интегрирования этого выражения получим S23 T V i R n 3 R n 1 . 2 T2 V2 (4) V Из уравнения изобарического процесса const слеT дует, что T3 V1 , T2 V2 поэтому выражение (4) приобретает вид S23 V i2 R n 1 . 2 V2 (5) Так как S12 0 , то S S23 V i2 R n 1 . 2 V2 (6) После подстановки численных значений в (6), получаем S 103 3 2 20 103 Дж 8,31 n 457 3 3 2 10 К 3 10 Ответ: – 457 Дж/K 5. Гелий массой m = 40 г расширяется так, что его давление в ходе обратимого процесса изменяется по закону p V . Найти приращение энтропии при увеличении объёма газа от V1 2 л до V2 6 л. 139 Дано m 40·10 –3 кг M 4·10 –3 кг / моль i 3 p V Решение Изменение энтропии будем искать по формуле Q dU A , T T 1 T 1 1 2 2 S 2 (3) где учтено, что Q dU A (первое начало термодинамики). Так как V2 6 103 м3 i dU R dT , а A pdV , то для S – ? 2 изменения энтропии будем иметь V1 2 103 м3 2 S 2 i dT p dV . R 2 T 1 T 1 (2) Преобразуем подынтегральную функцию во втором интеграле, для чего запишем уравнение состояния идеального газа с учётом того, что p V : RT pV RT V2 . Откуда для температуры имеем (3) V 2 T . R Тогда 2 pdV 2 V RdV dV 1 T V V2 R V V . 1 1 2 V V (4) Принимая во внимание (4), выражение (2) можем записать в виде 2 2 i dT dV . S R R 2 T V 1 1 После интегрирования имеем T V i S R n 2 R n 2 . 2 T1 V1 140 (4) (5) Выразим отношение температур через отношение объёмов, воспользовавшись уравнением (3) RT2 V22 T2 V22 (6) 2 . RT1 V12 T1 V1 Подставив (6) в (5), получим V V i S R n 2 R n 2 . V1 2 V1 2 Преобразуя это выражение, будем иметь V S R i 1 n 2 . V1 Проведём вычисления по этой формуле и получим окончательный результат: 40 103 Дж S 8,31 3 1 n 3 365,2 3 4 10 K Ответ: 365,2 Дж/K 6. Теплоизолированный сосуд объёмом 2 м3 разделён перегородкой на 2 одинаковые части. В одной половине находится 1 3 моль гелия при температуре T1 200 K , в другой – 2 2 моль аргона при температуре T2 400 K . Найти изменение энтропии системы после удаления перегородки и достижения равновесного состояния. 141 Дано Решение Так как сосуд теплоизолирован, тепV 2 м3 лообмен рассматриваемой системы с окруV1 V2 1 м3 жающей средой не происходит. Газ расши1 3 моль ряется без противодействия, поэтому А = 0. T1 200 K В соответствии с первым началом термоди2 2 моль намики внутренняя энергия системы, состоящей из двух газов не изменяется. В T2 400 K связи с этим количество теплоты, отданное S – ? газом, внутренняя энергия которого уменьшается, будет равно количеству теплоты, полученному газом, внутренняя энергия которого увеличивается: n U Ui 0 . (1) i 1 Найдём температуру равновесного состояния, воспользовавшись уравнением (1): 3 3 3 T T 1RT1 2RT2 1 2 RT0 T0 1 1 2 2 . 2 2 2 1 2 После вычисления будем иметь 3 200 2 400 T0 280 K . 3 2 При расчёте энтропии смеси идеальных газов пользуются теоремой Гиббса, согласно которой энтропия смеси газов равна сумме энтропий каждого газа в отдельности, вычисляемых при условии, что каждый газ при данной температуре один занимает весь объём. Тогда для изменения энтропии смеси газов имеем S S1 S2 . (2) 142 Так как в данной задаче параметрами равновесного состояния идеального газа являются температура и объём, энтропию находим по формуле S So R nV CV n T . Тогда изменение энтропии гелия, который обозначим как газ 1, будет равно T i T 2V 3 S1 1 R n o 1R n 1 1R n 0 1R n 2 , 2 T1 V1 2 T1 где учтено, что для одноатомных инертных газов, каковыми являются гелий и аргон, i = 3. Аналогично найдём изменение энтропии аргона, который обозначим как газ 2: S2 T 3 2R n 0 2R n 2 . 2 T2 В соответствии с (2) для нахождения изменения энтропии системы после удаления перегородки складываем S1 и S2 , получая 3 1 2 3 S R n T0 1 n T1 2 n T2 2 2 1 2 n 2 . Тогда 3 3 2 3 S 8,31 n 280 3 n 200 2 n 300 2 2 Дж 3 2 n 2 39,7 K Ответ: 39,7 Дж/K 143 Задания для аудиторной и самостоятельной работы 6.1. Термодинамическая система совершает произвольный термодинамический процесс, переходя из состояния 1 в состояние 2. Какие из величин, характеризующих этот процесс (внутренняя энергия U, энтропия S, работа A, теплота Q) зависят только от параметров начального (1) и конечного (2) состояний? Ответ: U и S 6.2. Газ расширяется в ходе двух обратимых изотермических процессов от объёма V1 до объёма V2 при: 1) T = T1; 2) T = T2 > T1. Сравнить количества теплоты, полученные газом в этих двух процессах, и приращения энтропии: а) ΔS1 > ΔS2, Q1 > Q2; б) ΔS1 < ΔS2, Q1 < Q2; в) ΔS1 = ΔS2, Q1 < Q2; г) ΔS1 = ΔS2, Q1 > Q2; д) ΔS1 = ΔS2, Q1 = Q2; е) ΔS1 > ΔS2, Q1 < Q2. Ответ: в 6.3. Идеальная тепловая машина работает по циклу Карно. Как изменится энтропия рабочего p тела в процессе изотермического расширения и в процессе адиабатического расширения? Ответ обосновать. Ответ: при изотермическом расширении энтропия возрастёт; при адиабатическом расширении энтропия не изменится. 6.4. Тепловая машина работает по обратимому циклу, состоящему из двух изобар и двух изохор. Как изменится энтропия рабочего тела за один цикл работы тепловой машины? Ответ обосновать. Ответ: энтропия не изменится. 144 6.5. На рисунке представлен прямой цикл теплового двигателя в координатах T S , где T термодинамическая температура, S энтропия. Укажите участки, на которых теплота передаётся рабочему телу двигателя от нагревателя, и участки, где теплота отдаётся холодильнику. Ответ: 2-3, 4-5, – теплота поступает; 6-7, 8-9 10-1 – отдаётся 6.6. На рисунке изображён цикл Карно в координатах термодинамическая температура – энтропия. На каком этапе происходит адиабатическое сжатие рабочего тела? Ответ обосновать. Ответ: на этапе 4 – 1 6.7. Во сколько раз следует увеличить объём азота массой 56 г, чтобы в изобарном процессе его энтропия увеличилась на S 29,1 Дж/К? Азот считать идеальным газом. Ответ: 1,65 6.8. При нагревании двух молей двухатомного идеального газа, его термодинамическая температура увеличилась в 2 раза. Определите изменение энтропии, если нагревание происходило изохорно. Ответ: 28,8 Дж/К 6.9. При изохорическом нагреве одного моля двухатомного идеального газа его температура изменилась от Т1 = 300К до Т2 = 600К. Найдите изменение энтропии газа. Ответ: 14,4 Дж/К 6.10. При изобарном нагреве трех молей идеального трёхатомного газа его температура изменилась от T1 =300К, до Т2 = 900К. Найдите изменение энтропии газа. Ответ: 109,55 Дж/К 145 6.11. Два моля идеального одноатомного газа сначала изобарно нагрели, так что объём газа увеличился в 2 раза, а затем изохорно охладили так что давление газа уменьшилось в 2 раза. Определите приращение энтропии в результате данных процессов. Ответ: ΔS = 11,52 Дж/К 6.12. При адиабатическом расширении азота массой m = 28 г его объём увеличился в 2 раза. Затем газ изобарно сжали до начального объёма. Определите изменение энтропии в ходе указанных процессов. Ответ: – 20,16 Дж/К 6.13. Кислород массой m = 2кг изотермически расширился, увеличив свой объём в пять раз. Найдите изменение энтропии. Ответ: 835,9 Дж/К 6.14. Кислород массой m = 1 кг имел объём V1 = 0,2 л при давлении р1 = 50 кПа. Затем газ в ходе некоторого процесса расширился до объёма V2 = 0,5 л так, что давление стало равным р2 = 20 кПа. Считая газ идеальным, определить приращение энтропии и изменение внутренней энергии газа. Ответ: 237,9 Дж/K; 0 Дж 6.15. Найти изменение энтропии при переходе азота массой 7 г от объёма V1 = 10 л при температуре T1 = 80°С к объёму V2 = 40 л при температуре T2 = 300°С. Ответ: 5,39 Дж/К 6.16. Три моля идеального газа с показателем адиабаты = 1,4 совершает политропический процесс, в результате которого абсолютная температура газа увеличивается в = 5 раз. Показатель политропы n = 1,7. 146 Найти приращение энтропии газа в этом процессе. Ответ: 43 Дж/К 6.17. Вычислить изменение энтропии трёх молей многоатомного идеального газа при его расширении в ходе политропического процесса от объёма V1 = 1 л до объёма V2 = 4 л. Показатель политропического процесса n = 1,2. Ответ: 13,6 Дж/К 6.18. Теплоизолированный сосуд, разделённый на две неравные части (V1 = 2 л, V2 = 3 л), наполнен идеальным газом. В первой части газ находится под давлением p1 = 105 Па при температуре t1 = 27°С, во второй части – под давлением p2 = 5·105 Па и той же температуре. Найти изменение энтропии всей системы после удаления перегородки и установления равновесного состояния. Ответ: 1,11 Дж/К 6.19. Идеальный одноатомный газ совершает процесс, описывающийся уравнением p po V , где po 105 Па. При V 5 103 м3 его энтропия достигает максимального значения. Найти значение постоянной . Ответ: 1,25·107 Па/м3 6.20. Пять молей идеального четырехатомного газа, нагрели от температуры Т1 = 200 К до Т2 = 500 К. Найти изменение энтропии, если известно, что при завершении процесса нагрева конечное давление стало равно начальному. Ответ: 152,3 Дж/К 6.21. Энтропия идеального газа изменяется по закону 2 T S So . Найти теплоту (в кДж), полученную газом при To увеличении температуры от To до T1 , если So = 100 Дж/К; 147 To = 600 К; T1 2To . Ответ: 280 кДж 6.22. Тепловая машина совершает циклический процесс 1–2–3–1, изображённый на графике в координатах T–S. Найти коэффициент полезного действия тепловой машины. T1 = 600 К; T2= 1200 K; S1 = 2 Дж/К; S2 = 4 Дж/К; S3 = 6 Дж/К. Ответ: 0,33 6.23. Тепловая машина совершает циклический процесс 1–4–3–2–1, изображённый на графике в координатах S – T. Найти коэффициент полезного действия тепловой машины. T1 = 550 К; T2 = 600 К; Т3 = 650 К. S1 = 1 Дж/К; S2 = 5 Дж/К. Ответ: 0,12 6.24. Изменение энтропии на участке между двумя адиабатами в цикле Карно ΔS = 4,19 кДж/К. Разность температур между двумя изотермами ΔT= 100 К. Какое количество полученной теплоты превращается в работу в этом цикле? Ответ: 419 кДж 6.25. Найти изменение энтропии при превращении куска льда массой 2 кг, находящегося при температуре – 30ºС, в воду с температурой 60ºС. Удельная теплота плавления льда λ = 3,35·105 Дж/кг; удельная теплоёмкость льда сл = 2,1·103 Дж/кг·К; удельная теплоёмкость воды св = 4,2·103 Дж/кг·К. Ответ: 4612 Дж/К 148 6.26. Найти изменение энтропии при превращении в пар 10 г льда, взятого при температуре t1 20o C . Удельная теплоёмкость льда сл 2,1103 кость воды св 4,2 103 льда 3,35 105 r 2, 26 106 Дж ; удельная теплоёмкг К Дж ; удельная теплота плавления кг К Дж ; удельная теплота парообразования кг Дж . кг Ответ: 87,57 Дж/K 149 7. Реальные газы. Уравнение Ван-дер-Ваальса При высоких давлениях и низких температурах экспериментально наблюдаемые свойства газов существенно отличаются от свойств, предсказываемых уравнением Менделеева-Клапейрона. Рассматриваемые в этих условиях газы в отличие от идеального называют реальными. Предложено более ста пятидесяти разновидностей приближённых уравнений состояния реальных газов (уравнения Дитеричи, Бертло, Клаузиуса, Редлиха-Квонга, Пенга-Робинсона, Камерлинг-Оннеса и др.), наиболее простым из которых и, в то же время, дающим хорошее согласие с экспериментом при умеренных плотностях, а качественно достаточно точно описывающим поведение реальных газов при высоких плотностях и при переходе из газообразного в жидкое состояние, является уравнение Ван-дер-Ваальса. В модели Ван-дер-Ваальса молекулы представляются в виде твёрдых шариков радиусом ro , которые при столкновении не могут сблизиться на расстояния меньшие, чем d 2ro . В расчёте на одну молекулу при столкновении двух молекул (тройные, четверные и т.д. столкновения не рассматриваются ввиду их малой вероятности) недоступным 3 2 ro 4 r 3 . Тадля движения становится объём, равный o 2 ким образом, если объём одного моля газа равен Vм, то молекула может двигаться только в пределах объёма Vм – b, 4 где b 4 N A ro3 . 3 Если расстояние между молекулами превышает ro , между ними начинают действовать силы притяжения, что 150 приводит к появлению дополнительного давления на газ, называемого внутренним давлением. Как показал Ван-дерВаальс, внутреннее давление обратно пропорционально a квадрату молярного объёма, т.е. pвнутр 2 , где а – постоVм янная Ван-дер-Ваальса, характеризующая силы молекулярного притяжения. Если учесть в уравнении Менделеева-Клапейрона, записанном для одного моля в виде p Vм R T , поправки на собственный объём молекул и внутреннее давление, получим уравнение Ван-дер-Ваальса для одного моля a p 2 Vм b RT . Vм В случае, когда в объёме V содержится ν молей газа и, V следовательно, объём моля Vм , уравнение Ван-дер-Ва альса приобретёт вид p a V V b RT . 2 2 Значения постоянных Ван-дер-Ваальса (a и b), определяемые опытным путем, для некоторых газов приведены в разделе Приложения. Уравнению Ван-дер-Ваальса для одного моля можно придать следующую форму pVм3 RT pb Vм2 aVм ab 0 . Это уравнение третьей степени относительно Vм, следовательно, оно имеет в общем случае три корня, и только при некотором значении температуры Т = Ткр, называемом критическим, оно имеет один корень. При температурах выше критического значения два корня представляют собой 151 комплексно-сопряжённые числа, а третий является действительным числом. Так как физический смысл имеют лишь вещественные положительные корни, то реально каждому значению давления при Т > Ткр соответствует одно значение объёма. Если Т < Ткр, то все три корня являются действительными. Рассмотрим графики зависимости р от Vм при постоянных температурах Т, называемые изотермами Ван-дерВаальса. При критической температуре на изотерме имеется точка перегиба К, в которой касательная параллельна оси абсцисс. Эту точку называют критической, и соответствующие ей объём Vкр и давление pкр также называют критическими. Критические параметры можно выразить через постоянные Ван дер Ваальса и универсальную газовую постоянную R: a 8a Vкр 3b; pкр ; Tкр . 2 27 b R 27 b 152 Экспериментальные значения критических параметров для некоторых газов приведены в разделе Приложения. При температурах меньших критической (Т < Ткр) изотермы Ван-дер-Ваальса имеют волнообразный участок: с ростом объёма от значения b кривая сначала монотонно опускается вниз, затем поднимается вверх и снова монотонно опускается, стремясь к нулю. Как показывает сравнение экспериментальной изотермы Эндрюса (изображена сплошной линией) с теоретической изотермой Ван-дер-Ваальса (изображена пунктиром), в действительности вместо волнообразного участка имеет место горизонтальная прямая BC, называемая линией конденсации. В состояниях, соответствующих этой линии, часть вещества находится в жидком, а другая часть – в газообразном (парообразном) состояниях, т.е. имеет место двухфазное состояние вещества, при котором жидкая и газообразная фазы находятся в равновесии. Участок изотермы Эндрюса АB соответствует нахождению вещества только в жидком состоянии, а участок CD соответствует газообразному (парообразному) состоянию. Вещество в газообразном состоянии при температуре ниже критической называют паром, а пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. В критической точке исчезает разница между жидкостью и газом, вещество становится физически однородным. При температурах бóльших критической (Т > Ткр) теоретическая изотерма реального газа отличается от изотермы идеального газа, представляющей собой гиперболу, только 153 некоторым искажением её формы, оставаясь монотонно спадающей кривой, асимптотически стремящейся к нулю. При этих температурах вещество может находиться только в газообразном состоянии и ни при каком давлении не может быть превращено в жидкость. При одной и той же температуре изотермы Ван-дерВаальса для различных газов не совпадают друг с другом. Запишем уравнение изотермы для одного моля вещества так, чтобы оно не зависело от природы газов и было, как и уравнение Менделеева-Клапейрона в рамках его применимости, универсальным. Введём для этого приведённые паV p раметры: объём м , давление и температуру Vмкр pкр T , что позволяет получить приведённое уравнение Tкр Ван-дер-Ваальса 3 2 3 1 8 . 154 Для одного моля различных веществ графики зависимости при одинаковых значениях τ совпадают. Из этого уравнения следует, что если вещества обладают двумя одинаковыми приведёнными параметрами, то и третий параметр тоже одинаков для этих веществ (закон соответственных состояний). Получим выражение для внутренней энергии реального газа. Отметим, что внутренняя энергия идеального газа определяется только кинетической энергией теплового движения его молекул, а внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул, равной для моля газа Eк СV T , и потенциальной энергии, обусловленной силами притяжения, действующими между всеми молекулами E п , т.е. U Eк Eп . Будем считать, что при T = const и, следовательно, при Ек = const, работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению потенциальной энергии взаимодействия A dEп . Учитывая, что A pвнутрdVм , где pвнутр a – внутреннее давление в реальном газе, а Vм2 Vм – объём моля, будем иметь dEп (a / V2м )dVм . Проинтегрировав это выражение при условии, что при Vм Uп 0 , получим 155 a . Vm Учитывая выражения для Ек и Еп, получим, что внутренняя энергия моля реального газа равна Um CVT a / Vм , Eп а для ν молей 2a . V Таким образом, в модели Ван-дер-Ваальса внутренняя энергия является функцией не только температуры, но и объёма. Молярная теплоёмкость при постоянном объёме для идеальных и реальных газов одинакова, в то время как молярная теплоёмкость при постоянном давлении реальных газов, в отличии от идеальных, зависит от температуры и объёма газа: R , Cp CV 2 2a b 1 1 RTV V т.е., строго говоря, уравнение Майера для реальных газов не применимо, но им можно пользоваться в некоторых слуT чаях, например, если кр 1 . T Чтобы продемонстрировать различия в поведении идеального и реального газов, рассмотрим адиабатический процесс (Q 0) их расширения в вакуум, в ходе которого не совершается внешняя работа (A 0) . Из первого начала термодинамики (Q dU A) следует, что изменение U C V T 156 внутренней энергии в этом случае равно нулю и для идеального, и для реального газов. Однако, если для идеального газа условие U 0 означает равенство температур начального Т1 и конечного Т2 его состояний, то для реального газа из этого условия следует, что он охлаждается. Действительно, так как U 0 , то для моля реального газа имеем a a a 1 1 CVT1 CVT2 T1 T2 . Vм1 Vм2 CV Vм1 Vм2 Так как V2м > V1м, то Т1 > Т2, т.е. реальный газ при адиабатическом расширении в вакуум охлаждается. В ещё большей степени различия между идеальным и реальным газом проявляются в ходе процесса Джоуля-Томсона, суть которого заключается в следующем. Газ заставляют вытекать из одного сосуда, где поддерживается давление р1, в другой, где давление равно р2, через элемент, при прохождении которого на газ действует сила, препятствующая его движению. Такими элементами могут быть, например, длинная узкая трубка, пористая перегородка. Соответствующий процесс называют дросселированием. Если дросселирование происходит при отсутствии теплообмена, то его называют адиабатическим дросселированием или процессом Джоуля-Томсона. Для реализации этого процесса был поставлен следующий эксперимент (опыт Джоуля-Томсона). В теплоизолированную цилиндрическую трубку, разделённую на две части пористой перегородкой, с каждой её стороны помещались поршни, которые могли перемещаться в трубке без трения. 157 Схема опыта Джоуля-Томсона Первый поршень находился под давлением р1, а второй – под давлением р2 ( p2 p1 ), которые в ходе опыта поддерживались постоянными. Предположим для определённости, что первоначально газ находился слева от перегородки при давлении р1, температуре Т1, занимая объём V1. Справа от перегородки газа не было, и второй поршень примыкал к ней. Первый поршень медленно перемещали до тех пор, пока он не прижимался к перегородке. При этом газ продавливался сквозь неё, и второй поршень, находившийся под давлением р2, двигался, пока газ не занимал объём V2 при температуре Т2, т.е. происходило адиабатическое дросселирование. В ходе этого процесса наблюдалось изменении температуры реального газа (эффект Джоуля-Томсона). Если газ при расширении в ходе адиабатического дросселирования охлаждается T 0 , то эффект ДжоуляТомсона называют положительным, а если же газ при рас- 158 ширении нагревается T 0 , то эффект называют отрицательным. В зависимости от условий дросселирования для одного и того же газа эффект Джоуля-Томсона может быть как положительным, так и отрицательным. Температура, при которой происходит изменение знака эффекта Джоуля – Томсона, называется температурой инверсии. В опыте Джоуля-Томсона для того, чтобы вытеснить газ из объёма V1 и заставить пройти через пористую перегородку, внешние силы совершают работу A1 p1V1 . При выходе через пористую перегородку газ совершает работу A2 p2V2 . При отсутствии теплообмена из первого начала термодинамики имеем U2 U1 p1V1 p2V2 U1 p1V1 U2 p2V2 . Видим, что в конце процесса Джоуля-Томсона величина U p V принимает такое же значение, как и в его начале. Величина H U p V , называется энтальпией и является функцией состояния. Таким образом, адиабатическое дросселирование – это изоэнтальпийный процесс. 159 Примеры решения задач 1. Два моля азота при температуре t 100 C занимают в первом случае объём 3 л, а во втором случае объём 0,1 л. Во сколько раз в этих случаях давление, оказываемое газом на стенки сосуда, отличается от давления, которое имел бы азот, если бы сохранил при рассматриваемых условиях свойства идеального газа. Дано Решение Если азот рассматривается как 2 моль реальный газ, его давление можно V1 3л найти из уравнения Ван-дер-Ваальса: V2 0,1л 2a p Па м6 V b RT , a 0,135 V2 2 моль после преобразования которого, полум3 b 3,86 105 чим моль RT 2a p2 p1 . p 2 ? ? V b V pид2 pид1 Вычислим давление реального газа в первом и втором случаях 2 8,31 173 3 10 2 3,86 105 ; 4 0,135 9, 24 105 (Па) 6 9 10 2 8,31 173 p 2 4 10 2 3,86 105 . 4 0,135 5 721,08 10 (Па) 108 p1 3 Если считать, что азот в заданных условиях описывается моделью идеального газа, то для вычисления давления 160 необходимо воспользоваться уравнением Менделеева-Клапейрона pид V RT , RT . V Рассчитываем pид для первого и второго случаев: из которого следует, что pид 2 8,31173 9,58 105 (Па) ; 3 3 10 2 8,31173 pид 2 287,53 105 (Па) . 4 10 pид1 Тогда p1 9, 24 105 0,96 ; pид1 9,58 105 p2 721,08 105 2,51 . pид2 287,53 105 Таким образом, в зависимости от среднего расстояния между молекулами давление реального газа может быть как больше, так и меньше давления идеального газа. p p Ответ: 1 0,96 ; 2 2,51 pид2 pид1 2. Три моля азота, рассматриваемого как реальный газ, расширяются адиабатически в вакуум так, что объём газа увеличивается от V1 = 2 л до V2 = 25 л. Определить приращение температуры газа. Колебательные степени свободы молекул азота не учитывать. 161 Дано Решение При расширении в пустоту работа i5 внешних сил A 0 . При адиабатиче 3 моль ском процессе Q 0 . Тогда из первого V1 2 л начала термодинамики, записанного в V2 25 л виде U Q A , следует, что внут6 Па м ренняя энергия газа в данном процессе a 0,135 2 не изменяется. моль Внутренняя энергия реального ΔT – ? газа определяется из выражения 2a , U C V T V тогда приращение внутренней энергии будет равно 2a 2a U CV T2 T1 , V1 V2 а так как U 0 , то 1 1 CV T2 T1 2a , V2 V1 i где CV R . 2 Из выражения (1) следует, что 1 1 1 1 2a 2 2a V2 V1 V2 V1 . T T2 T1 CV iR (1) (2) 1 1 2 32 0,135 3 2 103 25 10 T 26,9 K 5 8,31 Ответ: – 26,9 К 162 3. Два моля кислорода, занимавшие сначала объём V1 = 1 л при температуре t1 = –100ºС, расширились изотермически до объёма V2 = 20 л. Найти количество теплоты, полученное газом. Дано Решение Количество теплоты, полученной 2 моль газом, найдём из первого начала терV1 1 л модинамики V2 20 л (1) Q U A , t1 –100º С для чего определим изменение внутПа м6 ренней энергии газа U и работу, соa 0,136 моль2 вершённую газом при его расширении. 3 м Приращение внутренней энергии реb 3, 2 105 моль ального газа вычисляют по формуле: 2a 2a U C T T . (2) Q–? V 2 1 V1 V2 Так как в данном случае T const , то из (2) будем иметь 1 1 U 2a . V1 V2 Вычисляя, получим 1 1 U 22 0,136 3 516,8 (Дж). 3 20 10 10 Обратим внимание на то, что при изотермическом процессе с реальным газом U 0 , тогда как в модели идеального газа при изотермическом процессе U 0 . 163 Для определения совершённой газом работы воспользуемся формулой V2 A pdV , V1 в которую подставим выражение для давления, полученное из уравнения Ван-дер-Ваальса: 2a p V b RT V2 Тогда имеем p RT 2a 2 . V b V 2 RT 2a A dV 2 dV . V b V V1 V1 V2 V После интегрирования получим V b 2 1 1 A RT n 2 a . V1 b V1 V2 20 103 2 3, 2 105 2 1 1 A 2 8,31173 n 2 0,136 3 3 5 20 103 10 10 2 3, 2 10 8277,7 (Дж) Из выражения (1) следует, что количество теплоты, полученной газом, будет равно Q 516,8 8277,7 8794,5 Дж Ответ: 8794,5 Дж 4. При какой температуре 1 моль аргона будет занимать объём V = 1 м3, если давление равно p = 30·105 Па? Критические параметры для аргона pкр = 48,6·105 Па, Tкр = 150,8 K. 164 Дано Решение Так как известно значение Tкр , то 103 моль V 1 м3 p 30·105 Па p кр 48,6·105 Па Tкр 150,8K температуру аргона можно определить по формуле T (1) T Tкр , Tкр для чего необходимо вычислить параметр τ. Для этой цели воспользуемся приведенной формой уравнения состояния Ван-дер-Ваальса, которое для одного моля газа имеет вид: T–? 3 2 3 1 8 V V p где , м , Vм – объём моля вещества. p кр Vм кр (2) Очевидно, что параметр π равен 30 105 0,617 . 48,6 105 Для определения параметра ω будем иметь ввиду, что Vмкр 3b . Находим константу Ван-дер-Ваальса b, учитывая, что 8a ; Tкр RT 8a 27b2 8b 27bR b кр . a pкр 27bR a R 8pкр pкр 2 27b Вычисляя, получим Tкр 165 b Так как 3 8,31150,8 5 м 3, 22 10 . 5 8 48,6 10 моль м3 Vмкр 3 3, 22 105 9,66 105 , моль а 3 V 1 103 3 м Vм 3 10 10,35 . , то 10 9,66 105 моль Из уравнения (2) следует, что 3 2 3 1 . 8 Подставляя в эту формулу значения π и ω, будем иметь 3 0,617 107,12 3 10,35 1 2, 42 . 8 Воспользовавшись формулой (1), окончательно полу- чим T 2,42 150,8 364,9 K Ответ: 364,9 К 5. Найти эффективный диаметр молекулы азота, если критические параметры для него равны pкр = 33,9·105 Па, Tкр = 126,1 K. Дано Решение Для решения задачи найдём pкр 33,9·105 Па связь критических параметров азота с Tкр 126,1 K поправкой на собственный объём моd–? лекул в уравнении Ван-дер-Ваальса, 166 которая связана с диаметром молекулы выражением 4 d3 2 b 4 N A ro3 4N A N Ad3 , 3 6 3 4 3 d3 где ro – объём одной молекулы, ro – её радиус, а 3 6 d – диаметр. Тогда диаметр молекулы можно выразить через поправку b следующим образом d3 3b , 2 NA (1) где N A – число Авогадро. Так как критическая температура Tкр ческое давление pкр Tкр pкр 8a , а крити27bR a , то 27b 2 RTкр 8a 27b2 8b b . 27bR a R 8pкр (2) Подставив в (1) выражение (2), получим формулу для вычисления диаметра молекулы азота d3 3RTкр 16N A pкр . После подстановки численных значений будем иметь d3 3 8,31126,1 3,14 1010 м 23 5 16 3,14 6,02 10 33,9 10 Ответ: d = 3,14·10–10 м 167 6. Вычислить приращение температуры моля водорода в опыте Джоуля-Томсона, если до прохождения через пористую перегородку он имел параметры p1 = 106 Па, V1 103 м3 , а после прохождения через неё они приняли значения p2 = 5 105 Па, V2 5 103 м3 . Считать, что в указанных условиях уравнение Майера справедливо. Константы Ван-дер-Ваальса принять равными 3 Па м6 5 м , b 2,7 10 . a 0,024 моль2 моль Дано Решение Процесс Джоуля-Томсона явля 1 моль ется изоэнтальпийным процессом p1 106 Па H pV U const , поэтому p 2 5 105 Па (1) p1V1 U1 p2V2 U2 . i5 V1 103 м 3 Значение произведений p1V1 и p 2V2 V2 5 103 м 3 найдём с помощью уравнений Вандер-Ваальса, записанных для одного моля: Па м 6 моль 2 м3 b 2,7 105 моль ΔT – ? a 0,024 a p1 2 V1 b RT1, V1 a p2 2 V2 b RT2 , V2 из которых получим, что 168 p1V1 RT1 a ab p1b, V1 V12 a ab p 2 V2 RT2 p 2 b. V2 V22 (2) Так как внутренняя энергия моля реального газа в начальном и конечном состояниях равна a U1 CV T1 , V1 (3) a U 2 CV T2 , V2 то 2a a b p1V1 U1 R CV T1 p1b, V1 V12 (4) 2a a b p 2V2 U 2 R CV T2 p 2b. V2 V22 Подставив (4) в (1), будем иметь 2 2 1 2a V1 V2 ab V2 V1 T p p b . (5) 1 2 C p V1 V2 V12V22 По условию задачи молярную теплоёмкость при постоянном давлении для водорода можно определить по форi2 7 R R. муле Cp 2 2 Для вычисления приращения температуры численные значения физических величин подставим в выражение (5) и получим 169 2 0,024 103 5 103 103 5 103 5 6 6 2 0,024 2,7 10 25 10 10 T 0,83 (К) 7 8,31 106 25 106 106 5 105 2,7 105 Ответ: – 0,83 К 7. В опыте Джоуля-Томсона один моль водорода, первоначально занимавший объём V1 103 м3 при давлении p1 = 106 Па, перетекает сквозь пористую перегородку, занимая объём V2 102 м3 при давлении p2 = 105 Па. Вычислить приращение температуры газа. Считать, что в указанных условиях уравнение Майера справедливо. Константы Ван-дер-Ваальса принять равными 3 Па м6 5 м , . a 0,024 b 2,7 10 моль2 моль Дано Решение 6 При решении задачи учтём, что p1 10 Па в начальном и конечном состояниях p2 105 Па рассматриваемого процесса энтальV1 103 м3 пия принимает одно и то же значение 1 3 V2 10 м p1V1 U1 p2V2 U2 . (1) a 0,024 Па м6 моль2 b 2,7 105 м3 моль ΔT – ? Из анализа исходных данных следует, что при описании начального состояния необходимо учесть и 170 внутреннее давление pвнутр1 a , и поправку на суммарный V12 собственный объём молекул b, поэтому начальное состояние моля водорода должно описываться уравнением Вандер-Ваальса a p1 2 V1 b RT1. V1 В то же время расчёты показывают, что p2 V2 (2) pвнутр2 , а b . Это даёт возможность воспользоваться для описа- ния конечного состояния уравнением Менделеева-Клапейрона (3) p2V2 RT2 . Из уравнения Ван-дер-Ваальса получаем, что RT1 a p1 2. V1 b V1 (4) Домножив левую и правую части выражения (4) на V1 , будем иметь p1V1 RT1V1 a . V1 b V1 (5) Внутренняя энергия моля водорода в начальном состоянии равна a (6) U1 CVT1 , V1 а в конечном состоянии U2 CVT2 . 171 (7) Подставляем в равенство (1) выражения (3), (5), (6) и (7) и получаем RT1V1 2a CVT1 RT2 CVT2 . V1 b V1 Преобразуем это выражение, воспользовавшись уравнением Майера Cp CV R , RT1V1 2a CpT1 RT1 CpT2 . V1 b V1 Тогда приращение температуры T T2 T1 будет равно T 1 bRT1 2a , Cp V1 b V1 (8) где T1 – температура начального состояния водорода. Получим из уравнения (2) формулу для определения температуры Т1 1 a T1 p1 2 V1 b . R V1 После расчётов будем иметь 1 6 0,024 3 T1 10 2,7 105 119,9 (К). 10 6 8,31 10 Если считать справедливым в данных условиях уравнение Майера, то C p для водорода равно 3,5 R. Подставив в формулу (8) значения исходных данных и вычисленное значение T1 , будем иметь T 2,7 105 8,31119,9 2 0,024 1 0,70 (К). 3,5 8,31 103 2,7 105 103 Ответ: – 0,70 К 172 8. Моль водорода, находившийся в объёме V1 103 м3 при температуре T1 205 К , в результате адиабатического дросселирования медленно переходит в объём V2 V1 , в котором поддерживается атмосферное давление. Вычислить (с точностью до сотых) приращение температуры вследствие эффекта Джоуля-Томсона. Определить температуру инверсии водорода. Считать, что в указанных условиях уравнение Майера справедливо. Дано Решение Так как конечное состояние 1 моль водорода можно с удовлетворительCp 3,5R ной точностью описать уравнением T1 205 K Менделеева-Клапейрона, то, как поV1 5 104 м 3 казано при решении предыдущей Па м 6 задачи, для определения приращеa 0,024 моль 2 ния температуры следует использо3 5 м вать формулу b 2,7 10 моль 1 bRT1 2a T ΔT – ? Tинв – ? Cp V1 b V1 T 2,67 105 8,31 205 2 0,024 1 0 K 3,5 8,31 5 104 2,67 105 5 104 В том случае, когда T 0 , положительный эффект Джоуля-Томсона сменяется отрицательным. Температура, при которой это происходит, называется температурой инверсии. Значит температура инверсии для водорода равна Tинв T1 205 К . Ответ: 0 K; Tинв = 205 К 173 Задания для аудиторной и самостоятельной работы 7.1. Два моля водорода расширяются в пустоту, при этом объём газа увеличивается от V1 = 2 л до V2 = 10 л. Какое количество теплоты нужно сообщить газу, чтобы его температура не изменилась? Ответ: 38,4 Дж 7.2. Вычислить приращение температуры одного моля азота вследствие эффекта Джоуля-Томсона, получающееся при p1 = 106 Па, если температура T1 равна а) 273 K б) 373 K. Указание: для облегчения расчётов значение V1 определить из уравнения состояния идеального газа. Ответ: а) –2,7 K, б) –1,6 K 7.3. Какому давлению необходимо подвергнуть углекислый газ при температуре Т = 300 K, чтобы его плотность стала равной ρ = 500 кг/м3? Расчёт провести для реального и идеального газов. Ответ: p = 80·105 Па, pид = 283·105 Па 7.4. Один моль некоторого газа находится в сосуде объёмом 0,25 л. При температуре T1 = 300 K давление газа равно p1 = 90·105 Па, а при температуре T2 = 350 K давление p2 = 110·105 Па. Найти постоянные Ван-дер-Ваальса для этого газа. 3 Па м6 5 м , b 45,775 10 Ответ: а 0,1875 моль моль2 7.5. Найти величину поправок a и b в уравнении состояния Ван-дер-Ваальса для воздуха. Критические давление и температура равны Tкр = 132,5 K, pкр = 37,6·105 Па. Ответ: а 0,136 3 Па м6 5 м , b 3,67 10 моль моль2 174 7.6. Пятьсот молей трехатомного газа адиабатически расширяется в вакуум от объёма V1 = 0,5 м3 до V2 = 3 м3. Температура газа при этом понижается на 12,2 K. Найти постоянную а, входящую в уравнение состояния Ван-дер-Ваальса. Па м6 моль2 7.7. В сосуде объёмом V = 10 л находится m = 0,25 кг азота при температуре t = 27ºC. Какую часть давления газа составляет давление, обусловленное силами взаимодействия молекул? Ответ: 4,89% 7.8. Определить давление при которым должен находиться 1 кмоль азота, чтобы при температуре Т = 310 K он занимал объём V = 2,5 м3? Решить задачу, пользуясь приведённой формой уравнения состояния Ван-дер-Ваальса. Критические величины для азота pкр = 33,9·105 Па, Tкр=126,1 K. Ответ: p = 9,87·105 Па 7.9. Какую температуру Т имеет масса m = 3,5 г кислорода занимающего объём V =90 см3 при давлении p = 2,8 МПа? Газ рассматривать как: а) идеальный; б) реальный. Ответ: а) Т = 277,3 К; б) Т = 285,7 К 7.10. В закрытом сосуде объёмом V = 0.5 м3 находятся количество ν = 0,6 кмоль углекислого газа при давлении р = 3 МПа. Пользуясь уравнением Ван-дер-Ваальса, найти, во сколько раз надо увеличить температуру газа, чтобы давление увеличилось вдвое. Ответ: Т2/Т1 = 1,85 Ответ: а 0,365 175 7.11. В сосуде объёмом V = 10 л находится масса m = 0,25 кг азота при температуре Т = 27°С. Какую часть объёма сосуда составляет собственный объём молекул? Ответ: Vʹ/V = 0,86% 7.12. Найти эффективный диаметр молекулы кислорода, считая известными для кислорода критические значения Ткр и pкр. Ответ: d = 292,5·10–12 м 7.13. Один моль углекислого газа, занимавший при температуре Т = 127°С объём V1 = 0,5 л, расширяется изотермически до объёма V2 = 2V1. Определить работу при расширении газа. Ответ: А = 2097 Дж 7.14. Моль кислорода расширяется адиабатически в пустоту, в результате чего объём газа увеличивается от 1 л до 10 л. Определить приращение температуры газа. Ответ: ΔТ = –5,89 К 7.15. Углекислый газ массой m=1 кг находится при температуре 290 К в сосуде вместимостью 20 л. Определить давление газа, если: 1) газ реальный; 2) газ идеальный. Поправки а и b принять равными соответственно 0,365 Н∙м4/моль2 и 4,3∙10-5 м3/моль. Ответ: 1) 2,44 МПа; 2) 2,76 МПа 7.16. Два моль кислород занимают объём V1 = 1 л. Определить изменение T температуры кислорода, если он адиабатически расширяется в вакуум до объёма V2=10 л. Поправку а принять равной 0,136 Н∙м4/моль2. Ответ: –11,8 К 176 Истинная логика нашего мира – это подсчёт вероятностей. Дж. Максвелл ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ 8. Барометрическая формула. Распределение Больцмана. Распределение Максвелла Математическим аппаратом молекулярной физики является теория вероятностей, поэтому рассмотрим необходимые сведения из этой теории. Пусть производятся измерения некоторой физической величины Х, которая может в принципе принимать n различных значений, изменяющихся дискретным образом (Х1, Х2,...Хi,...Хn). В результате повторенного N раз опыта, было получено, что величина Х приняла значение, равное Х1 в N1 измерениях, Х = Хi в Ni измерениях, а Х = Хn в Nn измерениях. Вероятностью того, что величина Х примет значение равное Хi, называют предел отношения числа опытов Ni, в результате которых было получено, что Х=Хi, к общему числу измерений N, при условии, что N стремится к бесконечности: N P(X Xi ) im i . N N Из определения вероятности следует, что она может принимать значения в диапазоне от нуля до единицы. Действительно, вероятность невозможного события равна 177 нулю, а вероятность события, которое произойдёт N раз при N опытах (такое событие называют достоверным) равна единице. Рассмотрим случай, когда множество возможных значений величины Х характеризуется непрерывным спектром значений в диапазоне от Х = a до Х = b. Для описания непрерывных распределений вводится понятие плотности вероятности. Вероятность того, что измеренное значение величины Х окажется в интервале X вблизи некоторого значения X a,b , обозначим как ΔР(Х...Х+ X ). Плотностью вероятности f(X) называют предел отношения вероятности ΔР(Х...Х+ X ) к величине X при стремлении ширины диапазона X к нулю: P(X...X X) dP(X) f (X) im dX . X 0 X f X P X a X X X X X b X Зависимость плотности вероятности от значений рассматриваемой величины в статистической физике называют функцией распределения. Из определения плотности вероятности следует, что вероятность нахождения случайной величины Х в малом диапазоне dX вблизи заданного значения Х равно dP(X) f (X)dX . 178 Для определения вероятности нахождения величины Х в диапазоне значений от Х1 до Х2, который нельзя считать малым, проводят интегрирование функции распределения в соответствующих пределах: X2 P(X1 X X 2 ) f (X)dX . X1 Так как по условию величина Х может принимать значения только в интервале от а до b, то вероятность того, что она примет одно из значениий, принадлежащих этому интервалу, равняется единице, как вероятность достоверного события: b f (X)dX 1 , a где a x min , b x max . Зная функцию распределения f X , можно найти среднее значение любой функции F X в интервале значений Х от а до b по формуле b F X F X f X dX . a Использование полученных сведений начнём с рассмотрения распределения Больцмана. Равенство температур и давлений, а, следовательно, и концентраций частиц во всех частях системы является условием равновесия только при отсутствии внешних полей. Больцман доказал, что и в случае стационарных внешних силовых полей в термодинамической системе возможно равновесное состояние, но концентрация частиц (число частиц в единице объёма) в такой системе будет зависеть от 179 координат n n x, y,z . Зависимость от координат равновесной концентрации частиц, находящихся в стационарном силовом поле, называют распределением Больцмана. В качестве примера найдём распределение концентрации молекул в изотермической атмосфере, температура которой не зависит от высоты (T = const). Будем считать атмосферный газ идеальным газом. Давление на высоте h определяется весом вышележащих слоёв воздуха, поэтому давление на высоте h dh будет меньше давления на высоте h . Получим выражение, описывающее закон убывания давления с ростом высоты dmg dV g gSdh dp gdh . S S S Из уравнения состояния идеального газа следует, что m pM плотность идеального газа равна , поэтому выV RT ражение для дифференциала давления можно преобразовать к виду Mg dp Mg dp pdh dh . RT p RT После интегрирования получаем Mgh ln p const . RT При h = 0, p = p0, тогда const = ln p0 и p Mgh ln . p0 RT После потенцирования этого выражения будем иметь Mgh p p0 exp . RT Барометрическая формула 180 Учитывая, что p = nkT и M/R = m/k, будем иметь: mgh n h n 0 exp , kT R Дж где m – масса молекулы, k – постоян 1,38 1023 NА K ная Больцмана, NА = 6,02·1023 моль–1 – число Авогадро (количество молекул в одном моле вещества). Эта формула описывает распределение концентрации молекул по высоте в однородной изотермической атмосфере и представляет собой частный случай распределения Больцмана, которое в общем виде формулируется так: если система, состоящая из совокупности одинаковых частиц, участвующих в тепловом хаотическом движении, находится во внешнем стационарном силовом поле, то в равновесном состоянии концентрация частиц распределена по экспоненциальному закону: n x, y, z n 0e U x,y,z kT , где U(x,y,z) – потенциальная энергия одной частицы в точке с координатами (x,y,z); nо – концентрация частиц в окрестности точки (xо,yо,zо), в которой потенциальная энергия принята равной нулю; n – концентрация частиц в окрестности точки (x,y,z). От распределения молекул по значениям потенциальной энергии, перейдём к рассмотрению распределения молекул по значениям их кинетической энергии. Эта задача была решена Д.К. Максвеллом, который изучил характер распределения молекул по скоростям в идеальном случае, когда на газ не действуют внешние силы. При получении функций распределения молекул газа 181 по скоростям используют следующие исходные положения: 1. Идеальный газ находится в равновесном состоянии, что позволяет не учитывать столкновения молекул. 2. Все направления движения молекул газа равновероятны, поэтому распределение молекул по направлениям движения равномерно. v , где v – средняя скорость теплового 3. Так как c движения молекул, можно считать, что абсолютная величина скорости принимает непрерывный ряд значений от нуля и до бесконечности, а проекции скорости изменяются от –∞ до +∞. Исходя из этих допущений, Максвелл получил следующее выражение для функции распределения по значениям проекции скорости молекул газа на некоторое направление ℓ: 2 mv m f v e 2kT . 2kT Функция f v , представленная на f v рисунке, симметрична, так как из-за хаотичности движения число молекул, движущихся в противоположv ных направлениях, оказывается в среднем одним и тем же. Для функции распределения по модулю скорости Максвеллом было получено следующее выражение: 3 2 mv m 2 2kT 2 F(v) 4 v . e 2kT 182 Эта функция определяет вероятность того, что скорость молекулы находится в единичном интервале скоростей, включающем заданную скорость v. Конкретный вид функции распределения зависит от массы молекулы и от температуры Т. Скорость, отвечающую максимальному значению функции распределения, называют наиболее вероятной. Она равна: 2kT 2RT . m M Подставив выражение для наиболее вероятной скорости в выражение для функции распределения по модулю скорости, найдём максимальное значение F(v): vН.В. 4 m m . e 2kT T Из этой формулы следует, что при увеличении температуры (или уменьшении массы моле- F v кулы) максимум кривой F(v) T 1 T2 T1 смещается в сторону бóльших T2 скоростей и становится ниже, причём площадь, охватываемая v кривой, остаётся неизменной и равной единице. Среднюю арифметическую скорость (средний модуль скорости) вычисляют, пользуясь формулой: F(v Н.В. ) 3 2 mv 8kT 8RT m 2 3 2kT v v F(v) dv 4 . v e dv m M 2kT 0 0 183 Среднее значение квадрата скорости определяют из выражения: 3 2 mv 3kT m 2 4 2kT v 2 v 2 F(v) dv 4 v e dv . 2 kT m 0 0 Тогда среднюю квадратичную скорость можно вычислить по формуле: 3kT 3RT . m M Зная среднее значение квадрата скорости молекул, можно вычислить среднюю кинетическую энергию поступательного движения газовых молекул: vCP.KB. v2 E кин mv2 m 2 3 v kT . 2 2 2 Заметим, что v2 v2x v2y v2z . Из-за хаотичности теплового движения v2x v2y v2z , поэтому mv2y mv2x mv2z 1 kT . 2 2 2 2 Полученный результат является частным случаем более общей теоремы о равномерном распределении энергии по степеням свободы: на каждую степень свободы молекулы приходится в среднем одинаковая кинетическая энергия теплового движения, равная kT 2 . Согласно теореме о равномерном распределении энер- 184 гии по степеням свободы полная энергия теплового движения молекулы: i E kT , 2 где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекул. Из этого выражения следует, что температура является мера средней энергии хаотического движения частиц (молекул). 185 Примеры решения задач 1. Во сколько раз увеличился объём кислорода, расширяющегося адиабатически, если известно, что средняя квадратичная скорость его молекул увеличилась в 1,5 раза? Дано Решение Запишем уравнение адиабатического vср.кв.1 n 1,5 процесса в виде vср.кв.2 1 i 5 V2 –? V1 T1V11 T2V21 V2 T1 1 . (1) V1 T2 Отношение температуры газа до расширения (Т1) к его температуре после расширения (Т2) найдём, воспользовавшись выражением для средней квадратичной скорости молекул: v 3RT T vср.кв. ср.кв.1 1 . (2) M vср.кв.2 T2 Из (1) и (2) следует, что 2 V2 vср.кв.1 1 , V1 vср.кв.2 где показатель адиабатического процесса для кислорода равен i2 52 1, 4 . i 5 Тогда имеем V2 2 1,41 1,5 7,59 V1 Ответ: 7,59 186 2. Распределение молекул по скоростям в пучке, выходящем из небольшого отверстия в сосуде, описывается mv 2 , где Т – температура газа 2kT функцией F1 (v) Av3 exp внутри сосуда. Во сколько раз наиболее вероятное значение скорости молекул в пучке больше наиболее вероятной скорости молекул внутри сосуда? Дано Решение Наиболее вероятная ско mv 2 F1 (v) Av3 exp рость соответствует максимуму 2kT функции распределения молеvнв кул газа по скоростям. Чтобы –? Максвелл vнв определить наиболее вероятную скорость молекул газа в пучке найдём первую производную от функции распределе mv 2 , и приравняем её к нулю: 2kT ния вида F1 (v) Av3 exp 2 mv2 3 mv2 2mv A 3v exp 0 v exp 2kT 2kT 2kT или mv2 mv2 Av2 exp 0. (1) 3 kT 2kT Так как значения v 0 и v , удовлетворяющие условию (1), соответствуют минимуму функции распределения, то выражение для наиболее вероятной скорости в случае функции распределения F1 получим из равенства 2 3 vнв m 3k T 0 vнв . kT m 187 (2) Предполагаем, что для величин скоростей молекул внутри сосуда справедливо распределение Максвелла, для которого наиболее вероятная скорость определяется выражением 2k T . m Сравнивая (2) и (3), будем иметь Максвелл vнв v v нв Максвелл нв (3) 3 1, 22 . 2 Ответ: 1,22 3. Один моль гелия находится в сосуде с жёсткими стенками при температуре Т = 293 К. Какое количество теплоты надо сообщить газу, чтобы средняя арифметическая скорость его молекул увеличилась на 1%? Дано Решение По условию задачи 1 моль Т 293 К v2 i3 v1 v 2 v1 0,01 v1 1 0,01 , откуда следует, что v2 Q–? v1 1,01 . (1) Средняя арифметическая скорость молекул равна v 8RT , поэтому M v 2 v1 T2 . T1 188 (2) Сравнивая (1) и (2), получаем T2 1,01 T2 1,02 T1 . T1 (3) Так как V const , то из первого начала термодинамики следует, что i (4) Q U R T2 T1 . 2 Подставив (3) в (4), будем иметь i Q R 0,02T1 . 2 3 Q 1 8,31 0,02 293 73 Дж 2 Ответ: 73 Дж 4. Воздушный шар для метеорологических наблюдений перед запуском имеет объём Vо = 0,04 м3. Определить объём шара на высоте 3000 м над местом запуска. Считать, что температура воздуха в диапазоне высот от 0 до 3000 м постоянна и равна Т = 280 К. Дано Решение Vo 0,04 м3 h 3000 м Т 280 К M 29·10 –3 кг / моль V1 – ? Из условия T const следует, что p po Vo p1V1 V1 Vo o , (1) p1 где p o – давление газа в шаре на начальной высоте, p1 – давление на высоте h. Выражение, связывающее давление на начальной высоте и давление на высоте h, получим из барометрической формулы 189 Mgh p1 po exp . RT (2) Подставив (2) в (1), будем иметь po Mgh V1 Vo Vo exp . Mgh RT po exp RT 29 103 9,81 3000 3 V1 0,04 exp 0,058 (м ) 8,31 280 Ответ: 0,058 м3 5. Установленная вертикально закрытая с обоих концов труба наполнена газообразным кислородом. Высота трубы Н = 2 м, объём V = 200 л. Стенки трубы имеют всюду одинаковую температуру Т = 293 К. Давление газа внутри трубы вблизи её основания pо = 105 Па. Определить количество молекул кислорода, содержащихся в трубе. Дано Решение Количество молекул кислорода, Н2м содержащихся в трубе, равно V 200·10 –3 м3 N ndV , Т 293 К V p 0 105 Па Mgh где n n 0 exp – конценM 32·10 –3 кг / моль RT N–? трация молекул на некоторой высоте h внутри трубы, n 0 – концентрация молекул вблизи основания трубы; dV – элементарный объём, который представим как dV Sdh . Тогда Mgh N n 0 exp Sdh . RT 0 H 190 После интегрирования получим RT MgH N n0 S exp 0 exp . Mg RT Учитывая, что p V n 0 0 ; S ; R kNA , kT H формулу (1) преобразуем к виду p RT V MgH N 0 1 exp . kT Mg H RT После подстановки численных значений будем иметь 105 6,02 1023 200 103 N 32 103 9,81 2 (1) 32 103 9,81 2 24 1 exp 4,94 10 8,31 293 Ответ: 4,94·1024 191 Задания для аудиторной и самостоятельной работы 8.1. На рисунке представлены графики зависимости давления от высоты для одного и того же идеального газа при различных температурах. Укажите номер кривой, соответствующий наибольшей температуре. Считать, что ускорение свободного падения и температура газа с высотой не меняются. Ответ: 1 8.2. На каком из представленных рисунков правильно изображена зависимость давления идеального газа во внешнем однородном поле силы тяжести от высоты над уровнем моря для двух разных температур (Т2 > Т1)? Ответ обосновать. р h р h Т1 Т2 Т2 а) Т1 0 р h h б) Т1 0 р h Т2 в) 0 h Т2 Т1 h г) 0 h Ответ: г 192 8.3. Какой процент от давления воздуха на уровне моря составляет давление воздуха на высоте 4200 м? Температура воздуха от высоты не зависит и равна 10°С. Молярная масса воздуха равна 0,029 кг/моль. Ускорение свободного падения принять равным g = 9,81 м/с2. Ответ: 60,2 % 8.4. На какую высоту надо подняться на планете, атмосфера которой состоит из углекислого газа 3 (М = 44 10 кг/моль), чтобы давление уменьшилось в 2,72 раз? Температура атмосферы равна Т = 300 К; g = 20 м/с2. Зависимостью температуры и ускорения свободного падения от высоты пренебречь. Ответ: h = 2833 м 8.5. На какой высоте плотность воздуха –3 (М = 29·10 кг/моль) в полтора раза меньше его плотности на уровне моря? Температуру газа считать постоянной и равной t = 15°С. Ускорение свободного падения принять равным g = 9,81 м/с2. Ответ: 3411 м 8.6. Барометр в кабине летящего самолёта все время показывает одинаковое давление p = 79 кПа, благодаря чему лётчик считает высоту h1, полёта неизменной. Однако температура воздуха за бортом самолета изменилась с t1 = 5ºС до t2 = 1ºС. Какую ошибку в определении высоты допустил лётчик? Давление p0 у поверхности Земли считать нормальным. Ускорение свободного падения принять равным g = 9,81 м/с2. Ответ: – 27,5 м 8.7. Самолёт совершает полёт на высоте 10000 м. В кабине поддерживается постоянное давление, соответствую- 193 щее высоте 2500 м. Во сколько раз плотность воздуха в кабине больше плотности воздуха вне кабины, если температура наружного воздуха – 45ºC, а температура воздуха в кабине + 20ºC. Ускорение свободного падения принять равным g = 9,81 м/с2. Молярная масса воздуха равна 0,029 кг/моль. Ответ: 2,6 8.8. На каком рисунке правильно изображена зависимость логарифма концентрации молекул газа в изотермической атмосфере планеты от высоты h над её поверхностью? Ответ обосновать. Ответ: 1 8.9. На каком из представленных рисунков правильно изображена зависимость концентрации молекул идеального газа во внешнем однородном поле силы тяжести от высоты для двух разных температур (Т2 > Т1)? Ответ обосновать. n h n h Т1 Т2 Т2 а) 0 Т1 h б) 194 0 h n h n h Т1 Т2 в) 0 Т1 h г) Т2 0 h Ответ: б 8.10. Одинаковые частицы массой m = 2·10 г каждая распределены в однородном гравитационном поле напряжённостью G = 0,3 мкН/кг. Определите отношение n1/n2 концентраций частиц, находящихся на эквипотенциальных уровнях, отстоящих друг от друга на h2 – h1 = 15 м. Температуру во всех точках поля считать одинаковой и равной 300 К. Ответ: 8,8 8.11. На берегу моря концентрация молекул воздуха равна n o 1025 м–3. Найти потенциальную энергию одной –12 молекулы воздуха на высоте, где концентрация молекул равна n 6 1024 м–3. Считать температуру одинаковой на разных высотах и равной t 3 С. Ответ: 1,9·10–21 Дж 8.12. Определить силу, действующую на частицу, находящуюся во внешнем однородном поле силы тяжести, если отношение концентраций частиц на двух уровнях, отстоящих друг от друга на Δh = 0,5 м, равно n1/n2 = 3. Температуру Т считать везде одинаковой и равной 290 К. Ответ: 8,79·10–21 Н –18 8.13. Частицы массой m = 10 г взвешены в воздухе. Определить толщину слоя воздуха, на границах которого концентрация частиц различается в 1,5 раза. Температура 195 воздуха во всем объёме постоянна и равна Т = 280 К. Выталкивающей силой Архимеда пренебречь. Ускорение свободного падения принять равным g = 9,81 м/с2. Ответ: 0,16 м 8.14. На рисунке представлено распределение Максвелла молекул газа по проекции скорости для трёх различных идеальных газов при одной и той же температуре. Укажите график, соответствующий газу, состоящему из молекул с наименьшей массой. Ответ обосновать. Ответ: 3 8.15. Из маленького отверстия в стенке сосуда выходит пучок молекул, распределение которых по скоростям имеет вид F v Av5 exp Bv 2 . Найти наиболее вероятную скорость молекул. В = 0,05 с2/м2. Ответ: 7,07 м/с 8.16. В закрытом сосуде при температуре T = 294 К находится N = 6·1023 молекул идеального газа с молярной массой М. Сумма квадратов скоростей всех молекул равна = 1029 м2/с2. Найти молярную массу газа. Ответ: 0,044 кг/моль 8.17. При какой температуре газа, состоящего из смеси азота и кислорода, наиболее вероятные скорости молекул азота и кислорода будут отличаться друг от друга на Δvн.в. = 30 м/с? На сколько будут различаться их среднеквадратичные скорости при этой температуре? Ответ: 363 K; 36,7 м/с 8.18. При какой температуре средняя квадратичная скорость молекул кислорода больше их наиболее вероятной скорости на 100 м/с? Ответ: 381 К 196 8.19. Найти температуру водорода, при которой скоростям молекул v1 = 600 м/с и v2 = 900 м/с соответствуют одинаковые значения функции распределения Максвелла по модулю скорости. Ответ: 66,8 K 8.20. Водород и гелий находятся при температуре Т = 300 K. При каком значении скорости молекул значения функции распределения Максвелла по скоростям будут одинаковыми для обоих газов? Ответ: 1,61 км/с 8.21. Работа изотермического расширения некоторого газа массой m = 20 г от объёма V1 до объёма V2 = nV1, где n = 1,5, равна А = 731 Дж. Найти среднюю квадратичную скорость молекул газа. Ответ:520 м/с 8.22. Определить среднюю арифметическую скорость молекул газа, заключённого в сосуд вместимостью V=2 л под давлением p = 200 кПа. Масса газа m = 3 г. Ответ: 582,8 м/с 8.23. В закрытом сосуде при температуре Т = 300 К находится кислород. Найти относительную долю молекул, скорости которых лежат в интервале от v кв до vкв v , где v кв – средняя квадратичная скорость молекул, а v = 0,1 м/с. Ответ: 0,019% 8.24. Чему равно при данной температуре отношение средней энергии молекул метана (CH4), которые участвуют только в поступательном и вращательном движениях, к средней энергии молекул азота (N2) при условии, что в этой молекуле имеют место все виды движения атомов? 6 Ответ: 7 197 8.25. Чему равно при данной температуре отношение средней энергии молекул аммиака (NH3), имеющих пространственную структуру, к средней энергии молекул углекислого газа с учётом того, что молекула CO2 – линейная? В обеих молекулах имеют место все виды движения. 18 Ответ: 13 8.26. Внутренняя энергия одного моля некоторого двухатомного газа равна 6,02 кДж/моль. Определить среднюю кинетическую энергию вращательного движения одной молекулы этого газа. Газ считать идеальным. Колебательное движение атомов в молекуле данного газа не учитывать. Ответ: 4 1021 Дж 8.27. При нагревании некоторого газа на ΔТ1 = 140 К при постоянном давлении необходимо затратить количество теплоты Q1 = 2,45 Дж. Если это же количество газа охладить при постоянном объёме на ΔТ2 = 160К, то выделится количество теплоты Q2 = 2 Дж. Найти число степеней свободы молекулы этого газа. Ответ: 5 198 9. Явления переноса в газах В термодинамической системе, выведенной из состояния равновесия, развиваются особые необратимые процессы, называемые явлениями переноса, вынуждающие её стремиться к равновесному состоянию. Рассмотрим некоторые явления переноса в газах. Пусть, например, в неравновесной газовой системе в некотором направлении изменяется концентрация молекул. Тогда возникает явление переноса, называемое диффузией, которое заключается в переносе массы. Если имеет место градиент температуры, развивается другое явление переноса, называемое теплопроводностью, при котором происходит перенос энергии. В том случае, когда имеется градиент импульса молекул, протекает явление переноса, называемое вязкостью или внутренним трением, при котором происходит перенос импульса. Для количественной характеристики изменения физической величины используют градиент, представляющий собой вектор, своим направлением указывающий направление наибольшего возрастания этой величины, а по величине (модулю) равный скорости роста этой величины в этом направлении. Рассмотрим вязкость (внутреннее трение). Пусть при ламинарном движении скорость течения газа меняется от слоя к слою наибыстрейшим образом в направлении оси Z. При этом на границе между двумя смежными слоями, перпендикулярными оси Z, возникает сила внутреннего трения, которая, как показывает эксперимент, равна 199 du S, dZ Закон Ньютона где η – коэффициент внутреннего трения (коэффициент диdu намической вязкости), – модуль градиента скорости теdZ чения газа, показывающий, как быстро изменяется скорость упорядоченного движения (u) его молекул в направлении Z, перпендикулярном скорости u . Перенос импульса происходит в направлении его убывания, другими словами, направление переноса импульса противоположно направлению вектора градиента скорости упорядоченного движения молекул газа. Теоретически показано, что 1 v , 3 где ρ = m·n – плотность газа, m – масса молекулы, n – концентрация молекул газа (число молекул в единице объёма), v – средняя арифметическая скорость теплового (хаотиF ческого) движения молекул, – одна из важнейших характеристик теплового хаотического движения, называемая средней длиной свободного пробега газовых молекул. Средняя длина свободного пробега – это среднее расстояние, которое молекула проходит между двумя следующими друг за другом соударениями. Длина свободного пробега равна отношению среднего пути, проходимого молекулой за единицу времени (численно равного средней арифметической скорости теплового 200 движения v ) к числу испытываемых за это время столкновений, которое определяют по формуле: 2d 2 n v , где n – концентрация молекул; d – эффективный диаметр молекул (минимальное расстояние, на которое сближаются при столкновении центры двух молекул). Тогда v 1 1 , 2 2d n 2n где d 2 – эффективное поперечное сечение столкновения молекул. С ростом температуры энергия молекул возрастает, поэтому при столкновении их центры сближаются на меньшее расстояние, т.е. с ростом температуры эффективный диаметр d и эффективное поперечное сечение σ хотя и слабо, но уменьшаются. Согласно полученным формулам средняя длина свободного пробега молекул газа обратно пропорциональна концентрации и, следовательно, давлению. Так как плотность ρ газа пропорциональна давлению p, а обратно пропорциональна p, то η не зависит от давления газа. При повышении температуры v и увеличиваются, что приводит к росту вязкости η. Число молекул газа N, ежесекундно сталкивающихся с участком стенки сосуда площадью S, в котором находится газ, определяют по формуле 1 N n v S, 4 201 где n – концентрация молекул, v – их средняя арифметическая скорость. Если слои газа имеют разную температуру, то в газе возникает перенос теплоты от более нагретого слоя к менее нагретому, то есть имеет место явление теплопроводности. Предположим, что температура газа изменяется только в направлении оси Z. Экспериментально установлено, что в этом случае теплопроводность газа описывается уравнением dT dQ Sdt , dZ Закон Фурье где dQ – количество теплоты, переносимое за время dt через dT площадку S, расположенную перпендикулярно оси Z; – dZ модуль градиента температуры газа; χ – коэффициент теплопроводности, который зависит от свойств газа и условий, в которых находится газ. Знак «–» указывает, что перенос энергии происходит в направлении убывания температуры, т.е. направление переноса энергии противоположно направлению вектора градиента температуры. Для коэффициента теплопроводности получено следующее выражение: 1 v cV , 3 где сV – удельная теплоёмкость газа при постоянном объёме. Коэффициент теплопроводности χ не зависит от давления газа (по той же причине, по которой не зависит от давления коэффициент внутреннего трения η). Коэффициент теплопроводности χ возрастает с температурой несколько быстрее, чем T (за счёт небольшого роста, связанного с 202 уменьшением эффективного поперечного сечения столкновения молекул при росте температуры). Когда в смеси газов концентрация какого-либо газа распределена неравномерно, то возникает диффузия, заключающаяся в переносе молекул этого газа из мест с большей концентрацией в места с меньшей концентрацией. Если в сосуде находится только один газ, плотность которого в занимаемом им объёме неодинакова, то происходит диффузия молекул газа в среде того же самого газа, то есть самодиффузия. Предположим, что плотность газа изменяется только в направлении оси Z. Экспериментально установлено, что в этом случае диффузия газа описывается выражением: d dm D Sdt , dZ Закон Фика где знак «–» указывает, что диффузия (перенос массы) происходит в направлении убывания плотности; dm – масса газа, переносимого за время dt через площадку S, располоd женную перпендикулярно оси Z; – градиент плотности dZ газа; D – коэффициент диффузии. Коэффициент самодиффузии газа равен 1 D v . 3 При постоянной температуре, но изменяющемся давлении газа средняя скорость v теплового движения молекул остаётся постоянной, а средняя длина свободного пробега изменяется обратно пропорционально давлению p. В связи с этим при постоянной температуре коэффициент самодиффузии обратно пропорционален давлению p. С ростом температуры коэффициент самодиффузии увеличивается. 203 Примеры решения задач 1. Зазор между двумя очень длинными коаксиальными цилиндрическими поверхностями заполнен однородным изотропным веществом. Радиусы поверхностей r1 = 5 см, r2 = 7 см. Внутренняя поверхность поддерживается при температуре T1 = 290 K, наружная при T2 = 320 K. Найти температуру на расстоянии 6 см от оси цилиндров. Дано Решение r1 5 см r2 7 см r 6 см T1 290K T2 320K T–? Воспользуемся законом Фурье, согласно которому количество теплоты, переносимой в данном случае через поверхность площадью S 2rh за время dt, равно dT (1) dQ S dt . dr Предполагается, что температура граничных слоёв и распределение температур в объёме вещества с течением времени не изменяются. Стационарный режим реализуется, dQ если величина скорости переноса теплоты q с течеdt нием времени не изменяется. Выражение для модуля скорости переноса теплоты получим из (1): 204 dT (2) 2rh . dr Преобразуем (2), разделив в нём переменные Т и r: q dr . (3) dT 2h r Уравнение (3) интегрируем от поверхности внутреннего цилиндра до поверхности внешнего цилиндра T2 r r q 2 dr q (4) T dT 2h r r T2 T1 2h n r12 . 1 1 q Далее интегрируем уравнение (3) от поверхности внутреннего цилиндра до мысленно проведённой цилиндрической поверхности радиусом r, во всех точках которой температура равна Т: T r r q dr q (5) dT T T1 n . T 2 h r 2 h r 1 r1 1 Сравнив (4) и (5), будем иметь r n 2 r T2 T1 1 или T T1 r n r1 r n r T T1 T2 T1 1 . r n 2 r1 Подставив в (6) численные значения, получим 205 (6) 6 n 5 T 290 320 290 306 K . 7 n 5 Ответ: 306 К 2. Потолочное перекрытие теплового котла состоит из двух слоёв тепловой изоляции. Определить температуру t 2 на границе между слоями, если температуры внутренней и наружной поверхностей перекрытия соответственно равны t1 800 C и t 3 60 C , а толщина и теплопроводность каждого слоя соответственно равны d1 0,5 м, 1 1,3 d 2 0, 2 м, 2 0,16 Вт и мК Вт . мК Дано Решение t1 800 C ; t 3 60 C 1 d1 d1 0,5 м Вт мК d 2 0,2 м 1 1,3 t1 2 d2 t2 t3 Предполагается, что температура t2 на границе между слоями постоянна. Это возможно в том случае, когда количество теплоты, подводимое в единицу времени к единице площади поверхности границы, равно количеству теплоты, отводимой в единицу времени от единицы площади поверхности границы: Вт 2 0,16 мК t2 – ? 206 w 1 dQ const S dt (1) Запишем уравнение Фурье, считая, что ось х направлена перпендикулярно границе слоёв вправо dT (2) dQ Sdt . dx Сравнивая (1) и (2), получим dT dx . (3) w const dT const dx Интегрируем уравнение (3) сначала по параметрам первого теплоизолирующего слоя const 1 dT dx 1 T2 T1 const , T 1 0 d1 1 T2 d (4) а затем по параметрам второго слоя const 2 T dT 2 0 dx d22 T3 T2 const . 2 T3 d Из (4) и (5) имеем 1 T2 T1 2 T3 T2 , d1 d2 или, выражая температуру в градусах Цельсия, 1 t 2 t1 2 t 3 t 2 . d1 d2 После преобразований получим 1 t1 2 t 3 d d2 t2 1 . 1 2 d1 d 2 207 (5) (6) Подставив численные значения, будем иметь 1,3 0,16 800 60 0,5 0, 2 t2 625,9 С 1,3 0,16 0,5 0, 2 Ответ: 625,9 С 3. Коэффициент самодиффузии кислорода при Т = 273 К и p = 105 Па равен D 1,8 105 м2 / c . Во сколько раз средняя длина свободного пробега молекул кислорода при этих условиях превышает среднее расстояние между молекулами? Дано Решение Коэффициент самодиффузии Т 273 К D и средняя длина свободного проp 105 Па бега связаны следующим обD 1,8 105 м 2 / c разом M 32·10 –3 кг / моль 1 D v , (1) 3 –? a 8RT где v – средняя арифM метическая скорость молекул. Тогда из (1) имеем 3D M . 3D v 8RT (2) Найдём численное значение средней длины свободного пробега по формуле (2): 3 1,8 105 3,14 32 103 127 109 м 8 8,31 273 208 Для оценки среднего расстояния a между молекулами воспользуемся следующей формулой V 3 a , N RT где объём V= , а число молекул N NA . Тогда p a 3 RT kT 3 . pN A p Подставив численные значения, получаем 1,38 1023 273 3,35 109 м 105 Окончательно будем иметь a 3 127 109 37,9 . a 3,35 109 Ответ: в 37,9 раз 4. В результате некоторого процесса вязкость идеального газа увеличилась 2 раза, а коэффициент диффузии в 4 раза. Как и во сколько раз изменилось давление газа? Дано Решение Вязкость идеального газа определяем по фор2 2 муле 1 1 v , (1) D2 3 4 D1 p2 –? p1 где v 8RT – средняя арифметическая скоM рость движения молекул, 209 1 2 d n 2 kT 2 d 2 p – средняя длина свободного пробега молекул, – плотность газа. Коэффициент диффузии идеального газа равен 1 (2) D v . 3 Разделив (1) на (2), получим D 1 (3) 2 2 1 . D 1 D2 1 2 Из выражения (1) найдём отношение вязкостей газа после завершения процесса и до него v 2 2 2 2 T2 T2 p1 2 . (4) 1 v1 1 1 T1 T1 p2 1 2 1 , а по условию задачи 2 2, 1 1 2 поэтому из выражения (4) получим Как следует из (3), 3 T2 p1 4. T p 1 2 (5) Воспользуемся уравнением состояния идеального газа, чтобы выразить плотность газа через температуру и давления, что позволит найти связь между начальными и конечными значениями температуры и давления: m pM p T (6) 1 1 2. V RT 2 p2 T1 Из (3) и (6) следует, что T2 2p 2 . (7) T1 p1 210 Подставив (7) в (5), будем иметь 8p32 p1 8p2 p 4 16 2 2 . 3 p1 p 2 p1 p1 Ответ: давление увеличится в 2 раза. 5. Два сосуда разделены тонкой непроводящей тепло прокладкой. Стенки сосуда 1 поддерживаются при температуре T1 = 300 K, сосуда 2 при температуре T2 = 500 K. Сосуды сообщаются через маленькое отверстие. Установившееся давление газа в сосуде 1 равно p1 = 0,1 Па. Чему равно давление во втором сосуде? Считать, что диаметр отверстия меньше средней длины свободного пробега молекул. Дано Решение T1 300K T2 500K p1 0,1 Па p2 – ? В том случае, когда диаметр отверстия меньше средней длины свободного пробега молекул, столкновения молекул между собой можно не учитывать. Тогда в соответствии с условием равновесия среднее число частиц газа N12 , проходящих через отверстие за единицу времени в одном направлении, должно быть равно среднему числу частиц N 21 , проходящих за это же время в противоположном направлении: N12 N21 . (1) Число молекул N, ежесекундно проходящих через отверстие площадью S, равно количеству молекул, ежесекундно соударяющихся с участком стенки, площадь которого равна площади отверстия 211 1 N n v S, 4 p – концентрация молекул, а kT средняя арифметическая скорость. Из (1) и (2) следует, что где n n1 v1 n 2 v2 (2) v 8RT – их M p1 8RT1 p 8RT2 p p 2 1 2 . kT1 M kT2 M T1 T2 Видим, что при установлении равновесия давление во втором сосуде будет равно p 2 p1 p2 0,1 T2 . T1 500 0,129 Па 300 Ответ: 0,129 Па 212 Задания для аудиторной и самостоятельной работы 9.1. Перенос импульса упорядоченного движения газа происходит в направлении вектора n ex ey . Скорость потока газа направлена вдоль вектора n ' ex ey , где ex и ey – единичные векторы декартовой системы координат. Вдоль какого вектора направлен градиент величины этой скорости упорядоченного движения молекул газа? Ответ обосновать. Ответ: ex ey 9.2. Концентрация молекул газа одинакова во всех точках, а температура газа возрастает в положительном направлении оси Y. В каком направлении происходит перенос теплоты? Ответ обосновать. Ответ: в отрицательном направлении оси Y 9.3. Концентрация молекул газа одинакова во всех точках, а температура газа возрастает в направлении n ex ey , где ex , ey , ez – единичные векторы декартовой системы координат. В каком направлении происходит процесс переноса теплоты? Ответ: в напралении вектора ex ey 9.4. Величина концентрации молекул газа возрастает в направлении n ex ey , где ex , ey , ez – единичные векторы декартовой системы координат. В каком направлении происходит перенос массы? Ответ обосновать. Ответ: ex ey 9.5. Для какого из приведённых газов (гелия, азота, углекислого газа СО2, метана СН4.) коэффициент диффузии 213 имеет при одинаковых температуре и давлении наибольшую величину? Ответ обосновать. Ответ: для гелия 9.6. Как зависит давление газа от его температуры в процессе, при котором частота соударений молекул газа со стенкой сосуда не изменяется? Ответ: p const T 9.7. Идеальный газ совершает процесс, при котором величина средней длины свободного пробега его молекул не изменяется. Как при этом процессе давление зависит от температуры? Ответ: p const T . 9.8. Как и во сколько раз изменилась средняя длина свободного пробега молекул газа, совершившего изотермический процесс, в ходе которого объём газа увеличился от 1 м3 до 3 м3: Ответ: увеличилась в 3 раза 9.9. Газ находится в сосуде, объём которого может меняться, и совершает изотермический процесс, после которого число соударений молекул газа с единицей поверхности стенки сосуда за единицу времени увеличилось в 2 раза. Как и во сколько раз при этом изменился объём сосуда? Ответ: уменьшился в 2 раза. 9.10. Во сколько раз средняя длина свободного пробега молекул азота, находящегося при нормальных условиях, больше среднего расстояния между его молекулами? Ответ: в 18,6 раз 9.11. Теплопроводность гелия в 8,7 раза больше, чем у аргона (при нормальных условиях). Найти отношение эффективных диаметров атомов аргона и гелия. Ответ:1,66 214 9.12. Кислород и водород находятся в одном сосуде. Эффективный диаметр молекул кислорода d1 = 0,35 нм, водорода d2 = 0,27 нм. Во сколько раз отличаются их теплопроводности? Ответ: в 6,72 раза 9.13. В первом сосуде с объёмом V находится N1 молекул водорода (M1 = 2 г/моль) со средней квадратичной скоростью vкв1 , а во втором таком же сосуде находится N2 молекул азота (M2=0,028 кг/моль) со средней вероятной скоростью vвер2 . В сосудах сделали одинаковые отверстия площадью S. На сколько отличается число молекул, вылетающих из разных сосудов за одну секунду. Универсальная газовая постоянная R 8,31Дж моль К .V= 1 м3; N1 = 1023; N2= 1024; vкв1 = 500 м/с; vвер2 =400 м/с; S = 4 мм2. Ответ: 4,05·1020 9.14. В тонкой перегородке, разделяющей сосуд на две части, имеется круглое отверстие радиуса r = 1 мм. В сосуде находится гелий под давлением p = 1 Па. Стенки сосуда поддерживаются при температуре Т = 300 К. Определить количество молекул пролетающих через отверстие в единицу времени в каждом из направлений. Ответ: 2,4 1017 с1 . 9.15. При каком давлении отношение вязкости некото 0,3 кг / м3 , а рого газа к коэффициенту его диффузии D средняя квадратичная скорость его молекул равна vср.кв.=632 м/с? Ответ: 39942,4 Па 215 9.16. Определить среднюю длину свободного пробега λ молекул гелия при давлении p = 100 кПа и температуре Т = 273 К, если его вязкость при этих условиях η=13 мкПа·с. Ответ: 184 нм 9.17. Определите плотность ρ водорода, если средняя длина свободного пробега <ℓ> его молекул равна 1 см. Эффективный диаметр молекулы водорода принять равным d = 2,3∙10–10 м Ответ: 1,42∙10–6 кг/м3 9.18. Найти диаметр молекулы кислорода, если при температуре Т = 273 К его вязкость равна η = 18,8 мкПа·с. Ответ: 9,5·10–10 м 9.19. В сосуде с объемом V находится N молекул водорода, средняя квадратичная скорость которых равна v кв . Найти число ударов молекул о площадку стенки сосуда S за одну секунду. Универсальная газовая постоянная R 8,31Дж моль К . V= 1 м3; N = 1023; v кв = 650 м/с; S = 1 см2; = 2 г/моль. Ответ: 1,50·1021 9.20. В сосуде с объёмом V находится N молекул водорода. Сумма величин скоростей всех молекул равна vi . Сколько молекул вылетит из отверстия в стенке сосуда с площадью S за одну секунду. Универсальная газовая постоянная R 8,31Дж моль К . V= 1 м3; N = 1024; = 81026 м/с; S = 1 см2; = 2 г/моль. Ответ: 2·1022 9.21. Один моль кислорода (M = 32 г/моль) находится в закрытом сосуде с объёмом V. Длина свободного пробега . Найти эффективное сечение молекул (в нм2). 216 Постоянная Больцмана k 1,38 1023 Дж/К, число Авогадро NA 6 1023 моль–1. V = 4 м3; = 10–8 м. Ответ: 473 нм2 9.22. Один моль кислорода ( = 32 г/моль) находится в сосуде под поршнем. Длина свободного пробега молекул равна 1. При неизменном давлении температура увеличилась в n раз, а длина свободного пробега становится равной 2. Считая эффективный диаметр молекул неизменным, найти отношение 2 1 . n = 5. Ответ: 5 9.23. Идеальный четырехатомный газ находится в закрытом сосуде при очень низкой температуре, когда вращательные степени свободы не возбуждены. Средняя энергия одной молекулы при этом равна E1 . Во сколько раз увеличится средняя энергия молекулы при возбуждении всех вращательных и колебательных степеней свободы. Температура при этом увеличилась в 4,5 раза. E1 = 210–21Дж. Ответ: 27 раз 9.24. В двух сосудах находятся по одному молю гелия He и углекислого газа СО2. Во сколько раз молярная теплоёмкость углекислого газа при постоянном объёме больше, чем молярная теплоемкость гелия при постоянном давлении? Газы считать идеальными. Колебательные степени свободы все возбуждены. Ответ: 2,4 раза 9.25. В сферической колбе объёмом V = 1 л находится азот. При какой плотности азота средняя длина свободного пробега его молекул больше размеров сосуда? Диаметр молекул азота принять равным d = 0,3 нм. Ответ: 0,94·10–6 кг/м3 217 9.26. Найти теплопроводность воздуха при давлении р = 100 кПа и температуре t = 10°С. Диаметр молекул воздуха принять d = 0,3 нм. Ответ: 13,08·10–3 Вт/(м·К) 9.27. В сосуде объёмом V = 2 л находится N = 4·1022 молекул двухатомного газа. Теплопроводность газа 14 мВт/(м·К). Найти коэффициент диффузии D газа. Ответ: 2,029·10–5 м2/с 9.28. Найти диаметр молекулы кислорода, если при температуре t = 0°С вязкость кислорода = 18,8 мкПа/с. Ответ: 3·10–10 м 9.29. Коэффициент диффузии и вязкость кислорода при некоторых условиях равны D = 1,22·10-5 м2/с и =19,5 мкПа·с. Найти среднюю длину свободного пробега его молекул. (Диаметр молекул кислорода принять равным d = 0,36 нм). Ответ: 58 нм 9.30. При каком давлении р отношение вязкости неко 0,3 кг / м3 , торого газа к коэффициенту его диффузии D если средняя квадратичная скорость его молекул равна 632 м/с? Ответ: 39,9 кПа 218 БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Иродов И.Е. Физика макросистем. Основные законы: учебное пособие для вузов. – М.: Бином: Лаборатория Знаний, 2004. – 207 с. 2. Савельев И.В. Курс физики: учебное пособие для вузов: в 3 т. – СПб.: М.: Краснодар: Лань, 2008. Т. 1: Механика; Молекулярная физика. – 2008. – 352 с. 3. Жигунов В.В. Основные законы физики. / В.В. Жигунов, К.В. Жигунов. – Тула: ТулГУ, 2014. – 385 с. 4. Иродов И.Е. Задачи по общей физике.-7-е изд. – М.: БИНОМ, 2007. – 431 с. 5. Савельев И.В. Сборник вопросов и задач по общей физике. – СПб.: Лань, 2007. – 288 с. 6. Трофимова Т.И. Руководство к решению задач по физике: учебное пособие для бакалавров. – М.: Юрайт, 2001. – 266 с. 7. Физика: Задания к практическим занятиям: Учеб. пособие для вузов / И.И. Рубан, С.М. Жаврид, Н.Е. Великевич, Ж.П. Лагутина / Под общ. ред. Ж.П. Лагутиной. – Мн.: Выш. шк., 1989. – 236 с. 8. Рыбакова Г.И. Сборник задач по общей физике. – М.: Высш. шк., 1984. – 159 с. 9. Миронова, Г.А. Молекулярная физика и термодинамика в вопросах и задачах: Учебное пособие / Г.А. Миронова, Н.Н. Брандт, А.М. Салецкий. – СПб.: Изд-во "Лань", 2012. – 480 с. 219 ПРИЛОЖЕНИЯ Таблица Д.И. Менделеева 220 Константы уравнения Ван-дер-Ваальса Вещество Азот Водород Кислород Углекислый газ a, Н·м4/моль2 0,1350 0,0245 0,1358 0,36088 b, 10–6 м3/моль 38,620 26,653 31,671 42,840 Критическая температура Тк и критическое давление рк некоторых веществ Вещество Водяной пар Углекислый газ Кислород Аргон Тк, К 647 Рк, МПа 22,0 Вещество Азот Тк, К 126 Рк, МПа 3,4 304 7,38 Водород 33 1,3 154 151 5,07 4,87 Гелий 5,2 0,23 221 Учебное издание Жигунов Виктор Владимирович Жигунов Константин Викторович Кажарская Светлана Евгеньевна Муравлева Людмила Владиславовна ЗАДАЧИ ПО МОЛЕКУЛЯРНОЙ ФИЗИКЕ И ТЕРМОДИНАМИКЕ С РЕШЕНИЯМИ Учебное пособие Авторское редактирование Изд. лиц. ЛР № 020300 от 12.02.97. Подписано в печать Формат бумаги 60×84 1/16. Бумага офсетная. Усл. печ. л. . Уч.-изд. л. . Тираж 50 экз. Заказ . Тульский государственный университет. 300012, г. Тула, просп. Ленина, 92 Отпечатано в Издательстве ТулГУ 300012, г. Тула, просп. Ленина, 95