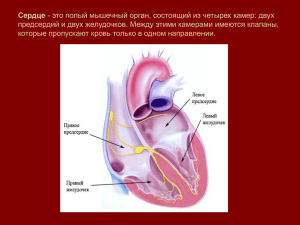
Государственное бюджетное образовательное учреждение высшего профессионального образования «Иркутский государственный медицинский университет» Министерства здравоохранения Российской федерации Кафедра патологической физиологии с курсом клинической иммунологии Патофизиология сердца учебное пособие Иркутск ИГМУ 2014 1 УДК 616.12 – 092 (075.8) ББК 52.527.0я73 П20 Рекомендовано ЦКМС ГБОУ ВПО ИГМУ Минздрава России к использованию в учебном процессе в качестве учебного пособия для студентов (протокол № Составители: Е.В. Гузовская – канд. мед. наук, доцент каф. патологической физиологии с курсом клинической иммунологии ГБОУ ВПО ИГМУ Минздрава России С.Ф. Непомнящих – канд. мед. наук, ст. препод. каф. патологической физиологии с курсом клинической иммунологии ГБОУ ВПО ИГМУ Минздрава России Рецензенты: Е.С. Енисеева – канд.мед. наук, доцент каф. госпитальной терапии ГБОУ ВПО ИГМУ Минздрава России Л.И. Корытов – доктор мед. наук, профессор кафедры нормальной физиологии ГБОУ ВПО ИГМУ Минздрава России П20 Гузовская, Е. В. Патофизиология сердца: учебное пособие / Е.В. Гузовская, С.Ф. Непомнящих; ГБОУ ВПО ИГМУ Минздрава России – Иркутск, ИГМУ – 48 с. Учебное пособие содержит основные разделы патофизиологии сердца – коронарная и сердечная недостаточность, аритмии. Пособие предназначено для всех студентов, изучающих патологическую физиологию и патологию. УДК 616.12 – 092 (075.8) ББК 52.527.0я73 © Е.В. Гузовская, С.Ф. Непомнящих, 2014 ©ГБОУ ВПО ИГМУ Минздрава России, 2014 2 Оглавление Вопросы для проверки исходного уровня знаний Вопросы для самоподготовки по теме занятия. Коронарная и сердечная недостаточность. 4 5 7 Сердечная недостаточность 11 Аритмии 18 Аритмии вследствие нарушения функции автоматизма Аритмии в результате нарушения функции проводимости Аритмии в результате нарушения возбудимости сердечной ткани. Смешанное нарушение свойств миокарда 20 25 31 41 Вопросы для самоконтроля усвоения материала. 42 Примеры тестовых заданий к разделу 47 3 Вопросы для проверки исходного уровня знаний 1. Какое свойство сердечной мышцы называется автоматизмом? 2. Как называется мышечная ткань сердца, обладающая свойством автоматизма? 3. Назовите основные компоненты проводящей системы сердца. 4. Какая структура проводящей системы сердца является водителем ритма первого порядка? 5. В чем заключается закон градиента сердца? 6. Что называют абсолютным рефрактерным периодом? 7. Чем характеризуется период относительной рефрактерности? 8. Как называется кривая, отражающая динамику разности потенциалов в двух точках электрического поля сердца в течение сердечного цикла? 9. Какие отведения применяют для регистрации электрокардиограммы? 10. Что отражает зубец Р электрокардиограммы? 11. Чем обусловлен комплекс QRST электрокардиограммы? 12. Что отражает зубец Т электрокардиограммы? 13. Какова продолжительность интервала РQ? Эталоны ответов: 1. Способность некоторых клеток к генерации потенциалов действия без воздействия сторонних раздражителей, в результате чего происходят самостоятельные сокращения сердца. 2. Атипическая мышечная ткань, клетки-пейсмекеры. 3. Синоатриальный (синусно-предсердный, Кейт-Флака) узел, атриовентрикулярный (предсердно-желудочковый, Ашоффа-Товара) узел, пучок Гиса и волокна Пуркинье. 4. Синоатриальный (синусно-предсердный, Кейт-Флака) узел. 5. Правило, впервые сформулированное В.Гаскеллом, согласно которому степень автоматии отдела тем выше, чем он ближе расположен к синусно-предсердному узлу. 6. Период, во время которого сердце не отвечает на раздражения, независимо от их силы и величины (период систолы). 7. Период, во время которого только интенсивный стимул может вызвать ответную реакцию сердца (начало расслабления сердечной мышцы). 8. Электрокардиограмма (ЭКГ). 9. Стандартные (3), грудные, однополюсные (униполярные) отведения, 10. Период возбуждения предсердий, является алгебраической суммой потенциалов, возникающих в правом и левом предсердии. 4 11. Возникновением и распространением возбуждения в миокарде желудочков, поэтому называется желудочковым комплексом. 12. Восстановление нормального потенциала мембраны клеток миокарда, т.е. реполяризацию миокарда. 13. 0,12 – 0,20 сек. 5 Вопросы для самоподготовки по теме занятия. 1. Коронарная недостаточность. Определение, этиология, патогенез. 2. Формы развития коронарной недостаточности. 3. Сердечная недостаточность. Определение, этиология принципы классификации. 4. Патогенез сердечной недостаточности. Механизмы компенсации гемодинамических нарушений. 5. Причины и механизмы декомпенсации сердечной недостаточности. 6. Классификация аритмий. 7. Причины и патогенез синусовой тахикардии. Клиническое значение. 8. Причины и патогенез синусовой брадикардии. Клиническое значение. 9. Причины и патогенез синусовой аритмии. Клиническое значение 10. Виды гетеротопных аритмий. Причины, электрокардиографические признаки. Клиническое значение. 11. Этиопатогенез замедления и блокады проведения импульсов в сердце. 12. Виды блокад, электрокардиографические признаки. Клиническое значение. 13. Синдром WPW. Этиопатогенез, проявления на ЭКГ. Клиническое значение. 14. Этиология и патогенез аритмий вследствие нарушения возбудимости сердца. 15. Виды аритмий вследствие нарушения возбудимости сердца, проявления на ЭКГ. Клиническое значение. 16. Смешанные нарушения автоматизма, проводимости и возбудимости. 6 Коронарная и сердечная недостаточность. Наиболее распространенной формой патологии сердца является ишемическая болезнь сердца. Согласно статистическим данным, в смертности от сердечно-сосудистых заболеваний ИБС занимает лидирующее положение ИБС – это острая или хроническая дисфункция миокарда, возникающая вследствие относительного или абсолютного уменьшения снабжения сердца артериальной кровью. Патофизиологической основой ИБС является коронарная недостаточность. Согласно клинической классификации следующие разновидности ИБС: экспертов ВОЗ, выделяют 1. Первичная остановка кровообращения (внезапная сердечная смерть). 2. Стенокардия. 3. Инфаркт миокарда. 4. Постинфарктный кардиосклероз. 5. Сердечная недостаточность. 6. Аритмии. С патофизиологической точки зрения можно выделить три формы ИБС: 1. Коронарная недостаточность (стенокардия непосредственно ишемия миокарда 2. Сердечная недостаточность 3. Аритмии сердца (в т.ч. внезапная сердечная смерть, которая трактуется как смерть, наступившая от электрической нестабильности миокарда (фибрилляция желудочков сердца), если инфаркт миокарда не подтвержден патологоанатомически) и инфаркт) – Исходы и осложнения ишемии сердца Коронарная недостаточность – форма патологии сердца, характеризующаяся несоответствием между притоком кислорода и субстратов метаболизма к миокарду по коронарным артериям и потребностью в них. Различают два вида КН: транзиторная (обратимая) и необратимая. Обратимые нарушения коронарного кровотока проявляется в зависимости от продолжительности периода ишемии в следующих формах: 7 • Стабильная стенокардия – длительность ишемии миокарда до 30 минут. Характеризуется в типичных случаях сильной сжимающей болью в области грудины слева, боль часто иррадиирует в область левой лопатки и левого плеча, продолжительность болевого приступа 5-15 минут. • Нестабильная стенокардия – длительность 30-60 минут • Состояние после реперфузии миокарда в остром периоде инфаркта миокарда. Может развиться, если продолжительность ишемии составляла 60-120 минут или более. При этом повторные, хотя и кратковременные приступы стенокардии нередко обусловливают развитие диффузного кардиосклероза, поскольку могут сопровождаться гибелью меньшего или большего количества клеток миокарда. Помимо этого, гипоксия является стимулятором функции фибробластов. Необратимое значительное уменьшение коронарного кровотока в каком-либо участке миокарда завершается, как правило, его гибелью – инфарктом. Если инфаркт не приводит к смерти, то погибший участок сердца замещается соединительной тканью – очаговый кардиосклероз. Этиология коронарной недостаточности. Выделяют 4 группы причин, приводящих к коронарной недостаточности. 1. причины, снижающие кровоснабжение миокарда. Коронарный атеросклероз. У 92% пациентов со стенокардией выявляется сужение коронарных артерий более чем на 50%. Уменьшение просвета сосудов вдвое снижает коронарный кровоток при нагрузке, а на 80% проявляется и в покое. Атеросклеротические изменения могут вызывать ишемию миокарда по следующим причинам: вопервых, сами атеросклеротические бляшки суживают просвет коронарных сосудов и мешают нормальному поступлению крови к сердечной мышце; во-вторых, в условиях атеросклероза легче образуются тромбы; в третьих, атеросклеротические бляшки могут изъязвляться и частицы их, превращаясь в эмболы, закупоривают венечные сосуды; в-четвертых, при атеросклерозе резко повышается чувствительность коронарных сосудов к спастическим влияниям, а измененный эндотелий вырабатывает больше вазоконстрикторных веществ (эндотелины, тромбоксан), нежели вазодилататорных (NO, простациклин). Внутрикоронарный тромбоз. Выявляется более чем в 90% случаев трансмурального инфаркта миокарда. К коронарному тромбозу в свою очередь, в основном приводят в основном события, происходящие на стенке сосуда (воспаление, атеросклероз, травма и 8 т.д.). Спазм коронарных сосудов обусловлен локальным повышением тонуса сосудистой стенки. Наиболее частой причиной спазма является тромбоксан А2, выделяемый тромбоцитами, количество которых при атеросклерозе в области бляшки повышено. Также спазму сосудов способствует нарушение обмена кальция и магния в сосудистой стенке, избыток эндотелинов, норадреналина и адреналина (в норме через β-адренорецепторы расширяют коронарные артерии, при значительном избытке через αадренорецепторы приводят к спазму). 2. причины, повышающие потребность миокарда в кислороде. Неадекватные физические нагрузки, артериальные гипертензии, тахикардия, тахиаритмии, тиреотоксикоз, инфекционные заболевания 3. сочетание 1 и 2. Может быть связано с повышением активности САС, поскольку КА оказывают положительный ино- и хронотропный эффект, снижают КПД энергопродуцирующих процессов, т.е. разобщают окисление и фосфорилирование, укорачивают диастолу, усиливают агрегацию форменных элементов крови → ухудшают кровоток. 4. снижение содержания кислорода и питательных веществ в крови. Гипоксия, гипогликемия. Патогенез коронарной недостаточности. На фоне относительной либо абсолютной ишемии сердца наблюдаются торможение тканевого дыхания с активацией анаэробного гликолиза, торможение окисления ЖК (в нормальных условиях они более чем на 70% обеспечивают энергетические потребности миокарда). Недостаток АТФ сопровождается нарушением деятельности АТФ-аз – натрий-калиевой, кальциевой и актин-миозиновой. В результате кардиомиоциты теряют калий, накапливаются кальций и натрий, снижается сократительная способность сердца. Накопление в цитоплазме натрия и воды приводит к набуханию органелл кардиомиоцитов. Избыток кальция сопровождается активацией липаз, фосфолипаз, ферментов перекисного окисления липидов. Все это приводит к дестабилизации лизосом, повреждению мембран и ферментов кардиомиоцитов, снижению синтеза АТФ и, что выражается в виде повреждения и/или гибели кардиомиоцитов. Протеолитические ферменты, освобождающиеся из разрушенных клеток, могут повреждать соседние клетки, что сопровождается увеличением зоны некроза. Повреждение и последующая деструкция кардиомиоцитов 9 приводит к нарушению основных свойств и функций миокарда – сокращения, автоматизма, проводимости и возбудимости. Ранее считалось, что ишемическое повреждение миокарда приводит либо к полному восстановлению структуры и функции миокарда, либо к его некрозу – инфаркту. Но иногда ишемические атаки могут приводить к длительной сократительной дисфункции без развития некроза миокарда. Таким образом сформировалось представление об «оглушенном» и «спящем» миокарде. В «оглушенном» миокарде ишемические изменения хотя и обратимы, но восстановление сократительной способности миокарда происходит очень медленно – от нескольких часов до нескольких недель. «Спящий» миокард отличается хронической сократительной дисфункцией, которая может длиться от нескольких недель до месяцев. Образно говоря, это своеобразный анабиоз, в результате которого за счет уменьшения сократимости достигается более экономный режим работы сердца. Обнаружение таких жизнеспособных зон в миокарде с помощью специальных методов поможет решить вопрос о необходимости хирургического восстановления кровотока в сердце – после развития некроза данное вмешательство будет запоздалым и излишним. Факторы повреждения сердца на раннем этапе постишемического возобновления кровотока. Другое название – реперфузионный коронарный синдром. Постишемическое возобновление венечного кровотока может быть обусловлено: • прекращением коронарного спазма • устранением агрегата форменных элементов (спонтанно или под влиянием медикаментов) • хирургической реваскуляризацией ранее ишемизированной зоны (аортокоронарное шунтирование, стентирование, баллонная ангиопластика) • возобновлением кровотока после временного выключения коронарного кровотока (операции на «сухом сердце») Самостоятельное возобновление кровотока в ранее ишемизированной зоне сердца, как правило, сопровождается полным восстановлением его структуры и функции, но такая ситуация обычно ассоциирована с кратковременной ишемией (10-20 минут). Принудительное возобновление тока крови (реперфузия) после длительной ишемии является самым эффективным способом устранения ее неблагоприятных последствий, поскольку ускоряет восстановление сократительной функции сердца и значительно увеличивает выживаемость больных инфарктом миокарда. 10 Время является критической детерминантой успеха любого режима фибринолитической терапии. У пациентов, получающих лечение в пределах 1 ч от начала боли в грудной клетке, смертность снижается примерно на 50%. В то же время, польза фибринолитической терапии, проведенной через 12 ч или позже после начала симптомов, очень незначительная или ее вообще нет. Проведение фибринолитической терапии на каждый час раньше позволяет уменьшить показатель смертности примерно на 1 %, что трансформируется в спасение дополнительных 10 жизней на 1000 пролеченных пациентов. Вместе с тем, начальный этап постокклюзионной реперфузии коронарных сосудов и миокарда в редких случаях сопровождается существенными расстройствами функции сердца: развитием аритмий, включая фибрилляцию желудочков, что чревато смертью пациента; преходящей дестабилизацией показателей центрального и органно-тканевого кровообращения, дисбалансом биохимических и электрофизиологических параметров сердца. Таким образом, реперфузия после длительного прекращения кровотока (1-4 часа) может ускорить повреждение миокарда. Это обусловлено следующими факторами: 1. повреждение митохондрий вследствие их осмотического разрыва (накопление Na, Са и воды при перфузии) → нарушение механизмов синтеза, транспорта и утилизации энергии, также связано с нарушением проницаемости мембран кардиомиоцитов. 2. повреждение липидов мембран вследствие усиления ПОЛ 3. преобладание холинергических влияний на сердце, что связано с истощением запасов катехоламинов Сердечная недостаточность – форма патологии сердечной деятельности, при которой нагрузка, падающая на сердце, превышает его способности совершать адекватную потребностям организма работу. Нагрузку на сердце определяют 2 основных фактора: • величина объема крови, притекающей к сердцу – преднагрузка • сопротивление изгнанию крови из сердца – постнагрузка Этиология. Можно выделить 2 группы факторов, обусловливающих развитие сердечной недостаточности: 1. оказывают прямое повреждающее действие на миокард. • физические. Травма миокарда, сдавление сердца экссудатом, опухолью, электроток и т.д. • химические, в том числе биохимические. Высокие концентрации БАВ (адреналин, тироксин), лекарства-разобщители окисления и 11 фосфорилирования, симпатомиметики, блокаторы транспорта электронов в дыхательной цепи. • биологические – инфекции, паразиты, токсины. • недостаток или отсутствие факторов, необходимых для деятельности сердца – ферменты, витамины, субстраты метаболизма, кислород 2. обусловливают функциональную перегрузку сердца. Это проявляется либо в увеличении количества притекающей к сердцу крови, либо в повышении сопротивления, которое оказывается при изгнании крови из сердечных полостей в аорту и легочную артерию: • в результате изменений в самом сердце (пороки клапанов, уменьшение массы сократительного миокарда в результате кардиосклероза или инфаркта), • в сосудистом русле (артериальная гипертензия, артериовенозные шунты), в системе крови (гиперволемия, полицитемия), • в нейрогуморальной регуляции сердечной деятельности (чрезмерная активация симпатоадреналовой системы, тиреотоксикоз) Как правило, СН является результатом действия патогенных факторов обеих групп. Основные подходы к классификации сердечной недостаточности По патогенезу: • в результате повреждения миокарда (миокардиальная) • вследствие функциональной перегрузки сердца (перегрузочная) • смешанная форма. По первичности механизма развития • Первичная (кардиогенная). Развивается в результате нарушения функции сердца при нормальной величине притока венозной крови к нему. Наиболее часто наблюдается при ИБС (может сопровождаться инфарктом миокарда, кардиосклерозом, дистрофией миокарда), миокардитах (например, при воспалительных поражениях мышцы сердца или выраженных и длительных эндотоксинемиях), кардиомиопатиях. • Вторичная (некардиогенная). Возникает вследствие первичного преимущественного уменьшения венозного притока к сердцу при нормальной величине сократительной функции миокарда. Наиболее часто встречается при острой массивной кровопотере, эпизодах пароксизмальной тахикардии (что приводит к снижению сердечного 12 выброса и возврату венозной крови к сердцу), диастолической дисфункции миокарда, коллапсе. По скорости развития: острая и хроническая. По локализации: лево-, правожелудочковая, тотальная По преимущественной недостаточности фазы сердечного цикла: • Систолическая сердечная недостаточность. При ней нарушается насосная (нагнетающая) функция сердца, что приводит к уменьшению сердечного выброса. К потере сократимости приводит повреждение миокарда и развитие фиброза. В результате снижается ударный объем сердца, но растет конечный систолический объем сердца. Поскольку к увеличенному систолическому объему сердца добавляется притекающая по венозным сосудам кровь, то и диастолический объем сердца тоже растет. Поскольку эластичность миокарда нормальна, то, благодаря его растяжению, внутрижелудочковое давление обычно уменьшается. • Диастолическая сердечная недостаточность — нарушение расслабления и наполнения левого желудочка. Обусловлена его гипертрофией, фиброзом или инфильтрацией, сдавлением сердца экссудатом. В результате нарушения податливости миокарда снижается наполнение желудочков кровью, что вызывает снижение сердечного выброса. Невозможность растяжения и расслабления миокарда приводит к увеличению внутрисердечного диастолического давления на фоне низкого конечного диастолического объема. Патогенез СН. Миокардиальная СН характеризуется снижением развиваемого сердцем напряжения, что проявляется быстрым падением силы и скорости его сокращения и расслабления. Перегрузочная СН формируется на фоне более или менее длительного периода его гиперфункции, что, в конце концов, также приводит к снижению силы и скорости сокращения и расслабления сердца. В обоих случаях снижение сократительной функции сердца сопровождается включением экстра- и интракардиальных механизмов компенсации этого сдвига: • механизм Франка-Старлинга (гетерометрический механизм) – увеличение силы сокращения в ответ на растяжение миокарда, т.е. обусловлен изменением длины сердечной мышцы. Включается при повышении преднагрузки. Данный механизм обусловлен 13 • • • • • эластическими свойствами миокарда и не сопровождается усилением расхода АТФ. увеличение силы сокращения при неизменной длине волокон миокарда и повышенном напряжении сердца (гомеометрический механизм). Включается при повышении постнагрузки и сопровождается повышением расхода АТФ. увеличение ЧСС в результате повышения давления в полых венах и правом предсердии (рефлекс Бейнбриджа) усиление симпатических влияний на сердце – при снижении сердечного выброса реагируют баро- и волюморецепторы дуги аорты, увеличивается сила и скорость сердечного сокращения. Наблюдается увеличение концентрации ионов кальция в клетках, опосредованное через β-адренорецепторы, что и служит основой увеличения силы сокращения сердца. активация ренин-ангиотензин-альдостероновой системы. Обусловлена снижением почечного кровотока вследствие снижения ударного объема сердца и спазмом почечных сосудов под действием катехоламинов. Позволяет поддерживать системное артериальное давление и увеличивает ОЦК, а, следовательно, и ударный объем сердца. наиболее продолжительным механизмом компенсации является гипертрофия миокарда. Активируется генетический аппарат кардиомиоцитов, ускоряется синтез нуклеиновых кислот и белков миокарда, что приводит к гипертрофии. Биологическое значение компенсаторной гипертрофии заключается в том, что интенсивность функционирования структур гипертрофированного миокарда снижается до величин, близких к нормальным. Изменения геометрии сердца при гипертрофии получили название ремоделирование миокарда. Сначала развивается концентрическая гипертрофия миокарда с усилением сокращения миокарда при нарушении диастолы. Дальнейшее ремоделирование сердца заключается в том, что происходит постепенная атрофия миокарда, развивается дилатация полостей сердца, снижается сократимость миокарда – то есть наступает декомпенсация и появляются клинические признаки сердечной недостаточности, такие как отеки, цианоз, одышка и т.д. 14 Механизмы декомпенсации при сердечной недостаточности. Все компенсаторные реакции, направленные на поддержание нормального кровотока в организме, при их значительном усилении начинают оказывать дезадаптивное действие. • Избыточная и длительная активация симпатоадреналовой системы ведет к потреблению большого количества кислорода сердцем, то есть способствует развитию его ишемии. В то же время снижается сосудистое обеспечение миокарда в результате отставания роста артериол и капилляров от увеличения размеров и массы мышечных клеток – развивается относительная коронарная недостаточность. Катехоламины индуцируют некроз и апоптоз кардиомиоцитов, развитие кардиосклероза. В гипертрофированном миокарде изменяется соотношение между субпопуляциями адренорецепторов – повышается количество α1-рецепторов и снижается количество β1и β2-рецепторов. При этом концентрация кальция в клетках сердца снижается и уменьшается сила его сокращения. • РААС. Усиливает активность симпато-адреналовой системы. Ангиотензин-II, как и катехоламины, способствует ремоделированию миокарда, вызывая сначала гипертрофию сердца, а потом апоптоз кардиомиоцитов и дилатацию полостей. Альдостерон является индуктором провоспалительных цитокинов, которые также усиливают повреждение сердца. Альдостерон считается одним из основных индукторов развития фиброза сердца. • Цитокины. У больных с сердечной недостаточностью в крови повышается содержание ИЛ-1,6,8,10, γ-интерферона, ФНО-α. Суммарные эффекты их активации заключаются в увеличении образования активных форм кислорода и повреждении миокарда. Системное действие цитокинов на организм может приводить к синдрому «сердечной кахексии» - по аналогии с раковой. Непрерывная компенсаторная гиперфункция и вызванная ею гипертрофия сердца ведет к нарушению сбалансированности роста его различных структур. Последнее проявляется следующими сдвигами: - нарушение регуляции работы гипертрофированного сердца в связи с отставанием роста нервных окончаний от увеличения массы кардиомиоцитов. - появляются дефекты функциональных соединений между кардиомиоцитами вследствие снижения синтеза специфических белков коннексинов. Этот механизм составляет основу дилатации полостей сердца, 15 а также сопровождается нарушениями передачи потенциала действия между кардиомиоцитами. - степень увеличения массы клеток миокарда больше, чем степень увеличения их поверхности. А ведь именно через сарколемму происходит транспорт катионов и субстратов метаболизма. Указанные изменения обусловливают развитие ионного дисбаланса, нарушение метаболизма кардиомиоцитов и регуляции их функции. - снижение энергообеспечения клеток миокарда в результате уменьшения массы митохондрий по сравнению с массой миофибрилл, а также в связи с недостатком кислорода и недостаточными обменными процессами. - понижение показателей сократительной функции сердца в связи с увеличением соотношения между легкими и тяжелыми цепями головок миозина, являющихся носителями АТФ-азной активности. - развитие интерстициального фиброза миокарда сопровождается появлением пролиферирующих клеток – миофибробластов, активно синтезирующих коллаген, избыток которого обусловливает выраженную диастолическую дисфункцию Этот комплекс изменений в конечном счете обусловливает падение силы сердечных сокращений и скорости контрактильного процесса. Основные звенья патогенеза СН на конечных этапах ее развития Несмотря на различие причин и своеобразие начальных звеньев патогенеза СН, ее конечные патофизиологические механизмы на клеточном и молекулярном уровнях едины. Среди них главные: - нарушение энергообеспечения миокарда - повреждение мембран и ферментов кардиомиоцитов - ионный дисбаланс - расстройства нейрогуморальной регуляции сердечной деятельности нарушение энергообеспечения миокарда развивается вследствие: - снижения продукции АТФ за счет подавления аэробного окисления углеводов - повреждения систем транспорта энергии в кардиомиоцитах в связи с понижением в клетках миокарда креатинфосфата - повреждение механизмов утилизации энергии в клетках миокарда, главным образом, за счет снижения активности АТФ-аз миозина, К-Naзависимой АТФ-азы. В результате энергия АТФ не используется эффективно аппаратом клеток миокарда. 16 Повреждение мембранного аппарата, 3 основных механизма: - внедрение липидов в клетки мембран. Обусловливается высокой способностью проникать и фиксироваться в биомембранах т.н. амфифильных липидов (жирные кислоты, лизофосфатиды, фосфолипиды). Они высвобождаются из липидных компонентов кардиомиоцитов под влиянием причин, вызывающих СН, а также могут захватываться клетками миокарда из плазмы крови, кроме того, внутриклеточное накопление амфифилов т.е. следствием увеличения содержания в них ацил-КоА (в норме окисляется в митохондриях). Накопление в клетках миокарда большого количества амфифилов сопровождается образованием в них мицелл. Включение мицелл в мембраны ведет к разрыву их двойного липидного слоя. - разрушение гидролазами. Высвобождение и активация гидролаз лизосом, в том числе липаз и протеаз, наблюдается уже в начальном периоде развития СН. Выход ферментов лизосом в саркоплазму кардиомиоцитов является результатом повышения проницаемости их мембран. Попавшие в гиалоплазму энзимы активируются том и гидролизуют белково-липидные комплексы мембран. - разрушение свободными радикалами и продуктами ПОЛ мембранных липидов, белков. Один из основных механизмов СН. Активация ПОЛ в ткани сердца является следствием: накопления продуктов гидролиза АТФ, увеличением содержания субстратов ПОЛ – жирных кислот, уменьшением содержания и активности антиоксидантов. Нарушение ионного баланса. Возникает вследствие изменения проницаемости мембран кардиомиоцитов, а также активности ферментов катионного транспорта. В итоге меняется соотношение ионов во внутри- и внеклеточном пространстве. В наибольшей степени это относится к ионам К, Na, Ca, Mg, т.е. к ионам, в основн6ом определяющим реализацию таких процессов как возбуждение, сокращение, расслабление миокарда. СН характеризуется снижением активности К-Na-АТФ-азы и накоплением в кардиомиоцитах ионов Na и потерей К. Увеличение концентрации ионов Na внутри клеток обусловливает задержку в миоплазме ионов Са, что в свою очередь приводит к нарушению расслабления миофибрилл, разобщению свободного и фосфорилирующего окисления→ ↓ содержания АТФ, активации Са-зависимых протеаз и липаз. Расстройство механизмов нейро-рефлекторной регуляции. В значительной степени определяет прогрессирующее течение СН. Характеризуется уменьшением концентрации нейромедиатора симпатической нервной системы норадреналина в ткани сердца. Это 17 обусловлено, главным образом, двумя факторами: снижением его синтеза в нейронах СНС (причина - ↓ активности тирозингидроксилазы) и нарушением захвата НА нервными окончаниями из синаптической щели (следствие дефицита АТФ, ацидоза, повреждения мембран нервных окончаний симпатических нейронов). Аритмии – это нарушения функции сердца, которые проявляются изменениями частоты и регулярности сердечных сокращений, а также сменой водителя ритма и нарушением нормальной последовательности возбуждения и сокращения отделов сердца. Классификация аритмий. I. Аритмии вследствие нарушения автоматизма 1. Номотопные: а) синусовая тахикардия б) синусовая брадикардия в) синусовая аритмия 2. Гетеротопные: а) предсердный ритм б) атриовентрикулярный ритм • с одновременным возбуждением предсердий и желудочков • с предшествующим возбуждением предсердий • с предшествующим возбуждением желудочков в) желудочковый ритм г) миграция водителя ритма II. Аритмии вследствие нарушения функции проводимости 1. по проявлению: • замедление и блокада проведения возбуждения • ускорение проведения возбуждения 2. по продолжительности: • временные • постоянные 3. по локализации: • синоатриальные • межпредсердные • атриовентрикулярные • внутрижелудочковые III. Аритмии вследствие нарушения функции возбудимости 1. экстрасистолия 18 • наджелудочковые (суправентрикулярные) и желудочковые (вентрикулярные) • единичные и парные • связанные с ритмом (аллоритмии) – экстрасистолы сочетаются в определенной последовательности с ритмом. бигемения (экстрасистола после каждого нормального сокращения) тригемения (после 2х синусовых сокращений) квадригемения (после3х синусовых сокращений) • Редкие (менее 30 в час), частые (> 30 в час.) • Мономорфные, полиморфные. 2. пароксизмальные тахикардии • наджелудочковые (предсердные, атриовентрикулярные) • желудочковые 3. трепетание • предсердий • желудочков 4. мерцание • предсердий • желудочков Как можно понять из приведенной выше классификации, развитие аритмий сердца может быть обусловлено нарушениями 3 основных функций сердца – автоматизма, проводимости и возбудимости. Автоматизмом у человека обладают атипичные кардиомиоциты, или клетки-пейсмекеры, которые объединяются в проводящую систему сердца (см. рис. 1). Иногда в результате дефектов развития формируются дополнительные проводящие пути, не встречающиеся в норме (пучок Кента, пучок Джеймса на рисунке), которые могут стать причиной нарушений ритма сердца. Синусовый и атриовентрикулярный узлы имеют обильную вегетативную иннервацию, поэтому изменения их функции (автоматизма и проводимости) зачастую связаны с изменением тонуса симпатической и парасимпатической нервных систем. Нарушения проводимости и возбудимости нижележащих отделов проводящей системы сердца обычно обусловлены гуморальными влияниями либо прямым повреждающим действием на клетки проводящей системы. 19 Рис. 1 Проводящая система сердца I Аритмии вследствие нарушения функции автоматизма Номотопные аритмии. Это нарушения автоматизма, которые характеризуются изменением частоты и регулярности деятельности синусового узла. Локализация водителя ритма при этом не изменяется. Синусовая тахикардия – увеличение частоты сердечных сокращений выше нормы при генерации импульсов синусовым узлом (нормальная частота сердечных сокращений: в первые 10 лет – 90-100; 10-15 лет – 80-90; до 60 лет- 64-74; старше 60 лет – 50-60 в минуту. Этиология и патогенез: • Эмоциональный стресс, физическая нагрузка, неврозы, страх, эндокринные заболевания (феохромоцитома, тиреотоксикоз, климакс) Механизм: усиление симпатических влияний на сердце. 20 • Повреждение центральных нервных образований (подкорковых ядер, ретикулярной формации, ядер продолговатого мозга), проводящих путей, парасимпатических ганглиев и нервных стволов, а также снижение холинореактивных свойств миокарда. Механизм: ослабление парасимпатических влияний на сердце. • Прямое действие на клетки синусового узла факторов физической, химической, биологической природы (гипоксемия, ацидоз, повышенная температура, интоксикация, инфекция) при миокардитах, перикардитах, механической травме, кардиосклерозе; никотин, алкоголь, кофеин, наперстянка. Механизм: прямое воздействие на элементы проводящей системы. Проявления на ЭКГ: • Зубец Р синусового происхождения • Укорочение интервалов R-R • Форма комплексов QRS не изменена Рис. 2 Синусовая тахикардия. ЧСС 140-150 в секунду. Синусовая брадикардия – замедление сердечной деятельности ниже 60 ударов в минуту с правильным ритмом (как правило, между 40 и 60 в мин). Этиология и патогенез • Раздражение ядер блуждающего нерва (повышение внутричерепного давления при менингитах, энцефалитах, опухолях, сотрясении головного мозга, мозговых кровоизлияний) или его окончаний; повышение внутрижелудочкового давления и тонуса миокарда – рефлекс Бецольда-Яриша, надавливание на глазные яблоки – рефлекс Ашнера-Даньини, надавливание в зоне проекции бифуркации сонной артерии – рефлекс Геринга; солнечного сплетения; ваго-вагальные рефлексы при почечных, желчных, желудочных и кишечных коликах. Механизм: активация влияния на сердце парасимпатической нервной системы. • Повреждение мозговых структур, например гипоталамуса; проводящих путей, нервных ганглиев и окончаний симпатической нервной 21 системы, снижение адренореактивных свойств миокарда при глубокой гипоксии, ишемии миокарда, особенно с последующей реперфузией. Механизм: снижение симпатоадреналовых воздействий на сердце. • Непосредственное воздействие повреждающих факторов физического, химического или биологического генеза на клетки синусового узла (механическая травма, кровоизлияние, инфаркт в зоне синусового узла, токсины, лекарства: хинин, препараты наперстянки, сердечные гликозиды, хинидин, морфий, метаболиты: билирубин, желчные кислоты). Механизм: прямое воздействие на синусовый узел. Проявления на ЭКГ: • Зубец Р синусового происхождения • Увеличение продолжительности интервала R-R • Форма комплексов QRS не изменена Рис. 3 Синусовая брадикардия, ЧСС 55 в минуту. Синусовая аритмия. Характеризуется изменением регулярности генерации импульсов в синусовом узле. Этиология и патогенез: • Нарушение соотношения симпатоадреналовых и парасимпатических воздействий на миокард • Колебания содержания в крови газов (СО2, О2), метаболитов (лактата, пирувата, желчных кислот), лекарственных препаратов (наперстянки, опиатов, холинолитиков, симпатолитиков и симпатомиметиков), которые замедляют или учащают сердечную деятельность • Действие агентов механического, физического и биологического характера непосредственно на клетки синусового узла (травма, кровоизлияние) • Изменение холино- и адренореактивных свойств сердца Проявления на ЭКГ: • Зубец Р синусовый, неправильный ритм с разницей между длиной самого большого и самого короткого интервала R-R > 0,16 с и 22 больше (более точный критерий – разница между интервалами R-R более 15%). Рис. 4 Синусовая аритмия. Гетеротопные аритмии. Это нарушения автоматизма, которые характеризуются неспособностью истинного водителя ритма генерировать импульсы либо нарушением проведения их в нижележащие участки проводящей системы. Этиология и патогенез. • Отказ или слабость синусового узла. • Полная синоатриальная блокада. • АВ-блокада II – III степени • Фибрилляция предсердий. При невозможности поддерживать нормальный синусовый ритм, его функцию на себя берут другие элементы проводящей системы, обладающие меньшей способностью к автоматизму. Эти ритмы еще называют замещающими. Предсердный медленный ритм. Обычно водитель в левом предсердии. На ЭКГ: • отрицательный зубец Р во 2,3, АVF, V6 (при нижнепредсердном ритме) Рис. 5 Предсердный ритм. Атриовентрикулярный ритм (узловой). Водитель ритма находится в АВ –узле. ЧСС 40-60 в мин. Возможны следующие варианты: А) с одновременным возбуждением предсердий и желудочков, т.е. импульсы возбуждают предсердия и желудочки одновременно. На ЭКГ: 23 • Зубец Р отсутствует • Комплекс QRS не изменен Рис. 6 Атриовентрикулярный ритм с одновременным возбуждением предсердий и желудочков Б) с предшествующим возбуждением предсердий На ЭКГ: • Отрицательный зубец Р перед QRS; Рис. 7 Атриовентрикулярный ритм с предшествующим возбуждением предсердий В) с предшествующим возбуждением желудочков На ЭКГ: • Отрицательный зубец Р после QRS Идиовентрикулярный (желудочковый) ритм носит замещающий характер, при подавлении активности центров первого и второго порядка. Преимущественно импульсы генерируются в пучке Гиса, верхней части межжелудочковой перегородки, в одной из его ножек или их разветвлениях (ритм ножек пучка Гиса) и реже в волокнах сети Пуркинье. На ЭКГ: • Частота ритма 30-40 уд. В минуту • Зубец Р отсутствует • Комплекс QRS уширен, деформирован, дискордантен с зубцом Т Рис. 8 Желудочковый ритм 24 Миграция водителя ритма – перемещение от цикла к циклу пейсмекера из синусового узла в нижележащие отделы сердца (преимущественно в АВ-узел) и обратно. Является результатом периодических изменений интенсивности вагусных влияний на функцию синусного узла. Повышенный тонус вагуса угнетает синусовый узел и центр возбуждения перемещается вниз к атриовентикулярному узлу. При нормальном тонусе блуждающего нерва снова активируется синусовый узел, и центр возбуждения опять возвращается на старое место. На ЭКГ: • Изменение формы и амплитуды зубца Р: в 1 цикле – нормальный зубец Р, во 2 – амплитуда его меньше, в 3 – зубец Р отсутствует, в 4 – отрицательный зубец Р и далее снова нормальный Рис. 9 Миграция водителя ритма. II Аритмии в результате нарушения функции проводимости Замедление и блокада проведения импульсов Этиология и патогенез • Повышение парасимпатических влияний на сердце и/или его холинореактивных свойств (периферическое или центральное раздражение n. Vagus), в первую очередь влияет на синоатриальную и атриовентрикулярную проводимость. • Непосредственное повреждение клеток проводящей системы сердца органическими, химическими и биологическими факторами (травмы, опухоли, соединительнотканные рубцы – у пожилых чаще, перерастяжение сердечной мышцы; интоксикация алкоголем, никотином, наперстянкой, хинидином, блокаторами βадренорецепторов; бактериальные яды при дифтерии, скарлатине, брюшном тифе, вирусной инфекции; нарушение трансмембранного распределения ионов (гиперкалиемия) • Болезнь Ленегра – склеро-дегенеративное поражение обеих ножек пучка Гиса без поражения миокарда и сосудов. Болезнь Леви – склеро-дегенеративное поражение межжелудочковой перегородки. Проведение импульсов нарушается в 2 случаях: либо импульс достигает кардиомиоцитов когда они находятся в состоянии 25 рефрактерности, либо участок ткани теряет способность проводить электрический импульс (при кардиосклерозе). В основе патогенеза блокад лежат следующие механизмы: • Удлинение рефрактерного периода • Декрементное (затухающее) проведение импульса. Рис. 10 Схема декрементного проведения импульса по миокарду. Прохождение импульса между двумя возбудимыми участками, разделенными небольшой зоной высокого сопротивления, сопровождается резким замедлением проводимости в дистальном участке волокна. Такие факторы, как ограниченная ишемия миокарда, местная высокая концентрация ионов К+, локальное сдавление или охлаждение и другие воздействия могут вызвать невозбудимость (т.е. длительный рефрактерный период) в сердечном волокне (волокне Пуркинье) и тем самым способствовать торможению передачи импульса через невозбудимую зону на близлежащие участки. Синоатриальная блокада – нарушение проведения импульса от синусового узла на предсердия. На ЭКГ: • Периодическое выпадение комплексов PQRST. Степень блокады определяется соотношением числа импульсов к числу проведенных импульсов = 4:3, 3:2, 5:4. При полной блокаде или частом выпадении сердечных сокращений происходит смена водителя ритма. 26 Рис. 11 Синоатриальная блокада. Межпредсердная блокада. Нарушение проведения возбуждения по предсердному пути Бахмана. При замедлении проведения импульса деполяризация левого предсердия происходит с отставанием, что и видно на ЭКГ как две отдельные волны – зубец Р становится двугорбым. При полной блокаде левое предсердие возбуждается импульсами из АВ-соединения, которые идут ретроградно, что приводит к появлению отрицательной фазы зубца Р. На ЭКГ: • зубец Р > 0,11 с. Может быть двухгорбым или двухфазным Рис. 12 Межпредсердная блокада. Виден двугорбый зубец Р Атриовентрикулярная блокада – замедление проведения возбуждения от предсердия к желудочкам либо полное прекращение предсердно-желудочковой проводимости I степени – предсердно-желудочковая проводимость замедлена, на ЭКГ – удлинение PQ >0,2 с. Зубец Т Зубец Р Рис. 13 АВ-блокада I степени. Длительность интервала PQ около 0,55 с 27 II степени – предсердно-желудочковая проводимость замедлена, некоторые импульсы полностью блокируются – происходит выпадение части желудочковых комплексов на ЭКГ. Первый тип – тип Венкебаха или Мобитц - I На ЭКГ: постепенное удлинение PQ с последующим выпадением желудочкового комплекса (периоды Венкебаха-Самойлова, через 5-7 ударов). Второй тип – блокада Мобитц – II. На ЭКГ: выпадение желудочковых комплексов при постоянном интервале PQ (регулярное или нерегулярной выпадение QRS). Рис. 14 АВ-блокада 2 степени, тип Мобитц-II Третий тип – выпадение каждого второго или двух и более подряд желудочковых комплексов. Длительное отсутствие сокращений желудочков проявляется в виде синдрома Морганьи-Адамса-Стокса (отсутствие пульса, сердечных тонов, потеря сознания). III степени – полная поперечная АВ-блокада: сокращения предсердий в своем темпе (синусовый ритм), желудочков – в своем. Ни один синусовый импульс не доходит до желудочков. На ЭКГ: • Интервалы Р-Р равны между собой, короче интервалов R-R Зубец Р Рис. 14 Полная поперечная АВ-блокада. Частота сокращений предсердий – 67 в минуту, желудочков – 30 в минуту. 28 Внутрижелудочковые блокады – замедление или прекращение проведения импульсов по одной, двум или трем ветвям пучка Гиса. На ЭКГ: уширение QRS >0,1 с., дискордантность ведущего зубца комплекса QRS и Т Рис. 15.1 Блокада правой ножки п. Рис. 15.2 Блокада левой ножки п. Гиса. Уширение комплексов QRS, Гиса. Уширение комплексов QRS, в отведениях V1 отведениях V5 и V2 в и V6 раздвоен/зазубрен зубец R, в V5 и раздвоен/зазубрен зубец R, в V1 и V6 – S. V2 – S. Ускорение проведения возбуждения. Синонимы: синдромы предэкзитации или ускоренного проведения. Ускорение проведения возбуждения связано с врожденным дефектом развития проводящей системы сердца – наличием дополнительных путей проведения импульсов. Полагают, что при данном синдроме по дополнительному пути импульсы распределяются и приходят в желудочек быстрее, чем по основному пути, не задерживаясь в АВ-соединении. При этом происходит преждевременная активация части желудочка. Остальная часть возбуждается поздним импульсом, проходящим через АВ-узел. Имеются 3 основных дополнительных пути (см. рис. 1): 1 путь – Паладина-Кента (основа синдрома Вольфа-Паркинсона-Уайта, WPW-синдром) – представляет видоизмененную миокардиальную ткань, локализованную в зоне АВ-кольца справа и слева и проводящие импульсы 29 из предсердия в желудочек. Этих пучков может быть два: левый (в митральном кольце) и правый (в трикуспидальном клапане) 2 путь – Махайма – состоит из двух волокон проводящей системы, соединяющий верхнюю часть пучка Гиса с желудочками. 3 путь – пучок Джеймса – представлен проводящей тканью, соединяющей предсердие с дистальной частью АВ-узла или пучком Гиса. На ЭКГ: PQ – укорочен (меньше 0,12 с.), QRS – уширен, деформирован положительной или отрицательной дельта-волной. Рис. 16 ЭКГ при WPW-синдроме. В большинстве отведений на восходящем колене зубца R видна деформация – ∆-волна. Наличие дельтаволны объясняется преждевременным возбуждением части желудочка в месте окончания дополнительного пути. Наличие 2 путей проведения, функционирующих с разной скоростью, создает возможность для формирования аритмий по механизму re-entry (см. рис. 18) – суправентрикулярных тахикардий, экстрасистолии, мерцания и трепетания предсердий. Ш Аритмии в результате нарушения возбудимости сердечной ткани. Возбудимость – способность сердечной ткани генерировать потенциал действия под влиянием раздражения. Этим свойствам обладают и кардиомиоциты, и клетки проводящей системы. Возбудимость кардиомиоцитов меняется в отдельные периоды сердечного цикла. Во время систолы они не возбуждаются: рефрактерны к раздражению; во время 30 диастолы возбудимость клеток восстанавливается. Даже в норме существуют два коротких интервала сердечного цикла, когда возбудимость миокарда повышена – так называемый “уязвимый” период и период “сверхнормальной” возбудимости. Уязвимый период находится в терминальной части фазы реполяризации. В этот период величина порогового потенциала снижена, а возбудимость повышена: даже сравнительно слабые электрические сигналы могут вызвать возбуждение и аритмию. Этот период совпадает с пиком волны Т на ЭКГ (фаза 3 потенциала действия) Сверхнормальный период в возбудимости следует непосредственно после фазы реполяризации, в начале диастолы и совпадает с волной U на ЭКГ. В этот период даже надпороговые импульсы могут вызвать потенциал действия. Аритмии, возникающие в результате нарушения возбудимости, называются условно ”активными”, ибо они возникают в результате появления “нового” водителя ритма (эктопического) с повышенной возбудимостью, генерирующего импульсы с частотой, превышающий синусовый ритм (отличие от “пассивных”, медленных замещающих аритмий). Также развитие аритмии возможно в результате сочетания нарушения возбудимости и проводимости сердечной ткани. Этиопатогенез аритмий вследствие нарушения возбудимости. Причины: • Заболевания сердечно-сосудистой системы, особенно ИБС • Нарушения электролитного баланса • Гипоксия • Интоксикация, в том числе профессиональные • Травмы головного мозга, сердца • Диагностические процедуры • Висцеро-висцеральные рефлексы с больных органов (при холецистите, почечно-каменной болезни). Патогенез. Выделяют два основных электрофизиологических механизма развития аритмии: Гетеротопного автоматизма. Механизм гетеротопного автоматизма, т. Е. появления очагов повышенной возбудимости обусловлен: • осцилляцией трансмембранного потенциала • местным электротоком повреждения. Этот вид нарушения образования импульса связан с появлением дополнительных осцилляций (колебаний) мембранного потенциала, 31 возникающих либо во время фазы реполяризации (фазы 2 и 3) основного ПД (“ранние” постдеполяризации), либо сразу после завершения ПД, т.е. в фазу 4 исходного ПД (“поздние” постдеполяризации). К основным причинам появления добавочных осцилляций мембранного потенциала относятся все факторы, ведущие к накоплению в сердечной клетке ионов Са2+. Ранние постдеполяризации возникают во время фазы 2 и 3 ПД, т.е. еще до завершения процесса реполяризации. Они образуются обычно при выполнении двух условий: • при значительном замедлении процесса реполяризации (на ЭКГ при этом фиксируется удлиненный интервал Q–Т); • при урежении основного ритма. Токи ранней реполяризации чаще возникают при врожденном или приобретенном синдроме удлиненного интервала Q–Т или при снижении внутриклеточной концентрации ионов К+. Поздние (задержанные) постдеполяризации образуются после завершения реполяризации основного ПД, т.е. во время фазы 4 ПД. Они возникают, как правило, при избыточном влиянии на сердце катехоламинов, при ишемии миокарда и дигиталисной интоксикации. В отличие от ранних постдеполяризаций, возникающих, как правило, на фоне брадикардии, поздние деполяризации провоцируются учащением сердечных сокращений, например, у больных ИБС на фоне физической нагрузки. Рис. 17 а – ранние постдеполяризации, б – поздние. 32 Если амплитуда этих колебаний потенциала достигает порога возбуждения, происходит образование нового преждевременного ПД, который в свою очередь может инициировать следующие преждевременные ПД и т.д. Re-entry: повторного входа возбуждения. Этим термином обозначают явление, при котором импульс, совершающий движение по замкнутому пути (петле, кругу, кольцу), возвращается к месту своего возникновения и повторяет движение (см. рис.18). На данной схеме показана циркуляция импульса на уровне концевых ветвлений волокон Пуркинье (т.н. micro-re-entry). В норме (рис. 18, А) две волны возбуждения встречаются в кардиомиоците и взаимно гасят друг друга. При наличии нарушений проводимости создаются условия для реализации механизма циркуляции импульса, которые заключаются в следующем: • необходимо наличие односторонней блокады проведения импульса – то есть импульс имеет возможность только ретроградного проведения, это возможно при нарушении процессов реполяризации и удлинении периода рефрактерности • проведение импульса в ретроградном направлении должно быть замедлено. Аналогичное явление может наблюдаться при циркуляции импульса на уровне более крупных элементов проводящей системы – например, при наличии дополнительных проводящих путей (рис.19) Длительная циркуляция импульсов лежит в основе формирования пароксизмальных тахикардий, трепетания и мерцания. 33 Достигнув точки «х», импульс следует по волокнам Пуркинье (α и β) к кардиомиоциту При блокаде волокна β импульс распространяется по волокну α, достигает блока в точке «y» и проводится ретроградно до точки «х». При нормальной скорости проведения по волокну β импульс застает волокно α в рефрактерном состоянии и блокируется При замедленном ретроградном проведении волокно α уже вышло из состояния рефрактерности и, таким образом, круг замыкается Рис. 18 Схема формирования циркуляции возбуждения импульса на примере micro-re-entry 34 Синусовый узел АВ- узел Пучок Кента Рис. 19 Macro-re-entry при функционировании пучка Кента (WPWсиндром). Виды аритмий вследствие нарушения возбудимости. Экстрасистола – внеочередной, преждевременный импульс, вызывающий сокращение всего сердца или его отделов. Единичные экстрасистолы обычно бессимптомны и не приводят к нарушениям гемодинамики. Экстрасистолы нарушают правильность синусового ритма не только потому, что они возникают преждевременно, но и благодаря формированию после них более или менее продолжительных пауз. Длина постэкстрасистолической (постэктопической) паузы зависит от того, вызывает ли экстрасистола разрядку основного водителя ритма — СА узла. Если экстрасистолический очаг находится в одном из желудочков сердца, то вызванное им возбуждение, двигаясь по проводящей системе сердца в ретроградном направлении, обычно достигает атриовентрикулярного соединения, что сопровождается развитием его рефрактерности. Последнее в большинстве случаев делает невозможным прохождение очередного импульса из синусно-предсердного узла в желудочки, в связи с чем 35 очередное сокращение желудочков выпадает и возникает удлиненная по сравнению с основным ритмом диастолическая пауза, которую называют постэкстрасистолической или компенсаторной. При желудочковых экстрасистолах интервал между пре- и постэкстрасистолическим сокращениями сердца обычно равен времени двух нормальных сердечных циклов; такую компенсаторную паузу называют полной (рис. 21). Экстрасистолы, возникающие в предсердиях или в зоне предсердножелудочкового соединения, в отличие от желудочковых экстрасистол распространяются ретроградно по предсердиям и «разряжают» синуснопредсердный узел. Следующий нормальный импульс генерируется в синусовом узле через время, равное интервалам между предсердными зубцами основного ритма. Вследствие этого компенсаторная пауза после предсердных и атриовентрикулярных экстрасистол короче, чем после желудочковых (неполная компенсаторная пауза) (рис. 20). Единичные экстрасистолы обычно бессимптомны и не приводят к нарушениям гемодинамики. Различают: Наджелудочковые экстрасистолы – предсердные и атриовентрикулярные. На ЭКГ: • Преждевременное появление P и QRS • Эктопический P (чаще отрицательный), может деформироваться и наслаиваться на зубец Т предыдущего комплекса • QRS не изменен • Неполная компенсаторная пауза Рис. 20 Наджелудочковая экстрасистола. Во II отведении виден отрицательный зубец Р перед комплексом QRS. Желудочковые экстрасистолы. На ЭКГ: • Преждевременный QRS – уширен, деформирован • Зубца Р нет • Дискордантность Т и ведущего зубца желудочкового комплекса • Полная компенсаторная пауза. 36 Рис. 21 Желудочковая экстрасистола. Таблица 1 ЭКГ-признаки желудочковых экстрасистол различного происхождения. зубец в Ведущий отведениях V5 V6 S, (Т вверх) Источник импульсации Левый желудочек Ведущий зубец отведениях V1 V2 R, (Т вниз) Правый желудочек S, (Т вверх) R, (Т вниз) Апикальная S, (Т вверх) S, (Т вверх) Базальная R, (Т вниз) R, (Т вниз) в Пароксизмальная тахикардия. Внезапно начинающийся и внезапно заканчивающийся приступ учащения импульсации правильного типа, исходящий из эктопического очага. О пароксизме говорят, когда число эктопических импульсов больше 3-5, а их частота 160-220 в мин. Суправентрикулярная пароксизмальная тахикардия. На ЭКГ: • Интервалы R-R равны между собой • Единый зубец Р + Т (иногда не виден) • Желудочковый комплекс не изменен Рис. 22 Наджелудочковая пароксизмальная тахикардия 37 Желудочковая пароксизмальная тахикардия: На ЭКГ: • Учащение ритма 150-240 в минуту • Отсутствие зубца Р • Деформация и уширение комплекса QRS, зубец Т дискордантен • Интервалы R-R равны между собой Рис. 23 Желудочковая пароксизмальная тахикардия. Зарегистрирован момент восстановления синусового ритма. При пароксизмальных тахикардиях происходит снижение минутного объема сердца – диастола укорачивается и уменьшается заполнение полостей сердца кровью. Как правило, приступ пароксизмальной тахикардии сопровождается артериальной гипотензией, головокружением или потерей сознания, иногда – приступом стенокардии. Трепетание – очень частая, но регулярная деятельность предсердий (220-380 в мин) и желудочков (160-300 в мин.) Мерцание – нерегулярная, беспорядочная электрическая активность предсердий или желудочков. Трепетание и мерцание предсердий. При трепетании предсердий чаще всего цепь возбуждения по механизму re-entry формируется в правом предсердии, т.е. ритм сердца с синусового меняется на предсердный. Но при такой высокой частоте предсердной импульсации большая часть волн возбуждения застает АВ-узел в рефрактерном периоде, поэтому частота сокращения предсердий в 3-4 раза выше, чем частота сокращений желудочков. Трепетание и мерцание связывают с формированием множественных очагов re-entry (рис. 24). 38 Рис. 24 Схема сложного многокольцевого re-entry в зоне инфаркта миокарда На ЭКГ: • Частые предсердные волны F в виде «зубцов пилы» перед комплексом QRS • Интервалы R-R чаще (но не всегда) равны между собой • Желудочковые комплексы не изменены Рис. 25 Трепетание предсердий При мерцании предсердий в миокарде предсердий возникает множество мелких очагов возбуждения, генерирующих импульсы со скоростью 600-800 в минуту. Полноценного сокращения предсердий при этом не происходит, кровь в предсердиях застаивается, что повышает риск тромбообразования и тромбоэмболии в большом круге кровообращения. Частота сокращений желудочков обычно выше чем в норме – 140-160 в минуту, что может сопровождаться уменьшением сердечного выброса. На ЭКГ: • отсутствие зубца Р, вместо него – мелкие волны f или прямая. • комплексы QRS регистрируются через различные промежутки времени, не изменены 39 Рис. 26 Мерцание предсердий (мерцательная аритмия). Трепетание и мерцание желудочков. При трепетании желудочков происходит очень частое регулярное сокращение желудочков – с частотой 250-300 в минуту. На ЭКГ – правильная синусоидальная кривая. Рис. 27 Трепетание желудочков Мерцание желудочков. В миокарде желудочков возникает множество мелких очагов возбуждения, генерирующих импульсы со скоростью 300-400 в минуту. Ввиду несогласованности их работы сокращения желудочков не происходит. На ЭКГ – недифференцированная кривая Рис. 28 Крупно- и мелковолновое мерцание желудочков. Клинически трепетание и мерцание желудочков равнозначны остановке сердца. IV Смешанное нарушение свойств миокарда Неполная атриовентрикулярная диссоциация (диссоциация с интерференцией) – одновременная, несогласованная работа двух центров ритма: как правило, номотопного (синусового) и гетеротопного (чаще атриовентрикулярного). При этом предсердия и желудочки сокращаются независимо друг от друга под влиянием двух различных очагов возбуждения. Эта аритмия является результатом сочетания нарушений автоматизма, проводимости и возбудимости. Для возникновения этого нарушения необходимо: 40 • два водителя ритма • более частая генерация импульсов в водителях ритма второго и третьего порядка – т.е. наличие синусовой брадикардии в сочетании с атриовентрикулярной или желудочковой тахикардией • отсутствие возможности ретроградного проведения импульсов из желудочков предсердия • невозможность распространения синусовой импульсации на желудочки – наличие АВ-блокады На ЭКГ: • зубцы Р положительны, независимы от комплексов QRS (диссоциация). • частота узлового либо желудочкового ритма немного выше синусового, • периодически регистрируются нормальные синусовые импульсы (на нижеприведенной ЭКГ это третий и последний комплекс – интерференция). Рис. 29 Диссоциация с интерференцией 41 Вопросы для самоконтроля усвоения материала. 1. Как проявляются нарушения автоматизма сердца? 2. Какие можно выделить группы аритмий вследствие нарушения функции автоматизма? 3. Какие нарушения ритма относятся к номотопным аритмиям? 4. Какие нарушения ритма относятся к гетеротопным аритмиям? 5. Назовите ведущие механизмы развития синусовой тахикардии. 6. Назовите причины возникновения гетеротопных аритмий вследствие нарушения функции автоматизма. 7. Назовите виды нарушений проведения импульсов в сердце. 8. Какие проявления на ЭКГ характерны для атриовентрикулярной блокады: I степени? II степени? III степени? 9. Каковы проявления синдрома WPW на ЭКГ? 10. Назовите виды аритмий вследствие нарушения возбудимости сердца. 11. Каковы основные причины аритмий вследствие нарушения функции возбудимости сердца? 12. Каковы основные электрофизиологические механизмы аритмий вследствие нарушения возбудимости сердца? 13. Назовите основные ЭКГ- признаки желудочковых экстрасистол. 14. Назовите основные ЭКГ- признаки мерцательной аритмии. Эталоны ответов. 1. Изменением частоты и регулярности сокращений сердца. 2. Гетеротопные и номотопные аритмии. 3. Синусовая тахикардия, синусовая брадикардия, синусовая аритмия. 4. Предсердный, атриовентрикулярный, желудочковый ритм, мигрирующий водитель ритма. 5. Активация влияний симпатической нервной системы на сердце; снижение парасимпатических влияний на сердце; прямое воздействие этиологических факторов на сердце. 6. Отказ синусового узла, резкая брадикардия или брадиаритмия; синоаурикулярная и полная атриовентрикулярная блокада; фибрилляция предсердий. 7. По характеру нарушения: замедление; блокада; ускорение. По продолжительности: временное; постоянное. По локализации: синоаурикулярное; внутрипредсердное; атриовентрикулярное; внутрижелудочковое. 8. Удлинение интервала РQ для блокады 1 степени; периодическое выпадение желудочковых комплексов – блокада II степени; 42 предсердия сокращаются в своем темпе, желудочки в своем, более медленном, зубец Р может следовать за желудочковым комплексом, его опережать, совпадать с ним – блокада III степени 9. Укорочение интервала РQ, дельта-волна на восходящем колене комплекса QRS. 10. Экстрасистола, экстрасистолия; пароксизмальная тахикардия; трепетание предсердий и желудочков; фибрилляция (мерцание) предсердий и желудочков. 11. Заболевания сердечно-сосудистой системы, особенно ИБС; нарушения электролитного баланса; интоксикации, в том числе профессиональные; гипоксия; травмы головного мозга, сердца; диагностические процедуры; патологические рефлексы с пораженных органов. 12. а) механизм повторного входа возбуждения (re-entry); б) гетеротопного автоматизма. 13. Преждевременный комплекс QRST; QRS уширен, деформирован; зубца Р нет; дискордантность Т и ST, полная компенсаторная пауза. 14. Зубец Р отсутствует, вместо него волны f, нерегулярные, разной амплитуды и формы, RR неодинаковые. Примеры тестовых заданий к разделу «Коронарная и сердечная недостаточность» Выберите один или несколько правильных ответов: 1. К ФАКТОРАМ, СНИЖАЮЩИМ КОРОНАРНЫЙ КРОВОТОК, ОТНОСЯТСЯ: 1) артериальная гипертензия 2) атеросклероз венечных артерий 3) коронароспазм 4) дыхательная недостаточность 5) аортальный стеноз 2. К ФАКТОРАМ, ПОВЫШАЮЩИМ ПОТРЕБНОСТЬ СЕРДЦА В КИСЛОРОДЕ, ОТНОСЯТСЯ: 1) стресс 2) гипертиреоз 3) атеросклероз коронарных артерий 4) гипотиреоз 5) гипертрофия миокарда 3. ПРИ СТАБИЛЬНОЙ СТЕНОКАРДИИ НАБЛЮДАЕТСЯ: 1) обратимое повреждение кардиомиоцитов 2) необратимое повреждение кардиомиоцитов 43 4. К ОБРАТИМЫМ ФОРМАМ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ ОТНОСЯТСЯ: 1) стабильная стенокардия 2) нестабильная стенокардия 3) инфаркт миокарда 4) синдром реперфузии миокарда 5. ПРОДОЛЖИТЕЛЬНОСТЬ ИШЕМИИ МИОКАРДА ПРИ СТАБИЛЬНОЙ СТЕНОКАРДИИ СОСТАВЛЯЕТ: 1) 5-7 минут 2) 40-60 минут 3) до 30 минут 6. ОСНОВНЫЕ ЗВЕНЬЯ ПАТОГЕНЕЗА КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ ВКЛЮЧАЮТ: 1) торможение тканевого дыхания 2) развитие гипергликемии 3) нарушение работы ионных насосов 4) недостаточная функция актин-миозиновой АТФ-азы 5) гипертрофия миокарда Примеры тестовых заданий к разделу «Аритмии». Выберите один или несколько правильных ответов. 1. НАРУШЕНИЯ АВТОМАТИЗМА СЕРДЦА МОГУТ ПРОЯВЛЯТЬСЯ В ВИДЕ: 1) изменение частоты сердечных сокращений 2) появление очагов повышенной возбудимости в миокарде 3) смена водителя ритма 4) выпадение комплексов QRS 2. ПРИЧИНАМИ СИНУСОВОЙ ТАХИКАРДИИ МОГУТ БЫТЬ: 1) эмоциональный стресс 2) физическая нагрузка 3) повышение артериального давления 4) повышение активности блуждающего нерва 5) лихорадка 6) ишемия миокарда 3. ПРЕДСЕРДНЫЙ МЕДЛЕННЫЙ РИТМ МОЖЕТ НАБЛЮДАТЬСЯ: 1) у людей без патологии сердца, например при нейроциркуляторной дистонии 2) только при заболеваниях сердца 4. МИГРИРУЮЩИЙ ВОДИТЕЛЬ РИТМА – ЭТО: 44 1) одновременная несогласованная работа двух водителей ритма 2) смена водителя ритма с синусового на другой 3) перемещение пейсмекера от цикла к циклу из синусового узла в нижележащие отделы и обратно 5. ДЛЯ ВОЗНИКНОВЕНИЯ ИНТЕРФЕРЕНЦИИ С ДИССОЦИАЦИЕЙ НЕОБХОДИМО: 1) два водителя ритма 2) более частая генерация импульсов в водителях ритма второго и третьего порядка – т.е. наличие синусовой брадикардии в сочетании с атриовентрикулярной или желудочковой тахикардией 3) отсутствие возможности ретроградного проведения импульсов из желудочков предсердия 4) учащение импульсации в синусовом узле 6. ПРИЧИНАМИ ЗАМЕДЛЕНИЯ И БЛОКАДЫ ПРОВЕДЕНИЯ ИМПУЛЬСОВ МОГУТ ЯВЛЯТЬСЯ: 1) повышение парасимпатических влияний на сердце или его холинореактивных свойств 2) повышение температуры тела 3) болезнь Ленегра 4) инфаркт в область пучка Гиса 7. ВО ВРЕМЯ «УЯЗВИМОГО» ПЕРИОДА СЕРДЕЧНОГО ЦИКЛА ВЕЛИЧИНА ПОРОГОВОГО ПОТЕНЦИАЛА КАРДИОМИОЦИТОВ: 1) снижена 2) повышена 8. ВЫДЕЛЯЮТ СЛЕДУЮЩИЕ РАЗНОВИДНОСТИ ПАРОКСИЗМАЛЬНЫХ ТАХИКАРДИЙ: 1) синусовая 2) наджелудочковая 3) желудочковая 4) внутрижелудочковая 9. К НАРУШЕНИЯМ ПРОВОДИМОСТИ ОТНОСЯТСЯ: 1) замедление проведения возбуждения 2) миграция водителя ритма 3) синусовая тахикардия 4) ускорение проведения возбуждения 5) блокады 6) экстрасистолы 10. В ОСНОВЕ ФОРМИРОВАНИЯ МЕХАНИЗМА RE-ENTRY ЛЕЖИТ СЛЕДУЮЩИЙ МЕХАНИЗМ: 45 1) декрементное проведение импульса 2) осцилляции трансмембранного потенциала 3) наличие односторонней блокады проведения импульса с возможностью ретроградного его проведения 11. В ОСНОВЕ ПОЯВЛЕНИЯ ОЧАГОВ ГЕТЕРОТОПНОГО АВТОМАТИЗМА ЛЕЖАТ СЛЕДУЮЩИЕ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ФЕНОМЕНЫ: 1) декрементное проведение импульса 2) осцилляции трансмембранного потенциала 3) наличие односторонней блокады проведения импульса с возможностью ретроградного его проведения 4) местный электроток повреждения 12. ДЛЯ АТРИОВЕНТРИКУЛЯРНЫХ ЭКСТРАСИСТОЛ ХАРАКТЕРНО: 1) преждевременное появление комплекса QRS 2) комплекс QRS не изменен 3) комплекс QRS уширен, деформирован 4) полная компенсаторная пауза 5) неполная компенсаторная пауза 6) отрицательный зубец Р перед или после комплекса QRS либо его отсутствие 13. НОМОТОПНЫЕ НАРУШЕНИЯ РИТМА ОТНОСЯТСЯ К АРИТМИЯМ ВСЛЕДСТВИЕ НАРУШЕНИЯ: 1) автоматизма 2) проводимости 3) возбудимости 14. МОЖЕТ ЛИ ОТКАЗ СИНУСОВОГО УЗЛА СТАТЬ ПРИЧИНОЙ ПОЯВЛЕНИЯ ГЕТЕРОТОПНЫХ АРИТМИЙ: 1) да 2) нет 15. ПРИ ИДИОВЕНТРИКУЛЯРНОМ РИТМЕ ИМПУЛЬСЫ МОГУТ ГЕНЕРИРОВАТЬСЯ В: 1) в синусовом узле 2) в атриовентрикулярном узле 3) в пучке Гиса 4) в ножках пучка Гиса 5) в волокнах Пуркинье 16. АТРИОВЕНТРИКУЛЯРНАЯ БЛОКАДА II СТЕПЕНИ ПРОЯВЛЯЕТСЯ В ВИДЕ: 1) удлинение интервала Р-Р 46 2) постепенное удлинение интервала PQ c последующим выпадением желудочкового комплекса 3) выпадение желудочковых комплекса при постоянном интервале PQ 4) самостоятельные сокращения предсердий и желудочков 17. ДЛЯ ЖЕЛУДОЧКОВЫХ ЭКСТРАСИСТОЛ ХАРАКТЕРНЫ СЛЕДУЮЩИЕ ПРИЗНАКИ: 1) преждевременное появление комплекса QRS 2) комплекс QRS не изменен 3) комплекс QRS уширен, деформирован 4) полная компенсаторная пауза 5) неполная компенсаторная пауза 6) отрицательный зубец Р перед или после комплекса QRS либо его отсутствие 18. В ОСНОВЕ РАЗВИТИЯ БЛОКАД СЕРДЦА МОГУТ ЛЕЖАТЬ СЛЕДУЮЩИЕ МЕХАНИЗМЫ: 1) удлинение рефрактерного периода 2) декрементное проведение импульса 3) гетеротопный автоматизм 19. ДЛЯ МЕРЦАНИЯ ПРЕДСЕРДИЙ ХАРАКТЕРНО: 1) ЧСС 400-500 в минуту 2) недифференцированная кривая на ЭКГ 3) зубец Р отсутствует 4) между комплексами QRS нерегулярные волны разной амплитуды и формы 5) интервалы между комплексами QRS разные 20. ЧАСТОТА АТРИОВЕНТРИКУЛЯРНОГО РИТМА СОСТАВЛЯЕТ: 1) 40-60 уд/мин 2) 60-80 уд/мин 3) 100-110 уд/мин 47 Учебное издание Гузовская Евгения Владимировна Непомнящих Светлана Федоровна Патофизиология сердца Учебное пособие 48