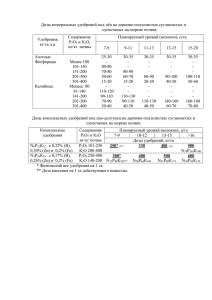
«ФОСФОР И ЕГО СОЕДИНЕНИЯ». Соединения фосфора РН3 – фосфин. Бесцветный, • Ядовитый газ, • С чесночным запахом, • Легко самовоспламеняется на воздухе. Получение: 1.Водный гидролиз фосфидов Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3 2.Кислотный гидролиз Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑ 3.Диспропорционирование фосфора в щелочах 4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ • Химические свойства PH3 1. PH3 – проявляет очень слабые основные свойства, поэтому он практически не реагирует с кислотами. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами. Например, фосфин реагирует с йодоводородной кислотой: PH3 + HI → PH4I 2. PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется: 2PH3 + 4O2 → P2O5 + 3H2O • • • • • • Р2О5 – оксид фосфора (V), или фосфорный ангидрид. Белый порошок, Без запаха, Хорошо растворяется в воде, Является кислотным оксидом Очень гигроскопичен Образует несколько кислот: Р2О5 +3 Н2О = 2Н3РО4 При нагревании Ортофосфорная, или фосфорная, кислота Р2О5 +Н2О = 2НРО3 На холоде Метафосфорная кислота. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода. 4P + 5O2 → 2P2O5 Р2О5 – применяют как осушающее или водопоглощающее средство. Многие органические вещества обугливаются при воздействии Р2О5 . При попадании на кожу может вызвать сильные ожоги. С чем кислотный оксид Р2О5 будет взаимодействовать : С основными оксидами Р2О5 + 3 СаО = Са3 (РО4)2 Со щелочами Р2О5 + 6 NаОН = 2 Nа3РО4 + 3 Н2О С водой Р2О5 + Н2О =2HPO3 С кислотой Р2О5 + H2SО4 = 2HPO3 + SО4 При взаимодействии в избытке Р2О5 со щелочами могут образовываться не только средние, но и кислые соли: Р2О5 + 4NaOH = 2Na2HPO4 + H2O Гидрофосфат натрия Р2О5 + 2NaOH + H2O = 2NaH2PO4 Дигидроосфат натрия Н3РО4 1. Получить ортофосфорную кислоту можно взаимодействием оксида фосфора (V) с водой: P2O5 + 3H2O → 2H3PO4 2.Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой: Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4 3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот. Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты: 5HNO3 + P → H3PO4 + 5NO2↑ + H2O Химические свойства ортофосфорной кислоты общие с другими кислотами Н3РО4 1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато: Н3РО4———>H+ + H2PO4– H2PO4– ———>H+ + HPO42– НРО42- ———>H+ + PO43– H3PO4 ———> H(+) + H2PO4(-) H2PO4(-) ———> H(+) + HPO₄(2-) HPO4(2-) ———> H(+) + PO4(3-) Легче всего идет диссоциация по первой ступени и труднее всего — по третьей Химические свойства ортофосфорной кислоты общие с другими кислотами 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода: 6Nа+2Н3РО4 ———>2Nа3РО4+ЗН2 3. Реагирует с основными оксидами: ЗСаО+2Н3РО4 ———>Са3(РО4)2+ЗН2О Химические свойства ортофосфорной кислоты общие с другими кислотами 4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли: Н3РО4+3NaОН ———>Nа3РО4+ЗН2О Н3РО4+2NН3———>(NН4)2НРО4 Н3РО4+NаОН ———>NаН2РО4+Н2О 5. Реагирует с солями слабых кислот: 2Н3РО4+ЗNа2СО3 ——>2Nа3РО4+ЗСО2+ЗН2О Химические свойства ортофосфорной кислоты специфические 1.При нагревании постепенно превращается в метафосфорную кислоту: 2Н3Р04 ———>Н4Р207+Н20 (двуфосфорная кислота) Н4Р2О7 ———>2НРО3+Н2О Качественная реакция на фосфат-ион РО43• • • • • Н3РО4+ЗАgNО3———> Ag3P04+3HNO3 желтый осадок РО43- + 3Ag+ = Ag3РО4 ↓ (желтый фосфат серебра) Полученный осадок растворяется в сильных кислотах. По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr 2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты. Например, фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция: Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2 Фосфат кальция растворяется под действием серной кислоты: Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4 3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями. Например, фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа: Ca3(PO4)2 + 8C → Ca3P2 + 8CO Фосфат кальция также восстанавливается алюминием при сплавлении: 3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3 4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами. Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты. Например, гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия: K2HPO4 + H3PO4 → 2KH2PO4 Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия: K2HPO4 + KOH → K3PO4 + H2O 5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами, но не реагируют с фосфорной кислотой. Например, дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата: NaH2PO4 + 2NaOH → Na3PO4 + 2H2O Соли фосфорной кислоты 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые: Фосфоритная мука - Ca3(PO4)2 Простой суперфосфат - смесь Ca(H2PO4)2 • H2O и CaSO4 Двойной суперфосфат - Ca(H2PO4)2 • 2H2O Дигидрофосфат аммония ( Аммофос) - в основном состоит из моноаммонийфосфата - NH4H2PO4 Гидрофосфат аммония – (NH4) 2HPO4 с (NH4) 2SO4 и другими примесями Костная мука - продукт переработки костей домашних животных Ca3(PO4)2 Преципитат - CaHPO4 • 2H2O Применение Закрепление Осуществите превращение согласно схеме: P →P2O5 → Mg3(PO4)2 → MgCI2 → Mg(OH)2 Осуществите превращение согласно схеме: Ca3P2 → PH3 → P2O5 → H3PO4 → Na3PO4 Установите соответствие между реагирующими веществами и ролью фосфора в окислительно-восстановительной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. РЕАГЕНТЫ РОЛЬ ФОСФОРА А) P + O2 → Б) P + Ca → В) P2O5 + K2O → 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) ни окислитель, ни восстановитель