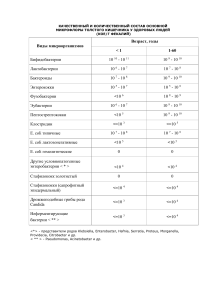
Размещено на http://www.allbest.ru/ МИНОБРНАУКИ РОССИИ Государственное бюджетное образовательное учреждение высшего профессионального образования «ПЕНЗЕНСКАЯ ГОСУДАРСТВЕННАЯ ТЕХНОЛОГИЧЕСКАЯ АКАДЕМИЯ» (ПГТА) Кафедра биотехнологии и техносферной безопасности Дисциплина «Биотехнология белка и биологически активных веществ» КУРСОВАЯ РАБОТА на тему: Технология получения ферментов на примере производства Lаспарагиназы Выполнил: студент гр. 08 БТ Захаркин Д.А. Руководитель: Черкасова Г.Н. Работа защищена с оценкой:_____________ Пенза 2012 Размещено на http://www.allbest.ru/ Содержание Введение 1. Общие понятия о ферментах 2. Классификация ферментов 3. Области применения ферментов 3.1 Амилолитические ферментные препараты 3.2 Протеолитические ферментные препараты 3.3 Пектолитические ферментные препараты 3.4 Целлюлолитические ферментные препараты 4. Продуценты ферментов, в том числе продуценты L-аспарагиназы 5. Получение штамма E. coli XLl-blue/pL-ASP-08 6. Технология культивирования продуцентов ферментов, в том числе продуцентов L-аспарагиназы 7. Технология выделения и очистки ферментных препаратов на примере производства L-аспарагиназы 8. Аппаратурное оформление технологической схемы Список литературы Размещено на http://www.allbest.ru/ Введение Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахарпод действием слюны. Однако механизм этих явлений был неизвестен. В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- иζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана. Размещено на http://www.allbest.ru/ 1. Общие понятия о ферментах Ферментами обычно называют вещества биологического происхождения, представляющие собой соединения белковой природы и являющиеся специфическими катализаторами. По своей природе ферменты являются сложными соединениями. Для большинства из них структура не является до конца установленной. Однако существование так называемой белковой "составляющей" - неотъемлемой части биологического катализатора можно считать доказанным для большинства промышленно получаемых ферментных препаратов. Практически все попытки "очистить" эти препараты от соединений белковой природы приводили к потере их каталитической активности. Все основные источники ферментов можно разделить на три основные группы: 1. Ткани животных как отход мясоперерабатывающей промышленности. Прежде всего, это богатые ферментами поджелудочная железа и слизистая оболочка желудка. 2. Некоторые растения. Например, такие гидролитические ферменты, как папаин и рицин извлекают соответственно из сока дынного дерева и инжирного дерева, из ячменя - амилазу. 3. Микроорганизмы. Выбор источника получения того или иного фермента предполагает учет ряда требований, предъявляемых к чистоте получаемого препарата, потребности в нем, стоимости сырья, проведения процессов выделения и очистки готового продукта. Из всех вышеперечисленных источников ферментов наибольшее практическое значение имеют микроорганизмы - продуценты ферментов. Их широкое использование обусловлено, прежде всего, их доступностью, возможностью организовать более эффективное промышленное производство на относительно дешевом сырье и управление, процессом Размещено на http://www.allbest.ru/ биосинтеза, используя, различные продуценты ферментных препаратов. Использование микроорганизмов значительно расширило круг получаемых ферментных препаратов с различным спектром действия. Только с их помощью удалось получить такие ферменты, как целлюлазы и глюкозоизомеразы. В качестве продуцентов ферментов, как правило, выбирают те штаммы-мутанты, полученные путем направленной селекции, которые обеспечивают максимальный выход целевого продукта при использовании стандартного оборудования. При этом штаммы-мутанты получают как традиционным путем с использованием таких широкоизвестных методов воздействия, как облучение УФ светом, γ- и рентгеновскими лучами, обработкой клеток различными химическими агентами: этилимином, диметилсуфатом, гидроксиламином, диазометаном, оксидом азота и пр., изменением температуры и величины рН, так и методами генной инженерии. Размещено на http://www.allbest.ru/ 2. Классификация ферментов По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом: КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям. Размещено на http://www.allbest.ru/ 3. Области применения ферментов Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи, с чем их применение в промышленности выгодно с экономической и экологической точек зрения. По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из нескольких тысяч известных в настоящее время ферментов наиболее широко в промышленности используются различные гидролазы, которые можно разделить на четыре основные группы ферментных препаратов. 3.1 Амилолитические ферментные препараты К этой группе препаратов относятся α- и β-амилазы и глюкоамилаза. Их используют для гидролиза крахмала и гликогена. В процессе гидролиза сначала образуются более простые полисахариды - декстрины, а в последующем - глюкоза. При этом α-амилаза гидролизует без определенного порядка α-1,4-глюкозидные связи с образованием декстринов, мальтозы и глюкозы, β-амилаза отщепляет остатки мальтозы, а глюкоамилаза - остатки глюкозы от концевых частей молекул полисахарида. Наиболее широкое применение эти препараты нашли в пищевой промышленности (производство патоки и глюкозы). 3.2 Протеолитические ферментные препараты Эта группа ферментов относится к гидролазам. Они обладают такой важной особенностью, как высокоселективное воздействие на некоторые Размещено на http://www.allbest.ru/ пептидные связи белковых молекул и пептидов. Например, пепсин способствует гидролизу пептидных связей с остатками ароматических аминокислот, трипсин катализирует гидролиз пептидной связи между остатками аминокислот аргинина и лизина. Ферментов, входящих в этот класс, очень много. Их классифицируют, в основном, по способности проявлять максимум ферментативной активности в определенной области рН раствора. Кислые протеазы проявляют максимум активности в интервале рН раствора от 1,5 до 3,0, нейтральные - 6,5-7,5, щелочные - от 8,0 и выше. Протеазы нашли свое применение в различных отраслях народного хозяйства: в пищевой и легкой промышленности (предварительная обработка свежего сырого мяса и шкур, животных в кожевенной промышленности), в химической промышленности при получении синтетических моющих средств с добавками протеолитических ферментных препаратов, в здравоохранении при лечении некоторых воспалительных процессов, ожогов, тромбозов, 3.3 Пектолитические ферментные препараты Пектолитические ферментные препараты используются для расщепления пектиновых веществ, содержащихся в стеблях растений (льна), в различных корнеплодах, фруктах. К ним относятся пектин, пектиновые кислоты и протопектин. Пектиновая кислота - это полимер галактурононой кислоты. Пектин - это полностью или частично этерифицированная метиловым спиртом пектиновая кислота. Протопектин представляет собой комплекс с целлюлозой и белковыми веществами. Строение комплекса пока полностью не установлено. Пектиновые вещества имеют молекулярную массу от 20000 до 200000. Все пектиназы делятся на две группы - гидролазы и трансэлиминазы. Первые катализируют процесс отщепления метоксильных групп (пектинэстераза) или обеспечивают разрыв α-1,4-гликозидных связей Размещено на http://www.allbest.ru/ (полигалактуроназы). расщепление Вторые пектиновых осуществляют веществ с негидролитическое образованием двойных связей (пектинтрансэлиминазы). Препараты нашли свое применение в легкой промышленности при вымачивании льна, в пищевой промышленности (осветление вин, используются при консервирование фруктовых соков). 3.4 Целлюлолитические ферментные препараты Целлюлолитические ферментные препараты обработке целлюлозы. Сама целлюлоза или клетчатка представляет собой полисахарид общей формулы (С6Н10О5)n и содержится в клеточных стенках растений. При степени полимеризации n=10 образует кристаллическую решетку. Нитевидные молекулы, взаимодействуя между собой, образуют прочные структуры - фибриллы. В объеме таких фибрилл существуют упорядоченные кристаллические участки, где молекулы расположены параллельно друг другу и связаны водородными связями, существуют также участки с неупорядоченной структурой - аморфные. Микроорганизмы способны синтезировать целый комплекс целлюлолитических ферментов, которые последовательно катализируют процесс гидролиза целлюлозы до глюкозы. В ферментном комплексе различают три группы ферментных препаратов: Ci-фактор, Сx-фермент и целлюбиазу. Целлюлолитические ферментные препараты нашли применение в целлюлозно-бумажной промышленности, медицинской промышленности (получении лекарственных веществ - стероидов из растений), в пищевой промышленности (при производстве растительных масел) и в сельском хозяйстве (в качестве добавок к кормам жвачных животных). По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоамилаза, Размещено на http://www.allbest.ru/ применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов. На коммерческий уровень поставлено ферментативное разделение рацемических смесей аминокислот и эфиров терпенов. Такие смеси образуются при химическом синтезе, и разделение их по оптическим свойствам составляющих имеет важное практическое значение. Известно, что для этого можно использовать традиционные физико-химические и химические методы избирательное (хроматография; взаимодействие механическое энантиомеров с разделение, другими оптически активными веществами), но гораздо более эффективными и удобными оказываются процессы, основанные на стереоспецифичности ферментов. Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление α - кетокислот в α - гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфатазу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных алкогольоксидазы и ферментативных каталазы формальдегиддисмутазы дрожжей бактерии реакций Hansenulla Pseudomonas с участием polimorpha putida и позволило осуществить окисление метанола в муравьиную кислоту с выходом 88- 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе (“каталитические антитела”), в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре Размещено на http://www.allbest.ru/ 100 °С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине. Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирозиназу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А. Я. Данилевским в 1886 г. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда протеолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых пептидогидролаз компонентов микроорганизмов. отходов Данная под воздействием технология, активно внедряющаяся во Франции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод. Развитие клеточной и генной инженерии было бы невозможно, если бы в распоряжении исследователей не было целого набора специфических ферментов (рестриктаз, лигаз, синтетаз, ферментов избирательно разрушающих клеточную оболочку и др.). Так, в настоящее время в продаже имеется более 300 различных рестриктаз. Ферменты широко используют в медицине, например в заместительной терапии в составе лечебных препаратов. Пероральное введение фенилаланинаммиак-лиазы снижает уровень фенилаланина в крови при фенилкетонурии. Протеолитические ферменты, амилазу и липазу применяют при заболеваниях желудочно-кишечного тракта и печени. В последние годы накопились данные об эффективности злокачественных применения новообразований. протеиназ Это в энзимотерапии объясняется большей проницаемостью мембран раковых клеток для гидролитических ферментов в сравнении с нормальными клетками, благодаря чему опухолевые клетки Размещено на http://www.allbest.ru/ быстро лизируются при введении смеси протеиназ (препарат «папайотин»). Протеолитические ферменты - плазмин и активирующие его стрептокиназу и урокиназу используют для растворения тромбов в кровеносных сосудах и разжижении гноя; коллагеназу - для рассасывания рубцовых образований; эластазу - для задержки развития атеросклероза; лизоцим - для лечения конъюнктивитов; дезоксирибонуклеазу из стрептококка (стрептодорназа) для лечения заболеваний верхних дыхательных путей и роговицы глаза. Размещено на http://www.allbest.ru/ 4. Продуценты ферментов, в том числе продуценты L-аспарагиназы Микроорганизмы способны синтезировать разнообразные ферменты. В зависимости от состава питательной среды и условий культивирования они легко переключаются с синтеза одного фермента на другой. У микроорганизмов сравнительно короткий цикл развития (10—100 ч), что позволяет получать сотни урожаев в год. Продуцентами ферментов могут быть бактерии, грибы, дрожжи и актиномицеты. Для промышленного получения ферментных препаратов используются как природные штаммы микроорганизмов, выделенные из естественных сред, так и мутантные, селекционированные воздействием на природные физических и химических мутагенов. Микроорганизмы синтезируют одновременно комплекс ферментов, но некоторые из них, особенно мутантные штаммы, продуцируют в значительных количествах лишь один фермент. Для получения амилолитических и протеолитических ферментных препаратов в промышленности наиболее часто используют различные штаммы гриба рода Aspergillus и бактерий Bacillus. У бактерий короче цикл развития, на их основе легче получать мутанты Так для получения амилаз широко применяют плесневые грибы рода Aspergillius, видов niger, orizae, usamii awamori, batatae; рода Rhizopus, видов delemar, tonkinensis, niveus, japonicum и др., а также отдельные представители Neurospora crassa и Mucor. Амилолитические ферменты синтезируют также некоторые дрожжи и дрожжеподобные грибы родов Saccharomyces, Candida, Endomycopsis и Endomyces. Многие бактерии, способны синтезировать активные амилазы: Bac. subtilis, Bac. diastaticus, Bac. mesentericus, Bac. mecerans, Вас. polymyxa и некоторые другие. Размещено на http://www.allbest.ru/ L-аспарагиназу продуцируют Е. coli и Erwinia carotovora. Фермент используют при химиотерапии некоторых форм лейкемии. L-аспарагиназа отщепляет одну аминогруппу от аспарагина, превращая его в аспарагиновую кислоту. Избирательность действия фермента определяется потребностью некоторых форм опухолевых клеток в аспарагине, тогда как нормальные клетки в аспарагине не нуждаются. В данной работе будет рассмотрен процесс получения ферментов на примере производства L-аспарагиназы с помощью штамма микроорганизма Е. coli XL1-blue/pL-ASP-08(Патент на изобретение №2397248). Новый штамм бактерий Escherichia coli XL1-blue/ pL-ASP-08 может быть использован для получения высокоочищенной генно-инженерной L-аспарагиназы, применяемой для изготовления лекарственных препаратов при лечении лимфобластных лейкозов, лимфо- и ретикулосарком в комбинированной химиотерапии. L-аспарагиназа (L-аспарагинамидогидролаза, ЕС3.5.1.1), относится к треониновым амидогидролазам, катализирует гидролитическое расщепление L-аспарагина с образованием аспарагиновой кислоты и аммиака и является одним из ключевых ферментов, осуществляющих взаимосвязь азотистого и углеродного обмена у про- и эукариотических организмов. В быстроделящихся лейкозных клетках гидролиз аспарагина, катализируемый L-аспарагиназой, приводит к нарушению биосинтеза белков и гибели опухолевых клеток, подавлению роста опухоли (Biochem. Pharmacol. 1985, 34, 559-565; Keefer JF, Moraga DA, Schuster SM et al). Таким действием обладает L-аспарагиназа из Escherichia coli, Ervinia caratovora, Ervinia chrysanthemi и некоторых других микроорганизмов Клетки штамма-продуцента проявляют устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием генов устойчивости в ДНК рекомбинантной плазмиды pL-ASP-08. Размещено на http://www.allbest.ru/ Предлагаемое изобретение обеспечивает синтез L-аспарагиназы в изоформе ЕсА2 с уровнем экспрессии не ниже 30-35% и активностью фермента 240-250 МЕ/мл культуральной жидкости. Рисунок 1 - Физическая карта рекомбинантной плазмиды pL-Asp-08. На рисунке 1 указаны уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: Xho I – 1, BamHI – 148, Hind – 1194 ori – участок инициации репликации плазмиды, lac O – гибридный промотор транскрипции, Stop codons – терминатор транскрипции рибосомного оперона E. coli, L-asparaginase – область, кодирующая L-аспарагиназу, bla – ген устойчивости к ампициллину. Размещено на http://www.allbest.ru/ 5. Получение штамма E. coli XLl-blue/pL-ASP-08 Получение штамма и проверку активности синтезируемой L- аспарагиназы проводят в три этапа. 1. Штамм E. coli XLl-blue/pL-ASP-08 получают путем введения плазмиды pL-ASP-08 в компетентные клетки Escherichia coli XL1-blue с помощью электропорации. бактериальные клетки Для исходного получения штамма компетентных Escherichia coli клеток XL1-blue (STRATAGENE: кат. номер: 200268) выращивают в 10 мл жидкой среды LB в течение ночи при 37°С и пересевают в 1 литр той же среды. Наращивание продолжают еще 2,5 часа при 37°С на качалке при интенсивной аэрации, а затем быстро охлаждают во льду. Клетки осаждают центрифугированием в течение 10 мин при 8000 об/мин при +4°С на центрифуге JA21 (Beckman, США). Осадок один раз промывают в равном объеме, т.е. в 1 л деионизированной воды. Осажденные клетки ресуспендируют 1/2 объема 10% глицерина, после осаждения клетки ресуспендируют 1/4 объема 10% глицерина и снова центрифугируют, полученный осадок ресуспендируют в 3 мл 10% глицерина, разливают в охлажденные пробирки «Эппендорф» по 40 мкл, быстро замораживают и хранят при -70°С. 2. Введение плазмиды pL-ASP-08 в компетентные клетки E. coli XL1blue проводят в стандартном режиме метода электропорации. Полученные клетки штамма Е coli XL1-blue/pL-ASP-08 вносят в 10 мл среды LB и выращивают при 37°С в течение ночи. Полученная культура клеток является инокулятом для наращивания культуры при определении продуктивности штамма E. coli XL1-blue/pL-ASP-08. 3. Для определение продуктивности штамма-продуцента L- аспарагиназы E. coli XL1-blue/pL-ASP-08 в 15 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, вносят 1% инокулята и выращивают при 37°С на качалке при 180 об/мин в течение 2 ч. Затем добавляют индуктор Размещено на http://www.allbest.ru/ изопропилтиогалактопиранозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают наращивание в тех же условиях еще 2,0 ч. Из культуральной жидкости отбирают пробу 1 мл и центрифугируют 6 мин при 12000 об/мин, после чего клетки ресуспендируют в 100 мкл деионизированной воды, добавляют 33 мкл буфера, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерина, 3% додецилсульфата натрия, 3% меркаптоэтанола и 0,01% бромфенолового синего и прогревают 10 мин при 100°С. Отбирают аликвоту (3 мкл) и анализируют электрофорезом в 12% полиакриламидном геле, содержащем 0,1% додецилсульфата натрия. Гель окрашивают Кумаси R250 и проводят цифровую обработку геля с помощью программы TotalLab. Продуктивность штамма E. coli XL1-blue/pL-ASP-08 составляет 35% фермента от суммарного клеточного белка, а содержание L-аспарагиназы в 1 мл культуральной жидкости составляет 165 мкг. Размещено на http://www.allbest.ru/ 6. Технология культивирования продуцентов ферментов, в том числе продуцентов L-аспарагиназы Технология получения ферментных препаратов микробным синтезом обязательно включает в себя стадию промышленного культивирования соответствующего микроорганизма. В условиях промышленного производства значительное количество продуцента получают одним из следующих двух способов: - культивирование на твердых питательных средах (поверхностный способ выращивания продуцента), - культивирование соответствующего продуцента в большом объеме жидкой фазы, содержащей все необходимые для нормального роста и развития микроорганизма питательные вещества (глубинный способ выращивания продуцента). Принципиальная технологическая схема процесса глубинного культивирования микроорганизмов представлена на рисунке 2. Для получения L-аспарагиназы применяется глубинный способ выращивания продуцента E. coli XL1-blue/pL-ASP-08 на жидкой питательной среде с интенсивной аэрацией. Процесс получения культуры включает приготовление посевного материала и выращивание производственной культуры E. coli XL1-blue/pLASP-08. Приготовление посевного материала. Ампулы с хранящейся E. coli XL1-blue/pL-ASP-08 поступают на завод из ВНИИПрБ. На каждой ампуле должна быть этикетка с названием культуры, датой начала хранения и подписью микробиолога. Для оживления культуры используют мясо-пептонный бульон (МПБ), который разливают в конические колбы объемом 750—1000 мл в количестве 75—100 мл. Колбы закрывают ватными пробками и стерилизуют при температуре 120° С в течение 30 мин, затем выдерживают в термостате при температуре 37±0,5°С в течение суток. Размещено на http://www.allbest.ru/ Рисунок 2 – Принципиальная технологическая схема процесса глубинного культивирования микроорганизмов. 1 – смеситель питательной среды; 2 – колонна для непрерывной стерилизации потока питательной среды острым паром; 3 - теплообменник – выдерживатель; 4 – теплообменник для охлаждения потока питательной среды; 5 – инокуляторы (посевные аппараты); 6 – индивидуальный фильтр для очистки воздуха, подаваемого в инокулятор; 7 – реактор – ферментер; 8,9 – насосы; 10 – масляный фильтр для предварительной очистки воздуха; 11 – компрессор; 12- головной фильтр для очистки воздуха В приготовленный таким образом МПБ в стерильном боксе переносят стерильно содержимое ампулы с культурой. Выращивание осуществляется в термостате при температуре 40±0,5° С в течение 40—48 ч. На поверхности бульона образуется белая складчатая пленка. Бульон должен оставаться прозрачным, однако возможно слабое хлопьевидное помутнение. Оживленная на МПБ культура может храниться при 4—6° С в течение 10 дней, при 20° С — не более 3 сут. Для проверки культуры на чистоту используют мясо-пептонный агар (МПА). Стерильный МПА разливают в стерильные чашки Петри и помещают их на сутки в термостат при температуре 37± ±0,5° С. Убедившись в стерильности МПА в чашках, его используют для работы. Размещено на http://www.allbest.ru/ Оживленную культуру петлей стерильно переносят в пробирку со стерильной дистиллированной водой, энергично встряхивают 5— 10 мин и отбирают стерильной пипеткой 0,2—0,3 мл в чашку Петри, размазывая среду стерильным шпателем по поверхности МПА. Чашки со средой выдерживают в термостате при температуре 40±0,5°С в течение 24—40 ч. На поверхности МПА должны вырасти только колонии микроорганизмов, характерные для E. coli XL1-blue/pL-ASP-08(Клетки мелкие, палочковидной формы, грамотрицательные, 1x3,5 мкм, подвижные) При росте на агаризованной среде LB колонии округлые, гладкие, полупрозрачные, блестящие, серые. Край ровный, диаметр колоний 1-3 мм, консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением, осадок легко седиментирует.). Присутствие другой микрофлоры свидетельствует о нестерильности посуды или оживленной культуры. Такую культуру нельзя использовать для производства. Колбы следует простерилизовать при температуре 127° С в течение 2 ч. Посевной материал выращивают поверхностным способом на жидких питательных средах. Посевным материалом для ферментации может служить оживленная на МПБ культура, которая прошла проверку на чистоту. Для получения посевного материала используется солодовое сусло с концентрацией СВ 8—12% и рН 7,3 (доводится 33%-ным раствором NaOH). Солодовое сусло разливают в конические колбы объемом 750—1000 мл в количестве 75—100 мл, колбы закрывают ватными пробками и стерилизуют в автоклаве при температуре 110° С, давлении 0,15 МПа в течение 30 мин. Затем колбы помещают на сутки в термостат при температуре 37±0,5° С. Выдержанное стерильное сусло должно быть прозрачным и не иметь на поверхности пленки микроорганизмов. Засев питательной среды культурой E. coli XL1-blue/pL-ASP-08 осуществляется следующим образом. В стерильном боксе оживленную культуру петлей стерильно переносят на поверхность питательной среды Размещено на http://www.allbest.ru/ (для засева достаточно 1—2 петель). Колбы с засевной средой не рекомендуется взбалтывать. Посевной материал выращивается в термостате при температуре 40±0,5°С в течение 24 или 40 ч. Культура на солодовом сусле вырастает в виде белой складчатой бархатистой пленки. Микробиологический контроль посевного материала заключается в проверке его на чистоту и на отсутствие бактериофага. Проверка посевного материала на чистоту проводится тем же способом, что и проверка оживленной культуры. Результаты проверки должны удовлетворять требованиям, предъявляемым к оживленной культуре. Проверка на отсутствие бактериофага производится следующим образом. Посевной материал петлей (1 раз) стерильно переносят в пробирку со стерильной дистиллированной водой. Пробирку энергично встряхивают в течение 5—10 мин, после чего из нее отбирают 0,2—0,3 мл среды и переносят в чашку Петри с чистой культурой E. coli XL1-blue/pL-ASP-08на МПА. Испытуемый посевной материал шпателем тщательно размазывают по всей поверхности. Инкубацию культуры осуществляют в термостате при температуре 40±0,5°С в течение 24 ч. После инкубации на чашках Петри с чистой культурой не должны выявляться фагоцитозные пятна, которые указывают на лизис бактерий бактериофагом. Посевной бактериофага, материал, используется проверенный для на засева чистоту и питательной отсутствие среды в производственном ферментаторе. До засева посевной материал желательно не взбалтывать и хранить при температуре 4-6° С. Выращивание производственной культуры. Технологический цикл состоит из следующих операций: подготовка ферментатора, приготовление и стерилизация питательной среды, стерилизация пеногасителя, стерилизация воздуха, засев питательной среды в ферментаторе, ферментация. Подготовка ферментатора к приему питательной среды производится следующим образом. После освобождения от культуральной жидкости ферментатор моют водой из шланга, осматривают снаружи и внутри. Затем Размещено на http://www.allbest.ru/ аппарат вместе с прилегающими к нему коммуникациями проверяют на герметичность воздухом при давлении 0,07 МПа с помощью мыльной пены. При полной герметизации аппарата и прилегающих коммуникаций приступают к их одновременной стерилизации. Для стерилизации ферментатора острый пар подают на аэратор, линию подачи питательной среды, спускную линию и линию передавливания посевного материала. Нагрев аппарат, закрывают вентиль на выхлопной воздушной линии и поднимают давление. Стерилизацию ведут при температуре 120—125° С, давлении 0,2 МПа в течение 1 ч. Избыточное давление сбрасывается через выхлопной вентиль. По окончании стерилизации отключают от ферментатора пеногасительный бачок и индивидуальный воздушный фильтр и охлаждают аппарат до 50—55° С. Поддерживая давление в аппарате 0,02—0,03 МПа, сливают образовавшийся конденсат и приступают к приему стерильной и охлажденной до 27° С питательной среды. Выращивание производственных культуры ферментаторах E. coli проводится XL1-blue/pL-ASP-08в на питательной среде следующего состава (в %): Кукурузная мука 6,0 Кукурузный экстракт 1,0 Дигидроортофосфат калия (диаммонийфосфат) 0,9 Мел 0,2 Подсолнечное масло (пеногаситель) 0,05 Вода 91,85 Питательная среда готовится в смесителях с мешалками. В первом смесителе соли и водорастворимые компоненты смешиваются с водой. После размешивания смесь насосом перекачивается во второй смеситель, в который задастся мука. После заваривания муки рН среды доводят раствором NaOH до 7,3 и добавляют пеногаситель. До подачи на стерилизацию питательная среда нагревается острым паром до 75—80° С. Размещено на http://www.allbest.ru/ Стерилизация питательной среды осуществляется на обычном установке непрерывной стерилизации, состоящей из контактной головки, трубчатого выдерживателя и теплообменника для охлаждения среды. Нагретая питательная среда центробежным насосом подается в греющую колонку, где она подогревается острым паром (давление 0,4—0,5 МПа) до 132—136° С, и затем в выдерживатель, где выдерживается при этой температуре в течение 25—30 мин. Из выдерживателя среда поступает в теплообменник, где охлаждается до 40—42° С. Из теплообменника питательная среда непрерывно отводится в предварительно подготовленный ферментатор. Во время приема среды в ферментаторе поддерживается давление 0,02—0,03 МПа. В случае сильного вспенивания во время загрузки или перед посевом среды в ферментатор подается стерильный пеногаситель. Объем среды должен составлять 60—65% от объема ферментатора. Если он меньше, то недостающий объем заменяют водой, которую подают в ферментатор через систему стерилизации. Для бесперебойного снабжения установки стерильным воздухом необходимо наличие двух головных фильтров. Перебивку головного фильтра проводят 1—2 раза в год. После перебивки головной фильтр стерилизуют острым паром при 130—150° С в течение 4—6ч, затем отдувают горячим воздухом с температурой 110—114° С до полного удаления влаги. Индивидуальные фильтры перезаряжают через 3—4 ферментации. В случае переброса среды в фильтр или нестернльности ферментации производится его внеочередная перебивка. Индивидуальные фильтры стерилизуют вместе с посевным аппаратом и ферментатором острым паром в течение 2 ч при давлении 0,18—0,20 МПа. Для удалении влаги из фильтров их продувают горячим воздухом. Контроль за перебросами питательной среды в фильтры ведется постоянно, для этого вентили отбора проб воздуха на фильтрах должны периодически открываться. Размещено на http://www.allbest.ru/ Необходимо систематически вести контроль за стерильностью поступающего на аэрацию воздуха. Способ проверки воздуха заключается в следующем. Колбу вместимостью 0,5—1,0 л со стерильным мясо-пептонным бульоном (100—150 мл) стерильно присоединяют к специальному пробному кранику воздуховода и начинают отбор воздуха с продуванием его через мясо-пептонный бульон. Воздух продувают 10—12 ч, при этом бульон не должен сильно пениться. По истечении этого времени плотно зажимают шланги выхода и входа воздуха, закрывают пробный краник воздуховода, отсоединяют колбу и выдерживают ее в термостате при 37±0,5˚ С в течение 48 ч. При наличии даже небольшого помутнения отмечают нестерильность воздуха. Питательная среда засевается в ферментатор через штуцер со строгим соблюдением стерильности при минимальном движении воздуха в цехе. После загрузки ферментатора через пробоотборник стерильно отбирают пробу среды на проверку ее стерильности, а затем давление в ферментаторе снижают до нуля, прекращают подачу воздуха и одновременно закрывают вентиль на выхлопной линии. Вокруг штуцера, через который осуществляется посев, зажигают факел, открывают штуцер и через зону огня вносят посевную культуру из колбы. После этого штуцер быстро закрывают, включают подачу воздуха и приоткрывают вентиль на выхлопной линии. В ферментаторе устанавливается избыточное давление 0,015—0,020 МПа. Для засева питательной среды в ферментаторе необходимо иметь 3—4 колбы с посевным материалом. Перед самым посевом содержимое колб стерильно (в боксе) сливают в одну. Процесс ферментации протекает при температуре 40— 42°С, которая поддерживается автоматически путем подачи теплой воды в рубашку аппарата. Аэрация среды стерильным воздухом и ее перемешивание мешалкой (частота вращения 200—220 мин-1) производятся непрерывно с Размещено на http://www.allbest.ru/ момента окончания посева и до конца процесса ферментации. Расход воздуха составляет 30—40 м3/ч на 1 м3 среды. Пробоотборник и нижняя сливная коммуникация должны находиться под паром, при вспенивании среды в процессе ферментации добавляется стерильный пеногаситель. Общая продолжительность ферментации составляет 30—40 ч. В процессе ферментации ведется строгий микробиологический и биохимический контроль за культурой. Для второго при соблюдении всех условий стерильности через каждые 6 ч отбирают пробы из ферментатора.. В норных двух пробах после засева определяют чистоту процесса ферментации и рН среды, который должен составлять рН 6,0-7,6. Готовая к сдаче в производство культура должна иметь следующие показатели: рН 6,8-7,6,. Обязательным условием является отсутствие посторонней микрофлоры. В случае инфицирования растущей культуры выращивание следует остановить и содержимое ферментатора стерилизовать при 0,2 МПа в течение 2 ч. Инфицированная культура подается на биологическую очистку. Количество инфицированных ферментации не должно превышать 5% от всего количества ферментации. Размещено на http://www.allbest.ru/ 7. Технология выделения и очистки ферментных препаратов на примере производства L-аспарагиназы Завершающей стадией любого микробиологического производства является выделение целевого продукта из культуральной среды и его очистка. Проведение этих стадий процесса обусловлено рядом технических сложностей, связанных, в основном, с нестабильностью (лабильностью) ферментов, потерей им активности под влиянием незначительных изменений внешних условий. Поэтому при выборе технологии выделения, концентрирования и очистки ферментных препаратов ищут решения, позволяющие проводить эти процессы в непрерывном режиме, с высокой скоростью, в "мягких" условиях и добиваться максимального обезвоживания образующихся осадков. Для уменьшения потерь продуктов применяют различные стабилизаторы ферментов, проводят процесс при оптимальном значении рН растворов, стараются обеспечить максимально возможную механизацию и автоматизацию всех процессов. L-аспарагиназа накапливается в культуральной жидкости и перед её очисткой и концентрированием необходимо отделить отделить от культуральной жидкости биомассу продуцента. Для отделения бактериальных культур применяется фильтрация – процесс пропускания культуральной жидкости через фильтрующий материал, на котором задерживается биомасса. Фильтрование бактериальных суспензий сопряжено с большими трудностями, которые обусловлены малым размером клеток, высокой вязкостью суспензий микрочастиц. Поэтому и наличием стадии большого фильтрования количества обычно примесей предшествует предварительная обработка суспензий с целью максимально возможной коагуляции клеток и примесей в более крупные и легко фильтруемые частицы. Размещено на http://www.allbest.ru/ используется L-аспарагиназа в медицине и применяется как противоопухолевое средство в терапии некоторых лейкозов. Поэтому степень его очистки должна быть очень высокой. В связи с этим для очистки и концентрирования L-аспарагиназы используется ультрафильтрация. В отличие от вакуум-выпаривания и других методов концентрирования ультрафильтрация (фильтрование через фильтры со сверхмалым размером пор) имеет ряд очевидных преимуществ, поскольку проводится в "мягких" условиях, обеспечивающих меньший процент снижения активности фермента. Кроме того, осуществляемое концентрирование сопровождается очисткой от балластных низкомолекулярных примесей и увеличением активности фермента в 100-150 раз. Однако энергозатраты оказываются рентабельными при концентрировании раствора до содержания сухих веществ не более 30%,что связано с забиванием пор мембраны белковыми молекулами и как следствие резким снижением скорости процесса. Процесс ультрафильтрации в режиме диализа позволяет получать высокоочищенные препараты. Для его осуществления в получаемый концентрат постоянно добавляют чистую воду. Такая пятикратная промывка позволяет в 250-300 раз повысить активность ферментного раствора, т.е. при концентрации раствор 30% содержит практически один белковый ферментный препарат. На практике процесс ультрафильтрации проводят в циркуляционных аппаратах периодического действия. Перед подачей раствора на стадию ультрафильтрации из него предварительно удаляют клетки продуцента и для предотвращения развития посторонней микрофлоры на поверхности мембран подвергают стерилизующей фильтрации через специальные бактериальные фильтры. В ходе проведения процесса ультрафильтрации в зависимости от свойств получаемого фермента раствор постоянно охлаждается до температуры 4-15 С. Недостатком метода ультрафильтрации следует считать забивание пор мембраны осадками или адсорбированными молекулами, что приводит к снижению производительности мембранного Размещено на http://www.allbest.ru/ аппарата во времени. Последнее требует периодического проведения промывки материала мембраны. Для предотвращения забивания пор мембраны осадками или сорбирующимися молекулами циркуляционный насос, используемый в этих установках, должен обеспечить линейную скорость потока жидкости через мембрану около 2-5 м/с. При таких скоростях наблюдается значительное гидравлическое сопротивление. Для его снижения на практике применяют две конструкции мембранных аппаратов: трубчатые мембранные аппараты и проточные с плоскими мембранными элементами, устанавливаемыми параллельно основному потоку раствора. В очищенном виде L-аспарагиназа является белым порошком, хорошо растворимым в воде. Выпускается во флаконах в лиофилизированном виде. фермент аспарагиназа препарат Размещено на http://www.allbest.ru/ 8. Аппаратурное оформление технологической схемы Основным аппаратом в производстве L-аспарагиназы является реакторферментер. Для культивирования продуцентов L-аспарагиназы используется ферментатор периодического действия с трехъярусной турбинной мешалкой объемом до 100 м3. Принцип его устройства показан на рисунке 3: Рисунок 3 - Ферментатор периодического действия (1 — турбинная трехъярусная мешалка, 2 — охлаждающий змеевик. 3 — секционная рубашка. 4 — отражательная перегородка. 5 - барботер. П-пар); I—XI — материальные и вспомогательные трубопроводы с запорно-регулирующими устройствами (I — посевная линия. I —подача стерильного сжатого воздуха. III — подача пара, IV — удаление отработанного воздуха. V — загрузочная линия, VI — линия введения добавок, VII подача пеногаситсля, VIII — подача моющего раствора. IX — пробоотборник. X -выдача продукта, XI — выдача в канализацию через нижний спуск). Размещено на http://www.allbest.ru/ Список литературы 1. Беккер М., Лиепиньш Г.К., Райпулис Е.П. Биотехнология– М.:Агропромиздат, 1990.–334с. 2. Елинов Н.П. Основы биотехнологии. – СПб.: фирма «Наука». 1995 3. Грачева И.М., Кривова А.Ю. Технология ферментных препаратов. — М.: Изд-во "Элевар", 2000 — 512 с. 4. Биотехнология. В 8 кн. / Под редакцией Н.С. Егорова, В.Д. Самуилова (том 5). — М.: Высшая школа, 1987 г. 5. Г.Н.Черкасова, Н.В.Фирсова, К.Р.Таранцева Методические указания к выполнению курсовых работ по дисциплине «Технология белковых и биологически активных веществ» – Пенза: Изд-во ПГТА, 2009 Размещено на Allbest.ru