Трилонометрия
реклама
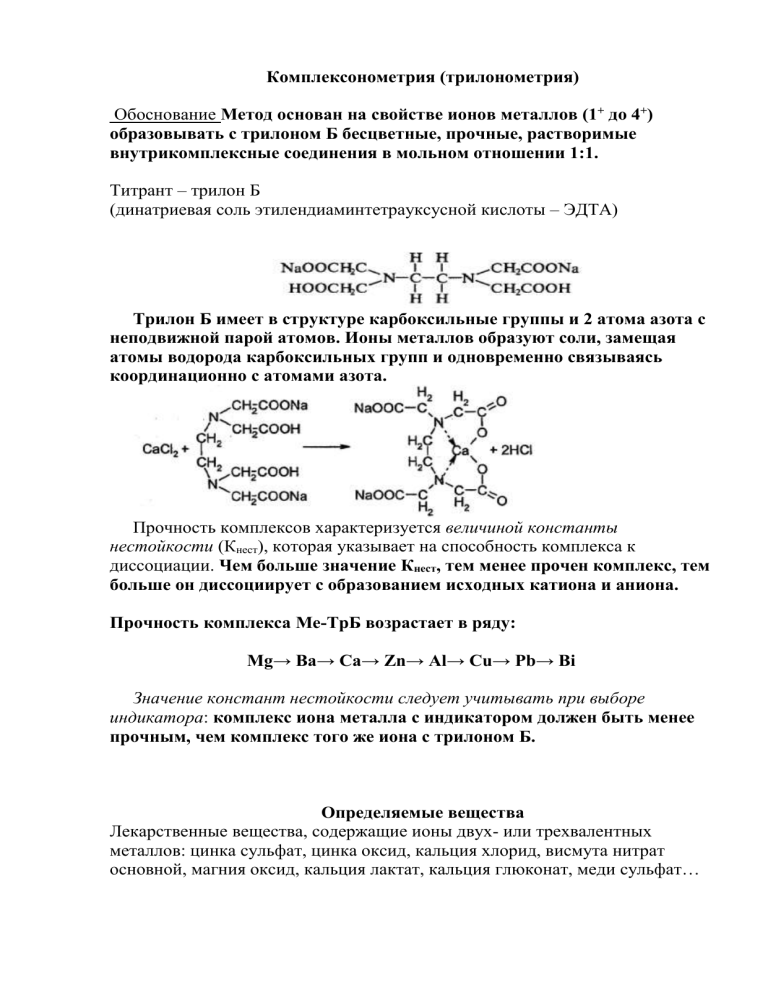
Комплексонометрия (трилонометрия) Обоснование Метод основан на свойстве ионов металлов (1+ до 4+) образовывать с трилоном Б бесцветные, прочные, растворимые внутрикомплексные соединения в мольном отношении 1:1. Титрант – трилон Б (динатриевая соль этилендиаминтетрауксусной кислоты – ЭДТА) Трилон Б имеет в структуре карбоксильные группы и 2 атома азота с неподвижной парой атомов. Ионы металлов образуют соли, замещая атомы водорода карбоксильных групп и одновременно связываясь координационно с атомами азота. Прочность комплексов характеризуется величиной константы нестойкости (Кнест), которая указывает на способность комплекса к диссоциации. Чем больше значение Кнест, тем менее прочен комплекс, тем больше он диссоциирует с образованием исходных катиона и аниона. Прочность комплекса Ме-ТрБ возрастает в ряду: Mg→ Ba→ Ca→ Zn→ Al→ Cu→ Pb→ Bi Значение констант нестойкости следует учитывать при выборе индикатора: комплекс иона металла с индикатором должен быть менее прочным, чем комплекс того же иона с трилоном Б. Определяемые вещества Лекарственные вещества, содержащие ионы двух- или трехвалентных металлов: цинка сульфат, цинка оксид, кальция хлорид, висмута нитрат основной, магния оксид, кальция лактат, кальция глюконат, меди сульфат… Реакция сопровождается выделением и накоплением ионов водорода. Связанные Н+ будут смещать реакцию в сторону образования комплекса, поэтому д.б. pH=9,5-10. Условия определения создание рН среды с помощью буферных растворов (например, аммиачного буферного раствора), растворов оснований (натрия гидроксида, аммония гидроксида, гексаметилентетрамина), кислот (например, кислоты азотной). Индикаторы – металлохромные органические красители: эриохром черный Т, хромовый темно-синий, ксиленоловый оранжевый, кальконкарбоновая кислота, пирокатехиновый фиолетовый и др. Индикация основана на свойстве ионов металлов образовывать с индикатором интенсивно окрашенные комплексы, но в другой, по сравнению с самим индикатором, цвет и по устойчивости уступающие комплексам ионов металлов с трилоном Б. 1.эриохром черный Т (кислотный хром черный специальный), Определяемые катионы Zn2+,Mg2+ (ФС) , Ca2+ . Изменение окраски при рН=9,5-10 раствора от красно-фиолетовой (комплекс) до синей (свободный индикатор) 2.Хромовый темно-синий (кислотный хром темно-синий). Определяемые катионы Ca2+ (ФС), Mg2+, Zn2+. Изменение окраски при рН=9,5-10 раствора от красной (комплекс) до сине-фиолетовой (свободный индикатор) HO OH N OH N NaO 3S Cl 3.пирокатехиновый фиолетовый. Определяемые катионы Zn2+,Bi3+ (ФС), Al3+, Pb2+ SO 3Na Изменение окраски при рН=2-3 раствора от синей (комплекс) до желтой (свободный индикатор) 4. Ксиленоловый-оранжевый. Изменение окраски при рН=2-3 раствора (красная – желтая), при рН=5-6 от красной до фиолетово-желтой. Определяемые катионы Bi3+Al3+ (ФС) Pb2+, Zn2+ 5. Кальконкарбоновая кислота. Изменение окраски при рН =12 от красновато-сиреневой до голубой. Определяемые катионы Ca2+ Zn2+ (МФ). Этапы титрования На первом этапе добавляют индикатор к р-ру, содержащему определяемый катион. Р-р должен иметь определенное значение рН, добавляют аммиачного буфера, кислоты или щелочи. Образуется хорошо растворимое в воде не устойчивое окрашенное соединение 1% металла с индикатором. На втором этапе – титруют трилоном Б, он связывает свободные ионы Ме в устойчивый комплекс, как правило бесцветный На третьем этапе – вблизи т.э. когда свободных ионов в р-ре нет, разрушается менее прочный комплекс Ме – индикатор и р-р окрашивается в цвет свободного индикатора. 1) 2) 3) Для четкого установления т.э. необходимо: 1) комплекс Ме+n – индикатор д.б. достаточно прочным, но его устойчивость д.б. в 10 раз меньше чем устойчивость комплекса Ме+n - ЭДТА. Иначе титрование будет закончено либо преждевременно, либо поздно. 2) концентрация индикатора д.б. малой, инд. должен связывать менее 1% ионов определяемого металла Ме+n 3) изменение окраски индикатора д.б. четким, контрастным, быстрым. Различают способы прямого, обратного и косвенного титрования. В большинстве случаев применяется прямое комплексонометрическое титрование. Прямым титрованием определяют растворимые в воде или кислотах лекарственные вещества, способные легко и быстро реагировать с трилоном Б. При определении оксидов металлов их предварительно растворяют в кислотах: MgO + 2НСl → MgCl2 + H2O ZnO + 2HCl → ZnCl2 + H2O Bi2O3 + 6 HNO3 → 2Bi(NO3)3 + 3 H2O Обратное титрование применяют для лекарственных веществ, нерастворимых в воде и кислотах, например бария сульфат когда образование комплекса с титрантом идет медленно во времени и при нагревании, например алюминия гидроксид, когда катионы осаждаются аммиаком аммиачного буфера. Обратный вариант основан на растворении определяемых веществ в избытке титрованного раствора трилона Б, остаток которого титруют вторым титрантом – магния сульфатом или свинца нитратом. В т.э. р-р приобретает окраску свободного индикатора. Особенности расчетов при комплексонометрическом титровании: 1) в независимости от заряда Ме+n (II или III) ЭДТА реагирует в соотношении 1:1 М.э = М.м Na2H2Tp (трилон Б) → 2Na+ + H2Tp2Mg+2 + Na2H2Tp → Na2MgTp +2H+ Аl+3 + Na2H2Tp → NaАlTp +2H+ + Na+ Кстех=1/1=1 Титрант приготовлен с учетом реальных частиц (РЧ) по ГФ ХI ОФС "Титрованные растворы" (РЧ Tpилон Б - РЧ принимаем за 1) fэкв= Кстех· (РЧ или УЧ) = Кстех· 1 М.э = fэкв · М.м = 1· М.м При расчете М.э эквивалента всегда берем М.э =М.м (кроме висмута нитрата основного) 2) титрант – динатриевая соль – двухосновной ЭДТУ кислоты. Для приготовления 1л 0,1н титрованного раствора учитывается основность кислоты и берут навеску выраженную в граммах а =0,1 • М.м (Трилона Б) : 2. Поэтому 0,1н = 0,05 М. Однако в химической реакции, лежащей в основе комплексонометрического определения, Трилон Б всегда вступает в реакцию 1 моль с 1 моль соли Меn+, т.е. основность здесь не имеет значения, поэтому при расчете титра соответствия в формулу подставляют не нормальную концентрацию в N, а молярную концентрацию (М, моль/л): Т = М.э · Ст-та= М.э · 0,05М (г/мл) 1000 1000 Расчет концентрации: С% = V · K· T · Vколбы · 100% a · Vал.пробы Висмута нитрат основной – расчет ведут по висмута оксиду (Bi2О3), при растворении его в HNO3 образуется 2 Bi(NО3)3 Bi2О3 + 6 HNO3→ 2 Bi(NО3)3+3 H2O 2 Bi3+ + 2Na2H2Tp →2NaBiTp +4H+ + 2Na+ Кстех=1/2 fэкв=1/2 ·1 М.э =1/2 · М.м = М.м/2 1) NaO 3S OH NaO 3S OH O N Zn O N N N +Zn+2→O2N O 2N Красно-фиолетовый 2) HOOC N COOK NaOOC N COOH +Zn+2+NH4OH+NH4Cl→ OOC Zn N COOK NaOOC N COO + 2H+ 3) NaO 3S O Zn HOOC O N N COOK N NaOOC O 2N NaO 3S N COOH → + OH OOC OH Zn N N COOK N NaOOC O 2N синий + N COO







![1) Для понижения концентрации [Fe ] до 10](http://s1.studylib.ru/store/data/004531731_1-c9f9271cd2d1cf918ee273e513a5f409-300x300.png)

