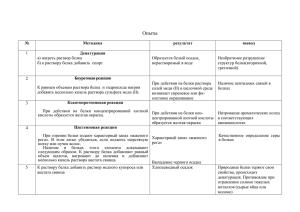
МИНИСТЕРСВО ОБРАЗОВАНИЯ И НАУКИ КЫРГЫЗСКОЙ РЕСПУБЛИКИ Кыргызский государственный технический университет им. И. Раззакова БИОХИМИЯ Лабораторный практикум для студентов пищевого направления БИШКЕК 2017 1 Рассмотрено на заседании кафедры «Технология консервирования» Прот. №13 27.04.2017 г Одобрено Методическим советом Технологического факультета Прот. №14 12.05.2017 г УДК: 637.1/3 Составили: Конкубаева Н. У., Элеманова Р. Ш. Рецензенты: к.т.н., проф. КГТУ им. И. Раззакова Джамакеева А.Дж., к.х.н. КГМА им. И. Ахунбаева Жумабаева Г. А., к.х.н. КТУ «Манас» Усубаелиева А. М. Биохимия: Лабораторный практикум для студентов пищевого направления/КГТУ им. И. Раззакова; Сост.: Конкубаева Н.У. – Б.: ИЦ «Текник», 2017 63 с. В лабораторном практикуме приведены краткие теоретические сведения и методики исследования основных классов, составляющих биологические объекты (белки, ферменты, углеводы, липиды и витамины) для студентов пищевого направления. Для студентов вузов очного и заочного обучения. Табл. 15. Библиогр.: 9 наименов. 2 СОДЕРЖАНИЕ 1. Лабораторная работа №1 Цветные реакции на белки и аминокислоты 3 2. Лабораторная работа №2 Некоторые свойства белков 12 3. Лабораторная работа №3 Способы получения ферментов и изучение их специфичности 21 4. Лабораторная работа №4 Термолабильность ферментов, влияние рН, активаторов и ингибиторов на их действие 27 5. 31 6. Лабораторная работа №5 Изучение строения и свойств углеводов по качественным реакциям Лабораторная работа №6 Роль клетчатки в жизнедеятельности и методы 7. Лабораторная работа №7 Определение показателей качества жиров 46 8. Лабораторная работа №8 Качественные реакции на витамины 54 3 39 ЛАБОРАТОРНАЯ РАБОТА №1 ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ I. ЦЕЛЬ РАБОТЫ Изучить химическое строение аминокислот и белков по их реакциям со специфическими реактивами. Студент должен знать: последовательность всех операций в анализе; причины изменения или появления окраски в исследуемых объектах; строение аминокислот и белков, специфические реакции, обусловленные их структурой; как представить результаты анализа в наиболее удобной для обсуждения форме. Студент должен уметь: приобретать навыки безопасной работы с органическими реактивами, концентрированными кислотами, нагревательными приборами; классифицировать аминокислоты и белки в зависимости от изменения окраски в специфических реакциях; обсуждать результаты и делать соответствующие выводы. II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Белки представляют собой высокомолекулярные полимеры аминокислот. Они являются важнейшей составной частью протоплазмы. Существование живой клетки, не содержащей белковых веществ, невозможно. Аминокислоты в молекуле белка соединены между собой пептидными связями (–СО–NН–). Огромное разнообразие белков в природе определяется их аминокислотным составом и порядком расположения аминокислот в полипептидной цепи. Число и последовательность аминокислотных остатков в молекуле определяют первичную структуру белка. Вторичная структура белка возникает за счет образования водородных связей между группами (N – H и O=C) данной полипептидной цепи, что приводит к упорядоченному расположению гибкой полипептидной цепи в виде спиральной и складчатой структуры. Третичная структура возникает между боковыми цепями аминокислотных остатков полипептидных цепей, к таким взаимодействиям относятся водородные связи, вандер-ваальсовы силы, дисульфидные (–S–S –) связи, ионные и т.д. В результате полипептидная цепь свертывается строго определенным образом, приобретая пространственную конфигурацию. Межмолекулярные взаимодействия между отдельными полипептидными цепями, обладающими вторичной и третичной структурой, приводят к образованию к четвертичной структуры белка. Далеко не все обладают четвертичной структурой, только те которые образованы более чем одной полипептидной цепью. Совокупность всех выше перечисленных уровней структуры белка и создает, так называемую, нативную (природную) структуру белковой молекулы. Присутствие белка в биологических объектах или растворах можно обнаружить с помощью цветных реакций. Существуют универсальные цветные реакции, которые дают все белки (биуретовая и нингидриновая) и специфические, обусловленные 4 наличием только определенных аминокислот в белках (ксантопротеиновая, Адамкевича, Вуазена, Шульце-Распайля, Паули, Сакагуши, Миллона и Фоля). Нуклеопротеиды содержат 3 – 6% фосфора, они нерастворимы в воде и в разбавленной СН3СOOH, а растворяются в разбавленных щелочах. Нуклеиновые кислоты, являющиеся простетической группой нуклеопротеидов, участвуют в важнейших процессах жизнедеятельности организма: синтезе белков, росте и размножении и др. Протеиды или сложные белки состоят из 2 компонентов: собственно белкового вещества и вещества небелкового характера, так называемой простетической группы. Эта группа в большинстве случаев сравнительно легко отщепляется от белковой части молекулы. В нуклеопротеидах нуклеиновые кислоты (поленуклеотиды) соединены с белками преимущественно основного характера (гистан, протамины). Универсальные цветные реакции Биуретовая рекация. Принцип метода. Биуретовая реакция обусловлена присутствием в белках пептидных связей (- СО – NH -), которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные в красно-фиолетовый цвет медные солеобразные комплексы. Биуретовую реакцию дают также некоторые небелковые вещества, например биурет (NH2-CO-NH-CO-NH2), оксамид (NH2CO-CO-NH2), ряд аминокислот (гистидин, серин, треонин, аспарагин). Реакция обязана наличию пептидных связей в белках: Биуретовая реакция с глицином При избытке щелочи происходит диссоциация СО – группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью образуется солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их не поделенных электронных пар. Возникающий комплекс очень стабилен. 5 Биуретовая реакция не является строго специфичной для пептидных связей Она получается и с веществами, не содержащими пептидных групп (например при наличии в молекуле групп –СН=NН –; =СН-NH-). Кроме того, биуретовую реакцию дают аминокислоты: треонин, гистидин, серии и некоторые амиды. Нингидриновая реакция. a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты. Реакция идет по схеме: Химизм реакции: -аминокислота нингидрин альдегид восстановленная форма нингидрина (гидриндантин) продукт конденсации сине-фиолетового цвета Реакция с нингидрином используется для визуального обнаружения aаминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции. Продукт этой реакции содержит в своем составе радикал (R) исходной аминокислоты, который обусловливает различную окраску: голубую, красную, и т.д. соединений, возникающих при реакции аминокислот с нингидрином. 6 В настоящее время нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количеств. Специфические реакции Ксантопротеиновая реакция. Эта реакция используется для обнаружения aаминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет. Желатин, например, не содержащий ароматических аминокислот, не дает ксантопротеиновой пробы. Химизм реакции: тирозин нитропроизводное тирозина желтого цвета рН 7,0 хиноидное производное оранжево-желтого цвета рН > 7,0 Реакция Адамкеевича связана с присутствием в молекуле белка аминокислоты триптофана и основана на способности триптофана в кислой с реде вступать в реакцию с альдегидами, образуя при этом окрашенные продукты. Та к, при добавлении к раствору белка незначительных количеств глиоксиловой кислоты (всегда присутствует в небольших количествах в ледяной уксусной кислоте) в присутствии крепкой серной кислоты получается красно-фиолетовое окрашивание. Триптофан в этой реакции конденсируется с формальдегидом, выделившимся из глиоксиловой кислоты под действием концентрированной 7 серной кислоты. Реакция Вуазене протекает только с теми белками, которые содержат своем составе триптофан. Химизм ее аналогичен реакции Адамкевича: и в том, и другом случае в конденсацию с триптофаном вступает формальдегид. Реакция Шульце-Распайля обусловлена присутствием в белке триптофана. Сущность реакции сводится к тому, что под влиянием серн ой кислоты происходит гидролиз сахарозы до моносахаридов, которые обезвоживаются, превращаясь в оксиметилфурфурол. Триптофан, реагируя с последним, образует комплекс, окрашенный в вишнево-красный цвет. Реакция Паули. При добавлении к разбавленным растворам белка сульфаниловой кислоты и нитрита натрия, в присутствии карбоната натрия, развивается вишнево-красное окрашивание. Возникновение реакции обусловлено наличием в белковой молекуле остатков гистидина и тирозина. П взаимодействии кислого раствора сульфаниловой кислоты с нитритом натрия образуется диазобензосульфоновая кислота. Ракция Миллона характерна для белков, содержащих ароматическую аминокислоту тирозин. При взаимодействии белка с реактивом Миллона (р-р азотнокислой ртути в концентрированной НNO 3 ) образуется осадок белка, который при нагревании окрашивается в красно-коричневый цвет. Реакция вызвана присутствием в белке фенольной группы тирозина, после взаимодействия с реактивом Миллона образуется ртутная соль нитропроизводного. Тирозин Ртутная соль нитротирозина Реакцию Миллона дают все белки, за исключением тех, молекулы которых не содержат тирозина (желатин, клупеин и др.). Реактив Миллона дает окрашивание почти со всеми фенолами. Реакция Сакагуши. Эта реакция обнаруживает в белке аминокислоту аргинин, которая в присутствии гипобромита (NаВrO) теряет аминогруппу, а продукт окисления конденсируется с ά-нафтолом, образуя вещество красного цвета. Происходящие при этом реакции можно представить следующей схемой: Реакция Фоля. Добавление к раствору белка крепкой щелочи и уксуснокислого свинца при кипячении приводит к потемнению раствора. Реакция 8 обусловлена присутствием в белке серосодержащих аминокислот (цистеина и метионина). Эти аминокислоты при нагревании в присутствии щелочи разрушаются, образуя сернистый натрий: Уксуснокислый свинец реагирует со щелочью с образованием плюмбита натрия: (СH3COO)2 + NaOH Pb(ONa)2 + 2CH3COOH Сернистый натрий при взаимодействии с плюмбитом образует черный осадок сернистого свинца: Na2S + Pb(ONa)2 + 2 H2O PbS + 4NaOH Материальное оснащение Реактивы: 30% NаОН; 1% CиSО4; 0,5% нингидрин; НNО3 конц.; NН3 конц.; ледяная уксусная кислота; Н2SО4 конц.; 2,5 %-ный раствор формальдегида; 10%-ный раствор сахарозы; 1%-ный раствор сульфаниловой кислоты; 0,5%-ный раствор нитрита натрия; 10%-ный раствор карбоната натрия; реактив Миллона;10% NаОН; 0,5%-ный раствор уксуснокислого свинца; Оборудование: штативы; пробирки; спиртовка. III. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТ Все реакции выполняются для всех исследуемых растворов. Для этого набор пробирок в штативе нумеруется в соответствии с нумерацией исследуемых растворов в таблице результатов анализа. Универсальные цветные реакции Биуретовая реакция. К 2 мл исследуемых растворов добавить 4мл 30-го раствора едкого натра, 2 мл 1%-го раствора CuSO4 и хорошо перемешать. Развивается красно-фиолетовое окрашивание. При стоянии на границе двух слоев появляется фиолетовое кольцо. Нингидриновая реакция. К 2 мл исследуемых растворов приливают 3-4 капли 0,5%-го раствора нингидрина и нагревают. Через 2-3 минут появляется розовое, красное, а затем сине-фиолетовое окрашивание. Специфические цветные реакции Ксантопротеиновая реакция. В пробирки наливают по 2 мл (на глаз) исследуемых растворов и прибавляют 6-10 капель концентрированной азотной кислоты. Под влиянием кислоты появляется осадок белка, который при нагревании окрашивается в желтый цвет. Затем дают пробиркам остыть и осторожно прибавляют несколько капель концентрированного аммиака. При этом желтая окраска переходит в оранжевую. 9 Реакция Адамкевича. В пробирки наливают несколько капель исследуемых растворов и прибавляют по 2 мл ледяной уксусной кислоты. Смесь слегка нагревают до растворения образующегося осадка. Охлаждают пробирку со смесью, а затем, сильно наклонив ее, осторожно по стенке приливают 1 мл концентрированной серной кислоты так, чтобы обе жидкости не смешались. При стоянии на границе двух жидкостей появляется красно-фиолетовое кольцо. Реакция Вуазене. В пробирки наливают по 2 мл исследуемых растворов и во все добавляют по одной капле 2,5%-го раствора формальдегида. Затем растворы смешивают и прибавляют по 6 мл концентрированной соляной кислоты (плотность не менее 1,175), после чего снова перемешивают. Реакция Шульце-Распайля. В пробирки наливают по 1 мл исследуемых растворов и добавляют по 2 капли 10%-го раствора сахарозы. В каждую пробирку приливают по 1 мл концентрированной серной кислоты, следя за тем, чтобы жидкости не смешивались. На границе раздела жидкостей появляется вишнево-красное кольцо. Реакция Паули. В пробирки наливают по 1 мл 1%-го раствора сульфаниловой кислоты и приливают по 2 мл 0,5%-го раствора нитрита натрия, сильно встряхивают и немедленно добавляют сначала по 2 мл растворов исследуемых белков, а затем по 6 мл 10%-го раствора карбоната натрия. После смешивания растворов развивается вишневокрасное окрашивание. Реакция Сакагуши. В пробирки налить по 5 мл исследуемых растворов белка и охладить льдом. Добавить по 1 мл 10%-го раствора едкого натра и по 1 мл 0,02%-го щелочного раствора альфа-нафтола, охладить льдом еще 2-3 мин и добавить по 10 капель раствора гипобромита. Появляется красное окрашивание, оно довольно быстро начинает исчезать из-за дальнейшего окисления образовавшегося пигмента избытка гипобромита. Для того, чтобы стабилизировать окраску, в пробирки нужно прилить по 1 мл 40%-го раствора мочевины, расщепляющей избыточный гипобромит. Реакция Фоля. В пробирки наливают по 1-2 мл 0,5%-го уксусно-кислого свинца. По каплям добавляют 20%-й раствор едкого натрия до растворения образовавшегося осадка, затем по 5 капель исследуемых растворов белка. Смесь постепенно нагревают и наблюдают потемнение раствора. Ход анализа, добавляемые реактивы, изменение окраски заносятся в таблицы 1 и 2. Таблица 1 Исследуемые растворы I. Белковые вытяжки 1. мясо Универсальные реакции биуретовая нингидриновая добавленный реактив окраска добавленный реактив окраска нингидрин NaOH + CuSO4 2. мука 3. яйцо 4. желатин II. Растворы аминокислот 1. лейцин 2. лизин 3. триптофан 4. цистеин 10 Таблица 2 Исследуемые растворы Ксантопротеиновая добав окраска реакт. Специфические реакции Адамкеевича добав реакт. окраска Фоля добав реакт. окраска I. Белковые вытяжки 1. мясо HNO3 +NH3 СН3СООН Н2SO4 + Pв(СН3СООН)2 +NaOH 2. мука 3. яйцо 4. желатин II. Растворы аминокислот 1. лейцин 2. лизин 3. триптофан 4. цистеин Вывод: в данной работе было изучено цветные реакции на белки и аминокислот. Существует универсальные цветные реакции, которые дают все белки (биуретовая и нингидриновая) и специфичные обусловленные наличием только определенные аминокислот в белках. IV. Контрольные вопросы Вариант 1 1. Уровни структурной организации белка. 2. Чем обусловлена биуретовая реакция? Напишите реакцию образования дипептида. 3. Назовите типы цветных реакций. Чем они определяются? Вариант 2 1. Какое окрашивание с нингидрином получается при взаимодействии пролина, оксипролина, амида аспарагиновой кислоты? 2. Как протекает взаимодействие триптофана с формальдегидом? В какой среде? (реакция Адамкевича) 3. Наличие каких остатков аминокислот обусловливает реакцию Паули? Вариант 3 1. Какие соединения кроме белка дают биуретовую реакцию? 2. Что происходит при взаимодействии серосодержащих аминокислот с солями свинца в щелочной среде? 3. Дают ли нингидриновую реакцию аминокислоты, белки, полипептиды? Вариант 4 1. Чем обусловлена реакция Шульца-Распайля? 2. Образование какого соединение обуславливает появление черного осадка и реакции Фоля? 3.Какова химическая природа белков? Напишите схему гидролиза белков? 11 Вариант 5 1. Перечислите циклические аминокислоты. Как протекает характерная для них реакция? 2. Является ли биуретовая реакция строго специфичной? Напишите реакцию образования трипептида. 3. Как приготовить 5%-й раствор уксуснокислого свинеца и 1%-й раствор желатина? Вариант 6 1. Чем обусловлена реакция Миллона? 2. Зависит ли протекание нингидриновой реакции от величины pH? 3. Приведите примеры пищевых продуктов, при приготовлении которых может наблюдаться потемнение за счет реакции Фоля? Вариант 7 1. В какой среде (кислой или щелочной) происходит образование биуретового комплекса. 2. Чем обусловлена реакция Сакагуши? 3. Что общего в реакциях Адамкевича и Вуазене? 12 ЛАБОРАТОРНАЯ РАБОТА №2 НЕКОТОРЫЕ СВОЙСТВА БЕЛКОВ I. ЦЕЛЬ РАБОТЫ Изучить на конкретном экспериментальном материале основные свойства белков: растворимость, наличие изоэлектрического состояния, явление денатурации – тепловой и под действием других факторов. Студент должен знать: о преемственности дисциплин, используя в качестве фундамента знания по органической, аналитической, физколлоидной химии (коллоидные растворы, буферные свойства, гидрофильные вещества и т.д.); факторы, поддерживающие гигантскую белковую молекулу в растворе; как достигается изоэлектрическое состояние для определенной белковой молекулы, какие аналитические операции снимают заряд, убирают гидратную оболочку; внешние проявления в белковых растворах при достижении изоэлектрической точки, при денатурации; использование и практическое применение этих свойств в пищевой промышленности. Студент должен уметь: объяснить понятие коагуляции, свертываемости, денатурации, знать их очередность при действии самых различных факторов (температура, органические и минеральные кислоты, алкалоидные реактивы, соли тяжелых металлов); пользоваться пипетками разного объема, вплоть до микропипеток; использовать изучение свойств белков для возможного выделения белков из природных объектов и разделения природных смесей белков; находить аналогии в лабораторных исследованиях и в технологических приемах приготовления пищи (варка яиц, посол бульонов, осветление соков и т.д.). II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Важным естественным свойством белков является их растворимость в воде, водно-солевых растворах и в водных полярных растворителях (спирт). Большой молекулярный вес белков объясняет выраженный коллоидный характер их водных растворов. Водные растворы белков дают даже в молекулярнодисперсном состоянии коллоидные растворы – это значит, диаметр белковых частиц в растворе не превышает 0,001 мк. Белки имеют большое сродство к воде и поэтому легко растворяются в ней. Процесс растворения белков тесно связан с гидратацией их макромолекул. Коллоидные растворы белка достаточно устойчивы. Такая стабильность обусловлена двумя основными факторами: во-первых, белковая частица несет электрический заряд, и, во-вторых, вокруг белка образуется водная оболочка, состоящая из нескольких слоев, что препятствует коагуляции (объединению белковых молекул и выпадению их в осадок). При осаждении белка нужно лишить его этих факторов, используя различные агенты, снижающие заряд или разрушающие гидратную оболочку белковой частицы. Белки по химическим свойствам являются амфотерными веществами, так как в них, в их молекуле, имеются свободные карбоксильные и аминные группы. Кислотные свойства белков обуславливаются за счет кольцевых карбоксильных групп и 13 дикарбоновых аминокислот. Кислую среду помогают создавать фенольные гидроксилы в составе тирозина и сульфогидрильные группы серосодержащих аминокислот. Щелочными свойствами белки обязаны аминным, иминным и гуанидиновым группам диаминокислот. Присутствие одновременно кислых и основных групп в белках в водной среде обуславливает образование биионов: В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н+ из NH+3: В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой: Таким образом, фактором, определяющим поведение белка как аниона или катиона, является концентрация водородных ионов, или значение рН среды. При повышении концентрации водородных ионов (среда кислая - рН 0-7) белок становится катионом, при ее понижении (среда щелочная- рН 7 -14), наоборот, белковые частицы становятся анионами. Такая способность белка проявлять или кислотные, или щелочные свойства характеризует его как амфотерное соединение. Однако при определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4,8-5,4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот (см. Аминокислоты). В изоэлектрической точке белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок. Очень интересным у белков является их способность к денатурации. В лабораторной работе №1 уже давалось определение нативной (натуральной, естественной) структуре белков, при соблюдении которой белки и выполняют свои многочисленные функции в организме. Нативными называют белки, обладающие всеми характерными свойствами (растворимость, определенная величина ИЭТ, биологическая активность и т.д.), однако эти природные свойства сохраняются в пределах очень узкой области температур, рН и 14 других физико-химических параметров. Это так называемые физиологические условия нахождения белка в живом организме, характеризующиеся сложной упорядоченной пространственной конфигурацией молекулы (четвертичная, третичная, вторичная, первичная структуры). Стоит только несколько превысить температуру, изменить рН и т.д., как происходит глубокое изменение уникальной структуры нативного белка, а именно развертывание упорядоченных четвертичных, третичных, вторичных уровней структур, сопровождающееся потерей характерных для него свойств (растворимости, биологической активности и т.д.). Это явление потери нативности называется денатурацией. Денатурация, как правило, затрагивает четвертичную, третичную и частично вторичную структуру белковой молекулы и не сопровождается какими-либо изменениями первичной структуры, т.е. разрушаются, главным образом, дисульфидные мостики и водородные связи. Из строго упорядоченной нативной структуры получается беспорядочный клубок полипептидных нитей. Внешне это проявляется выпадением в осадок растворов белка, т.е. их коагуляцией. Денатурация происходит под действием высокой температуры и других, так называемых осаждающих факторов: солей тяжелых металлов, алкалоидных реактивов, минеральных и органических кислот, органических реактивов и концентрированных растворов нейтральных солей. Классический пример тепловой денатурации – вареное яйцо; кислотной денатурации – простокваша. Почти все белки денатурируют при нагревании (исключение составляет желатин). Для разных белков температуры их денатурации неодинаковы. Одни денатурируют при 50-600С, а другие могут выдерживать даже непродолжительное кипячение. При тепловой денатурации происходит необратимые изменения вторичной и третичной структур молекул белка, в результате чего коллоидные частицы белка из гидрофильных становятся гидрофобными. Скорость тепловой денатурации зависит от присутствия в растворе ионов солей и концентрации водородных ионов. Особенно быстро и полно денатурируют белки, а значит, происходит их коагуляция, т.е. осаждение при нагревании в изоэлектрической точке. В сильнокислых растворах (за исключением азотной, трихлоруксусной и сульфосалициловой кислот) белковые частицы перезаряжаются и несут положительный заряд, что повышает их устойчивость – они не выпадают в осадок даже при кипячении: В сильнощелочных растворах белки тоже перезаряжаются (или происходит усиление имеющегося заряда), они приобретают отрицательный заряд, вследствие чего тоже остаются в растворе даже при кипячении: В сильнокислых растворах белки могут коагулировать при добавлении достаточного количества какой-либо нейтральной соли (хлорида натрия, сульфата аммония). Коагуляция наступает как вследствие дегидратирования белковой частицы, так и потому, что адсорбированные по знаку заряда коллоидной частицы нейтрализуют 15 заряд частицы и наступает момент, когда силы притяжения между молекулами превышают силы отталкивания, и белок выпадает в осадок. Реакции осаждения белков весьма разнообразны, однако их можно разделить на две группы: 1) Практически необратимые реакции осаждения, при которых белки претерпевают глубокие изменения и не могут быть вновь растворены в первоначальном растворителе. Это является следствием денатурации белка, т.е. глубокого изменения в пространственной нативной структуре молекулы, в результате которого теряется способность белка растворяться в обычных для него растворителях. Фактически процесс денатурации белка сводится к разрушению нативной вторичной и третичной структуры белка. К необратимым реакциям относятся осаждение белка солями тяжелых металлов, алкалоидными реактивами, минеральными и органическими кислотами и осаждение при нагревании. 2) Обратимые реакции осаждения, при которых осаждаемые белки не подвергаются глубоким изменениям и поэтому получаемые осадки белков могут быть растворены в первоначальном растворителе. Молекулы белка при этом сохраняют свои первоначальные, нативные, включая биологические, свойства и не подвергаются заметной денатурации. К обратимым реакциям осаждения следует отнести осаждение белков органическими растворителями (спиртом или ацетоном) и высаливание белков (осаждение под влиянием концентрированных растворов нейтральных солей: NH4Cl, NaCN, (NH4)2SO4 и др.). Соли тяжелых металлов (свинца, меди, серебра, ртути и др.) с белками образуют прочные комплексные соединения. Кроме того, тяжелые металлы снимают электрический заряд, глубоко изменяют вторичную и третичную структуру макромолекул белка. При осаждении белков солями тяжелых металлов требуются слабые их концентрации и относительно небольшие количества. Свойством белков связывать тяжелые металлы широко пользуются в медицинской и ветеринарной практике, как противоядием при отравлении солями ртути, меди, свинца и др. При избытке уксуснокислого свинца и сернокислой меди наблюдается растворение осадка (пептизация), что связано с перезарядкой белкового комплекса вследствие адсорбции избытка ионов металла на его поверхности. При избытке солей серебра и ртути пептизация не наблюдается. Осаждение белка алкалоидными реактивами чаще всего обусловлено наличием в белке азотистых гетероциклических группировок. Алкалоидными называются реактивы, способные осаждать алкалоиды. Большая часть алкалоидных реактивов (красная кровяная соль, танин, пикриновая кислота, соли КI, HgI2 и др.) реагируют только в кислой среде. Механизм осаждения заключается в образовании нерастворимых солеобразных соединений с основными азотистыми группами. В этом соединении белок является катионом, а алкалоидный реактив – анионом. В кислой среде частицы белка перезаряжаются и переходят в состояние катионов. В щелочной среде они растворяются. Некоторые алкалоидные реактивы, например, таннин, используются в пищевой промышленности (осветление соков). Осаждение белка концентрированными минеральными кислотами (кроме H3PO4) происходит за счет дегидратации белковых частиц с одной стороны, и нейтрализации зарядов с другой стороны. Кроме того, возможно образование солей белка. В избытке серной и соляной кислот и при длительном их воздействии происходит перезарядка белка, частичный его гидролиз, а осадок белка растворяется. При избытке азотной кислоты растворение осадка белка не происходит (точный механизм этого явления не установлен: возможно, что ион NO3- мешает перезарядке белковой молекулы). 16 Из растворов белки могут осаждаться также органическими кислотами. Разные кислоты действуют на белок неодинаково. Наиболее сильнодействующими и высокоспецифическими являются сульфосалициловая кислота и трихлоруксусная кислота: SO3H→Cl3COOH- HO COOH Трихлоруксусная кислота осаждает только белки, а продукты их распада (мочевина, аминокислоты, амиды, пептиды и др.) остаются в растворе. Это имеет важное значение для определения небелкового остаточного азота, в частности, в сыворотке крови. При некоторых заболеваниях (инфекционные др.) наступает резкое увеличение количества остаточного азота в крови. Сульфосалициловая кислота осаждает не только белки, но и высокомолекулярные полипептиды. Механизм осаждения белков органическими кислотами объясняется дегидратацией белковой молекулы и снятием заряда. Осаждение белка органическими растворителями (спиртом, ацетоном, эфиром, хлороформом и др.) происходит только из нейтральных и слабокислых растворов. Органические растворители разрушают водную оболочку белка и, тем самым, снижают его устойчивость в растворе. Если в растворе белка присутствуют соли, то осадок образуется быстрее вследствие снятия заряда с коллоидной частицы. Нейтральные соли щелочноземельных металлов вызывают обратимые осаждения белков (высаливание). Под действием солей KCl, (NH4)2SO4, NH4Cl, Na2SO4, NaCl происходит адсорбция ионов с противоположным зарядом на коллоидных частицах. Белковая частица становится электронейтральной (происходит снятие заряда), в результате понижается ее устойчивость в растворе. Кроме того, соли щелочных металлов, растворяясь, связывают большие количества воды, что при достаточно высоких концентрациях ведет к денатурации коллоидных частиц и лишает защитной водной оболочки. Белки при этом выпадают в осадок. Осадок белков (гель), полученный высаливанием, может быть вновь растворен после уменьшения концентрации солей диализом или разбавлением водой. Высаливание, таким образом, является обратимым процессом. Степень выпадения в осадок зависит от ионной силы раствора осадителя, размера частиц белковой молекулы, величины ее заряда, гидрофильности. Разные белки осаждаются при различных концентрациях солей, поэтому в осадка, полученных путем постепенного повышения концентрации солей, отдельные белки находятся в различных фракциях. Для разделения белков этим методом широко используют сульфат аммония. Глобулины выпадают в осадок при полунасыщении (NH4)2SO4, альбумины – при полном насыщении. В насыщенном растворе сульфата аммония все белки выпадают в осадок. Материальное оснащение Реактивы: 1% СН3СООН; 10% СН3СООН; спирт; ацетон; хлороформ; 10% сульфосалициловая кислота; 1%-ный раствор яичного белка, 0,2 М раствор CH3COOH, 0,2 М раствор CH3COONa, этиловый спирт, ацетон, хлороформ, насыщенный раствор NaCl, 30%-ный раствор NaОН, концентрированные кислоты (НCl, 17 НNО3, Н2SO4), 1%-ные растворы таннина, пикриновой кислоты, железистосинеродистого калия, раствор йода в йодистом калии, насыщенный раствор фенола, 7%-ный раствор СuSO4, 5% CH3COONa, 5% AgNO3, насыщенный раствор сульфата аммония. Оборудование: штативы, пробирки, спиртовка, водяная баня. III.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ Определение изоэлектрической точки белка. Оно основано на снятии с молекулы белка основных факторов его стабильности в растворе (отталкивание одноименно заряженных молекул и наличие гидратной оболочки) и в последующей коагуляции молекулы белка. После достижения изоэлектрического состояния белка путем создания определенного рН к белку прибавляется вещество, обладающее большей гидрофильностью, чем белок (этиловый спирт). Оно отнимает от молекулы белка его гидратную оболочку. Для определения изоэлектрической точки белка сначала готовят серию буферных растворов согласно таблице 3, используя градуированные пипетки на 1-2 мл и микропипетки на 0,1 и 0,2 мл. По мере приливания содержимое пробирок тщательно взбалтывают. Наблюдают через 20-30 мин помутнение, которое обозначают степень коагуляции по нижеприведенной схеме в таблице 3 (в толбике коагуляция): + слабая коагуляция; ++ более сильная коагуляция; +++ наиболее сильная коагуляция; - отсутствие осадка. Таблица 3 Определение изоэлектрической точки N проб. 1 2 3 4 5 6 Состав буферного раствора, мл; 0,2 M 0,2 M CH3COOH CH3COONa 1.9 1,8 1,4 1,0 0,6 0,2 0,1 0,2 0,6 1,0 1,4 1,8 1%-ный раствор белка куриного яйца, мл 0,5 0,5 0,5 0,5 0,5 0,5 Этиловый спирт, мл Ф 0,5 0,5 0,5 0,5 0,5 0,5 3.4 3,8 4,4 4,7 5,1 5,7 Коагуляция Осаждение белка нагреванием. В 5 пробирок наливают по 2 мл раствора белка. Содержимое первой пробирки нагревают, наблюдая постепенное выпадение белка в осадок. Во вторую пробирку добавляют к белку 1 каплю 1%- ной уксусной кислоты и нагревают. Наблюдают более полное и быстрое выпадение осадка. В третью пробирку к белку добавляют 0,5 мл 10% - ной уксусной кислоты и нагревают. Осадок не образуется даже при кипячении. В четвертую пробирку к белку добавляют 0,5 мл 10%-ной уксусной кислоты и 34 капли насыщенного раствора хлористого натрия и подогревают. Наблюдают выпадение белков в осадок. 18 В пятую пробирку добавляют к белку около 0,5 мл 30%-ного раствора едкого натрия и подогревают. Осадка белка не образуется даже при кипячении. Осаждение белка органическими растворителями. В три пробирки наливают по 1–2 мл раствора белка, добавляют 0,2–0,3 г хлористого натрия и энергично встряхивают. В первую пробирку постепенно (каплями) приливают 2–3 мл спирта, во вторую 2–3 мл ацетона и в третью – хлороформа. Энергично взбалтывают и через 3-6 мин наблюдают выпадение мелкого осадка белков. Осаждение белка концентрированными минеральными кислотами. В три пробирки наливают по 15–20 капель концентрированных соляной, серной и азотной кислот. Затем наклонив пробирки, осторожно по стенке пробирки приливают равный объем раствора белка. На границе двух слоев жидкости появляется осадок белка в виде тонкой пленки. Осторожно встряхивая пробирки, обнаруживают растворение осадка в случае осаждения соляной и серной кислоты. В пробирке с азотной кислотой белок не растворяется. Осаждение белка органическими кислотами. В две пробирки наливают по 5 капель раствора белка. В одну пробирку добавляют 1–2 капли 10%- ного раствора сульфосалициловой кислоты, в другую –1–2 капли 10%-ного раствора трихлоруксусной кислоты. В пробирках образуется осадок белка. Осаждение алкалоидными реактивами. В две пробирки наливают по 2 капли раствора белка и подкисляют их 2-3 каплями 1% -ного раствора уксусной кислоты в одну пробирку проливают 2-3 капли раствора таннина, в другую 5-6 капель раствора пикриновой кислоты. Наблюдают выпадение белка в осадок. В третью пробирку наливают 2 мл раствора белка, подкисляют 2-3 каплями 1%ного раствора уксусной кислоты и добавляют 1-2 капли йода в йодистом калии. Наблюдают выпадение белка в осадок. В пятую пробирку наливают 1-2 мл раствора белка и добавляют 5-8 капель насыщенного раствора фенола, встряхивая пробирку после каждой капли. Наблюдают осаждение белка. Осаждение белка солями тяжелых металлов. В три пробирки вносят 5 капель 1% -ного раствора яичного белка и по 1 капле в первую пробирку 7%-ного раствора сульфата меди, во вторую – 5% -ного раствора уксуснокислого свинца, в третью – 5%ного раствора нитрата серебра. Во всех пробирках образуются осадок. В первую пробирку добавляют еще 5-10 капель 7%-ного раствора сульфата меди, при этом наблюдается растворение осадка. В третью пробирку вносят 5-10 капель 5%-ного раствора нитрата серебра. Растворения осадка не происходит. Осаждение белка сернокислым аммонием. В пробирку наливают 2–3 мл раствора белка, прибавляют равный объем насыщенного раствора сернокислого аммония и взбалтывают. В результате получается полунасыщенный раствор сернокислого аммония. В осадок выпадают глобулины. Через 5–7 мин отфильтровывают содержимое пробирок. В фильтрате остаются альбумины, а на фильтре – глобулины. Для осаждения альбуминов в фильтрат добавляют кристаллический сернокислый аммоний до полного насыщения, т.е. пока порошок остается нерастворенным. В осадок выпадают альбумины. Результаты исследования заносят в таблицу 4. 19 Таблица 4 Изучение осадителей белка Исследуемый белок Осадители Характер и цвет осадка Чем обусловлена реакция? Вывод: в данной работе были изучены основные свойства белков: растворимость, наличие изоэлектрического состояния, явление денатурации (тепловой, под действием солей тяжелых металлов, алкалоидных реактивов, минеральных и органических кислот, органических реактивов и концентрированных растворов, нейтральных солей). Также были изучены факторы, обуславливающие ход той или иной реакции. IV. Контрольные вопросы Вариант 1 1. Перечислите основные свойства белков. 2. В чем разница между высаливанием и денатурацией? 3. На чем основано производство кисломолочной продукции? Вариант 2 1. Какие растворы дают белки? Чем это объясняется? 2. Под действием чего происходит денатурация белков? В чем она заключается? 3. Механизм осаждения белков под действием алкалоидных реактивов. Вариант 3 1.Чем обусловлена устойчивость белков и растворах? Как снимаются стабилизирующие факторы с белковой молекулы в работе? 2. Виды обратимой и необратимой денатурации. 3. Приведите примеры тепловой денатурации из пищевой промышленности. Вариант 4 1. Какие свойства (кислотные или щелочные) проявляют белковые растворы? От чего это зависит? 2. Какие белки называют нативными? 3. Перечислите денатурирующие факторы. Вариант 5 1. Поясните поведение биполярного иона в щелочной и кислой среде реакциями. 2. Механизм осаждения белков под действием органических растворителей и органических кислот 3. Приведите примеры пищевых продуктов, получение которых основано на денатурации. Вариант 6 1. Чем характеризуется изоэлектрическое состояние белковой молекулы? 2. Дайте определение явлению денатурация. 3. Применение осаждающих факторов в пищевой промышленности и в химическом анализе. 20 Вариант 7 1. В какой среде наблюдается изоэлектрическое состояние у белков, состоящих из диаминокорбоновых кислот и моноаминокарбоновых кислот? 2. Механизм осаждения белков при нагревании. 3. Приведите примеры пищевых продуктов, при получении которых используется денатурация. Вариант 8 1.По какому внешнему признаку определяется изоэлектрическое состояние белковых молекул? 2. Перечислите денатурирующие факторы, механизм их воздействия на белковую молекулу. 3. Использование осадителей белков в пищевой промышленности и в химическом анализе. 21 ЛАБОРАТОРНАЯ РАБОТА №3 СПОСОБЫ ПОЛУЧЕНИЯ ФЕРМЕНТОВ И ИЗУЧЕНИЕ ИХ СПЕЦИФИЧНОСТИ I. ЦЕЛЬ РАБОТЫ Изучение способов получения ферментов, препараты которых используются во всех последующих работах. Исследование основного свойства ферментов – их специфичности. Студент должен: знать отличия биологических катализаторов от неорганических; приобрести навыки извлечения разных ферментов из клеток; уметь классифицировать действия ферментов по их названиям, по субстратом; знать примеры специфичности ферментов; изучить термолабильности ферментов на примере амилазы, влияние температуры на скорость ферментативной реакции; знать схему расщепления крахмала и гликогена; знать механизм активирующего и ингибирующего действия на ферменты. II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Одним из основных и увлекательных разделов биохимии, который во многих отношениях можно считать сердцем этой науки, является изучение ферментов. Ведь существование живого организма – это бесчисленная цепь биохимических реакций, которые протекают с большой скоростью благодаря участию природных катализаторов, называемых ферментами или энзизмами. Ферментами называют вещества белковой природы, которые вырабатываются клетками растительных и животных организмов, которые значительно ускоряют все химические процессы, происходящие в живых организмах. Образуясь в клетках, ферменты могут проявлять свое каталитическое действие также и вне клеток. Некоторые ферменты, например, пищеварительные и в природных условиях действуют преимущественно вне клеток. В настоящее время значительная часть исследований, связанных с живыми клетками, посвящена ферментам, поскольку различные физиологические функции, например, мышечные сокращения, нервная проводимость, почечная секреция и жизнь клетки в целом непрерывно связаны с активностью ферментом. В живых организмах небелковые катализаторы не обнаружены. Они значительно различаются по размеру молекул. Белки ферменты, подобно всем катализаторам, ускоряют химические реакции. Энергия активации – это энергия, необходимая для перевода молекулы с субстратом в реакционноспособное состояние. Субстратом называется вещества, превращение которых катализирует ферменты. Общие свойства всех ферментов их высокая эффективность и специфичность, наличие центров, подверженность влиянию активаторов и катализаторов, зависимость их действий от температуры (термобильность) и значение рН. Все они обусловлены белковой природой ферментов. Эффективность действия ферментов чрезвычайно высока: одна молекула фермента может катализировать превращение 102 – 105 молекулы субстрата в 1 мин, что намного выше, чем у неорганических катализаторов. Ферменты высоко 22 специфичны в отношении своих субстратов и типов катализируемых реакций. Различают абсолютную специфичность, групповую и стереоспецифичность. В ходе ферментативного катализа происходит образование промежуточного соединения (комплекса) фермента с его субстратом, что установлено наличием центра в молекуле фермента (активный субстратный и аллостерический ). Часть фермента, которая активно взаимодействует с субстратом, называется активным центром. Часть фермента, ответственная за присоединение субстрата, своеобразная якорная площадка, называется субстратным центром. Часть полипептидной цепи фермента, которая способствует определенному пространственному расположению активного центра, называется аллостерическим центром. Аллостерический центр может соединяться с различными веществами, но не с субстратом, и оказывать влияние на активный центр фермента, вызывая торможение или активирование его действия. Вещества, которые либо увеличивают, либо уменьшают скорости катализируемых реакций, действия, чаще всего на аллостерический центр ферментов, называют эффекторами. Они изменяют структуру фермента, таким образом, что изменяется скорость катализируемой реакции. Различают эффекторы-активаторы и эффекторы-парализаторы, или ингибиторы ферментов. В различии от неорганических катализаторов, ферменты обладают очень высокой каталитической активностью в условиях нормальной температуры и давлении. При низких температурах ферменты сохраняются, но скорость катализируемых ими реакции при этом резко снижаются. Это свойство ферментов лежит в основе торможения процессов распада, порчи пищевых продуктов при холодильном хранении. При повышении температуры скорость ферментативных реакций увеличивается только до определенного максимального значения. При дальнейшем повышении температуры происходит снижение скорости реакции вследствие тепловой денатурации белковой части фермента, вплоть до полной потери активности, т.е. инактивации фермента (температура 60-80⁰ С). Влияние рН на скорость ферментативных реакций ярко выражено для каждого фермента и имеется определенное значение рН (оптимум рН), при котором скорость реакции наибольшая. Скорость ферментативной реакции может зависеть, при прочих разных условиях, от концентрации ферментов и концентрации веществ, на которые фермент действует. При постоянном количестве фермента скорость реакции вначале быстро растет, а затем, по мере уменьшении концентрации субстрата, и увеличении количества продуктов расщепления замедляется. По своему химическому строению ферменты классифицируются на одно – и двухкомпонентые. Однокомпонентные ферменты состоят только из белковых молекул. Двухкомпонентные – кроме белковой части, называемой апоферментом, имеют и небелковую простетическую группу - кофактор. В роли кофакторов выступают как ионы металлов (Сu2+, Mn2+ и др.), так и органические вещества довольно сложного строения. Эти органические вещества слабосвязаны с белковой частью фермента и свободно диссоциируют, легко разъединяются апорферментом при диализе. Их называют коферментами. Многие органические коферменты не могут синтезироваться в организме млекопитающих и являются необходимыми компонентами пищи или витаминами. НАД содержит витамин РР, ФАД – витамины В2 и т.д. Согласно общепринятой номенклатуре, название фермента составляется из названия субстрата и суффикса – аза, название классов – из названия катализируемых реакций добавлением тог же суффикса –аза. Например, ферменты, ускоряющие распад белков (протенов и протеиодов), называются протеазами, пектинов – пектолазами, липидов – липазами, крахмал (амилазу и амилопектин) – амилазами и т.д. Имеются и 23 так называемые тривиальные названия – пепсин от латинского pepsts -разжижаю, каталаза от слова «катализ» и т.д. В зависимости от типа катализируемых реакций все ферменты классифицируют на 6 классов: 1.Оксидоредуктазы катализируют окислительно–восстановительные реакции; 2. Трансферазы катализируют реакции переноса, транспортировки; 3. Гидролазы ускоряют реакции гидролиза, т. е. распад сложных веществ до простых под действием воды; 4. Лиазы катализируют негидролитический распад ; 5. Изомеразы ускорят реакции изомеризации; 6. Лигазы или синтетазы катализируют присоединение друг к другу молекул, сопровождающееся расщеплением пирофосфатной связи. Внутри каждого класса существует деление на подклассы и под подклассы, которые уточняют природу ферментной реакции. Некоторые ферменты сравнительно легко могут быть извлечены из клетки (амилаза, мальтаза слюны и другие пищеварительные ферменты). Другие ферменты прочно связаны с элементами клеточной структуры и могут быть извлечены в раствор только после механического разрушения клеток (сахараза дрожжей, уреаза сои, амилаза солода, тирозиназа картофеля, липаза зерновых культур и другие ферменты). Специфичность ферментов является одним из важнейших свойств, отличающих их от неорганических катализаторов. Некоторые ферменты обладают абсолютной специфичностью, действуя только на один субстрат. Так уреаза катализирует распад только мочевины уреаза CO(NH2)2 + H2O CO2 + 2NH3 Амилаза слюны ускоряет гидролиз только крахмала до мальтозы, не оказывая действия на дисахариды. Мальтаза слюны ускоряет гидролиз дисахарида мальтозы, но не оказывает действия на другой дисахарид – сахарозу, который расщепляется только сахарозой. Действие амилазы на крахмал обнаруживается по результатам реакции с йодом, нерасщепленный крахмал дает с йодом синее окрашивание, а расщепленный амилазой раствор крахмала при добавлении йода приобретает желтоватый цвет, т.е. цвет самого йода. Действие сахаразы на сахарозу обнаруживается по реакции Троммера с сахарозой до и после ее взаимодействия с сахарозой. Реакция Троммера основана на способности углеводов, имеющих свободные карбонильные альдо – и кетогруппы, при нагревании восстанавливать гидрат окиси меди голубого цвета в гидрат закиси желтого цвета. При дальнейшем нагревани гидрат закиси переходит в красную закись меди. Нерасщепленная исходная сахароза, в которой глюкоза и фруктоза соединены по альдо- и кетогруппам, реакцию восстановления по Троммеру не дает цвет осадка – голубой. Действие фермента уреазы обнаруживается с помощью индикатора фенолфталеина, фиксирующего изменение реакции среды в щелочную сторону. Материальное оснащение Реактивы: петролейный эфир, толуол, 0,5% крахмал, слюна разведенная 1:5, 0,5% сахароза, 1% мочевина, 1% фенолфталеин, 1% йод в йодистом калии, 10% гидрат 24 окиси натрия, 5% сернокислая медь, препараты сахаразы и уреазы, полученные в первой части работы. Оборудование: воронки типа "слезка" и воронки большого диаметра, фарфоровые ступки, лабораторная мельница, терка полиэтиленовая, мерная колба на 100 мл, мерные цилиндры на 10 и 50 мл, колба Эрленмейера, пипетка глазная, бумажные фильтры, марля. Пробирки 9 шт, глазная пипетка, термостат отрегулированный на 370С, водяная баня, спиртовка. III.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ Сахаразу из дрожжей получают по способу А. И. Лебедева: 0,5 г сухих дрожжей в фарфоровой ступке тщательно растереть до мелкого порошка, затем добавить по каплям 2-3 мл дистиллированной воды. Не прекращая растирать. Полученную смесь профильтровать через маленький складчатый фильтр в воронке типа "слезка". Фильтрат, собранный в пробирку, называется мацерационным сокам Лебедева и используется как раствор фермента сахаразы. Активная уреаза находится в бобах сои. Способ ее получения основан на извлечении водой из соевой муки, предварительно освобожденной от жиров. Около 3-5 г сухих соевых бобов тщательно измельчить на лабораторной мельнице или в фарфоровой ступке. Подготовленную муку перенести в колбу Эрленмейера и залить 10 мл петролейного эфира, перемешать и оставить для настаивания 10 мин. Затем слить с осадка первую порцию петролейного эфира и залить новой в том же объеме, вновь перемешать и настаивать 10 мин. После второй экстракции содержимое колбы тщательно перемешать и профильтровать через складчатый бумажный фильтр. Оставшуюся на фильтре обезжиренную муку подсушить на воздухе, залить 5-кратным (15-25 мл) объемом воды, тщательно перемешать и дать отстояться. Отфильтрованную или отцентрифугированную жидкость использовать как препарат фермента уреазы. Препарат амилазы и каталазы солода получают следующим образом: 5 г мелко измельченного солода (проросшие зерна злаков пшеницы, ячменя) поместить в мерную колбу на 100 мл, добавить дистиллированной воды около 80-90 мл, сюда же прилить 5 капель толуола, взболтать и оставить для отстаивания на 24 часа. Затем довести водой до метки хорошо перемешать и отфильтровать через складчатый бумажный фильтр. Препарат фермента тирозиназы получают из клубня картофеля, который пропускается через терку из полиэтилена. Навеску 1-2 г этой протертой массы заливают 5 мл воды и тщательно перемешивают. Полученную смесь отфильтровывают через 2 слоя марли. Фильтр является препаратом фермента тирозиназы. Для доказательства специфичности действия ферментов амилазы, сахаразы и уреазы подготавливаются 3 серии пробирок с растворами соответствующих субстратов - крахмала, сахарозы и мочевины. Каждая серия состоит из 3 пробирок. В 3 пробирки первой серии наливают по 10 капель 0,5% крахмала и добавляют в первую пробирку 5 капель разведенной в 5 раз слюды (амилазу), во вторую - 5 капель вытяжки из дрожжей (сахаразу), в третью - 5 капель фильтрата из сои (уреазу). В 3 пробирки второй серии наливают по 10 капель 0,5% сахарозы и добавляют в первую пробирку 5 капель амилазы, во вторую - 5 капель вытяжки сахаразы, в третью 5 капель уреазы. В 3 пробирки третьей серии наливают по 5 капель мочевины и по 2 капли фенолфталеина и добавляют в первую пробирку 5 капель амилазы, во вторую - 5 капель сахаразы, в третью - 5 капель уреазы. Все подготовленные 9 пробирок помещают в термостат или в водяную баню с температурой 37-40С на 15 минут. По окончании термостатирования в пробирки 25 первой серии добавляют по одной капле 0,1% иода в иодистом калии и отмечают окрашивание, занося результаты в таблицу. С содержимым трех пробирок второй серии проделывают пробу по Троммеру, т.е. прибавляют половину от объема, имеющегося в пробирках, 10% щелочи, затем несколько капель 6% медного купороса и нагревают до кипения. Если в пробирке образуются редуцирующие сахара (глюкоза и фруктоза со свободными полуацетальными гидроксилами), то сначала появляется желтый осадок, который при дальнейшем нагревании приобретает красный цвет. Если сахароза не гидролизована, то исходный голубой цвет осадка не изменяется. Однако нельзя добавлять избыток гидрата окиси меди, так как в этом случае может образоваться окись меди черного цвета. В пробирках третьей серии отмечают изменение окраски индикатора фенолфталеина, которое тоже заносят в таблицу. Таблица 5 Специфичность действия ферментов Серии пробирок 1 серия 1 2 3 2 серия 1 2 3 3 серия 1 2 3 Субстрат Фермент Крахмал Крахмал Крахмал Амилаза Сахараза Уреаза Сахароза Сахароза Сахароза Амилаза Сахараза Уреаза Мочевина Мочевина Мочевина Амилаза Сахараза Уреаза реакция с иодом Контрольные реакции реакция по Троммеру реакция с фенолфталеином Вывод: в данной работе были изучены способы получения ферментов, а также была изучено основное свойство ферментов и их специфичность, т.е. действие фермента на один субстрат. IV. Контрольные вопросы Вариант 1 1.Как составляют три серии пробирок для доказательства специфичности ферментов? 2. Номенклатура и классификаций ферментов (по структуре, по катализируемым реакциям). 3. Написать реакции гидролиза крахмала. Вариант 2 1. Как определить действие фермента уреазы в данной работе? 2. Способы получения ферментов. 3. Написать реакцию гидролиза сахарозы. Вариант 3 1. Как определить действие фермента сахаразы? 2. Что такое ферменты? Происхождение их названий. 26 3. Локализация ферментов в клетке Вариант 4 1. Как определить действие фермента амилазы? 2. Каков механизм ферментативного катализа? 3. Что такое мацерационный сок Лебедева? Вариант 5 1. Понятие об индикаторах. Какие вещества в данной работе используют в качестве индикаторов действия амилазы и уреазы? 2. Отличие ферментов от неорганических катализаторов. 3. Способ получение уреазы. Вариант 6 1. Что такое реакция Троммера? 2. Какова химическая природа ферментов? 3. Получение препарата сахаразы. Вариант 7 1. Чем отличаются три серий пробирок друг от друга? 2. Привести примеры апоферментов, коферментов и кофакторов. 3. Написать реакция гидролиза мочевины. Вариант 8 1. Что общего в трех сериях приборок, используемых в данной работе? 2. Виды специфичности ферментов. 3. Способы получения ферментов. Вариант 9 1. К какому классу относятся ферменты амилазы, сахаразы, уреазы? 2. Перечислите основные свойства ферментов. 3. Способы получения ферментов. Вариант 10 1. Как обнаружить действие амилазы на крахмал? 2. Как обнаружить действие уреазы на мочевину? 3. Классификация ферментов по строению. Вариант 11 1. Что такое специфичность ферментов? Привести примеры. 2. Какие центры в ферментах вам известны? 3. Апоферменты, коферменты, кофакторы. Привести примеры. 27 ЛАБОРАТОРНАЯ РАБОТА №4 ТЕРМОЛАБИЛЬНОСТЬ ФЕРМЕНТОВ, ВЛИЯНИЕ рН, АКТИВАТОРОВ И ИНГИБИТОРОВ НА ИХ ДЕЙСТВИЕ I. ЦЕЛИ РАБОТЫ Изучить термолабильность ферментов – одно из важнейших их свойств, которое широко используется в пищевых технологиях; влияние рН и некоторых веществ на активность амилазы. Студент должен: знать влияние температуры на активность ферментов; знать влияние рН среды на активность ферментов; знать влияние активаторов и ингибиноров на активность ферментов; уметь установить рН оптимума действия фермента амилазы; уметь определить температурный оптимум действия фермента амилазы; уметь установить ингибитор и активатора для фермента амилаза; по окраске йода установить глубину распада крахмала. II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Повышение и понижение температуры сильно изменяют скорость ферментативного катализа. Эта зависимость активности ферментов от температуры называется термолабильностью. Низкие температуры резко снижают активность ферментов. С повышением температуры на каждые 100С скорость ферментативной реакции закономерно увеличивается примерно вдвое. Такое увеличение наблюдается только до температуры порядка 40-600С. Наивысшая температура, при которой нативные свойства ферментов и максимальная каталитическая сила действия фермента на субстрат может продолжаться длительный период времени, называется оптимальной температурой. Для большинства растительных ферментов температурный оптимум находится в пределах 50-600С, для животных в пределах 40-500С. При дальнейшем нагревании после достижения оптимума температуры скорость катализируемой реакции замедляется вплоть до полного прекращения процесса. Это обусловлено постепенной денатурацией белка фермента от нагревания, которая начинается выше 40-600С и заканчивается при 70-1000С. Потеря полной активности фермента, т.е его инактивация, является результатом денатурации белковой структуры фермента. На величину температурного оптимума влияет время теплового воздействия. Например, для ферментативной реакции, длящейся несколько секунд, оптимальная температура будет при более низких температурах. Субстратом в этой работе является полисахарид крахмал. Распад протекает ступенчато, через декстрины – обломки молекулы крахмала, в основном в зависимости от их окраски с йодом или от их сходства с близлежащими продуктами. Различная окраска при реакции с йодом свидетельствует о различной степени гидролиз крахмала, обусловленной разными скоростями ферментного катализа при разных температурах. 28 Схема распада (деструкции) крахмала Окраска с йодом Крахмал (амилон) Амилодекстрины Эритродекстрины Ахродекстрины Мальтодекстрины Мальтоза - Синяя Фиолетовая Красная, коричнево-оранжевая Цвет йода ----//-------//------ Активаторы стимулируют действие ферментов. Механизм их действия различен: эти вещества могут быть связующим мостиком между ферментом и субстратом, могут удерживать субстрат около активного центра фермента, могут изменять константу равновесия ферментативной реакции и т. д. Механизм ингибирующего действия ферментов тоже разнообразен, но чаще всего сводится к двум типам торможения: конкурентному и неконкурентному. При конкурентном торможении ингибитор, обладающий структурным сходством с субстратом, соединяется с ферментом, подменяя собой субстрат, конкурируя с ним. Так, как часть фермента расходуется на образование комплекса фермент-ингибитор, количество образующего фермент-субстратного комплекса снижается. Фермент Активатор Амилаза слюны Пепсин Липаза поджелудочная Аденозинтрифосфатаза Енолаза, анетил-КоА-синтетаза Хлористый натрий Соляная кислота Желчная кислота Ионы магния, марганца - //- -//- -//- При неконкурентном торможении ингибитор взаимодействует ферментным белком или простетической группой, вследствие чего фермент теряет реакции какоголибо биохимического процесса. Материальное оснащение Реактивы: 0,5% крахмал, слюна в разведении 110,1:5, 0,1% йод в 0,2% йодистом калии, 1% хлористый натрий, 1% сернокислая медь, 1% иод в иодистом калии, 0,5% крахмал, 0,2 М двузамещенный фосфорнокислый натрий, 0,1 М лимонная кислота, 1% хлористый натрий. Оборудование: штативы с пробирками, глазная пипетка, карандаш по стеклу, холодильник (для льда), цилиндр мерный на 10 мл, микробюретки или микропипетки, водяная баня или термостат (температура 37-400С). III.ПОРЯДОК ПРОВЕДЕНИЯ РАБОТЫ Влияние активаторов и ингибиторов. В три пробирки приливают по 3 мл раствора слюны в разведении 13. В первую пробирку добавляют 1 каплю 1% хлористого натрия, во вторую - 1 каплю 1% сернокислой меди, в третью - 1 каплю воды. После этого в каждую пробирку приливают по 5 капель 1% крахмала. Все три пробирки оставляют при комнатной температуре на 1-3 минуты (в зависимости от индивидуальных особенностей активности амилазы). С содержимым каждой пробирки проделывают реакцию на крахмал, приливая по 1 капле раствора йода в йодистом калии. Результаты работы заносят в таблицу 6. 29 Таблица 6 № Субстрат Фермент Добавленное вещество 1 Крахмал Амилаза Хлористый натрий 2 Крахмал Амилаза Медный купорос 3 Крахмал Амилаза Вода Окрашивание в реакции с йодом Примеча-ние Влияние температуры. В 4 пронумерованные пробирки приливают по 10 капель 0,5% раствора крахмала и ставят первую на лед (0С), вторую - в штатив при комнатной температуре (200С), третью - в термостат при температуре 37-400С, четвертую - в кипящую водяную баню (+1000С). Через 5 мин в пробирку с раствором крахмала, который приобрел требуемую температуру, добавляют по 10 капель слюны, разведенной в 10 раз, перемешивают и вновь оставляют на 10 мин при тех же температурах. В это время подготавливаются 4 пробирки с индикатором для продуктов расщепления субстрата крахмала - в каждую из них наливают по 5 мл дистиллированной воды и по 1 капле 0,1% раствора йода в 0,2% йодистом калии. После пятиминутного воздействия фермента амилаза на субстрат крахмал из каждой опытной пробирки отбирают по 1-2 капли в заготовленные пробирки с йодом. Если во всех пробирках жидкость окрасится в синий цвет, то йодную пробу - реакцию с йодом повторяют через следующие 5 мин во вновь заготовленные пробирки с индикатором. Необходимо занести в таблицу 7 окраску исследуемого раствора в каждой пробирке и дать название окрашенному продукту. Таблица 7 Влияние температуры на действие фермента 00С 200С 400С 1000С Окраска субстрата по йодной пробе Название окрашенного продукта Влияние рН среды. Наибольшую активность ферменты проявляют в пределах довольно узкой зоны рН, называемой оптимумом рН. Таблица 8 Оптимальные значения рН для некоторых ферментов Фермент Пепсин Трипсин Сахараза Амилаза слюны Липаза желудочного сока Липаза панкреатическая Оптимум рН 1,0-1,5 8,0-9,0 6,2 6,9-7,0 6,0 7,0-8,5 Активность фермента уменьшается, если рН меняется в любую сторону от оптимального значения. В 7 пробирок наливают 0,2 М двузамещенный фосфорнокислый натрий и 0,1 М лимонную кислоту в соотношениях, указанных в табл. 9. Получают буферные растворы с рН от 5,6 до 8,0. В каждую пробирку добавляют по 10 капель 1% хлористый натрий и 0,5% крахмал, по 10 капель слюны, разведенной в 10 раз. Перемешивают содержимое пробирок и помещают их в водяную баню или термостат при температуре 380С на 5-10 мин (в зависимости от индивидуальных особенностей слюны). Затем во все пробирки добавляют по 1 капле йода в йодистом 30 калии, перемешивают и определяют рН, при котором амилаза действует наиболее активно. Таблица 9 Влияние рН Среды на активность амилазы № п/п 1 2 3 4 5 6 7 Кол-во 0,2 М Кол-во 0,1 фосфорно-кислого лимонной 2-замещенного кислоты, мл натрия, мл 0,58 0,63 0,69 0,77 0,87 0,94 0,97 0,42 0,37 0,31 0,23 0,13 0,06 0,03 М рН смеси Кол-во 0,5% Кол-во Окрашивание крахмала и разведенной йодом 1% слюны 1:100 хлористого натрия по 10 капель по 10 капель 5,6 6,0 6,4 6,8 7,2 7,6 8,0 - с Примечание. В зависимости от активности слюны ее можно разводить не в 100, а в 50 или 10 раз. Вывод: в данной работе были изучены такие свойства ферментов, как термолабильность, т.е. зависимость активности ферментов от температуры, влияние рН, т.е. нахождение наибольший активности ферментов в пределах довольно узкой зоны рН, а также влияние активаторов и ингибиторов на каталитические свойства ферментов. IV. Контрольные вопросы Вариант 1 1. Номенклатура ферментов, их названия. 2. Как влияет время теплового воздействия на величину температурного оптимума? 3. Что такое оптимум рН? Привести примеры. Вариант 2 1. Классификация ферментов по катализируемым реакциям. 2. Написать реакцию гидролиза крахмала. 3. Зависимость действия ферментов от температуры и рН. Вариант 3 1. Что такое ферменты? 2. Что такое термолабильность фермента? 3. Дать схему распада крахмала. Понятие о декстринах. Вариант 4 1. Что такое температурный оптимум ферментов? Инактивация ферментов? 2. Конкурентное и неконкурентное торможение. 3. Какие центры в ферментах вам известны? Вариант 5 1. Что такое эффекторы? Какие эффекторы вам известны? 2. Апоферменты, коферменты, кофакторы. Привести примеры. 3. Для чего добавляют 0,2 М раствор фосфорнокислого 2-замещенного натрия при определений рН оптимум амилазы? 31 ЛАБОРАТОРНАЯ РАБОТА №5 ИЗУЧЕНИЕ СТРОЕНИЯ И СВОЙСТВ УГЛЕВОДОВ ПО КАЧЕСТВЕННЫМ РЕАКЦИЯМ I. ЦЕЛЬ РАБОТЫ Изучить типы классификаций углеводов и их свойств по тем качественным реакциям, в которые они вступают. Студент должен знать: какие принципы лежат в основе всех видов классификаций всех видов углеводов; какие функции выполняют углеводы в живых организмах, чем обусловлено многообразие этих функций; химизм реакций, используемых в производстве и в анализе пищевых продуктов. Студент должен уметь: доказать характерными цветными реакциями принадлежность любого углевода к той или иной группе; объяснить появление цвета химическим строением анализируемого объекта; освоить навыки безопасной работы с кислотами, органическими реактивами, нагревательными приборами. II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Углеводы составляют абсолютное большинство органических соединений на Земле. К углеводам относятся соединения, обладающие разнообразными и часто совершенно различными свойствами. Среди них есть вещества низкомолекулярные и высокомолекулярные, кристаллические и аморфные, растворимые в воде и не растворимые в ней, гидролизуемые и не гидролизуемые, способные очень легко окисляться и сравнительно устойчивые к действию окислителей и т.д. Многообразие свойств находится в тесной связи с химической природой углеводов, со строением их молекул. Этим многообразием объясняется и активное участие углеводов в жизненно важных процессах, протекающих в живых организмах. Являясь основным компонентом нашей ежедневной пищи, углеводы поставляют большую часть энергии, необходимой для живого организма. Углеводы играют основную роль в структуре живых систем, особенно растительного происхождения. Углеводами или сахаридами называют полиоксиальдегиды и полиоксикетоны с общей формулой Cx(H2O)y , а также производные этих соединений. По отношению к реакции гидролиза все углеводы разделяют на простые – моносахариды, которые не подвергаются распаду под действием воды, и сложные – полисахариды, дающие при гидролизе 2 и более моносахаридных звеньев. Простые моносахариды классифицируют в первую очередь по числу углеродных атомов – на биозы, триозы, тетрозы, пентозы, гексозы и т.д. В зависимости от наличия альдо– или кето– группы в составе моносахаридов они делятся на альдозы и кетозы. Альдегидные и кетонные группы в молекулах моносахаридов обычно существуют в полуацетальной форме, образование сложных углеводов из простых происходит в результате типичных химических реакций полуацеталей – их взаимодействия с гидроксильной группой спиртов – при этом образуются полные ацетали или просто ацетали. Связь, с помощью которой моносахариды соединяются друг с другом, называется гликозидной. Эта связь может образоваться между первым атомом углерода, т. е. карбонильным атомом углерода в 32 альдозах (или вторым – карбонильным атомом углерода в кетозах) одного моносахарида и гидроксильной группой при 2, 3, 4 или 6 атоме углерода другого моносахарида. В зависимости от числа моносахаридных остатков, соединенных гликозидными связями, сложные углеводы относят к олигосахаридам или полисахаридам. Олигосахариды (от греческого “олигос” - немного) составлены из 2 – 8 моносахаридных остатков. Поэтому они подразделяются на дисахариды, образованные из двух моносахаридов, трисахариды из трех и т.д. Углеводы с более чем 8 моносахаридными остатками называют полисахаридами; общее число таких остатков может достигать многих сотен и даже тысяч. Во всех случаях, независимо о того два или две тысячи моносахаридов соединены друг с другом, они находятся в циклической форме. В зависимости от того, обладает ли углевод восстановительными свойствами, различают редуцирующие и не редуцирующие сахара. Все моносахариды являются редуцирующими. Восстановительные свойства их обусловлены той небольшой долей молекул со свободными карбонильными группами, которая, присутствует в моносахаридах (в основном, как отмечалось выше, альдегидные и кетонные группы обычно существуют в форме полуацеталей): H OH H OH OH H C – C - C – C - C - CH2 OH O C - C - C – C – C - CH2 OH H OH H H Альдоза Д-глюкоза OH H OH OH HO H OH H полуацеталь Д-глюкопираноза Сложные углеводы далеко не все относятся к редуцирующим: свойства восстановителя проявляют только те, у которых одна из моносахаридных составляющих имеет свободную гидроксильную группу при первом атоме углерода. Это дисахариды мальтоза, целлобиоза, лактоза, в отличие от сахарозы, у которой карбонильные группы обоих моносахаридных остатков вовлечены в гликозидную связь. Все анализы необходимо проводить с полным набором растворов углеводов (5%- ные растворы глюкозы, фруктозы, рибозы, сахарозы и крахмала) и гидролизатов сахарозы и крахмала. Если в ходе реакции получается окраска в соответствии с описанием, в соответствующем столбце таблицы проставляется цвет раствора, если окраска не получилась – ставят прочерк. В данной работе изучаются реакции универсальные (с альфа-нафтолом), характерные только для отдельных углеводов (с сернокислым кобальтом и йодом), для групп углеводов (реакции Селиванова, Мура, с дифениламином). Особый интерес представляют реакции, обусловленные редуцирующими свойствами углеводов (реакции Троммера, Фелинга). Количественное содержание углерода в молекуле углевода можно определить по реакции Толленса. Кроме того, здесь изучаются реакции гидролиза дисахарида и полисахарида. Углеводы способны в присутствии концентрированной серной кислоты образовывать фурфурол, который в свою очередь дает фиолетовую окраску с альфанафтолом и красную с тимолом (реакции Молиша). 33 С сернокислым кобальтом в щелочной среде появляется фиолетовая окраска только в случае наличия сахарозы в растворе. Молекулярный йод используется в качестве реактива на крахмал и гликоген, что связано с адсорбционными свойствами молекул – гигантов этих полисахаридов. Образующийся комплекс в случае крахмала имеет синюю, в случае гликогена – краснобурую окраску. Так, как йод плохо растворим в воде, применяют раствор Люголя – это смесь йода и йодистого калия в воде. Йод с йодистым калием образует легкорастворимый в воде комплекс. Кетозы при нагревании в присутствии кислоты теряют три молекулы воды и образуют оксиметилфурфурол, который при взаимодействии с резорцином дает соединение вишнево-красного цвета, иногда бурый-красный осадок (реакция Селиванова). При нагревании альдоз с кислотами тоже способен образовываться оксиметилфурфурол, но эта реакция протекает значительно медленнее, чем с кетозами, что обусловливает специфичность этой реакции на кетозы. При наличии альдегидной группы в присутствии щелочи в ходе нагревания идет образование карамеланов, что легко обнаруживать по изменению окраски до темнобурной и запаху, свойственному карамели (реакция Мура). При нагревании смеси кетозы и дифениламина образуется интенсивное синее окрашивание. Если в растворе углевода имеется углерод со свободной карбонильной группой (раствор моносахарида) или полисахарида со свободным гликозидным гидроксилом (т. е. при первом углеродном атоме любого моносахарида, входящего в его состав), такая жидкость обладает редуцирующим свойством: она способна восстановить гидроксид меди голубого цвета до гидрата закиси меди (желтого цвета) или до закиси меди (красного цвета). В случае использования солей серебра идет реакция серебряного зеркала, где серебро из одновалентного восстанавливается до элементарного с нулевой валентностью. Реакция с медью протекает так: СuSО4+ 2NаОН= Сu(ОH)2+ Na2SО4 Голубой цвет H O OH C Cu H C OH OH C H H OH + C OH OH Cu H C OH OH CH2OH 34 COOH H C OH OH C H H C OH H C OH желтый цвет 2CuOH + H2O 2CuO красный цвет CH2OH Эта так называемая реакция Троммера. Ее нельзя проводить в присутствии избытка солей меди, т.к. в этом случае желтая и красная окраска маскируется черным осадком окиси меди, образующимся при нагревании избытка гидрата окиси меди в щелочной среде. Для устранения этого недостатка Фелинг предложил проводить реакцию в присутствии сегнетовой соли (калий- натриевая соль виннокаменной кислоты), связывающей избыток гидрата окиси меди и препятствующей, следовательно, образованию окиси меди. Реакция Фелинга лежит в основе многих методов количественного определения углеводов, широко используемых в лабораторной практике для анализа пищевых продуктов и других объектов. Реакция Толленса является специфичной для пентоз. Она обусловлена взаимодействием флороглюцина с фурфуролом, образующимся из пентозы при нагревании с HCl. При этом образуется продукт конденсации красного цвета Дисахариды довольно легко подвергаются гидролизу, распадаясь при этом на составляющие их моносахара: H2SO4 C12H22O11 +H2O C6H12O6 + C6H12O6 Реакция гидролиза сахарозы носит еще свое собственное название – инверсия (от латинского инвентере – обращать, переворачивать), что объясняется изменением угла вращения плоскости поляризованного луча исходной сахарозы. Сахароза вращает его вправо на +66,5º. Смесь равных количеств фруктозы и глюкозы, полученная при гидролизе сахарозы вращает плоскость поляризованного луча влево (фруктоза -92º, глюкоза +52,5º). Инверсия сахарозы имеет большое значение при производстве варенья для предотвращения дефекта засахаривания, т.е. выделения кристаллов сахара. 35 Растворимость смеси сахарозы и инвертного сахара (равных количеств глюкозы и фруктозы, образуемых при гидролизе сахарозы) выше растворимости чистой сахарозы. Поэтому при соотношении сахарозы и инвертного сахара в готовом продукте 1:1 нет опасности засахаривания варенья. Гигантские молекулы крахмала при гидролизе распадаются, давая последовательно декстрины, мальтозу, глюкозу. Декстрины – более простые полисахариды меньшего молекулярного веса, обломки молекулы крахмала. В начале гидролиза образуются амилодекстрины, дающие с йодом фиолетовую окраску, затем эритродекстрины, дающие с йодом красно-бурое окрашивание и, наконец, ахродекстрины, не окрашивающиеся йодом. Затем идут мальтодекстрины. Следующим за декстринами продуктом гидролиза является дисахарид мальтоза, который в свою очередь распадается на две молекулы моносахарида глюкозы. Материальное оснащение Реактивы: 5%-ные растворы углеводов (глюкаоза, фруктоза, сахароза, лактоза, крахмал и др.); 0,2%-ный раствор альфа- нафтола, тимол спиртовый раствор, Н2SО4 конц., сернокислый кобальт, раствор дифениламина, раствора Люголя; Реактив Селиванова; 30% NаОН; раствор СuSО4; реактив Фелинга I и II, флороглюцина; 10% NаОН. Оборудование: штативы, пробирки, водяная баня, спиртовка. III.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ Реакция Молиша. В ряд пробирок, соответствующий количеству испытуемых сахаров, наливают по 2 мл раствора сахаров. Во все пробирки добавляют по 5 капель 0,2%-ного раствора альфа- нафтола. Затем по стенкам осторожно наливают по 5 капель концентрированной серной кислоты. Не перемешивая содержимое пробирок, отмечают результат в таблице. Аналогично проводят реакцию с тимолом, взяв его вместо альфанафтола. Проба с сернокислым кобальтом. К 2 мл испытуемых растворов прилить несколько капель сернокислого кобальта и около 1 мл щелочи. Наблюдаемую окраску записать в таблицу. Реакция с йодом. В пробирки с 2 мл испытуемых углеводов прибавляют 2-3 капли раствора Люголя. Результат наблюдения заносят в таблицу. Реакция Селиванова. В ряд пробирок наливают по 2 мл реактива Селиванова и по 2 капли исследуемых сахаров. Нагревают на кипящей водяной бане и через 2 мин наблюдают, появляется ли окрашивание. Реакция Мура. В пробирки с 2 мл исследуемых сахаров добавляют столько же 30%-ного раствора едкого натрия. Смесь нагревают до кипения. После появления окраски осторожно подкисляют разбавленной кислотой, при этом более ощутимым становится запах. Реакция с дифениламином. К 1 мл исследуемых сахаров добавить 0,5 мл раствора дифениламина и 1 мл соляной кислоты. Смесь нагревают в кипящей водяной бане. С момента появления окраски продолжают нагревать еще 5 минут. Реакция по Троммеру. В ряд пробирок с 2 мл исследуемых растворов добавляют по 2 мл едкого натра и по каплям медный купорос до появления гидрата окиси меди (неисчезающая муть), затем верхнюю часть пробирок осторожно нагревают и следят за изменением цвета в соответствующих реакции пробирках. Конечный результат заносят в таблицу. 36 Реакция по Фелингу. В ряд пробирок с 2 мл испытуемого раствора вносят по 1 мл реактивов Фелинга ( I и II) нагревают. Реакция Толленса. В ряд пробирок с 1 мл испытуемых сахаров вносят по 5-7 капель раствора флороглюцина в соляной кислоте и кипятят смесь в течение 1 минуты. Наблюдаемое изменение окраски в пробирках фиксируют в таблице. Гидролиз сахарозы. В пробирку вносят 2 мл раствора сахарозы и 1 мл 10%ного раствора серной кислоты. Нагревают смесь до кипения, после 1-2 мин кипячения содержимое пробирки, т.е. гидролизат, нейтрализуют по индикатору рН=7 и, разделив нейтрализованный гидролизат по трем пробиркам, проводят реакцию по Троммеру, Селиванову, Муру. Результаты заносят в таблицу по строке - сахароза после гидролиза. Гидролиз крахмала. В пробирку вносят 1 мл раствора крахмала и 1 мл серной кислоты. После встряхивания отбирают две капли смеси в другую пробирку и добавляют раствор Люголя, обнаруживают крахмал (синяя окраска). Пробирку со смесью раствора крахмала и серной кислоты помещают в кипящую водяную баню для гидролиза. Через каждую минуту из этой пробирки отбирают пробы раствора, переносят их в пустые пробирки. Сразу же после взятия каждой пробы к ней добавляют каплю раствора Люголя и отмечают цвет. Пробы берут до тех пор, пока продукты гидролиза не перестанут окрашиваться йодом (до естественной окраски самого разбавленного йода - желтой). Затем в оставшемся гидролизате после его нейтрализации открывают присутствие глюкозы (реакцией по Троммеру и Муру). Результаты заносят в табл. 10. 37 Таблица 10 № п/п Исследуемые растворы сахаров Характерные реакции 1 Галактоза Молиша Реакт. Окрас тимол красный 2 Лактоза тимол красный 3 Глюкоза тимол красный 4 Крахмал тимол красный 5 Сахароза тимол красный 6 Крахмал после гидролиза Сахароза после гидролиза 7 Селиванова Реакт. Окрас Реактив желтый Селиванова Реактив желтый Селиванова Реактив желтый Селиванова Реактив желтый Селиванова Реактив ВишневоСеливанова красный Реактив Селиванова с кобальтом с йодом Мура Реакт. Окрас Реакт. Окрас Реакт. Окрас CoSO4 синий Раствор Желтый Люголя CoSO4 синий Раствор Желтый Люголя CoSO4 синий Раствор Желтый Люголя CoSO4 синий Раствор Желтый Люголя CoSO4 синий Раствор Желтый Люголя Раствор Желтый Люголя Троммеру Реакт. Окрас Фелинг Реакт. Окрас Вишневокрасный Вывод: в данной работе были изучены типы классификаций углеводов и их свойств по качественным реакциям, в которые они вступают. Были изучены универсальные реакции ( с альфа-нафтолом и тимолом), характерные только для отдельных углеводов и т.д. 38 IV. 1. 2. 3. Контрольные вопросы Вариант 1 Приведите примеры низкомолекулярных и высокомолекулярных углеводов. Напишите формулы. Физические, химические свойства этих углеводов. Что такое альдозы и кетозы? Приведите примеры цветных реакций. Гидролиз крахмала. Техники анализа. Ступенчатость схемы распада. Какими цветными реакциями подтверждается этот процесс? Вариант 2 1. Какие функции выполняют углеводы в живых организмах? Приведите примеры. 2. Что такое простые и сложные углеводы? Приведите примеры. 3. Приведите примеры специфических цветных реакций. Техника анализа Вариант 3 1. Приведите примеры гидролизуемых и негидролизуемых углеводов. Строение их молекул. Физические и химические свойства этих углеводов. 2. Как классифицируются простые углеводы? 3. Обладают ли сложные углеводы восстановительными свойствами? Примеры. Вариант 4 1. Закон перехода количественных изменений в качественные на примере углеводов. 2. Что такое гликозидная связь? Где она образуется? Формулы полуацеталей. 3. Приведите примеры универсальных цветных реакций на углеводы. Вариант 5 1. Приведите примеры углеводов, растворимых в воде и не растворимых, кристаллических и аморфных. От чего зависят эти свойства? 2. Как образуется сложные углеводы? Анализ и синтез на примере сложных углеводов. 3. Приведите примеры цветных реакций, характеризующих наличие или отсутствие восстановительных свойств углеводов. Техники, химизм проведения реакций. Вариант 6 1. Чем объясняется формулы многообразия свойств углеводы? 2. Как классифицируются сложные углеводы? 3. Гидролиз сахарозы. Техника анализа? Каким цветным реакциями протекание реакций гидролиза. доказывается Вариант 7 1. Приведите примеры легко окисляющихся и не окисляющихся углеводов. Напишите формулы. 2. Отличия олисахаридов и полисахаридов. Формулы наиболее распространеных представителей. 3. Инверсия. Сущность процесса его практическое применение. 39 ЛАБОРАТОРНАЯ РАБОТА № 6 РОЛЬ КЛЕТЧАТКИ В ЖИЗНЕДЕЯТЕЛЬНОСТИ И МЕТОДЫ ЕЁ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ I. ЦЕЛЬ РАБОТЫ Изучить свойства клетчатки, её роль в жизнедеятельности, научиться определять ее количественное содержание. Определение содержания "сырой" клетчатки основано на разложении всех других органических веществ, входящих в состав исследуемого продукта, кроме клетчатки, при кипячении проб в кислоте и щелочи (по Геннебергу и Штоману). Студент должен знать: классификации углеводов; к какому классу относятся целлюлоза и гемицеллюлозы, их строение; как протекает гидролиз этих соединений; методы определения «сырой» клетчатки. Студент должен уметь: ориентироваться в роли и распространении клетчатки в природе, в значении ее на процессы пищеварения, во влиянии ее на ход технологических процессов; вести расчеты по результатам весового анализа. II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Зерновые, овощи и фрукты содержат лигнин, целлюлозу, пектин и другие соединения – так называемые волокнистые вещества. Эти углеводы, которые не усваиваются и не принимают непосредственного участия в обменных процессах организме, так как в пищеварительном тракте человека не вырабатываются ферменты, способные их расщеплять. Поэтому считалось: если пищевые волокна не перевариваются в желудочно-кишечном тракте, значит, они являются балластом и от них следует избавиться. Такая позиция поддерживалась развитием технологии производства продуктов питания. Однако недостаточное потребление волокнистых веществ привело к статически достоверному росту раковых заболеваний толстой кишки. Сейчас ученные пришли к выводу, что волокнистые вещества необходимы в питании для здоровья человека, так как они способны удерживать воду в просвете кишки, увеличивая тем самым объем пищевого комка, стимулируя перистальтику и ускоряя движение по кишечнику, сокращая время контакта вредных продуктов переваривания пищи и загрязняющих ее веществ со слизистой оболочкой толстой кишки. Их сорбционная, связывающая способность к таким вредным для организма веществам, как холестерин, мочевина, микотоксины, канцерогены, органические и желчные кислоты и другие. А ведь 10 г пищевых волокон – лишь четвертая-пятая часть суточной потребности человека. Оптимальное количество пищевых волокон в сутки в среднем должно быть в пределах 40 – 70 г (в зависимости от индивидуальных, климатогеографических и национально-генетических особенностей людей). Большую часть пищевых волокон составляет клетчатка. В понятие «клетчатка» разные ученые вкладывают далеко не одинаковый смысл: одни считают, что клетчатка состоит из целлюлозы и маннита, другие – только из лигнина и гемицеллюлоз. Третьи вводят термин «полу клетчатка» и только им 40 называют гемицеллюлозы – большую группу полисахаридов, не растворяющихся в воде, но растворимых в щелочных растворах. Однако все ученые сходятся в следующем: клетчатка-наиболее широко распространенные вещества на нашей планете – на ее долю приходится до 50 % углерода всей биомассы. Молекулярный вес клетчатки точно не установлен (3300001 900000). Это объясняется тем, что клетчатка не является индивидуальным веществом, а представляет собой смесь разнообразных веществ: целлюлозы, гемицеллюлоз, инкрустирующих веществ и др. Молекулы клетчатки имеют нитевидную форму. Они соединяются в пучки, называемые мицеллами. Каждая мицелла состоит приблизительно из 60 молекул клетчатки. Соединение отдельных молекул клетчатки в мицеллы происходит водородными связями. На рисунке показана схема водородных связей между параллельными молекулами сухой (А) и увлажненной (Б) клетчатки. Н Н O - OH O H O O HO H H O O OH O H H H O O HO Н H H H O O OH O H H H O O H O O H O Б) A) Водородная связь гораздо менее прочна, чем обычная химическая связь. Однако значительное число водородных связей в мицеллах клетчатки обуславливают прочность этого полисахарида. Мицеллы образуют определенным образом ориентированную сетчатую структуру. При одревеснении клетчатых стенок имеющиеся между мицеллами пустоты заполняются лигнином. Клетчатка не является питательным веществом, т.к. она не переваривается в желудочно-кишечном тракте человека и не может, следовательно, служить источником энергии и пластического материала. Поэтому много лет в науке о питании все не перевариваемые полисахариды (сюда же входят пектиновые вещества) называли «балластными веществами». Этот термин сейчас устарел в связи с тем, что в основе современной трофологии (науки о питании) лежит парадигма адекватного питания, т. е. питания, соответствующего строению и особенностям желудочно-кишечного тракта, 41 преобладанию мембранного пищеварения в нем, созданию необходимых условий для жизнедеятельности микрофлоры кишечника. В трофологии введено понятие «пищевые волокна». Оно в полной мере отражает ту огромную роль, которую эти вещества (клетчатка и пектины) играют в жизнедеятельности человека. Ведь благодаря пищевым волокнам обеспечивается необходимый суточный объем пищи (не менее 2,0-2,5 кг), при котором наступает чувство насыщения; создаются благоприятные условия для нормального продвижения пищи по желудочно-кишечному тракту. Пищевые волокна нормализуют деятельность полезной кишечной микрофлоры, способствуют выведению из организма шлаков и избыточного холестерина, выступая как сорбент. Итак, основные составляющие клетчатки, а значит и пищевых волокон – это целлюлоза и гемицеллюлозы. Целлюлоза, так же как крахмал и гликоген, является полимером глюкозы. Только вследствие различий в пространственном расположении кислородного мостика, соединяющего остатки глюкозы, крахмал и гликоген растворимы в воде, подвергаются распаду в пищеварительном тракте, тогда как целлюлоза в воде не растворяется, а лишь набухает и в желудочно-кишечном тракте остается неизменной до толстого кишечника. Вот здесь реализуется еще одно положительное свойство целлюлозы и других компонентов пищевых волокон: они становятся питательной средой для микрофлоры кишечника, в результате полезной жизнедеятельности которых образуется много биологически активных веществ в частности витаминов В12. При кипячении с крепкой серной кислотой целлюлоза нацело превращается в глюкозу, при более слабом гидролизе из целлюлозы получается целлобиоза. В молекуле целлюлозы остатки α – и β- глюкозы связаны гликозидными связями β1-4 в виде длинной цепочки. Гемицеллюлозы гидролизуются легче, чем целлюлоза, образуются при этом различные моносахара – маннноза, глюкоза, арабиноза, ксилоза и поэтому, соответственно носят названия: гемицеллюлозы гексаны, маннаны, галактаны, гемицеллюлозы пентозы – арабаны и ксиланы. В значительном количестве гемицеллюлозы сосредоточены в древеснеющих частях растений – в кожуре, семенах, орехах, кукурузных початках. Пищевые волокна попадают в организм человека преимущественно с овощами, фруктами, изделиями из зерновых культур (крупы, мука грубого помола). В питании некоторых групп очень мало пищевых волокон из-за того, что они предпочитают высоко рафинированные продукты: сладости из муки высших сортов, осветленные прозрачные соки и др. Это является одной из причин, так называемых болезней цивилизации – атеросклероз, диабета, атонии кишечника, ожирения, нарушений обмена веществ и др. Кроме того, пища, богатая пищевыми волокнами привносит в организм и другие некалорийные, но необходимые вещества – витамины, макро- и микроэлементы. При сбалансированном питании нерафинированными продуктами растительного и животного происхождения происходит боле полное переваривание пищи. Таким образом, широкое распространение клетчатки в растительном мире, современные взгляды на пищеварение, признание позитивной роли пищевых волокон в нем, влияние их на технологические процессы обуславливают необходимость изучения методов количественного определения клетчатки в сырье и продуктах, так как количество клетчатки в них характеризует их пищевую ценность. При определении клетчатки ее полное отделение от всех сопровождающих веществ представляет большие трудности, поэтому в лабораторной практике чаще всего определяют нечистую, «сырую» клетчатку. «Сырая» клетчатка представляет собой смесь остатков от отработки пробы слабыми кислотами и щелочами. Серная 42 кислота гидролизует нерастворимые в воде (один из компонентов крахмала амилопектин и частично гемиллюлозы), растворяет амиды, алкалоиды и часть минеральных веществ, омыляет и эмульгирует жиры, растворяет гемицеллюлоз, белковых и зольных веществ. Существующие методы определения клетчатки сводятся к переводу в растворимое состояние всех частей исследуемого объекта, кроме клетчатки, к получению промытого, высушенного и взвешенного остатка. Такое отделение клетчатки от других соединений основано на ее значительной стойкости при действии обычных гидролизующих и даже окисляющих средств, которые разлагают и переводят в раствор основную массу сопровождающих веществ, почти не изменяя химического состава самой клетчатки. Из этой группы методов чаще всего применяют метод Геннеберга и Штоманна или его упрощенные модификации. Метод Кюршнера и Ермакова позволяет почти полностью удалить лигнин и гемицеллюлозы, однако он трудоемок и требует набора дорогих реактивов. Некоторые авторы для получения более точных результатов массу сырой клетчатки подвергают озолению и по разности определяют содержание целлюлозы. Из методов определения целлюлозы наиболее точным является метод глубокого гидролиза обработкой серной кислотой с переводом целлюлозы в глюкозу. В лабораторном учебном практикуме предлагается ускоренный метод. Материальное оснащение Реактивы: раствор серной кислоты – 1,25% (автоматической пипеткой берут 7,0 мл серной кислоты уд. веса 1,84 и доливают дистиллированной водой до литра или отмеривают кислоту цилиндром, но проверяют концентрацию раствора титрованной щелочью); раствор едкого калия 5%; лакмусовая или универсальная индикаторная бумага; Приборы: аналитические весы, сушильный шкаф, бюксы, фильтровальная бумага, колбы, воронки. III.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ Объектами исследования могут быть как свежие овощи и плоды, так и в высушенном состоянии. Свежие картофель, морковь, лук или другие объекты очищаются от кожицы и тщательно измельчаются, после чего на аналитических весах отвешивают две параллельные навески в размере около 2 г. Высушенные объекты перед взятием навески тщательно измельчают, после чего берут навески, размер которых рассчитываются, исходя из содержания сухих веществ или влаги в свежем и высушенном объекте и размере свежей пробы. Навески переносят в стаканы на 600 мл, приливают по 200 мл 1,25% водного раствора серной кислоты. Уровень жидкости отмечают карандашом. Содержимое стаканов кипятят на плитке с асбестовой сеткой в течение 30 мин под тягой. По мере испарения жидкости в стаканы доливают до уровня метки кипящую дистиллированную воду, чтобы концентрация раствора не увеличивалась. Содержимое стаканов периодически перемешивают стеклянной палочкой с надетой на конец резиновой трубкой. Пока жидкость в стакане кипит, подготавливают прибор для фильтрования, состоящий из водоструйного насоса, колбы Бунзена, воронки Бюхнера, стакана и трубок. Сам процесс фильтрования здесь представляет некоторую сложность и требует 43 определенного опыта в работе. Учитывая это, для проведения данной работы использована упрощенная модификация метода по опыту научно-исследовательской лаборатории Всесоюзного института животноводства. Прибор очень прост и состоит из конической колбы на 500-600 мл, и воронки диаметром 15-20 см. Внутрь воронки вкладывается фильтр того же диаметра, что и воронка, из шелка или поплина (применение плотной материи вместо бумажного фильтра имеет преимущество: дает возможность многократно пользоваться одним и тем же кусочком материи, с которого легко смываются частички клетчатки). После получасового кипячения стакан снимают с огня, содержимому дают осесть и горячую жидкость фильтруют через подготовленный фильтр. Ткань хорошо пропускает воду и задерживает все твердые, не растворившиеся при кипячении в кислоте частички исследуемого объекта. Кислота в данном случае не будет разъедать фильтра, т.к. используется она в концентрации 1,25 %. Кроме того, концентрация ее на поверхности ткани сразу же упадет, вследствие немедленного трехкратного промывания осадка горячей дистиллированной водой до нейтральной реакции. Придерживая воронку с фильтром над стаканом на 600 мл, сильной струей горячей воды из промывалки смывают все частицы вещества, приставшие к фильтру и к воронке, т.е. производят перенос осадка в чистый стакан. После чего туда же наливают 50 мл 5% водного раствора едкого калия (или натрия) и доводят общий объем жидкости в стакане горячей дистиллированной водой до 200 мл. Перемешав содержимое палочкой, кипятят его 30 мин, подливая по мере испарения горячую воду до метки. За время получасового щелочного кипячения жидкости необходимо подготовить фильтры из фильтробумаги, диаметром 15-20 см и вложить их в металлические бюксы с крышкой (2 фильтра). Оба бюкса с фильтрами и крышкой взвешивают на аналитических весах с точностью до 0,001 г и ставят в сушильный шкаф с прикрытой крышкой. Высушивание ведется в течение 30-40 мин., затем бюксы ставят в эксикатор на 15-20 мин для охлаждения и взвешивают непосредственно перед фильтрованием. После щелочного кипячения в раствор переходит большая часть всех оставшихся органических веществ из исследуемой пробы. Остается лишь "сырая" клетчатка. Фильтрование осадка проводится также, как было указано выше после кислотной обработки: сначала содержимое стакана фильтруют через матерчатый фильтр. Затем ведется промывание осадка большим количеством горячей дистиллированной воды до полного удаления щелочи (проба по индикатору). Затем клетчатку с матерчатого фильтра необходимо перенести на бумажный фильтр, предварительно высушенный в бюксе до постоянной массы и взвешенный с точностью до 0,001. Перенос осуществляется путем смывания клетчатки с плотного фильтра струёй горячей дистиллированной воды из промывалки в чистый стакан. После чего из этого стакана осадок от промывной воды отфильтровывают через подготовленный бумажный фильтр. После ополаскивания стакана и стекания воды с бумажного фильтра с клетчаткой его вынимают из воронки, складывают пакетом и сначала подсушивают на воздухе или в сушильном шкафу, а затем вкладывают в соответствующую бюксу и высушивают в шкафу при температуре 100-105С до постоянного веса. После чего бюксы с фильтром и исследуемым веществом взвешивают с точностью до 0,001 г, предварительно поместив их в эксикатор для охлаждения. При наличии в лаборатории органических растворителей (спирт, эфир) можно получить более точные результаты. После ополаскивания стакана и стекания воды с фильтра с клетчаткой осадок клетчатки, оставшийся на фильтре, промывают 2-3 раза 44 спиртом, а потом столько же раз эфиром. Часть веществ, нерастворимых в воде, серной кислоте и щелочи, при этом извлекается спиртом и эфиром. Кроме того, спирт удаляет из осадка воду, а эфир – спирт. Обезвоженный фильтр с осадком идет на высушивание. Результаты анализа оформляют в виде табл. 11. Таблицы 11 Количественное определение «сырой» клетчатки № п\п пробы Исслед. продукт 1 Картофель Навеска продукта г 2,0 Масса бюкса с пустым фильтром после высуш., г 18,23 Масса бюкса с фильтром и клетчаткой, г 19,82 Масса бюкса с фильтром и клетч. после I высуш., г 18,93 Масса бюкса с фильтром и клет. после II высуш., г 18,27 Масса «сырой» клетчатки г Конц клетчатки в% 0,04 2 Для расчета содержания клетчатки в растительном материале при естественной влажности и в воздушно - сухом состоянии используют следующую формулу: х = а 100/ в; где: х содержание "сырой" клетчатки, % на естественную влажность или в воздушно-сухом состоянии (в зависимости от состояния исследуемого продукта); а вес "сырой" клетчатки, г; а = d c; где: d масса бюкса с фильтром и клетчаткой после третьего (или второго) высушивания; c – масса бюкса с пустым фильтром; в – навеска свежего исследуемого вещества или в воздушно-сухом состоянии, г. Для взятия навески сушеного продукта проведут предварительный расчет. Пример расчета: Расчет навески для лука сушенного, если в естественном, свежем виде навеска составляет 2 г (содержания сухих веществ в луке 10%). В луке сушеном, по ГОСТу – 12-14% остаточной влаги, т.е. 88-86 % с.в. Используем формулу закона действующих масс: m1c1 = m2c2; 2 г 10% = X г 86%; Х= 210/86 0,23 г значит, навеска сушеного лука должна быть в пределах 0,2 – 0,3 г, пересчет содержания клетчатки на абсолютно сухое вещество: в свежем луке обнаружено 1,5% клетчатки. Концентрация сухих веществ в свежем луке – 10 %; Значит 1,5 г клетчатка – в 10 г с.в. (или в 100 г свежего лука); Х г клетчатки – в 100 г абсолютно сухого вещества этого лука; Х = 1,5 100/10 = 15 % клетчатки на абсолютно сухое вещество. 45 IV. Контрольные вопросы Вариант 1 1. Классификации углеводов, роль различных групп в живых организмах. 2. Очередность операций для количественного определения клетчатки. 3. Пищевые волокна, их состав и роль в организме. Вариант 2 1. Что такое «клетчатка»? 2. Виды фильтрующих материалов, используемых в работе. 3. Строение и свойства целлюлозы. Вариант 3 1. Компоненты клетчатки. 2. Техника первого этапа ускоренного метода анализа. 3. Расчетная формула для определения количества клетчатки. Вариант 4 1. Что понимают под термином «балластные» вещества? 2. Подготовка проб пищевых продуктов к анализу. 3. Расчет количественного содержания клетчатки по результатам анализа. Вариант 5 1. Что такое «пищевые волокна»? 2. Какие приемы позволяют получить данные по количеству клетчатки? 3. Техника высушивания до постоянной массы. Вариант 6 1. Роль пищевых волокон в пищеварении. 2. Что такое «сырая» клетчатка? 3. Подготовка бумажных фильтров в работе. Вариант 7 1. Строение основных составляющих клетчатки, и их свойства. 2. Основной принцип методов определения клетчатки. 3. Почему целлюлоза не переваривается в желудочно-кишечном тракте? Вариант 8 1. Главные поставщики пищевых волокон в питании. 2. Понятия «чистой» и «сырой» клетчатки. 3. Что общего и чем отличаются друг от друга крахмал и целлюлоза? 46 ЛАБОРАТОРНАЯ РАБОТА №7 ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЕЙ КАЧЕСТВА ЖИРОВ А. Определение кислотного числа жиров I.ЦЕЛЬ РАБОТЫ Изучить метод определения содержания свободных жирных кислот в жире, определить кислотное число в исследуемом продукте. Студент должен знать: строение, классификацию и свойства липидов; наиболее распространенные жирные кислоты и их свойства; смысл константы «кислотное число» и принцип метода определения кислотного числа жиров; методы определения кислотного числа. Студент должен уметь: по полученным данным рассчитать кислотное число данного жира; по величине кислотного числа судить о степени свежести и сортности жира. II.КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Пищевые жиры представляют собой смесь различных триацилглициридов со свободными жирными кислотами. На нейтрализацию последних всегда расходуется некоторое количество щелочи, поэтому некоторое количество несвязанных жирных кислот в составе даже очень свежего жира всегда имеется. Кислотным числом жира называется количество миллиграмм (мг) гидроокиси калия или натрия. Необходимое для нейтрализации свободных жирных кислот, содержащихся в одном грамме жира или миллилитре масла. Кислотное число является важным показателем свойств и состояния жира. При хранении жиров или тепловой обработки под действием кислорода воздуха, света, высокой температуры, в присутствии воды, триацилглицириды распадаются на глицерин и жирные кислоты таким образом, общее количество свободных жирных кислот возрастает, а вместе с ним растет и кислотное число. Чем выше кислотное число, тем ниже его сортность. При кислотном числе выше 4,5 растительное масло не допускается в промышленную переработку. Отработанное масло, у которого кислотно число перешло допустимое значение – 2,5 используется для технических целей. Материальное оснащение Реактивы: калия гидроокись ч.д.а.; 0,1 н водный или спиртовой раствор калия или натрия гидрокись 0,1 н водный или спиртовый раствор; спирт этиловый технический (гидролизный) или спирт синтетический, или спирт этиловый ректификованный технический; эфир диэтиловый; фенолфталеин 1%-ный спиртовый раствор; вода дистиллированная; смесь растворителей: спирто-эфирная. Спирто-эфирную смесь готовят из двух частей диэтилового эфира и одной части этилового спирта с добавлением 5 капель раствора фенолфталеина на 50 мл смеси. Смесь нейтрализуют 0,1 н раствором гидроокиси калия или натрия до едва заметной 47 розовой окраски. При использовании спирто-эфирной смеси титрование проводят водным или спиртовым раствором гидроокиси. Весы лабораторные; баня водяная; колбы конические вместимостью 250 мл; бюретки с делениями 0,1 мл вместимостью 25 и 50 мл; бюретки с делениями 0,01 и 0,02 мл вместимостью 2 или 5 мл (для определения кислотного числа менее 2 мг КОН/г); бумага фильтровальная лабораторная. III. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ В коническую колбу отвешивают с погрешностью не более 0,01 г 3...5 г масла, приливают 50 мл нейтрализованной смеси растворителей и взбалтывают. Если при этом масло не растворяется, его нагревают на водяной бане, охлаждают до температуры 15...20С. Полученный раствор масла при постоянном взбалтывании быстро титруют 0,1 н раствором гидроокиси калия или натрия до получения слабо-розовой окраски, устойчивой в течение 30 с. При титровании 0,1 н водным раствором гидроокиси калия или натрия количество спирта, применяемого вместе с эфиром, во избежание гидролиза раствора мыла, должно не менее чем в 5 раз превышать количество израсходованного раствора гидроокиси. При кислотном числе масла свыше 6 мг КОН г берут навеску масла с погрешностью не более 0,01 г 1...2 г и растворяют ее в 40 мл нейтрализованной смеси растворителей. При кислотном числе масла менее 2 мг КОН/г титрование ведут из микробюретки. Результаты работы заносят в таблицу 12. Таблица12 Продукт Вес колбы, г Вес колбы с Навеска, г Количество КОН, пошедшее на жиром, г титрование, мл Кислотное число масла (в мг КОН/г) вычисляется по формуле: К.ч. = 5,611 КV/n, где 5,611 коэффициент, равный значению расчетной массы КОН в 1 мл 0,1 Н раствора КОН, а при использовании NaOH этот коэффициент получают путем умножения расчетной массы NaOH в 1 мл 0,1 н раствора (равной 4,0) на 1,4 отношение молекулярных масс КОН и NaOH; К поправка к титру 0,1 н раствора гидроокиси калия или натрия; V объем 0,1 н раствора гидроокиси калия или натрия, израсходованного на титрование, мл; n масса масла, г. За окончательный результат принимают среднее арифметическое двух или трех параллельных определений. При разногласии в оценке качества продукции за окончательный результат принимают среднее арифметическое не менее чем четырех параллельных определений, полученных потенциометрическим или индикаторным методом. 48 Вычисления проводят с точностью до второго знака после запятой, с последующим округлением результата до первого знака. IV. Контрольные вопросы Вариант 1 1. Напишите реакцию гидролиза глицеридов. 2. Дайте определение кислотнoму числу. 3. Почему по кислотному числу можно судить о степени свежести жира? Вариант 2 1. Выведите самостоятельную расчетную формулу определения к.ч. жира? 2. Почему при хранении или тепловой обработке к.ч. повышается? 3. Принципы метода определение к.ч. Вариант 3 I. Состав природного жира? 2. Ход работы определения к.ч. 3. Есть ли существенное определения к.ч. твердых и жидких жиров? Вариант 4 1. Классификация липидов. 2. Почему по кислoтному числу можно судить о степени свежести жира? 3. Принцип метода определения к.ч. Вариант 5 1. Напишите реакцию титрования при определении к.ч. 2. Основные физические свойства липидов. 3. Верхний предел к.ч. для пищевых жиров, как можно использовать негодный для пищевых целей жир? Bapиант 6 I. Для чего при определении делают минимум два титрования? 2. Что такое к.ч.? 3. Напишите реакцию гидролиза нейтральных жиров. Б. Определение числа омыления жиров I. ЦЕЛЬ РАБОТЫ Цель работы заключается в определении величины числа омыления конкретного технологического жира; необходимо также сравнить жиры различного происхождения по величине числа омыления. Студент должен знать: химический состав и физико-химические свойства липидов; характеристику насыщенных, ненасыщенных и других жиров кислот, входящих в состав жиров; число омыления и эфирное число жиров; 49 Студент должен уметь: работать с органическими растворителями; брать навески жира на аналитических весах по разности; судить о количестве свободных и связанных кислот в жирах различного происхождения по величине числа омыления. II.КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Числом омыления называется число миллиграммов гидроксида калия или натрия, необходимое для нейтрализации как свободных, так и связанных (в форме глицеридов) жирных кислот, содержащихся в 1 г жира. Содержание свободных жирных кислот в масле характеризуется кислотным числом, содержание свободных и связанных – числом омыления, число связанных кислот определяется расчетным путем и называется эфирным числом. Таким образом, эфирное число выражается числом миллиграммов при омылении эфирных связей жирных кислот в 1 г масла. Экспериментально эфирное число определяется по разности между числом омыления и кислотным числом. При хранении сливочного масла и маргарина происходит прогоркание, вызванное самопроизвольным омылением, выделившаяся при этом масляная кислота придает неприятный запах. Эфирное число дает представление о низко- и высокомолекулярности остатков жирных кислот в нейтральных жирах, различные по сорту или природе нейтральные жиры могут иметь разные количества связанных кислот (связей) и, соответственно, количество глицерина. То масло, которое при одинаковой массе дает большое значение эфирного числа имеет больше низкомолекулярных жирных кислот. В противном случае, больше высокомолекулярных жирных кислот. Материальное оснащение Реактивы: Гидроксид калия или натрия (0,5 н) в спирте (95%-ном); соляная кислота (0,5 н титрованная); фенолфталеин (1%-ный спиртовый раствор). Оборудования: Весы аналитические; баня водяная; колбы конические на 50 мл с обратным холодильником (2 шт.); пипетки градуированные; бюретки на 25 или 50 мл (2 шт.). III. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ В одну колбу емкостью 50 мл вносят 0,5 г жира, отвешенного на аналитических весах, а в другую - 0,5 мл воды. Затем в обе колбы добавляют на 15 мл 0,5 н спиртового раствора гидроксида калия. Колбы закрывают пробками с обратными воздушными холодильниками (длина 70) и нагревают на кипящей водяной бане в течение 3040 мин при периодическом встряхивании. Нужно, чтобы жидкость в колбе слабо кипело и чтобы верхняя часть трубки не нагревалось. По окончании омыления в каждую колбу добавляют по 1520 мл воды, по 34 капли фенолфталеина и титруют 0,5 н раствором соляной кислоты заносят в следующую таблицу 13. 50 Таблица 13 Продукт Масса колбы с пробкой без масла Масса колбы, с маслом, г Навеска, г Количество 0,5 н HCl пошедшее на титрование Контр. опыт рабочий опыт Расчет числа омыления производят по формуле: Число омыления = (V1- V2)K 28,05 / , где V1 объем 0,5 н раствора HCI, идущей на титрование контрольного раствора (колба с водой), мл; V2 объем 0,5 н раствора, затраченного на титрование опытного раствора (колба с жиром); К поправка к титру HCl; масса жира, г. За окончательный результат принимают среднее арифметическое двух или трех параллельных определений. По результатам определения к.ч. и числа омыления вычисляют эфирное число жира. IV. Контрольные вопросы Вариант 1 1. Что называется числом омыления? 2. Напишите реакцию взаимодействия жира со щелочью. 3. Почему раствор гидpоксида калия готовится на спирту? Вариант 2 1. Что характеризует эфирное число? 2. Что такое мыло с химической точки зрения? 3. Выделите самостоятельно формулу определения эфирного числа. Вариант 3 I. Напишите реакцию титрования при определении числа омыления. 2. Для чего определяют число омыления? 3. Принцип метода определения числа омыления. Вариант 4 1. Для чего проводят контрольную работу? 2. Можно ли судить о пищевой ценности жира по эфирному числу? 3. Классификация липидов. Вариант 5 1. Как происходит прогоркание сливочного масла и маргарина? 3. Принцип метода определения числа омыления. 3. Формула расчета при определении числа омыления. 51 В. Определение йодного числа масла I. ЦЕЛЬ РАБОТЫ Определить величину йодного числа конкретного технического жира, дать техническую характеристику исследуемому жиру. Студент должен знать: химический состав природных жиров; характеристику ненасыщенных жирных кислот, входящих в состав жиров; определение понятия "жировые константы", в частности "йодное число строение, классификацию и свойства липидов; Студент должен уметь: брать навески масла материалов; определять величину йодного числа с выводом расчетной формулы; находить зависимость между величиной йодного числа жира и его температурой плавления; вывести расчетную формулу для определения йодного числа. II. КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Как написано выше, жирные кислоты, входящие в состав глицеридов, практически определяют их физико-химические свойства. Так, если в составе преобладают ненасыщенные кислоты, то температура плавления такого жира низкая и при обычных условиях он жидкий. Например, в составе подсолнечного масла 39% олеиновой и 46% линолевой ненасыщенных кислот и температура плавления его равна 21⁰С. О степени ненасыщенности жира, а значит, и о его склонности к окислению (высыханию, прогорканию) и другим изменениям, происходящим при хранении и переработке пищевых и технических масел, судят по величине йодного числа. Йодное число выражается количеством граммов йода, которое присоединяется к двойным связям к 100 г жира. Чем выше йодное число, тем более жидок данный жир, тем более он пригоден для приготовления лаков, красок и олифы, и тем менее он пригоден к пище. Другие галогены (хлор, бром) тоже присоединяются к двойным связям ненасыщенных жирных кислот, но в отличии от йода еще могут расходоваться на замещение атомов водорода в радикалах. Механизм взаимодействия ненасыщенных жирных кислот с йодом таков: Материальное оснащение Весы аналитические; флакончики из-под пенициллина; колбы конические на 250 мл с пробками (2 шт.); бюретки на 25 мл (2 шт.); цилиндр мерный на 100 мл. Растительное масло; спирт этиловый; раствор йода (0,2 н) в 96%-ном спирте; (25,4 г свежевозогнанного йода переносят в мерную колбу на 1000 мл и растворяют в спирте); раствор гипосульфата натрия (0,1 н); крахмал (0,5%-ный). 52 III. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ В сухую коническую колбу емкостью 250 мл с пришлифованной стеклянной пробкой помещают исследуемое масло. Навеску берут на аналитических весах. Для жидких масел навеску удобнее взвешивать следующим способом: взвешивают флакон (из-под пенициллина) с маслом и пипеткой в пробке, отмеривают из нее пипеткой в колбу 3-4 капли масла и снова взвешивают флакон. По разности масс определяют величину навески масла. В колбу добавляют 25 мл спирта для растворения навески. Если масло плохо растворяется, можно подогреть колбу на водяной бане (осторожно!). Во второй колбе ставят контрольный опыт, т.е. берут в нее 25 мл спирта. В каждую колбу (опытную и контрольную) прибавляют из бюретки 12,5 мл 0,2 н спиртового раствора йода, смешивают, приливают 100 мл дистиллированной воды и хорошенько встряхивают, закрыв пробкой. Через 5 мин содержимое колб оттитровывают 0,1 н раствором тиосульфата натрия с начало до появления слабожелтого окрашивания, а потом, прибавив 1 мл раствора крахмала, титруют до исчезновения синего окрашивания. Результаты исследования заносят в таблицу 14. Таблица 14 Продукт Маргарин Масса флак. с пробкой, пипеткой и маслом, г Масса флак. с пробкой пипеткой, и остатком масла, г 111,8 112,72 Навески, г 0,98 Количество тиосульфата, мл рабочий опыт 21,4 контр. опыт 22,7 Йод-ное число 1,7 Йодное число вычисляют по формуле: Йодное число = [(V1 –V2)0,0127/] 100, Йодное число = [(22,7 –21,4)0,0127/ 0,98] 100 = 1,7, где: V1 количество 0,1 н раствора тиосульфата, пошедшее на титрование контрольного опыта, мл; V2 количество 0,1 н раствора тиосульфата, пошедшее на титрование рабочего раствора, мл; 0,0127 титр тиосульфата по йоду, г/мл; навеска жира, г; 100 перерасчет на 100 г масло. За окончательный результат принимают среднее арифметическое двух или трех параллельных определений. Расхождение в параллельных опытах допускаются лишь в десятых долях получаемых чисел. IV. Контрольные вопросы Вариант 1 1. Дайте характеристику непредельным жирным кислотам. 2. Что характеризует йодное число и чем оно выражается? 3. Каков механизм воздействия непредельных жирных кислот с йодом? 53 Вариант 2 l. Haпишите реакцию взаимодействия йода с тиосульфатом. 2. Выведите самостоятельно расчетную формулу определения йодного числа. 3. Окислительное прогоркание жиров. Вариант 3 1. Дайте определение йодного числа. 2. Расчетная формула при определении йодного числа. 3. Как взаимодействуют другие галогены с непредельными жирными кислотами? Вариант 4 l. Принцип метода определения йoдного числа. 2. Что используется в качестве индикатора при определении йодного числа? 3. Какой жир (твердый или жидкий) быстрее подвергается прогорканию? 54 ЛАБОРАТОРНАЯ РАБОТА №8 КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ВИТАМИНЫ 1.ЦЕЛЬ РАБОТЫ Изучение строения и свойств витаминов по тем качественным реакциям, в которые они вступают. Студент должен знать: по какому признаку классифицируются витамины; какие функции выполняют витамины в живых организмах; как влияет отсутствие, недостаток и излишек витаминов на организм человека; что является источником витаминов; как сохранить витамины в продуктах при хранении сырья и приготовлении пищи; химизм реакций, происходящих при качественном анализе витаминов. Студент должен уметь: доказать по характерным цветным реакциям наличие тех или иных витаминов в растворе; объяснить появление цвета химическим строением анализируемого витамина или образовавшегося соединения; освоить навыки безопасной работы с крепкими кислотами, органическими реактивами, нагревательными приборами. II.КРАТКИЕ СВЕДЕНИЯ ИЗ ТЕОРИИ Витамины – низкомолекулярные вещества, относящиеся к различным классам органических соединений. Они являются непременными участниками физиологических процессов у животных, растений и микроорганизмов. Витамины отличаются от всех других органических веществ двумя признаками, они не входят в состав структуры органов и тканей и не используются организмом в качестве источника энергии. Начало изучению витаминов было положено русским ученым Н.И.Луниным. который в 1888 г. на основании результатов длительных опытов установил, что для нормального роста и развития живого организм, помимо белков, жиров, углеводов, минеральных веществ и воды необходимы еще какие-то, пока неизвестные вещества, отсутствие которых приводит животный организм к гибели. По сравнению с остальными питательными веществами витамины требуются в ничтожно малых количествах и выполняют в организме те или иные каталитические функции. В основном витамины синтезируются растениями, с которыми главным образом и поступают в организм человека, поэтому потребность человека в витаминах обеспечивается за счет пищи, а в последнее время и за счет синтезированных искусственным путем препаратов витаминов. Однако некоторое витамины могут быть образованы в организме человека из своих предшественников, так называемые провитаминами (так, ретинол – витамин А – образуется из провитамина – каротина). В настоящее время получены вещества, которые имеют подобную витаминам химическую структуру, но оказывают прямо противоположное действие. Они названы антивитаминами. Открытие антивитаминов сыграло исключительную роль в профилактике и лечении многих инфекционных заболеваний. Витамины обладают способностью усиливать сопротивляемость организма, поэтому их называют защитными средствами отсутствие или недостаток витаминов в 55 пище приводит к глубокому нарушению обмена веществ и, в конечном счете, к развитию ряда тяжелых заболеваний. Так, рахит, цинга, бери-бери, пеллагра и др. Они возникают вследствие полного отсутствия витаминов в пище, такое состояние называют авитаминозом. Авитаминозы и гипервитаминозы (заболевания, вызванные передозировкой витаминов в пище) встречаются сейчас довольно редко. Зато гиповитаминозы (явления частичной недостаточности вследствие малого потребления витаминов) являются злободневной проблемой нашего времени. Недостаточность витаминов в организме может быть вызвана не только небольшим содержанием их в пище, но и в неправильном приготовлении последней, когда не учитывают чувствительность витаминов к свету, воздуху, теплу и воде. Кроме того, в детском и пожилом возрасте. Во время болезни, при больших физических нагрузках организм нуждается в повышенных дозах витаминов. Основным сырьем для пищевой промышленности являются растительные объекты, богатые витаминами. Решить проблему витаминов в питании позволит широкое использование в рационе питания продуктов растительного происхождения, а иногда и добавление искусственно полученных препаратов в продукты питания – так называемая витаминизация. Все витамины обозначаются буквами латинского алфавита: А, В, С и т.д. Наряду с этими РР – антипеллагрический (preventive pellagra), витамин D – антирахитический и т.д. в настоящее время принято решение именовать витамины по их химической структуре витамин А – ретинол, витамин В – тиамин, витамин В6 – перидоксин, витамин РР – никотиновая кислота или никотинамид и т.д. Содержание витаминов в продуктах выражают в миллиграммах на 100 г продукта или миллиграмм – процентах (мг %). По способности растворяться в воде или жирах все витамины делятся на две группы: Жирорастворимые: Водорастворимые: Витамин А и провитамин А Витамины группы В Витамин Д и провитамин Д Витамин С Витамин Е Витамин РР Витамин К Витамин Р Витамин F биотин (витамин Н) и т.д. Витамины растворимые в жирах. К отличительным особенностям жирорастворимых витаминов относятся присущее только им явление витамерии (существование витаминов с различной химической формулой и одинаковым физиологическим действием на живой организм: витамины А1, А2, А3 и Д2 и Д3, восемь токоферолов и т.д.), наличие провитаминов – веществ, не обладающих биологической активностью, но при попадании в организм легко превращаются в витамины (каротин – провитамин А, эргостерин – провитамин Д). Кроме того, явление гипервитаминоз диагностируется в настоящее время в основном только для жирорастворимых витаминов (случай отравления печенью медведя – гипервитаминоз А; резкое повышение кальция в крови и классификация внутренних органов – гипервитаминоз Д; угнетение роста и снижение функций размножения – гипервитаминоз Е). Группа витаминов А (ретинол). Витамины группы А (А1, А2) являются производными каротинов – желтых пигментов растений, относящихся к ненасыщенным углеродам. Так же, как и каротины, они не растворимы в воде, но растворяются в различных жирорастворителях. Витамин А принимает участие во всех функциях организма связанных с его ростом и правильным течением процессов обмена веществ, особенно в детском возраст. 56 Он служит для поддержания функций кожи, слизистых оболочек, особенно дыхательных путей. Этот витамин необходим также для сохранения структуры роговицы (по-латыни retina). Недостаток витамина А ведет к прекращению роста, общему истощению организма, выпадению волос, заболеваниям глаз и даже к слепоте. Основным клиническим проявлением авитаминоза А у детей является поражение роговой оболочки, известное под названием ксерофтальмин (сухость роговой оболочки глаза). Ксерофтальмия в тяжелых случаях может привести к изъявлению роговицы (гиперкератоз). У взрослых одним из ранних симптомов авитаминоза А является снижение способности видеть и различать предметы в сумерках. Этот симптом получил название куриной или ночной слепоты. При авитаминозе А, помимо задержки роста, наблюдается общее понижение иммунобиологических защитных сил организма от инфекции. Витамин А встречается преимущественно в животной пище; в рыбе всех видов, печени, рыбьем жире, в сердце, в почках, в желтке яйца, цельном молоке, жирном сыре. В растительной пище он встречается только в виде своего предшественника или провитамина – каротина, который в ходе ферментативных процессов превращается в печени в витамин А (абрикосы, томаты, морковь, петрушка, шпинат). Продукты, содержащие этот витамин, теряют его при неправильном хранении. Витамин устойчив к высокой температуре, но очень чувствителен к свету и кислороду воздуха. Суточная потребность для взрослых в витаминах А составляется в среднем 1,5-2,5 мг, в каротине – 2-5 мг. Витамин D (кальциферол, антирахитический). Отсутствие или недостаток витамина D в пище детей приводит к развитию заболевания, известного под названием рахит, характеризующегося рядом специфических патологических симптомов. У взрослых недостаточность витамина D обычно проявляется в виде остеомаляции и остеопороза (размягчение костей), которые возникают вследствие вымывания из костей солей кальция и фосфора, и в виде плохого самочувствия из-за низкого содержания их в крови и веществах кости. Витаминной активностью при авитаминозе D обладают несколько ненасыщенных стеринов, содержащих в своей молекуле структуру циклопентанопергидрофенантрена. К ним относится эргокальциферол (витамин D 2), получаемый из провитамина эргостерола облучением его ультрафиолетовыми лучами, и холекальциферол (витамин D1), образующийся в коже животных из 7дегидрохолестрерина также при облучении ультрафиолетовыми лучами. Оба витамина D в чистом виде представляют собой бесцветные кристаллы, хорошо растворимые в жирах и органических растворителях. Витамины D относительно устойчивы к действию щелочей, но минеральные кислоты, длительное воздействие кислорода воздуха и нагревание растворов витаминов до 200 ⁰С приводят к разрушению и потери их биологической активности. Давно известно, что рыбий жир, благодаря высокому содержанию в нем витамина D применяется для лечения вызванных отсутствием витамина D болезненных состояний. Другими источниками витамина являются мясо, яйца, цельное молоко, ростки зерна. Провитамины D встречаются в шпинате, капусте, дрожжах. Суточные дозы для детей – 10-15 мкг, для взрослых – 20-25 мкг. Витамин Е (токоферолы). Этот растворимый в жирах витамин, обладая противоокислительными свойствами, защищает витамин А в пищеварительном тракте и в клетках организма от окисления. Достаточное обеспечение организмом витамина Е улучшает одновременно и снабжение его витамином А. витамин Е необходим для предотвращения бесплодия и нормального протекания процессов размножения. 57 Е-авитаминоз проявляется в потере способности нормального вынашивания плода, в дегенерации семенных клеток, в развитии мышечной слабости, в параличах. Все токоферолы (α,β,γ,δ) играют важную роль в процессах биологического окисления в клетках. Природными источниками витамина являются растительные масла, кроме того, большое количество его найдено в проростках зерновых и бобовых культур (пшеница, рожь, соя). Токоферолы устойчивы к действию щелочей и кислот. При обычных условиях приготовления пищи не разрушаются. Потребность в витамине равна 30 мг в сутки. Витамины группы К (филлохинон,антигеморрагические витамины). Недостаток в организме животных и человека витамина К приводит к замедлению процесса свертывания крови. Явление выраженного авитаминоза К у человека и животных обычно не наблюдается, т.к. для последних естественным источником витамина к является микрофлора кишечника. Однако на состояние микрофлоры может влиять множество факторов, что в свою очередь, при некоторых патологических состояниях, может приводить к явлениям гиповитаминоза К. Хорошим источником витамина К являются все зеленые части растений, в основном все виды капусты, шпинат. Крапива, картофель, зерно, стручковые плоды. Организм в состоянии сам синтезировать филлохинон с помощью бактерий кишечника. Витамины группы К выдерживают температуру до 120 ⁰С, но разрушается щелочами (пищевая сода), сильными кислотами и подвержены действию света и кислорода воздуха. Суточная потребность около 1-1,5 мг. Витамины, растворимые в воде. Витамины группы В. Витамины В объединяются в комплекс витаминов (В1 ,В2, В6) хотя они по структуре различны, но встречаются главным образом, в ржаном хлебе, в ростках зерновых и бобовых культур, в дрожжах. Другими источниками витаминов В являются молоко, мясо, стручковые плоды, картофель, орехи и все виды овощей. Длительное пребывание продуктов воде способствует выщелачивынию всех водорастворимых витаминов; они чувствительны к свету и воздуху, относительно хорошо переносят высокую температуру, но разрушаются в присутствии поваренной соли. Витамин В1 (тиамин, аневрин. антибери-берийный фактор). Витамин В1 является соединением, содержащим тиазоловое и пиримидиновые кольца. Наличие серы и азота в молекуле дало основание назвать его тиамином. Солянокислый тиамин представляет собой бесцветные кристаллы в виде игл, растворимые в воде, спирте, кислотах и не растворимые в эфире и хлороформе. К действию высокой температуры тиамин устойчив в кислой среде, в то время как в щелочной среде он легко разрушается. В природе тиамин В1 встречается как в окисленной, так и в восстановленной форме. Сохраняется длительное время в сушеных овощах и фруктах. Недостаток витамина В1 является одной из причин плохого самочувствия. Пониженной умственной и физической работоспособности, нервозности. Авитаминозом В1 является заболевание «бери-бери» - специфический полиневрит, проявляющийся поражением нервных стволов, судорогами, параличами, болезненностью в области сердца. Суточная потребность составляет 2-3 мг. Витамин В2 (рибофлавин). Изолированная недостаточность витамина В2 очень редко наблюдается у человека. Чаще всего она возникает как сопутствующее заболевание при неполноценном питании и недостаточном содержании в процессах клеточного обмена и играет значительную роль в процессе дыхания. Недостаток его в 58 организме влечет за собой вялость, быструю утомляемость, бессонницу, ослабление зрения, выпадение волос, повреждения кожи. У больных гипо- и авитаминозом развиваются дерматоз с поражением слизистой оболочки глаз в углах рта, в области носа и глаз, воспаление роговой оболочки с васкуляризацией ее мелкими сосудами, помутнение хрусталика (катаракта). Витамин В2 в химическом отношении представляет собой производное изоаллоксазина, которое связано с пятиатомным спиртом рабитолом, его полное название 6,7-диметил-9рибитил-изоаллоксазин или рибофлавин. Это соединение мало растворимо в других органических растворителях, кристаллизуется в виде желто-оранжевых игольчатых кристаллов, горьких на вкус. Насыщенные водные растворы рибофлавина окрашены в желто-зеленый цвет с характерной желто-зеленой флюоресценцией в видимом и ультрафиолетовом цвете. Рибофлавин довольно устойчив и не теряет биологической активности при нагревании до 120 ⁰С в течение нескольких часов. При действии восстановителей рибофлавин превращается в бесцветный и нефлюоресцирующий лейкофлавин. Суточная потребность – 1,5-2,5 мг Витамин РР (никотинамид, ниацин, противопелларгический витамин). Витамин РР (никотинамид) играет активную роль в осуществлении функций кожи, а также слизистой оболочки и нервной системы. Он является составной частью всех живых клеток. При недостаточном поступлении никотинамида с пищей развивается нарушения в пищеварительном тракте, потеря аппетита, тошнота. Воспаление кожи. Связанное с авитаминозом РР заболевание называют пеллагрой (шершавая кожа). Пеллагра характеризуется поражением нервной системы в виде невритов и тяжелых нарушений психики, поражением кожи и слизистых оболочек в виде дерматита, стоматита и глоссита, а также желудочно-кишечного тракта, проявляющимся диареей. Заболевание наиболее распространено в тех районах, где население питается преимущественно кукурузой, которая отличается низким содержанием триптофана, из последнего в организме может образоваться витамин РР. Противопеллагрической активность, помимо никотиновой кислоты, обладает ее амил, который встречается в больших количествах в природе, чем свободная никотиновая кислота. В чистом виде никотинамил – бесцветный кристаллический порошок, хорошо растворимый в воде, спирте и органических растворителях. Суточная потребность колеблется от 15 до 25 мг. Витамин С (аскорбиновая кислота). Витамин С был открыт в 1933 г как средство против скорбута (цинги). Функции аскорбиновой кислоты в человеческом организме весьма разнообразны. Она играет важную роль в деятельности всех клеток, участвует в обмене веществ. Витамин С способствует в уплотнении капилляров и тем самым укрепляет защитные силы организма в борьбе с инфекциями, поддерживает эластичность соединительной ткани и жизнедеятельность костной, хрящевой ткани и ткани зуба. И, наконец, они участвует в обмене железа, способствуя усвоению организмом этого важного элемента. Значение витамина С для здоровья настолько велико, что отсутствие или даже недостаток его вызывает значительные нарушения в организме: плохое самочувствие, снижение умственной и физической работоспособности, быстрая утомляемость, повышенная чувствительность к простуде и инфекциям. Шпинат, капуста, томаты, салат, морковь, зелень – источники аскорбиновой кислоты. Первое место по содержанию витамина занимают дикие культуры, особенно шиповник (600-300 мг %), облепиха, ягоды (черная смородина, клубника, рябина, лимоны, апельсины). Зимой источником витамина является картофель. При питании натуральными продуктами не должно возникнуть недостатка в витамине С. Легкая окисляемость витамина требует особых условий при хранении сырья и приготовлении 59 пищи, герметизации аппаратуры, использования вакуума, пониженные температуры обработки, использование не коррозирующего оборудования. Суточная потребность в витамине С составляет 75-120 мг. Витамин Р. К веществам Р-витаминного действия относят соединения фенольной природы. Они угнетают активность холинэстеразы, сукцинатдегидрогеназы и некоторых других ферментов, а также задерживают окисление адреналина. В основе строения веществ Р- витаминного действия лежит ядро флавона. К ним относятся: рутин, эриодиктин, гесперидин, кверцетин и др. Препаратами витамина Р, имеющими практическое значение, являются: 1) цитрин (геспередин), выделяемый из кожуры цитрусовых 2) препарат, называемый «витамин Р», выделяемый из листьев чайного дерева; 3) рутин (гликозид кверцетина), получаемый из листьев гречихи. Недостаток витамина Р в пище приводит к повышенной проницаемости кровеносных капилляров, ломкости кровеносных сосудов. Авитаминоз Р обычно сопутствует авитаминозу С. Таким образом, цинга – полиавитаминоз С и Р, при котором такие клинические симптомы как кровоизлияние в ткани, боль в конечностях, общая слабость и быстрая утомляемость, и есть прежде всего выражение авитаминоза Р. Действие его проявляется лишь в присутствии минимальных количеств витамина С. Высокое содержание витамина Р обнаружено в лимонах, венгерском перце, чае, черной смородине. Суточная доза точно не установлена. Материальное оснащение Спиртовка, пробирки, глазные пипетки, пипетки с одной меткой на 1 и 2 мл (5 шт.), рыбий жир, 0,1%-ный спиртовой раствор токоферола, 0,25%-ный раствор рибофлавина, никотиновая кислота, серная и азотная концентрированные кислоты, раствор брома в хлороформе в соотношении 1:60, хлороформ, анилиновый реактив 15 частей анилина + 1 часть концентрированной HCL, анилин, 10%-ный NaOH, 5%-ный K3Fe (CN)6, цинк металлический, 10%-ный CH3COOH, 5%-ный Cu(CH3COO)2, 0,001%ный раствор метиленовой сини, 10%-ный NaCO3, рунит (порошок и насышенный водной раствор), хлорид железа (III) 1%-ный, серная кислота (концентрированная, S= 1,84 г/см3), растворы для приготовления фелинговой жидкости, соляная кислота (0,5%ная), гидроксид натрия (10%-ный), воронка, фильтры бумажные, молибденовокислый аммоний (2,5%-ный), лист чайного дерева, этиловый спирт. IV. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ Все реакции выполняются в сухих пробирках, куда реактив вносятся глазной пипеткой. Качественные реакции на жирорастворимые витамины Реакция на витамин А. В сухой пробирке смешивают 1 каплю рыбьего жира с 5 каплями хлороформа и добавляют 1 каплю концентрированной серной кислоты. Жидкость приобретает красно-бурый цвет. Реакция на витамин Д. В сухой пробирке смешивают по 2 капли рыбьего жира и раствора брома в хлороформе. Смесь в пробирке окрашивается постепенно в зеленоголубой цвет. 60 Анилиновая проба на витамин Д. В пробирке смешивают 1 каплю рыбьего жира с 5 хлороформа, затем добавляют при помешивании 1 каплю анилинового раствора. Образовавшаяся эмульсия желтого цвета при нагревании приобретает красную окраску. Реакция на витамин Е. В пробирке смешивают 5 капель раствора витамина Е и 10 капель концентрированной азотной кислоты. Встряхивая и осторожно нагревают. Образуется красная эмульсия. Реакция на метинол (витамин К). В пробирке смешивают 5 капель метинола с 2 каплями анилина. Смесь окрашивается в красный цвет. Качественные реакции на водорастворимые витамины Реакция на витамин В1. В две пробирки наливают 5 капель 10% NaOH и столько же 5% раствора K3 (CN)6. В одну из пробирок добавляют 3 капли раствора тиамина, а в другую столько же воды. Обе пробирки нагревают. В первой смесь окрашивается в оранжевый, а во второй в светло-желтый цвет. Реакция восстановления витамина В2. 10 капель взвеси рибофлавина наливают в пробирку, добавляя туда же 5 капель концентрированной соляной кислоты и кусочек металлического цинка. Происходит бурное выделение пузырьков водорода. Выделяющийся водород реагирует с рибофлавином, и раствор изменяет окраску из желтой в красную, а затем в розовую и бесцветную. Проба на никотиновую кислоту. В пробирку помещают небольшое количество витамина РР, добавляют 10 капель раствора уксусной кислоты и нагревают до растворения витамина. К горячему раствору добавляют равный объем раствора уксусно-кислой меди. При стоянии выпадает синий осадок. Реакция восстановления красителей. В двух пробирках смешивают по 1 капле раствора метиленовой сини и раствора бикарбоната натрия, добавляя затем в одну из них 5 капель 1% вытяжки из шиповника или водного раствора витамина С, а в другую столько же дистиллированной воды. Нагревание пробирок над пламенем горелки приводит к обесцвечиванию жидкости в пробирке с витамином С. Подготовка экстракта катехина. В прбирку помещают несколько кусочков сухого листа чайного дерева и заполняют спиртом до 1/3 объем пробирки. Встряхивают до тех пор, пока спирт не окрасится в зеленовато-желтый цвет. Полученный экстракт, содержащий катехины чая, отделяют фильтрованием и выполняет с ним все последующие реакции. Реакция с молибденовокислым аммонием. К 5 каплям спиртового экстракта добавляют 1 каплю 2,5% раствора молибденовокислого аммония, появляется красное окрашивание, переходящее при разбавлении раствора спиртом в оливковое и желтозеленное. Реакция с хлоридом железа (III). Хлорид железа (III) образует с рутином комплексное соединение, окрашенное в изумрудно-зеленый цвет. Координационные связи возникают между ионом железа и атомами кислорода фенольным гидроксильных групп молекулы рутина. К 1-2 мл насыщенного водного раствора рутина прибавляют несколько капель 1%-ного раствора хлорида железа (III). Реакция с концентрированной серной кислотой. Концентрированная серная кислота образует с флавонами и флавонолами оксониевые (флавилиевые) соли, растворы которых характеризуются ярко-желтой окраской. К 1-2 мл насыщенного водного раствора рутина осторожно по стенке пробирки добавляют 1 мл концентрированной серной кислоты, на границе двух жидкостей возникает окрашенное в желтый цвет кольцо. 61 Рекция рутина с фелинговой жидкостью. При кислотном гидролизе рутина в начале отщепляется молекула рутинозы, которая далее распадается на глюкозу и рамнозу, обладающие восстанавливающими свойствами. К 0,5 г рутина добавляют 5 мл 0.5%-ного раствора соляной кислоты. Смесь доводят до кипения, кипятят в течение 1 мин, затем фильтруют. К 5 мл полученного фильтрата приливают 3 мл 10%-ного раствора гидроксида натрия и 3 мл фелинговой жидкости (готовится непосредственно перед употреблением) и снова нагревают до кипения. Выпадает красный осадок оксида меди (1). Результаты опыта заносят в таблицу 15. Таблица 15 Качественные реакции на витамины Наименование витамина Химическая структура витамина Применяемые реактивы Получаемое окрашивание Чем обусловлена реакция IV. Контрольные вопросы Вариант 1 1. Витамины, как класс веществ. 2. Витамины, растворимые в жирах. 3. Качественные реакции на водорастворимые витамины. Вариант 2 1. Охарактеризовать провитамины и aнтивитамины. 2. Витамины, растворимые в воде. 3. Качественные реакции жирорастворимые витамины. Вариант 3 l. Охарактеризовать состояние организма, вызванные избытком, недостатком или полным отсутствием витаминов в рационе питания. 2. Способы сохранности витаминов при хранении сырья и в процессе приготовления пиши. 3. Цель работы: что должен уметь и знать студент, выполнив данную лабораторную работу? Вариант 4 1. Классификация витаминов. Их названия и обозначения. 2. Источники водорастворимых витаминов. 3. Суточная потребность в жирорастворимых витаминах. Вариант 5 1. Перечислить качественные реакции на витамины. Цель их проведения. 2. Источники жирорастворимых витаминов. 3. Суточная потребность в водорастворимых витаминах 62 СПИСОК ИСПОЛЬЗОВАННЫХ ЛИТЕРАТУР 1. Комов, В.П. Биохимия / В.П. Комов, В.Н.Шведова.– М.: Дрофа, 2004.-639с. 2. Биологическая химия /(Ю.Б. Филиппович, Н.И. Ковалевская,Г.А. Севастьянова и др.); под ред. Н.И. Ковалевской.- М.: ИЦ«Академия», 2008.-256с. 3. Белясова, Н.А. Биохимия и молекулярная биология / Н.А. Белясова. - Минск: Книжный дом, 2004. - 415с. 4. Коничев, А.С., Севастьянова, Г.Н. Молекулярная биология/А.С. Коничев, Г.Н. Севастьянова. – М.: ИЦ «Академия», 2005.-400с. 5. Ляшевская,Н.В., Устюжанина,Е.Н., Байдалина,О.В. Биохимияи молекулярная биология: Методические указания к лабораторным занятиям. - Горно-Алтайск: РИО «Универ-Принт».2005.- 84с. 6. Ленинджер, А. Основы биохимии: в 3 т. / Альберт Ленинджер.- М.: Мир, 1985. 7. Степанов, В.М. Молекулярная биология. Структура и функциибелков / В.М. Степанов. - М.: Высш. шк., 1996. – 335 с. 8. Кухта, В.А., Морозкина. Основы биохимии/В.А. Кухта, Морозкина. М.: Медицина, 1999. 9. Биохимия/ Под ред. акад. Е.С. Северина.- М.: ГЭОТАР-Медиа, 2008.-768с. 63