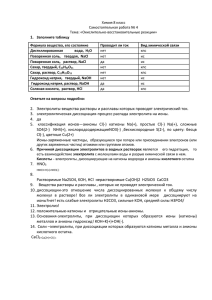
Тема: «Роль в » СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ +1 +1Н 1 Н +8 26 +8О ×× ×× Н×О×Н ×× О Н 104,5 Н ×О× ×× ДИПОЛЬ Молекула воды Атом водорода 0,2 нм Водород Водород Кислород O- H+ H+ O- H+ H+ Диполь-структура, имеющая одновременно и положительный, и отрицательный заряды. O- H+ O- H+ H+ Ковалентная связь Водородная связь H+ Физические свойства При обычных условиях без вкуса и запаха,в тонких слоях бесцветна,в толстых имеет голубоватый цвет 0°С- твердое состояние (лёд) 100°С - кипит и переходит в водяной пар Атомы водорода присоединены к атому кислорода, образуя угол 104,5° С Вода в нормальных условиях сохраняет жидкое агрегатное состояние, тогда как аналогичные водородные соединения являются газами (H2S, CH4, HF) Химические свойства Вода-окислитель(с щелочными и щелочно-земельными металлами)образуя щелочь и водород 2Na0 +2H2O = 2NaOH +H20 Вода-восстановитель( с сильным окислителем) 4F0 +2H2O = 4HF +O20 Вода горит во фторе голубым пламенем Разложение воды(заметно при 2000° С) 2H2O = 2H20 +O20 Реакции соединения с оксидами активных металлов,образуя растворимые основания 2Li2O +2 H2O =4LiOH С кислотными оксидами P2O5 +3 H2O =t 2 H3PO4 соответствующие кислоты С некоторыми солями, образуя кристаллогидраты FeSO4 +7 H2O = FeSO4 * 7 H2O Кислотно-основные свойства Не в значительной степени, но диссоциирует т.е. вода-очень слабый амфотерный электролит H2O = H+ + OH- Реакционная среда Транспорт вещества Фактор диссоциации Катализатор Реагент Вещества: (в 100г воды растворяется более 1г вещества) ( в 100г воды- от 0,01 до 1г вещества) В 100г воды растворяется менее 0,01г вещества Растворение Гидратация это это Не просто физический процесс, но и результат диффузии Химическое взаимодействие веществ с водой Водные растворы- это гомогенные системы, состоящие из молекул воды, частиц растворенного вещества и продуктов их взаимодействия. Гидратированные молекулы- это молекулы, окруженные оболочкой из молекул воды. Гидратация- взаимодействие воды с молекулами растворяемого вещества. Медный купорос CuSO4 * 5H2O Гипс CaSO4 * 2H2O Кристаллическая сода Na2CO3 * 10H2O Электролиты - это вещества, которые в растворах распадаются на ионы- диссоциируют. Степень электролитической диссоциации- это отношение молей вещества, распавшегося на ионы, к общему количеству растворенного вещества. Степень электролитической диссоциации NА ( число диссоциированных молекул) α = ─────────────────────────── N ( общее число молекул) Сильные (степень э д стремится к единице) Слабые (Степень э д стремится к нулю) Слабые электролиты Многие неорганические и почти все органические кислоты Сильные электролиты Щелочи, все соли ,некоторые кислоты NaOH = Na+ + OHAl2(SO4)3 = 2Al3+ + 3SO42- HNO2 H+ + NO2CH3COOH CH3COO- + H+ Аррениус Сванте (1859–1927) Предложил (1887) всесторонне обоснованную теорию электролитической диссоциации, согласно которой активность и степень диссоциации электролитов на ионы уменьшается с ростом концентрации их растворов. Кислоты HCl = H+ + Cl- Основания KOH = K+ + OHCH3NH2 * H2O Соли Al2(SO4)3 = 2Al3+ + 3SO42- CH3NH3+ + OH- CH3COONa = CH3COO- + Na+ Химический состав клетки 70-80% Задание для 1 группы: Впишите недостающие слова: 1) Все вещества по их способности проводить электрический ток в растворах делятся на ______________ и ________________. электролиты неэлектролиты Процесс распада электролита на ионы называется __________________ ______________. электролитической диссоциацией В растворах электролиты диссоциируют на _______________ и отрицательные ______________ ионы. положительные По степени электролитической диссоциации сильные ислабые электролиты делятся на _________ _______. 2) Все соли – электролиты, CuSO4 – электролит ___________. Все растворимые основания – сильные электролиты, NaOH – ___________________. сильный электролит Задание для 2 группы: Покажите выигрышный путь, состоящий из названий веществ или растворов, которые: а) проводят электрический ток Хлорид натрия (р-р) Раствор сахара Сульфат натрия (р-р) Вода, насыщенная O2 Серная кислота (р-р) Спирт Дисциллированная вода Азотная кислота (р-р) Гидроксид натрия (р-р) б) не проводят электрический ток Дисциллированная вода Сахар (тв.) Раствор сахара Минеральная вода Соляная кислота Нитрат натрия (р-р) Известковая вода Гидроксид калия (р-р) Карбонат кальция (тв.) в) являются сильными электролитами Раствор аммиака в воде Сахар (тв.) Серная кислота (р-р) Гидроксид калия (р-р) Соляная кислота Нитрат натрия (р-р) Угольная кислота Дисциллированна я вода Карбонат кальция (тв.) Задание для 3 группы: Соотнесите: 1. А) Электролиты Б) Неэлектролиты 2. А) Сильные электролиты Б) Слабые электролиты 3. Электролиты: А) NaCl Б) KOH В) HNO3 1) Кислоты 2) Оксиды 3) Простые вещества 4) Соли 5) Основания 1) Азотная кислот 2) Вода 3) Гидроксид натрия 4) Соляная кислота 5) Гидроксид алюминия Ионы в растворе электролита: 1) OH¯ + 2) H + 3) Na 4) K + 5) NO3¯ – 6)Cl