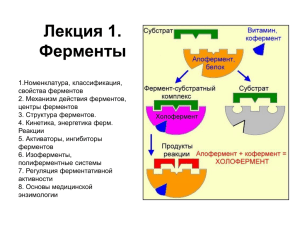
ПЯТИГОРСКИЙ МЕДИКО-ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ - филиал государственного бюджетного образовательного учреждения высшего профессионального образования «ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» Министерства здравоохранения Российской Федерации Кафедра технологии лекарств Д.В. Компанцев, Л.Н. Савченко, Т.Ф. Маринина, Т.Ю. Манджиголадзе, А.А. Чахирова МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОСВОЕНИЮ ДИСЦИПЛИНЫ «БИОТЕХНОЛОГИЯ (В ТОМ ЧИСЛЕ БИОНАНОТЕХНОЛОГИИ)» Образовательная программа «БИОТЕХНОЛОГИЯ (В ТОМ ЧИСЛЕ БИОНАНОТЕХНОЛОГИИ)» (подготовка научно-педагогических кадров) НАПРАВЛЕНИЕ ПОДГОТОВКИ 06.06.01 БИОЛОГИЧЕСКИЕ НАУКИ Пятигорск 2015 УДК 615.012/.014(076) ББК 52.82я35.66 М54 Рецензент: И.Н. Андреева, д-р фармац. наук, проф. каф. ЭОЗиФ Ю.А. Морозов, канд. фармац. наук, доц. каф. технологии лекарств ФГБОУ ВПО «Северо-Осетинского государственного университета им. К.Л. Хетагурова, г. Владикавказ Д.В. Компанцев, Л.Н. Савченко, Т.Ф. Маринина, Т.Ю. Манджиголадзе, А.А. Чахирова М 54 Методические рекомендации по освоению дисциплины «Биотехнология (в том числе бионанотехнологии)». Образовательная программа «Биотехнология (в том числе бионанотехнологии)». Направление подготовки 06.06.01 БИОЛОГИЧЕСКИЕ НАУКИ /Д.В. Компанцев, Л.Н. Савченко, Т.Ф. Маринина, Т.Ю. Манджиголадзе, А.А. Чахирова. – Пятигорск: ПМФИ - филиал ГБОУ ВПО «Волг ГМУ», 2015. – 72с. Методические рекомендации разработаны в соответствии с рабочей программой дисциплины «Биотехнология (в том числе бионанотехнологии)» учебного плана 030106 78-11-1234(5)-3486.plax и предназначены для обучающихся по образовательной программе подготовки кадров высшей квалификации «Биотехнология (в том числе бионанотехнологии)» очной и/или заочной формы обучения. УДК 615.012/.014(076) ББК 52.82я35.66 Печатается по решению ЦМК ПМФИ - филиал ГБОУ ВПО ВолгГМУ Минздрава РФ © Пятигорский медико-фармацевтический институт - филиал ГБОУ ВПО ВолгГМУ Минздрава Российской Федерации, 2015 2 СОДЕРЖАНИЕ № п/п Название темы стр. Тема 1 Малоотходные и безотходные производства. Роль биотехнологии. Биотехнологическая обоснованность малоотходных и безотходных промышленных производств. Производство микробиотехнологическим способом молочной кислоты. Малоотходные и безотходные производства. Роль биотехнологии. Биосинтез лимонной и уксусной кислот. Элементы энзимологии. Ферменты. Ферменты и их биологическая роль. Классификация и номенклатура. Активные центры ферментов. Субстратная специфичность. Факторы, обеспечивающие ферментативный катализ. Элементы энзимологии. Ферменты. Иммобилизация ферментов. Ингибиторы: обратимые (конкурентные, неконкурентные), необратимые. Обратимая и необратимая денатурация ферментов. Способы иммобилизации ферментов на различных носителях. Фитобиотехнология. Основные задачи. Получение биологически активных веществ при культивировании растительных клеток и тканей в искусственных условиях. Питательные среды для культивирования клеток и тканей растений. Условия культивирования. Фитобиотехнология. Трансгенные растения. Стадии производства БАВ из культуры клеток и тканей растений. Культура каллусных тканей. Методы культивирования клеток и тканей растений. Генная инженерия в медицине и фармации. Конструирование генно-инженерно-модифицированных (трансгенных) растений. Технология генной инженерии растений. Проблемы и перспективы. Генная инженерия в медицине и фармации. Штаммы – суперпродуценты. Биомасса промышленных микроорганизмов как сырье для получения продуктов различного назначения. Современные научные исследования. Получение антибиотиков. Антибиотики как природные антиметаболиты. Пенициллины, цефалоспорины, тетрациклины, аминогликозиды, противоопухолевые антибиотики. Получение витаминов. Микробиологическое производство витаминов для здравоохранения. Низкомолекулярные биорегуляторы – коферменты и витамины: НАД, НАДФ, ФМН, ФАД, липоевая кислота, АТБ, биотин, ас- 5 Тема 2 Тема 3 Тема 4 Тема 5 Тема 6 Тема 7 Тема 8 Тема 9 Тема 10 9 14 18 23 27 31 35 39 43 3 Тема 11 Тема 12 Тема 13 корбиновая кислота. Нанобиотехнология. Основные понятия, современное состояние исследований. Технологическая схема получения микро- и нананокапсул. Методы получения. Аппаратура. Перспективы применения. Нанобиотехнология. Наноносители, фулерены, наносомы. Микрокапсулирование. Характеристика методов получения микро- и нанокапсул. Пробиотики в фармации. Препараты для лечения дисбактериоза. Общая схема процесса производства пробиотиков. Задания для рубежного контроля Задания для промежуточной аттестации 47 51 55 59 67 4 Занятие №1 1.Тема: Малоотходные и безотходные производства. Роль биотехнологии. Биотехнологическая обоснованность малоотходных и безотходных промышленных производств. Производство микробиотехнологическим способом молочной кислоты 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить малоотходные и безотходные биотехнологические процессы, принципы безотходных технологий на примере производства органических кислот. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - характеристику безотходных и малоотходных производств; - значение биотехнологии в малоотходных производствах; - микробиологический способ производства молочной кислоты. В итоге занятия обучающийся должен уметь: - выбирать подходящие штаммы микроорганизмов для биосинтеза молочной кислоты; - подбирать состав питательной среды; - составлять технологическую и аппаратурную схемы производства молочной кислоты. 4. Выполнить следующие задания: 1. Составить технологическую схему производства молочной кислоты методом сбраживания. 2. Выбрать субстрат и составляющие его компоненты. 3. Установить оптимальные условия процесса брожения. 5. Информационные материалы. Безотходная технология - это идеальная модель производства, которая в большинстве случаев в настоящее время реализуется не в полной мере, а лишь частично (отсюда становится ясным и термин "малоотходная технология"). Однако уже сейчас имеются примеры полностью безотходных производств. При создании безотходных производств приходится решать ряд сложнейших организационных, технических, технологических, экономических, и других задач. Для разработки и внедрения безотходных производств можно выделить ряд взаимосвязанных принципов. Основным является принцип системности. В соответствии с ним каждый отдельный процесс или производство рассматривается как элемент динамичной системы - всего промышленного производства как элемент экологоэкономической системы в целом, включающей, кроме материального производства и другой хозяйственно-экономической деятельности человека, природную среду, а также человека и среду его обитания. Таким образом, принцип системности, лежащий в основе создания безотходных производств, должен учитывать существующую и усиливающуюся взаимосвязь, и взаимозависимость производственных, 5 социальных и природных процессов. Другим важнейшим принципом создания безотходного производства является комплексность использования ресурсов. Этот принцип требует максимального использования всех компонентов сырья и потенциала энергоресурсов. Как известно, практически все сырье является комплексным, и в среднем более трети его количества составляют сопутствующие элементы, которые могут быть извлечены только при комплексной его переработке. Одним из общих принципов создания безотходного производств является цикличность материальных потоков. К простейшим примерам цикличных материальных потоков можно отнести замкнутые водо- и газооборотные циклы. Общим принципом создания безотходного производства является также рациональность его организации. Определяющими здесь являются требование разумного использования всех компонентов сырья, максимального уменьшения энерго-, материало- и трудоемкости производства и поиск новых экологически обоснованных сырьевых и энергетических технологий, с чем во многом связано снижение отрицательного воздействия на окружающую среду и нанесение ей ущерба, включая смежные отрасли народного хозяйства. Конечной целью в данном случае следует считать оптимизацию производства одновременно по энерготехнологическим, экономическим и экологическим параметрам. Основным путем достижения этой цели являются разработка новых и усовершенствование существующих технологических процессов и производств. Целый ряд биотехнологических производств можно отнести к малоотходным, когда после выделения целевого продукта, образующиеся отходы используют для дальнейшей переработки. Например, после варки пива, остается солодовая дробина, которую используют как корм для крупного рогатого скота. Производство многих антибиотиков, базирующееся на использовании бактерий стрептомицетов, также приближается (или может быть приближено) к малоотходным. Плотные отходы после термообезвреживания могут быть использованы в качестве корма для сельскохозяйственных животных, так как белковое, минеральное и, в ряде случаев, витаминное содержание (В12) клеток является важной добавкой к их дневному рациону. Однако, по некоторым данным, в клеточной биомассе не должно содержаться ощутимых количеств остаточных антибиотических веществ, что, якобы, может сказаться на селекционировании резистентной микрофлоры, включая патогенную и условно патогенную (в частности, из семейства Enterobacteriaceae). По другим данным антибиотики не только профилактические и лечебные средства, но и стимулируют прибавление веса, увеличивают эффективность использования кормов. Применительно к микробной биотехнологии имеются данные об использовании плотных отходов в производстве антибиотиков и ферментов (биомассы клеток) в качестве армирующего накопителя в бетонных изделиях. В производстве декстрана возможна организация безотходной технологии. Исходя из механизма биосинтеза полисахарида видно, что отходом производства является фруктоза. К сожалению, на предприятиях, изготавливающих декстран, фруктоза чаще вместе с маточными растворами спускается в трап. Между тем 6 фруктоза может быть очищена и использована для пищевых целей, например, в виде сиропа. К малоотходным следует отнести биосинтез органических кислот. Производство молочной кислоты Молочная (2-гидроксипропановая) кислота СН3С*Н(ОН)СОО содержит один асимметрический атом углерода, в связи с чем и существует в виде пары энантиомеров. Кроме того, известна рацемическая молочная кислота. Все три формы встречаются в природе. Рацемическая оптически неактивная молочная кислота образуется из углеводов в результате молочнокислого брожения под действием бактерий Bacillus lactic acidi и Bacillus Delbruckii. Представляет собой бесцветные гигроскопические кристаллы, хорошо растворимые в воде. Получить безводную молочную кислоту очень трудно, так как обезвоживание ее растворов сопровождается образованием лактида. Образуется при скисании молока, квашении капусты, в различных соленьях, выполняя при этом роль консерванта, так как способна препятствовать развитию гнилостных бактерий. Соли и эфиры молочной кислоты называются лактатами (от лат. lac. lactis -молоко). Лактаты кальция и железа (II) применяются в медицине. Молочную кислоту используют в качестве добавки к безалкогольным напиткам, эссенциям, фруктовым сокам, джемам и сиропам; для декальцификации кож в дубильной промышленности, а также при производстве пластмасс, когда L(+)-форму полимеризуют в полилактат, применяемый для производства пластиковых оберток. Получение молочной кислоты. Образование молочной кислоты лактобактериями происходит в естественных условиях при скисании молока и молочных продуктов, а также при ее целенаправленном получении в производственных условиях. Молочнокислые бактерии относят к 4 родам: Lactobacillus, Leuconostos, Streptococcus и Pedicoccus. Род Lactobacillus включает 3 подрода – Тhermobacterium, Streptobacterium и Betabacterium. Представители первого из них не растут при 15°С, но могут выдерживать температуры выше 50°С. Стрептобактерии не являются термофилами. Бетабактерии образуют D -L-молочную кислоту из глюкозы. Одни из них (термобактерии, стрептобактерии, стрептококки и педикокки) являются гомоферментативными, образующими при сбраживании гексоз преимущественно молочную кислоту, другие (бетабактерии и лейконостоки) - гетероферментативными, образующими молочную и уксусную кислоты, диоксид углерода, возможно этанол; молочнокислые бактерии могут использовать мальтозу, глюкозу, лактозу, осахаренный крахмал и пр. В целом, лактобактерии - требовательны к питательным средам - многие из них нуждаются в ряде витаминов из группы В, некоторых аминокислотах, пуринах и пиримидинах, отдельных органических кислотах алифатического ряда (уксусной, лимонной, олеиновой). Для сбраживания глюкозы и гидролизатов крахмала на практике применяют обычно Lactobacillus delbrueсkii, L. bulgaricus, L.leichmanii одни или в смеси между собой или со Streptococcus lactis для сбраживания мальтозы иногда используют L. casei. В промышленном производстве молочной кислоты обычно используют термофильные гомоферментативные виды, активно синтезирующие целевой продукт при 50°С. Таким видом является L.delbrueckii штамм Л-3, отличающийся вы7 сокой стабильностью и активностью кислотообразования (выход молочной кислоты составляет 95-98% от потребленной сахарозы Принципиальная технологическая схема получения L(+)-молочной кислоты состоит в следующем: мелассную среду, содержащую 5-20% сахара, вытяжку солодовых ростков, дрожжевой экстракт, витамины, аммония фосфат, засевают L.delbrueckii. Брожение протекает при 49-50°С при исходном рН 6,3-6,5. По мере образования молочной кислоты ее периодически нейтрализуют мелом. Весь цикл ферментации завершается за 5-10 дней; при этом в культуральной жидкости содержатся 11-14% лактата кальция и 0,1-0,5% сахарозы. Клетки бактерий и мел отделяют фильтрованием (отход), фильтрат упаривают до концентрации 30%, охлаждают до 25°С и подают на кристаллизацию, которая длится 1,5-2 суток. Кристаллы лактата кальция обрабатывают серной кислотой при 60-70°С, гипс выпадает в осадок, а к надосадочной жидкости добавляют желтую кровяную соль при 65°С для удаления ионов железа, затем натрия сульфат для освобождения от тяжелых металлов. Красящие вещества удаляют с помощью активированного угля. После этого раствор молочной кислоты подвергают вакуум-упариванию до 50% или 80%. Оставшийся, не до конца очищенный раствор молочной кислоты, используют для технических целей. Более очищенную кислоту можно получать при перегонке ее сложных метиловых эфиров, при экстракции изопропиловым эфиром в противоточных насадочных колоннах. С помощью L.bulgaricus получают молочную кислоту из молочной сыворотки; гидролизаты пентозанов в кукурузных кочерыжках, соломе и других видах пентозного сырья можно использовать для сбраживания клетками L. brevis. В конце 80-х годов разработана технология получения молочной кислоты с помощью клеток Streptococcus thermophilus, адгезированными на микросферах из активированного угля и помещенными в биореактор, работающий по принципу «кипящего» или псевдосжиженного слоя, через который перемещаются микросферы. В нижней части они сорбируют субстрат, в верхней - молочную кислоту, благодаря чему нет надобности в регуляции рН в процессе ферментации. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Что такое безотходная технология? 2. Основные принципы безотходных производств. 3. Биотехнологическая обоснованность малоотходных производств. 4. Почему брожение можно отнести к малоотходным производствам? 5. В чем состоит рациональность использования отходов при производстве антибиотиков? 6. Характеристика и применение молочной кислоты. 7. Получение молочной кислоты лактобактериями. 8. Промышленное производство молочной кислоты. 9. Условия проведения стадий технологического процесса. 10.Получеенипе молочной кислоты с использованием иммобилизованных клеток бактерии. 8 Занятие №2 1. Тема Малоотходные и безотходные производства. Роль биотехнологии. Биосинтез лимонной и уксусной кислот 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить малоотходные и безотходные биотехнологические процессы, принципы безотходных технологий на примере производства органических кислот. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - характеристику безотходных и малоотходных производств; - требования, предъявляемые к безотходному производству; - роль биотехнологии в создании малоотходных производств; - микробиологические способы получения лимонной и уксусной кислот. В итоге занятия обучающийся должен уметь: - выбирать подходящие штаммы микроорганизмов для биосинтеза лимонной и уксусной кислот; - подбирать состав и готовить питательные среды; - составлять технологические и аппаратурные схемы производства лимонной и уксусной кислот. 4. Выполнить следующие задания: 1. Составить технологические схемы производства лимонной и уксусной кислот. 2. Выбрать субстрат и составляющие его компоненты. 3. Установить оптимальные условия аэробного окислительного процесса. 5. Информационные материалы. Безотходная технология представляет собой такой метод производства продукции, при котором все сырье и энергия используются наиболее рационально и комплексно в цикле: сырьевые ресурсы - производство - потребление - вторичные ресурсы, и любые воздействия на окружающую среду не нарушают ее нормального функционирования. Эта формулировка не должна восприниматься абсолютно, т.е. не надо думать, что производство возможно без отходов. Представить себе абсолютно безотходное производство просто невозможно, такого и в природе нет. Однако отходы не должны нарушать нормальное функционирование природных систем. Создание безотходных производств относится к весьма сложному и длительному процессу, промежуточным этапом которого является малоотходное производство. Под малоотходным производством следует понимать такое производство, результаты которого при воздействии их на окружающую среду не превышают уровня, допустимого санитарно-гигиеническими нормами, т. е. ПДК. При этом по техническим, экономическим, организационным или другим причинам часть сырья и материалов может переходить в отходы и направляться на длительное хранение или захоронение. 9 Требования к безотходному производству На пути совершенствования существующих и разработки принципиально новых технологических процессов необходимо соблюдение ряда общих требований: • осуществление производственных процессов при минимально возможном числе технологических стадий (аппаратов), поскольку на каждой из них образуются отходы, и теряется сырье; • применение непрерывных процессов, позволяющих наиболее эффективно использовать сырье и энергию; • увеличение (до оптимума) единичной мощности агрегатов; • интенсификация производственных процессов, их оптимизация и автоматизация; • создание энерготехнологических процессов. Сочетание энергетики с технологией позволяет полнее использовать энергию химических превращений, экономить энергоресурсы, сырье и материалы и увеличивать производительность агрегатов. Биотехнология открывает широкие перспективы для развития малоотходных производств. В качестве примера можно привести биосинтез органических кислот, поскольку для их производства используют мелассы - отход спиртового брожения. Производство лимонной кислоты Лимонную кислоту широко используют в пищевой, фармацевтической и косметической промышленности. Ею заменяют фосфаты в составе детергентов, так как она полностью метаболизируется живыми организмами. Лимонная кислота образует хелаты с металлами, поэтому ее применяют для их очистки. Объем мирового производства цитрата составляет 400 тыс. т/год. Для промышленного производства лимонной кислоты используют главным образом культуру гриба Aspergillus niger, а также A.wentii. Рост культуры грибов обычно регулируют путем изменения содержания фосфата, ионов марганца, железа и цинка в среде. Дефицит фосфата ведет к сверхпродукции цитрата. Роль ионов металлов не до конца установлена. Считают, что дефицит ионов металлов влияет на свойства клеточных мембран и морфологию гиф. Процесс ферментации, ведущий к образованию лимонной кислоты, проводят при низких значениях рН 3-4, что облегчает поддержание стерильных условий ферментации и уменьшает возможность образования побочных продуктов. В более щелочной среде происходит накопление щавелевой и глюконовой кислот. Предполагают, что в кислой среде стимулируется гликолиз, что обеспечивает направление потока углерода в цикл Кребса. Питательные среды для культивирования продуцентов лимонной кислоты в качестве источника углерода содержат дешевое углеводное сырье: мелассу, крахмал и глюкозный сироп. Гриб А. niger чаще всего выращивают на мелассе. Гриб Trichoderma viride синтезирует значительные количества цитрата из глюкозы, что позволяет использовать для этого процесса целлюлозу. Предложены штаммы бак10 терий (Corynebacterium, Arthrobacterium, Brevibacterium) и дрожжей рода Саndida, осуществляющие процесс на основе n-парафинов (С9-С30), которые пока широко не внедрены в промышленность. Существует несколько технологических вариантов промышленного производства лимонной кислоты. Первоначально был разработан вариант процесса, основывающийся на поверхностной ферментации, позднее - на глубинном культивировании. Поверхностный способ жидкофазной ферментации А.niger для промышленного производства лимонной кислоты реализуют в «бродильных камерах», где размещают на стеллажах кюветы (8-10 штук на один стеллаж) одну над другой. На дне каждой кюветы имеется сливной штуцер. «Бродильные камеры» оборудованы приточно-вытяжной вентиляцией, обеспечивающей равномерный приток стерильного воздуха заданной температуры и влажности. Температура в камерах поддерживается на уровне 34-36°С, высота питающего слоя жидкой мелассной среды 6-12см. Максимальное тепловыделение (500-550 кДж/м2*ч) имеет место к 5 суткам; исходная концентрация сахаров в питательной среде в среднем порядка 12%; начальное значение рН 6,8-7,0 снижается до 4,5 в течение первых трех суток и до 3,0 - к концу процесса (8-9 сутки). Максимальное кислотообразование в таких условиях происходит на 5-6 сутки (100-105 г/м2 пленки гриба*ч-1, а затем стабильно удерживается на уровне 50-60 г/м2*ч-1. В собранной культуральной жидкости содержится смесь органических кислот - лимонная, глюконовая, щавелевая и неиспользованный сахар в примерном соотношении 45-50:3:1:7, то есть лимонная кислота составляет от 80 до 90%. Ее выделяют химическим путем - добавляют к нагретой до 100°С культуральной жидкости известковое молоко или мел, доводя рН до 6,8-7,0; это количество составляет примерно 2,5-3%; трехзамещенный кальция цитрат, хуже растворимый в горячей воде, чем в холодной, выпадает в осадок вместе с кальция оксалатом (кальция глюконат остается в растворе); осадок отфильтровывают, промывают горячей водой и гидролизуют серной кислотой. Свободная лимонная кислота остается в растворе, а негидролизованный кальция оксалат и образовавшийся гипс остаются в осадке. Раствор лимонной кислоты очищают, подвергают вакуум упариванию и кристаллизуют. Кристаллы кислоты высушивают и фасуют. Мицелий продуцента либо используют для выделения фермента пектиназы, либо высушивают и поставляют на корм скоту и домашней птице (желательно - в обезвреженном - убитом виде); наконец, он может быть использован, как источник флавинов. После окончания процесса отруби экстрагируют водой, куда переходят кислоты, а затем выделяют цитрат кальция и чистую лимонную кислоту Глубинный способ производства базируется на использовании специальных культур А. niger (в России применяют селекционированный штамм № 288/9). Инокулят подращивают сначала в инокуляторе, затем - в посевном аппарате (примерно в 1/10 объема основного ферментатора) на среде с 3-4% сахара. Спустя 1-1,5 суток инокулят передают из посевного в основной ферментатор, где процесс ведут в течение 5-10 суток на аналогичной среде с трехразовым доливом 25-28% (по сахару) раствора мелассы с целью доведения конечной концентрации сахара в 11 культуральной жидкости до 12-15%. После окончания ферментации (контроль снижение кислотообразования) мицелий гриба отфильтровывают, а культуральную жидкость подвергают обработке, как это описано выше. Производство уксусной кислоты Уксусная кислота и ее производные (в особенности уксусный ангидрид) важнейшие вещества, без которых немыслима современная промышленность органического синтеза. Большие количества их расходуются для получения ацетилцеллюлозы (искусственное волокно, негорючая кинопленка). Соли уксусной кислоты служат средствами борьбы с вредителями сельского хозяйства (например, парижская зелень - смесь ацетата и арсенита меди), протравами при крашении тканей (соли алюминия, хрома, железа). Сложные эфиры, полученные из уксусной кислоты, широко используются как растворители. В ходе синтеза многих важных продуктов (красителей, лекарственных препаратов, продуктов тонкого органического синтеза) используется реакция ацетилирования. введение остатка уксусной кислоты вместо спиртового или аминного водорода. При этом получаются соответственно сложные эфиры или амиды. Микробиологический способ получения уксусной кислоты состоит в конверсии этанола в уксусную кислоту при участии бактерий штаммов Acetobacter, Gluconobacter. Процесс идет в анаэробных условиях, в режиме непрерывного культивирования продуцента. Для роста бактерии Асеtobacter aceti используют питательные среды, содержащие 6-12% этилового спирта, 1% бактериального гидролизата, 0,05% дигидрофосфата калия, 0,1% гидрофосфата аммония и 0,05% сульфата магния. Максимальная удельная активность непрерывной культуры А.асеti (количество микрограммов субстрата, подвергшегося окислению 1 мкг биомассы за 1 мин) достигается к 20-м суткам культивирования при концентрации спирта 7% и составляет 3,0 ед/мг. Уксусную кислоту можно получать не только из чистого этилового спирта, но и из фруктовых сиропов, вин, ягод и т.п. Поскольку уксуснокислые бактерии не превращают углеводы непосредственно в уксусную кислоту, исходное сырье должно подвергаться спиртовому брожению. Самой старой технологией получения столового уксуса лучшего качества был так называемый медленный, или орлеанский (французский) процесс, в котором исходным сырьем было легкое виноградное вино, которым на 3/5 заполняли плоские деревянные чаны и туда же наливали столовый уксус, заполняя оставшиеся 2/5 объема (в уксусе содержатся уксуснокислые бактерии). На поверхности смеси развивалась пленка ацетобактерий. После завершения окисления этанола отбирали из чана 10% жидкости, а взамен добавляли столько же вина. Вместо плоских чанов можно использовать деревянные бочки, например, дубовые, емкостью до 20дкл. В них должны быть отверстия для поступления воздуха и сливной кран. Процесс можно вести полунепрерывно, отрегулировав подачу свежих порций вина и слив готового уксуса. В настоящее время почти везде «пищевой» уксус получают согласно так называемому «генераторному», или немецкому (быстрому) процессу, впервые реализованному в 1832г. Особенность его создание максимальной поверхности для снабжения воздухом уксуснокислых бактерий и. как следствие, быстрое окисле12 ние спирта в уксусную кислоту. Названную технологию осуществляют так же в деревянных емкостях – трехсекционных генераторах (из дуба, пихты, красного дерева и пр.) В верхней секции размещено распылительное устройство для разбрызгивания 3-10% водного раствора этанола (например, сегнерово колесо), в средней - наполнитель для создания хорошо аэрируемой поверхности (стружки буковые, березовые; стержни кукурузных початков; виноградные выжимки; керамические материалы и др.) в нижней - собирается готовый уксус. Секции в генераторах разделены дырчатыми перегородками. Воздух подается снизу и выходит через негерметично закрытый верх. Генераторы могут быть рецеркуляционного типа на 30-60м3, в которых воздух перекачивается с относительно постоянной скоростью и регулирование температуры (27-29°С) осуществляют путем охлаждения уксусной смеси. При получении уксуса необходимо хорошо контролировать температуру и подачу воздуха, чтобы избежать заметной потери спирта и уксусной кислоты за счет их сгорания (полного окисления) до СО2 и Н2О. Питательные вещества (кроме спирта) в уксусной смеси будут влиять на жизнеспособность ацетобактерий. Необходимо иметь в виду, что качество используемой воды для разбавления этанола могут заметно сказываться на снижении активности микробов в этом процессе (медь, железо, олово, цинк). Уксус, получаемый из разведенного этанола, обычно не подвергают «старению», так как оно не прибавляет каких-либо приятных вкусовых и обонятельных ощущений. Готовый уксус осветляют фильтрованием, разливают в стеклянные емкости и пастеризуют. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Безотходная технология как метод производства. 2. Требования, предъявляемые к безотходному производству. 3. Роль биотехнологии в малоотходном производстве. 4. Почему производство органических кислот микробиологическим способом относят к малоотходным? 5. Микроорганизмы, используемые в производстве лимонной кислоты, условия их культивирования? 6. Питательные среды для культивирования продуцентов лимонной кислоты. 7. Поверхностный способ жидкофазной ферментации при производстве лимонной кислоты. 8. Глубинный способ производства лимонной кислоты. 9. Микробиологический способ получения уксусной кислоты конверсией этанола. 10. Генераторный способ получения уксусной кислоты. 13 Занятие №3 1. Тема: Элементы энзимологии. Ферменты. Ферменты и их биологическая роль. Классификация и номенклатура. Активные центры ферментов. Субстратная специфичность. Факторы, обеспечивающие ферментативный катализ 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить свойства ферментов как биологических катализаторов, значение и роль активного центра, субстратную специфичность и факторы, обеспечивающие ферментативный катализ. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - свойства ферментов как биологических катализаторов; - классификацию и номенклатуру ферментов; - технологические схемы промышленного производства ферментов. В итоге занятия обучающийся должен уметь: - обеспечивать условия, необходимые для получения ферментных препаратов; - определять субстратную специфичность ферментов; - осуществлять технологические операции производства ферментов; - составлять аппаратурные и технологические схемы производства. 4. Выполнить следующие задания: 1. Получить пепсин методом высаливания из животного сырья. 2. Определить протеолитическую активность пепсина и его количественное содержание. 5. Информационные материалы. Химическая и инженерная энзимология возникла на стыке молекулярной биологии, физической химии и энзимологии. Это наука о создании биоорганических катализаторов, в которых использованы принципы действия активных центров ферментов. Химическая энзимология изучает широкий круг вопросов, связанных с новыми аспектами функционирования ферментов как гетерогенных биокатализаторов, создаваемых для промышленного производства фармацевтических препаратов и пищевых продуктов. Ферменты традиционно и давно (еще в древности) применялись в практической деятельности как уникальные ускорители многих химических реакций. Скорость реакций, протекающих при участии ферментов, в 1012-1014 раз выше, чем реакций, осуществляемых катализаторами неорганической природы. Ферменты - биологические катализаторы белковой природы, которые применяются в различных отраслях народного хозяйства, в том числе при производстве лекарственных средств, а также в медицинской практике как лечебные и диагностические препараты. Всего для клинического применения разрешено свыше 40 ферментов животного, растительного и микробного происхождения. Особенностью ферментов является их исключительно высокая активность 14 (они ускоряют реакции в миллиарды раз). Так, одна единственная молекула фермента может катализировать при обычной температуре превращение от тысячи до миллиона молекул вещества в минуту. Эта скорость катализа недостижима для небиологических катализаторов. Другое, не менее важное, свойство ферментов специфичность (избирательность) их действия в отношении структуры субстрата, типа реакций и условий ее проведения. Ферменты, обладая высокой специфичностью, направляют превращение вещества в строгое русло. Они катализируют реакции в мягких условиях, т.е. при обычном давлении, небольшой температуре и значениях рН, близких к нейтральным, весьма чувствительны к сдвигам рН среды и изменению температуры. Так как максимальная активность фермента обусловлена оптимальной конформацией молекулы фермента в целом и активного центра в частности, то даже небольшие изменения окружающих условий, которые затрагивают связывание субстрата или конформацию третичной структуры белка, будут соответственно влиять на скорость ферментативной реакции. Оптимальное рН для каждого фермента означает, что состояние его ионизации соответствует наилучшей комплементарности. Изменение температуры вызывает противоречивый эффект: с одной стороны, при повышении температуры до 37-40°С скорость ферментативной реакции увеличивается, что закономерно для катализа; с другой стороны, при температуре более 50°С начинается денатурация фермента. Ферментативные процессы не дают побочных реакций, для них характерен 100%-й выход целевого продукта. Ферменты регулируемы, т.е. могут изменять свою активность под воздействием ряда факторов, при этом выход целевого продукта будет разным. Этим обеспечивается скоординированность всех метаболических процессов во времени. Скорость ферментативной реакции прямо пропорциональна количеству фермента, поэтому недостаток фермента в организме означает низкую скорость превращения какого-либо соединения, и наоборот, одним из путей приспособления организма к изменениям внешней среды является увеличение количества требуемого фермента. Известно более 6000 ферментов, многие из которых катализируют только одну реакцию; 150 из них выделены в кристаллическом виде. Энзимы классифицируются не как индивидуальные вещества, а как катализаторы определенных химических превращений или групп химических превращений, в соответствии с этим их подразделяют на шесть основных классов: • оксидоредуктазы - катализаторы окислительно-восстановительных реакций; • трансферазы - реакции переноса отдельных групп с одной молекулы на другую; • гидролазы - гидролитическое расщепление связей (с участием воды); • лиазы (синтазы) - реакции соединения или расщепления молекул (присоединения-отсоединения воды, аммиака, диоксида углерода и т.д.); • изомеразы - взаимопревращение изомеров (изменение строения внутри одной молекулы); • лигазы (синтетазы) — образование связей в реакции конденсации двух 15 разных соединений с участием энергии АТФ. Результаты тщательных исследований показали, что молекулы большинства ферментов во много раз больше, чем молекулы тех субстратов, которые атакуют данный фермент, и что в контакт с субстратом вступает лишь очень небольшая часть его молекулы - обычно от трех до двенадцати аминокислотных остатков. Этот участок белковой глобулы, где происходит связывание субстрата и его дальнейшее химическое превращение, называют активным центром фермента. Он формируется из фрагментов полипептидной цепи, в том числе из отдельных аминокислотных остатков, содержащих разнообразные по реакционной способности функциональные группы, например гистидина, лизина, аргинина, триптофана и некоторых других. Для проявления каталитического действия ферментов наибольшее значение имеют следующие функциональные группы: карбоксильные группы аспарагиновой и глутаминовой кислот (ε-СООН) и С-концевых остатков аминокислот, имидазольная группа гистидина, SН-группа цистеина, ОН-группа серина. Карбоксильные группы в активных центрах ферментов могут выполнять роль контакта для субстратов, осуществлять кислотно-основный катализ, оказывая влияние на полярность расположенных по соседству с ними связей или групп фермент-субстратного комплекса и вызывая электронные смещения путем образования водородных связей. Имидазольная группа гистидина является важной функциональной группой многих ферментов, рН-оптимум действия которых лежит в зоне рН 4,0-7,0. Она обладает высокой реакционной способностью благодаря особенности строения имидазола, имеющего сопряженную систему связей. В водных растворах один из атомов азота приобретает электрофильные, а другой - нуклеофильные свойства. Свойства атомов азота могут обратимо меняться, поэтому каждый атом имеет двойственные качества электро- и нуклеофильного реагента и способен действовать как кислотно-основный катализатор и переносчик положительных и отрицательных групп. SН- группы остатков молекул цистеина очень реакционноспособны и выполняют разнообразные функции в ферментах: участвуют непосредственно в катализе или играют роль контактных групп. Гидроксильная группа входит в активный центр протеаз и эстераз. ОНгруппа свободного серина, подобно другим первичным спиртовым группам, химически весьма инертна. Предполагают, что повышение ее реактивности в активных центрах ферментов, как и SН-групп, обусловлено воздействием на нее других функциональных групп. Существует мнение, что большую роль в активации серинового остатка некоторых протеолитических ферментов играет имидазольная группа, сближенная с этим остатком в третичной структуре фермента. В третичной структуре каталитически активные функциональные группы фиксированы в сближенном состоянии, удобном для одновременного их взаимодействия с сорбированной молекулой субстрата. Определенную жесткость такой конструкции придают α-спирали и β-структуры, дисульфидные мостики и другие типы связей и взаимодействий. Кроме того, в формировании активного центра принимают участие молекулы воды, входящие в гидратационные слои, а в ряде случаев также и ионы метал16 лов, связанные с белком (Fе2+, Сu2+, Zп2+, Мg2+, Са2+, Мп2+ и др.), и органические кофакторы (коферменты). У одних ферментов кофакторы присоединяются к белковой части - апоферменту ковалентно (небелковую часть в этом случае называют простетической группой), а у других - при участии целого ряда более слабых сил (водородных связей, гидрофобных или ион-ионных взаимодействий), которые и ориентируют эту каталитически активную группу по отношению к полипеитидной цепи. Активный центр, следовательно, является весьма сложной структурой, которая может составлять существенную часть молекулы фермента. Часто он имеет форму «щели», в которой размещается субстрат и удерживается в ней боковыми группами аминокислот, локализованными в стенках «щели». В других случаях активный центр распространяется на значительную часть молекулы фермента и может включить субстрат связывающие группы, относящиеся к разным участкам главной цепи. Ряд ферментов являются сложными белками и имеют в своем составе углеводы или липиды. В последние годы активный центр ферментов, действующих на полимерные субстраты (протеазы, карбогидразы), рассматривают как центр, состоящий из отдельных участков - «сайтов». Каждый «сайт» связывает мономерный остаток полимерного субстрата. Когда связывающая группа субстрата соединяется с соответствующим центром связывания фермента, энергия связывания принимает максимальное значение. В этом случае говорят, что фермент и субстрат структурно комплементарны. Согласно теории индуцированного соответствия Кошланда каталитически активная конфигурация у фермента возникает только в момент присоединения к нему частицы субстрата в результате ее деформирующего действия. После превращения субстрата и удаления продуктов реакции структура белка возвращается в исходное положение и затем вновь присоединяет молекулу субстрата. Энергетически менее предпочтительная, но каталитически активная конформация активного центра образуется лишь в фермент-субстратном комплексе. 6. Задание для текущего контроля Вопросы по теме занятия: 1. История развития инженерной энзимологии как науки. 2. Структура и функции ферментов. 3. Субстратная специфичность ферментов 4. Факторы, влияющие на активность ферментов. 5. Классификация и номенклатура ферментов. 6. Применение ферментов в медицине и фармации. 7. Основные представления о ферментативном катализе. 8. Активный центр фермента, его значение и роль. 9. Влияние витаминов и ионов тяжелых металлов в формировании активного центра. 10. Факторы, обеспечивающие ферментативный катализ. 17 Занятие №4 1. Тема: Элементы энзимологии. Ферменты. Иммобилизация ферментов. Ингибиторы: обратимые (конкурентные, неконкурентные), необратимые. Обратимая и необратимая денатурация ферментов. Способы иммобилизации ферментов на различных носителях 2. Продолжительность занятия – 6 часов 3. Цель занятия: Изучить способы иммобилизации ферментов на различных носителях. Значение и способы ингибирования, денатурации ферментов. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - значение иммобилизации ферментов; - способы иммобилизации на различных носителях; - различные виды ингибирования и денатурации ферментов. В итоге занятия обучающийся (аспирант) должен уметь: - выбирать и готовить носители для иммобилизации конкретных ферментов; - осуществлять процесс иммобилизации различными способами; - оценивать качество иммобилизованного фермента. 4. Выполнить следующие задания: 1. Получить иммобилизованный пепсин методом адсорбции на нерастворимом сорбенте. 2. Определить протеолитическую активность полученного иммобилизованного фермента. 3. Провести иммобилизацию клеток дрожжей включением в гель альгината кальция. 5. Информационные материалы. Ферменты – белковые вещества, выполняющие функции катализаторов химических реакций, используемые в медицине, фармацевтической и химической промышленности. Высокая лабильность ферментов к различным факторам окружающей среды, быстрая инактивация в организме, наличие антигенных свойств чужеродных организму белков – в значительной мере могут быть устранены при использовании ферментов в иммобилизованном виде. Иммобилизованными называют такие ферменты, которые выделены из клетки, искусственно закреплены на носителе и сохраняют свойственную им каталитическую активность. Иммобилизация - это технология, согласно которой молекулу фермента включают в какую-либо фазу или соединяют с нерастворимым носителем. Комплекс «фермент-носитель» отделен от раствора, но при этом может обмениваться с ним молекулами субстрата, эффектора или ингибитора. В промышленных целях для иммобилизации используют главным образом энзимы, выделенные из микроорганизмов. Они примерно в 100 раз дешевле, чем ферменты животного или растительного происхождения, и более доступны. 18 По сравнению со свободными ферментативными препаратами, иммобилизованные ферменты имеют существенные преимущества: - они обладают высокой стабильностью, в несколько тысяч раз превышающей стабильность свободных ферментов, и поэтому достаточно долговечны; - они легко отделимы от реакционной среды, что позволяет получать чистые продукты реакции; - иммобилизация дает возможность многократно использовать ферментный препарат; - иммобилизованные ферменты технологичны, что позволяет либо вести процесс непрерывно, регулировать его скорость и, соответственно, выход продукта, либо в любой момент остановить реакцию; - с помощью подбора носителей и методов иммобилизации можно целенаправленно изменять некоторые свойства ферментов (специфичность, рН, температуру, стабильность) для оптимизации процесса. Носители для иммобилизации ферментов. В зависимости от структуры, носители подразделяют на природные и синтетические, органические и неорганические, полимерные и низкомолекулярные. Природные полимерные носители по своей химической природе подразделяют на белковые (кератин, фиброин, коллаген, желатин), полисахаридные (целлюлоза, декстран, агароза, каррагинан, альгиновые кислоты и их соли, аминополисахариды - хитин и хитозан) и липидные (модель «фермент - липид» в виде монослоя или бислоя сферической формы-липосома), наиболее приближенные к естественным комплексам, существующим в клетке. Синтетические полимерные носители подразделяют на три группы полиметиленовые, полиамидные и полиэфирные. Благодаря разнообразию, механической прочности и доступности, они широко используются для иммобилизации. Кроме того, при производстве синтетических полимеров можно значительно разнообразить их форму (гранулы, трубочки и т. д.), варьировать величину пор, вводить различные функциональные группы. Носители неорганической природы могут быть представлены материалами из глины, стекла, керамики, силикагеля, графитовой сажи, а также оксидами металлов и т. д. Преимущества этой группы носителей состоят в легкости регенерации, возможности получения любой их формы при производстве и вариабельности размера пор. Иммобилизацию ферментов можно осуществлять физическими и химическими методами. Физические методы основаны на адсорбции фермента на нерастворимом носителе, на включении фермента в поры поперечносшитого геля, в полупроницаемые структуры. Адсорбция ферментов на нерастворимом носителе. Молекула фермента удерживается на поверхности носителя благодаря электростатическим, гидрофобным, дисперсионным взаимодействиям или возникновению водородных связей. Прочность связывания фермента с носителем небольшая. Иммобилизация ферментов путем включения в гель (обычно-полимерный 19 гель). Метод обеспечивает равномерное распределение фермента в объеме носителя, достаточно прост и применяется для иммобилизации отдельных молекул определенного энзима, мультиферментных комплексов и интактных клеток. Однако он непригоден для работы с ферментами, которые воздействуют на водонерастворимые субстраты. Иммобилизация в полупроницаемые структуры. В этом случае раствор фермента и раствор субстрата разделяют с помощью полупроницаемой мембраны (микрокапсулирование, включение в липосомы). Метод используется главным образом в фундаментальных научных исследованиях и в медицине. Использование химических методов приводит к возникновению ковалентных связей между ферментом и носителем. Этот способ получения промышленных биокатализаторов наиболее распространен. Химическое присоединение энзима к носителю отличается высокой эффективностью и прочностью связи. Однако химические методы иммобилизации сложны и дороги, но незаменимы в научных исследованиях при создании ферментов с контролируемыми свойствами. Иммобилизация на носителях, несущих гидроксигруппы. В этой группе наиболее распространен бромциановый метод, который позволяет связывать фермент с полисахаридным или синтетическим носителем. Иммобилизация на носителях, несущих аминогруппы. Аминогруппы носителя превращают в соли диазония, к которым впоследствии присоединяют молекулы ферментов за счет взаимодействия с фенольными, аминными, имидазольными, тиольными, гуанидиновыми группами этих ферментов. Иммобилизация на носителях, несущих сульфгидрилъные группы. Если и носитель, и фермент несут сульфгидрильные группы, то под воздействием кислорода воздуха эти группы легко окисляются с образованием дисульфидных связей. Среди всех методов иммобилизации оптимальным считается метод включения ферментов в полимерные гели. Также широко распространены адсорбционное присоединение и химические методы, основанные на ковалентном связывании. Достаточно часто иммобилизацию проводят за счет включения ферментов в мембраны и микрокапсулы, тогда как другие приемы используют в единичных случаях. Ингибирование и денатурация ферментов Ингибиторы ферментов важны в медицине, фармакологии ветеринарии и сельском хозяйстве, в то же время иногда они служат полезными инструментами для биохимика, который занимается исследованием метаболических путей и механизма действия фермента. Особенность живых систем заключается в том, что распад или синтез важных соединений происходит последовательно, небольшими этапами, каждый из которых катализируется ферментом и осуществляет небольшое химическое изменение. Ингибитор, действующий только на один из ферментов этих последовательных этапов, будет эффективно блокировать весь цикл, и препятствовать метаболическому процессу, часто с непредсказуемыми последствиями. Когда ингибитор специфически блокирует единственный этап метаболиче20 ского цикла, накапливаются метаболиты, образовавшиеся на стадии, предшествующей заблокированной. Идентификация метаболитов позволяет сделать определенные заключения относительно метаболического пути. Действие ингибиторов может быть обратимым и необратимым. «Обратимые» ингибиторы быстро взаимодействуют с ферментом, и устанавливается равновесие между заблокированным ферментом, с одной стороны, и комплексом фермент-ингибитор, с другой. Степень угнетения активности в подобной системе зависит от концентрации ингибитора и при его удалении диализом ферментативная активность полностью восстанавливается. «Необратимые» ингибиторы нельзя удалить диализом, и ингибирование обычно со временем прогрессирует. Если концентрация «необратимого» ингибитора превышает уровень фермента, то в результате наступает общая и постоянная инактивация. Обратимое ингибирование. «Обратимые» ингибиторы сгруппированы в три основных класса в зависимости от их влияния на кинетику взаимодействий между ферментом и субстратом: конкурентные, неконкурентные и бесконкурентные. Конкурентное ингибирование. Ингибитор обычно является структурным аналогом субстрата и, как предполагают, присоединяется к ферменту в нормальных субстрат связывающих участках молекулы, образуя комплекс ферментингибитор. Хотя ингибитор способен связываться с ферментом и, таким образом, «конкурировать» с субстратом, условия специфичности действия фермента таковы, что не может произойти разрыв его связи с ингибитором. Следовательно, присутствие ингибитора эффективно уменьшает концентрацию субстрат связывающих участков молекулы, пригодных для присоединения истинного субстрата и, по-видимому, будет изменять константу, связанную с субстратом. Поскольку присоединение, как субстрата, так и ингибитора обратимо, активность фракции фермента в форме неактивного комплекса фермент-ингибитор будет зависеть от относительных концентраций субстрата и ингибитора. Исследование кинетики необратимого взаимодействия конкурентных ингибиторов с ферментами может быть использовано для определения абсолютной концентрации ферментов или, в случае, когда молекула фермента содержит несколько активных центров, для определения абсолютной концентрации активных центров. Это определение, как было изложено выше, является необходимым для расчета кинетических констант, как самих ферментативных реакций, так и взаимодействия ферментов с ингибиторами. Обязательными требованиями к ингибиторам, с помощью которых такие определения могут быть проведены даже для неочищенных ферментных препаратов, являются следующие: а) необратимость взаимодействия; б) специфичность реакций с активными центрами исследуемого фермента (т. е. отсутствие взаимодействия с другими веществами); в) строгая стехиометрия взаимодействия с активными центрами фермента. Неконкурентное ингибирование. Ингибитор по структуре обычно не похож на субстрат и, как предполагают, связывается с ферментом в отдельном, удаленном от активного центра, участке молекулы. В этом случае нет конкуренции меж21 ду субстратом и ингибитором. Присоединение ингибитора не изменяет сродство фермента к субстрату, но препятствует образованию продуктов. Необратимые реакции торможения. Необратимое торможение ферментативных реакций характеризуется образованием при взаимодействии ингибитора с ферментом прочного соединения, обычно в результате возникновения ковалентных связей с функциональными группами белка, прямо или косвенно участвующими в каталитическом процессе. Характерным примером такого типа реакций ингибирования является взаимодействие фосфорорганических веществ ангидридного строения с некоторыми ацилгидролазами. Денатурация - это конформационное изменение биологической макромолекулы, приводящее к необратимой или обратимой утрате ею способности к выполнению определенной биологической функции. Наблюдаемая на опыте потеря ферментом функциональной активности может иметь ряд причин. Например, наряду с денатурацией идут процессы взаимодействия между макромолекулами или модификация функциональных групп, которые также приводят к инактивации белка. Природа необратимой денатурации может быть как термодинамической, так и кинетической. В первом случае необратимая денатурация обусловлена тем, что белок из нативного состояния с локальным минимумом свободной энергии переходит в денатурированное состояние, которое соответствует глобальному минимуму свободной энергии. В случае кинетической необратимости белок из нативного состояния с глобальным минимумом свободной энергии переведен в денатурированное состояние, соответствующее локальному минимуму. Можно выделить шесть основных причин инактивации белков: агрегация; тиолдисульфидный обмен; изменения в первичной структуре, например, химическая модификация функциональных групп; расщепление S –S cвязей; диссоциация на субъединицы белков с четвертичной структурой; конформационные изменения в макромолекуле. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Что собой представляют иммобилизованные ферменты? 2. Каких целей достигают при иммобилизации ферментов в биотехнологическом производстве? 3. Как получают иммобилизованные ферменты? 4. Чем обусловлены экономические преимущества биотехнологического производства, основанного на иммобилизованных ферментах, перед традиционными? 5. В чем сущность физических методов иммобилизации? 6. Дайте характеристику химических методов иммобилизации. 7. Область применения иммобилизованных ферментов. 8. Значение ингибирования в энзимологии. 9. Обратимое и необратимое ингибирование. 10 Что такое денатурация ферментов? 22 Занятие № 5 Тема: Фитобиотехнология. Основные задачи. Получение биологически активных веществ при культивировании растительных клеток и тканей в искусственных условиях. Питательные среды для культивирования клеток и тканей растений. Условия культивирования 2. Продолжительность занятия – 5 часов 3. Цель занятия: Освоить технологию получения растительного сырья in vitro и методы его идентификации. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - основы каллусогенеза;- особенности строения растительных клеток; - методы культивирования культур растительных клеток. В итоге занятия обучающийся (аспирант) должен уметь: - готовить растительный материал для получения первичного каллуса; - приготовить питательную среду для получения биомассы, провести выращивание биомассы; - провести анализ полученной биомассы. 4. Выполнить следующие задания: 1. Изучить условия культивирования растительных клеток и тканей. 2. Приготовить питательную среду для получения биомассы женьшеня, получить биомассу и провести анализ. 5. Информационные материалы. Растения - ценный источник БАВ, использующийся в фармацевтической, медицинской, пищевой и других отраслях промышленности. Однако в настоящее время запасы экономически важных лекарственных растений уменьшаются. Их плантационное выращивание зачастую нерентабельно. Решение этой проблемы было найдено в выращивании изолированных тканевых и клеточных культур, способных синтезировать широкий спектр веществ - вторичных метаболитов: алкалоидов, терпенов, гликозидов, полифенолов и др. Промышленный способ выращивания изолированных культур дает возможность за короткий срок (30-45 сут) получать большой объем ценного лекарственного сырья. Основные задачи фитобиотехнологии: 1. Получение ценных для медицины, парфюмерии, косметики и других отраслей промышленности веществ вторичного синтеза (алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и др.) на основе клеточных культур растений. Как правило, вторичные вещества получают из каллусной ткани, культивируемой на твердой (агаризованной) или жидкой (суспензионная культура) питательной среде. На основе клеточных технологий получают такие медицинские препараты, как диосгенин - из клеток диоскореи, аймалин - из клеток раувольфии змеиной, тонизирующие вещества - из клеток женьшеня. Продуктивность культивируемых клеток в результате их селекции in vitro может значительно превышать продуктивность целых растений. Преимущества данного способа заключаются также в 23 возможности использовать для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год. 2. Использование изолированных клеток в селекции растений in vitro на устойчивость к различным неблагоприятным факторам среды: засухе, засолению, низким и высоким температурам, фитопатогенам, тяжелым металлам и др. 3. Использование культуры изолированных тканей для размножения и оздоровления посадочного материала. Этот метод, названный клональным микроразмножением растений, позволяет получать от одной меристемы сотни тысяч растений в год. Получение биологически активных веществ при культивировании растительных клеток и тканей начинается с процесса получения культуры каллусной ткани, состоящей из сообщества клеток, выращиваемых на искусственной питательной среде. Каллус (от лат. callus - толстая кожа, мозоль) – ткань, образующаяся в местах повреждения органов растения и обычно возникающая при неорганизованной пролиферации клеток растений. Используется для получения изолированных тканей и клеток растений. Изолированные культуры каллусов могут быть получены из различных органов растений (корни, побеги, листья) или из определенного типа клеток (эндосперм, пыльца). Выбранный эксплантант должен находиться в подходящем «биологическом» состоянии, необходимом для получения каллусных культур. Также изолированные культуры растительных клеток можно применять для биотрансформации. Условия культивирования. Культивирование растительных клеток и тканей осуществляется в асептических условиях. Микроорганизмы, которые могут попасть в питательную среду, выделяют токсины, ингибирующие рост клеток и приводящие культуру к гибели. Поэтому при всех манипуляциях с клетками и тканями при культивировании in vitro соблюдают определенные правила асептики в ламинарбоксе или в асептических комнатах. В первом случае асептика достигается подачей профильтрованного стерильного воздуха, направленного из ламинарбокса наружу, на работающего. Асептические комнаты стерилизуют с помощью ультрафиолетовых ламп, а работают в таких помещениях в стерильной одежде. Рабочую поверхность столов в асептических комнатах и инструменты перед работой дополнительно стерилизуют спиртом. Питательные среды стерилизуют в автоклаве при температуре 120°С и повышенном давлении в течение 15-20мин. Если в состав питательных сред входят вещества, разрушающиеся при автоклавировании, их следует стерилизовать путем фильтрации через бактериальный фильтр. Затем стерильные профильтрованные компоненты добавляют в проавтоклавированную среду, охлажденную до температуры 400С. Растительные ткани сами по себе могут служить серьезным источником заражения, так как на их поверхности всегда находится эпифитная микрофлора. Поэтому необходима поверхностная стерилизация. Микроорганизмы могут находиться и внутри растительной ткани. Наиболее часто внутреннее инфицирование встречается у тропических и субтропических растений. Поэтому кроме поверхностной стерилизации иногда приходится применять антибиотики, которые и убивают микробную фло24 ру внутри ткани. Питательные среды для культивирования клеток и тканей растений. Изолированные клетки и ткани культивируют на многокомпонентных питательных средах. Они могут существенно различаться по своему составу, однако, в состав всех сред обязательно входят необходимые растениям макро- и микроэлементы, углеводы, витамины, фитогормоны и их синтетические аналоги. Углеводы (обычно это сахароза или глюкоза) входят в состав любой питательной смеси в концентрации 2 - 3%. Они необходимы в качестве питательного компонента, так как большинство каллусных тканей лишено хлорофилла и не способно к автотрофному питанию. Поэтому их выращивают в условиях рассеянного освещения или в темноте. Исключение составляет каллусная ткань мандрагоры, амаранта и некоторых других растений. Обязательными компонентами питательных сред должны быть ауксины, вызывающие дедифференцировку клеток экспланта, и цитокинины, индуцирующие клеточные деления. При изменении соотношения между этими фитогормонами или при добавлении других фитогормонов могут быть вызваны разные типы морфогенеза. Высокое содержание нитратов, ионов аммония, калия, фосфата способствует быстрому росту клеток. Истощение среды значительно снижает рост и процессы вторичного метаболизма. Однако изначально низкое содержание фосфатов в питательной среде способно стимулировать синтез вторичных метаболитов. Установлено, что культивирование каллусов солодки голой на среде с половинной концентрацией азота и фосфора в темноте увеличивает содержание фенольных соединений в 1,6 раза по сравнению с каллусами, растущими на полной среде. В среду могут быть добавлены эндоспермы незрелых зародышей (кокосовый орех, конский каштан и др.), различные экстракты (солодковый, дрожжевой, томатный сок). Введение их в среду дает интересные результаты, но такие эксперименты трудно воспроизводимы, так как действующий компонент, как правило, точно неизвестен. Например, добавление в питательную среду отдельных фракций кокосового молока не давало никаких результатов, в то время как нефракционированный эндосперм вызывал деление клеток. При приготовлении твердых питательных сред для поверхностного выращивания каллусных тканей используют очищенный агар-агар - полисахарид, получаемый из морских водорослей. Среда Мурасиге и Скуга - самая универсальная. Она пригодна для образования каллусов, поддержания неорганизованного каллусного роста, индукции морфогенеза у большинства двудольных растений. Так, изменение соотношения ауксина и кинетина приводит к образованию либо корней (преобладание ауксина), либо стеблевых культур (преобладание кинетина). Среда Гамборга и Эвелега хорошо подходит для культивирования клеток и тканей бобовых растений и злаков, среда Уайта обеспечивает укоренение побегов и нормальный рост стебля после регенерации, а среда Нича и Нич пригодна для индукции андрогенеза в культуре пыльников. На рост и развитие растительных тканей in vitro большое влияние оказывают физические факторы - свет, температура, аэрация, влажность. 25 Свет. Большинство каллусных тканей могут расти в условиях слабого освещения или в темноте, так как они не способны фотосинтезировать. Вместе с тем свет может выступать как фактор, обеспечивающий морфогенез и активирующий процессы вторично синтеза. Освещение может влиять на метаболизм каллусных клеток. Температура. Для большинства каллусных культур оптимальной является температура 260С. В то же время каллусы и культуры клеток растут даже при температуре 320С. Поэтому при выращивании культуры in vitro необходимо тщательно изучить влияние всех абиотических факторов, в том числе, температурного, на рост и метаболизм клеток. Аэрация. Для выращивания суспензионных культур большое значение имеет аэрация. Особенно важно снабжение воздухом культивируемых клеток в больших объемах ферментаторов. Известно, что синтез вторичных метаболитов в суспензионной культуре был наибольшим при подаче воздуха снизу. При выращивании клеток в малых объемах (в колбах) нормальная аэрация достигается при постоянном перемешивании суспензии. Влажность. Оптимальная влажность в помещении, где растут культуры, должна составлять 60-70%. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Основные задачи фитобиотехнологии. 2. Дать определение каллусной ткани. 3. Основные условия культивирования растительных клеток и тканей. 4. Влияние физических факторов на рост и развитие растительных тканей in vitro. 5. Преимущества растительного сырья, получаемого при выращивании культур клеток, перед сырьем из плантационных или дикорастущих растений. 6. Как осуществляют стерилизацию питательных сред? 7. Компоненты питательных сред обязательные при культивировании in vitro. 8. Фитогормоны и их влияние на морфогенез. 9. Универсальная питательная среда для образования каллусов. 10. Методы культивирования культур растительных клеток. 26 Занятие № 6 1. Тема: Фитобиотехнология. Трансгенные растения. Стадии производства БАВ из культуры клеток и тканей растений. Культура каллусных тканей. Методы культивирования клеток и тканей растений 2. Продолжительность занятия – 5 часов 3. Цель занятия: Освоить технологию поверхностного культивирования тканей раувольфии змеиной. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - методы культивирования клеток и тканей; - получение in vitro необходимой биомассы; - методы контроля полученной биомассы. В итоге занятия обучающийся (аспирант) должен уметь: - готовить растительный материал; - выращивать каллусную ткань на агаризованной питательной среде (поверхностное культивирование); - провести анализ (определить содержание аймалина в сухой биомассе). 4. Выполнить следующие задания: 1. Изучить поверхностное культивирование каллуса. 2. Получить биомассу раувольфии змеиной. 3. Определить содержание аймалина. 5. Информационные материалы. Трансгенные растения. Методы генетической инженерии позволяют достаточно быстро создавать новые генотипы растений, т. е. значительно сокращают время, которое затрачивается на классическую селекцию. Кроме того, применение этих методов позволяет изменять генотип целенаправленно. В отношении растений роль генетической инженерии сводится, главным образом, к созданию сортов сельскохозяйственных растений, устойчивых к насекомым-вредителям, фитопатогенам, гербицидам, пестицидам, различным стрессовым факторам. Проводятся работы по введению генов, регулирующих созревание плодов, отвечающих за синтез витаминов или лекарственных препаратов и т. д. Получение трансгенных растений значительно облегчается благодаря присущему растениям свойству тотипотентности, т. е. способности любой клетки растительного организма регенерировать целое растение. Следовательно, достаточно получить несколько трансформированных клеток, чтобы регенерировать из них растения-трансгены. Была предпринята удачная попытка использовать пыльцу в качестве супервектора при трансформации, что позволяет исключить появление растений-химер. Имеются сообщения об использовании искусственной бактериальной хромосомы в качестве векторной системы, что позволяет переносить целые кассеты генов, кодирующие множественные ступени биохимических процессов. Это открывает 27 такие широкие перспективы в трансформации растительных организмов. Первая волна трансгенных растений, допущенных для практического применения, содержала дополнительные гены устойчивости (к болезням, гербицидам, вредителям, порче при хранении, стрессам). Нынешний этап развития генетической инженерии растений относится к «метаболической инженерии». При этом ставится задача не столько улучшить те или иные имеющиеся качества растения (как при традиционной селекции), сколько научить растение производить совершенно новые соединения, используемые в медицине, химическом производстве и других областях. Этими соединениями могут быть, например, особые жирные кислоты, полезные белки с высоким содержанием незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины, антитела, интерфероны и другие «лекарственные» белки, новые полимеры, не засоряющие окружающую среду, и т. д. Использование трансгенных растений позволяет наладить масштабное и дешевое производство таких веществ и тем самым сделать их более доступными. В основе промышленного производства БАВ (лекарственный субстанций и др.) из культуры клеток растений лежит ряд последовательных стадий и операций: получение высокопродуктивных продуцентов, разработка оптимальных условий культивирования продуцента БАВ с максимальным биосинтезом целевого продукта, разработка и внедрение в практику соответствующих методов и условий выделения и очистки БАВ, создание готовых препаратов и контроль качества. Первая стадия. Подготовка среды для культивирования продуцента и посевного материала. Для каждого продуцента БАВ, для каждого вновь образуемого каллуса и суспензионной культуры растений разрабатывается своя оптимальная среда. Вторая стадия. Подготовка посевного материала – одна из ответственных операций в цикле биологического методы получения БАВ из культуры тканей. Для твердофазного метода культуру ткани выращивают на агаризованной стерильной питательной среде в колбах. Для глубинного (суспензионного) метода культуру ткани предварительно выращивают на агаризованной стерильной среде в пробирках, затем из пробирок высеивают в колбы с жидкой питательной средой и проводят две генерации глубинного выращивания на качалках Третья стадия биосинтеза – основная биологическая стадия процесса получения БАВ из культуры тканей. Задача этой стадии – обеспечение для продуцента БАВ таких условий развития, которые бы способствовали максимальному уровню биосинтеза БАВ. Эффективность стадии биосинтеза зависит от уровня образования БАВ из культуры ткани и определяется генетическими особенностями организма, составом питательной среды, режимом развития продуцента. В настоящее время производство БАВ из культуры тканей осуществляют двумя способами ферментации: суспензионное культивирование (глубинное культивирование) и культивирование на поверхности твердой среды (твердофазная ферментация). 28 Четвертая стадия - выделение, очистка БАВ и получение готовой продукции. Очистка целевого продукта осуществляется обычно в две стадии: предварительная обработка биомассы и выделение, очистка БАВ. Пятая стадия - получение готовой продукции. После выделения и химической очистки БАВ его необходимо высушить – удалить из препарата свободную и связанную воду. Фасовку порошков производят в емкость из оранжевого стекла. Готовый продукт подвергается тщательному аналитическому, биологическому и фармакологическому контролю. Культура каллусных тканей. Методы культивирования клеток и тканей растений В зависимости от способа, условии культивирования и происхождения можно выделить несколько типов культур клеток и тканей. Если культивирование происходит поверхностно на агаризованной питательной среде, то образуется каллусная ткань. Она не имеет четко выраженной структуры, но может различаться по плотности. Происхождение и условия выращивания определят, будет ли каллусная ткань рыхлой, средней плотности или плотной. Рыхлая каллусная ткань имеет сильно оводненные клетки, легко распадается на небольшие группы клеток и кластеры и поэтому может быть использована для получения суспензионной культуры. Ткань средней плотности характеризуется хорошо выраженными меристематическими очагами. В ней легко инициируются процессы органогенеза. Наконец, у плотных каллусных тканей различают зоны редуцированного камбия и трахеидоподобных элементов. Существует также суспензионная культура клеток, которую выращивают в жидкой питательной среде, так называемое глубинное культивирование. Клеточные суспензии образуются как из каллусных тканей, так и непосредственно из экспланта. Для получения суспензионных культур предпочтительнее брать каллусы рыхлого типа. Если для этой цели необходимо использовать плотный каллус, то его можно разрыхлить, исключив из питательной среды соли Са2+. Суспензионные культуры представлены разными агрегатами каллусных клеток. Клеточные суспензии играют значительную роль в биотехнологии. Они могут быть использованы для получения изолированных протопластов, которые применяют для клеточной селекции, при введении чужеродных ДНК и других процессах. Клеточные суспензии культивируют в больших количествах для получения вторичных метаболитов, выявления новых веществ, для выращивания клеточной биомассы. Однако увеличение клеточной биомассы в результате деления клеток и синтез вторичных метаболитов разобщены во времени. Большой интерес представляет культура одиночных клеток. Ее применяют в клеточной селекции для отбора гибридных клеток и их клонирования, а также для генетических и физиологических исследований. Например, вопрос о причинах генетической неоднородности легче решать, используя клон-потомство одной клетки, а не гетерогенную ткань исходного экспланта. Методы культивирования одной клетки или нескольких клеток: 1. Метод ткани - «няньки» - кондиционирующий фактор выделяется нахо29 дящимися рядом с одиночной клеткой кусочками ткани – «няньки». 2. Метод «кормящего слоя» - кондиционирующий фактор выделяют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка. 3. Кондиционирование среды - осуществляется путем добавления в нее питательной среды, отфильтрованной от интенсивно делящихся клеток. 4. Метод культивирования одиночных клеток - осуществляется в микрокапле, т.е. в очень малом объеме (≈20 мкл) богатой питательной среды. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Получение трансгенных растений. 2. Векторы на основе плазмиды агробактерии. 3. Стадии производства БАВ из культуры клеток тканей. 4. Типы культур клеток и тканей растений. 5. Методы культивирования клеток и тканей. 6. Каллусная клетка. Цикл ее развития. 7. Суспензионный способ получения культуры клеток и тканей. 8. Поверхностное культивирование куль тур клеток и тканей. 9. Методы культивирования одной или нескольких клеток. 10. Использование трансгенных растений в медицине. 30 Занятие №7 1. Тема: Генная инженерия в медицине и фармации. Конструирование генно-инженерно-модифицированных (трансгенных) растений. Технология генной инженерии растений. Проблемы и перспективы 2. Продолжительность занятия 5 часов 3. Цель занятия: Освоить технологию получения изолированных протопластов механическим методом. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - методы получения трансгенных растений; - получение in vitro необходимой биомассы; - векторные системы, используемые в генно-инженерных работах; - изолированные протопласты, цель их получения. В итоге занятия обучающийся (аспирант) должен уметь: - выделять протопласт из целой клетки; - провести анализ полученных протопластов. 4. Выполнить следующие задания: 1. Изучить технологию генной инженерии растений. 2. Изучить способы выделения изолированных протопластов. 3.Получить изолированные протопласты механическим методом и провести анализ. 5. Информационные материалы. Трансгенными (или генетически модифицированными) называются растения, в геном которых методами генетической инженерии перенесены гены из других организмов. Процесс переноса называется генетической трансформацией. Основным преимуществом такой технологи по сравнению с традиционной селекцией является возможность переноса всего одного гена. Что практически не затрагивает исходный генотип и значительно ускоряет процесс получения новых сортов растений. Наиболее широко используемый метод трансформации – агробактериальный, который был разработан на основе природного процесса. Почвенная бактерия Аgrobacterium tumefaciens способна инфицировать двудольные растения, вызывая опухоли - корончатые галлы. Как выяснилось, при этом происходят перенос и встраивание в растительный геном двух групп генов: продукты одних вмешиваются в нормальный метаболизм растения и способствуют разрастанию опухоли, а продукты других синтезируют опины, вещества, не нужные растению, но используемые в пищу бактериями. Ученые модифицировали агробактерии таким образом, что они вместо собственных переносят в растения гены, способствующие появлению хозяйственно ценных признаков. Впоследствии был разработан ряд других методов трансформации растительных клеток, из которых наибольшее распространение приобрел биобаллисти31 ческий. Он используется чаще всего для генетической модификации однодольных растений, не чувствительных к агробактериям. В специальных установках микрочастицы золота или вольфрама с нанесенной на них рДНК проникают в геном клеток мишени. Признаки, которые возможно придать растениям с помощью генной инженерии, весьма разнообразны и в основном ограничены только наличием соответствующих генов, причем их можно разделить на три группы. К первой группе относится устойчивость к различным факторам окружающей среды - гербицидам, болезням, вредителям, засухе, засолению. Вторая группа представляет интерес непосредственно для потребителей модификация вкуса и аромата плодов, увеличение продолжительности их хранения, изменение окраски цветов, бессемянность, улучшение питательной ценности растений. В третью группу входят растения-«биофабрики», способные синтезировать вакцины, ферменты, биополимеры и другие биологически активные вещества. В настоящее время в генно-инженерных проектах используют векторы на основе Тi-плазмид, транспозируемые элементы и вирусы растений. ДНК Аgrobacterium tumefaciens содержат Тi-плазмиды, вызывающие опухоли растений. В геноме агробактерии имеется Т-ДНК, содержащая гены, отвечающие за образование опухолей и синтез опинов. Именно этот участок Тi-плазмиды встраивают в ДНК растений. При реконструкции Тi-плазмид, используемых в генно-инженерных проектах, Т-ДНК области заменяют генами, представляющими интерес для человека. Как правило, это целевой ген устойчивости сельскохозяйственных растений к насекомым-вредителям и селективный, который определяет резистентность к определенным веществам (например, антибиотикам). Встраивание этого гена позволяет трансформированной клетке расти в питательной среде с антибиотиками, в то время как обычные клетки в ней гибнут. Иногда включают репортерный ген. который позволяет качественно определить трансформированную клетку, например по окрашиванию или свечению в ультрафиолетовом свете. В последние годы ученые используют новый подход для получения трансгенных растений с «antisense RNA» (перевернутой или антисмысловой РНК), который позволяет управлять работой интересуемого гена. В этом случае при конструировании вектора копию ДНК (кДНК) встраиваемого гена переворачивают на 180 град. В результате в трансгенном растении образуется нормальная молекула мРНК и перевернутая, которая в силу комплементарности нормальной мРНК образует с ней комплекс, и кодируемый белок не синтезируется. Такой подход был использован для получения трансгенных растений томатов с улучшенным качеством плодов. В вектор была включена кДНК гена РG, контролирующего синтез полигалактуроназы (роlуgаlacturonase) - фермента, участвующего в разрушении пектина, основного компонента межклеточного пространства растительных тканей. Продукт гена РG синтезируется в период созревания плодов томатов, а увеличение его количества приводит к тому, что томаты становятся более мягкими, что, в свою очередь, значительно сокращает срок их 32 хранения. Отключение этого гена позволило получить растения томатов с новыми свойствами плодов, которые не только значительно дольше сохранялись, но и сами растения были более устойчивы к грибным заболеваниям. Перспективы использования трансгенных растений в медицине Во всем мире активно ведутся работы по созданию на основе трансгенных растений так называемых «съедобных вакцин», которые в дальнейшем можно будет использовать для предупреждения наиболее опасных болезней человека. Например, учеными СО РАН успешно ведется разработка противотуберкулезной вакцины. При создании вакцины ученые используют гены человека, кодирующие синтез специфических антител к белкам возбудителя болезни – Мусоbacterium tuberculosis. Эти антитела и обеспечивают иммунитет к данному заболеванию. Гены, кодирующие антитела против туберкулеза, встроили в геном растительных клеток. Из клеток, в которых удачно произошло встраивание защитных генов, регенерировали полноценные растения, которые обладают способностью синтезировать антитела против туберкулеза. Традиционные методы лечения туберкулеза не всегда безвредны и эффективны, и ученые надеются, что использование трансгенных растений дает шанс не только избавиться от болезни, но и избежать побочных эффектов. Также в Институте физиологии и биохимии растений СО РАН создается вакцина против СПИДа, гепатита на основе трансгенеза томата и огурца. Группе немецких ученыхгенетиков из Giessen University во Франкфурте удалось вырастить генетически модифицированную морковь, которая содержит вакцину против гепатита В, что позволяет значительно снизить затраты на профилактику этого заболевания (по официальной статистике ВОЗ около 350млн человек в мире инфицированы вирусом гепатита В, который приводит к тяжелым повреждениям печени, хронизации процесса и смертельным исходам, ежегодно унося 1млн человеческих жизней). Трансгенная морковь может расти в разных климатических поясах и на разных грунтах, хорошо хранится, транспортируется, может употребляться в сыром виде. Потребляя этот продукт с пищей, человек как бы постоянно вводит вакцину маленькими дозами, чем поддерживает активность иммунитета к вирусу гепатита В. Иммуноглобулины к раковому эмбриональному антигену были получены в трансгенных растениях риса и пшеницы. Такие антитела используются в иммунотерапии онкологических заболеваний. За последние несколько лет в ведущих биотехнологических центрах мира созданы трансгенные растения-продуценты широкого спектра гормонов, цитокинов, факторов роста и ферментов, имеющих потенциальное применение в фармакологии. Все они не уступали по биологической активности аналогам, получаемым из других систем экспрессии. Производство рекомбинантных белков для медицинских целей с использованием традиционных систем требует значительных финансовых затрат. Так, например, недостаток лизосомального фермента гликоцереброзидазы в организме вызывает синдром Гоше. Единственным видом терапии этого заболевания является внутривенное введение гликоцереброзидазы. Долгое время этот белок получали из плаценты человека, на поддержание жизни одного пациента в течение года требовалось 160000$. Переключение продукции 33 гликоцереброзидазы на культуру клеток млекопитающих снизило стоимость этого препарата, однако не вытеснило его из группы "самых дорогих лекарств в мире". Было показано, что трансгенные растения способны синтезировать биологически активную гликоцереброзидазу человека. В дальнейшем были получены высокопродуктивные трансгенные растения табака, в которых содержание гликоцереброзидазы человека варьировало от 1 до 10% ТSР. Ожидается, что получение рекомбинантной гликоцереброзидазы из таких растений позволит значительно снизить её стоимость. По закону, принятому Всемирной организацией здравоохранения, предлагаемые источники лекарственных препаратов, в частности трансгенные растения, должны быть зарегистрированы и пройти серию клинических испытаний. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Природная векторная система, используемая для переноса генов в растения. 2. Методы получения трансгенных растений. 3. Что лежит в основе метода «antisense RNA» для получения трансгенных растений. 4. Конструирование генно-модифицированных растений. 5.Изолированные протопласты и их использование как объекта в генетической инженерии растений. 6. Способы получения изолированных протопластов. 7. Использование трансгенных растений для медицинских целей. 8. Трансгенные растения – продуценты антител. 9. Трансгенные растения – продуценты субъединичных вакцин. 10. Растения – продуценты фармацевтических белков. 34 Занятие № 8 1. Тема: Генная инженерия в медицине и фармации. Штаммы – суперпродуценты. Биомасса промышленных микроорганизмов как сырье для получения продуктов различного назначения. Современные научные исследования 2. Продолжительность занятия 5 часов 3. Цель занятия: Овладеть навыками использования ферментной системы микобактерий для биотрансформации. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - способы биотрансформации; - аппаратурное оформление процесса биотрансформации полупродуктов стероидной структуры. Схему биотрансформации. В итоге занятия обучающийся (аспирант) должен уметь: - осуществить посев микобактерий; - произвести выделение и кристаллизацию андростендиона; - рассчитать содержание стероида в культуральной жидкости. 4. Выполнить следующие задания: 1. Теоретически знать этапы биотехнологии рекомбинантной ДНК. 2. Получить стероид в культуральной жидкости. 5. Информационные материалы. Методы биотехнологии рекомбинантных ДНК: 1. Специфическое расщепление ДНК рестрикцирующими нуклеазами, что в значительной степени ускоряет выделение различных генов и манипуляции с ними. 2. Быстрое секвенирование всех нуклеотидов в очищенном фрагменте ДНК, позволяющее определить точные границы гена и кодируемую им аминокислотную последовательность полипептида. 3. Гибридизация нуклеиновых кислот, позволяющая с большой точностью выявить специфические нуклеотидные последовательности на основе их способности связывать комплементарные основания. 4. Клонирование ДНК, суть которого сводится к введению ДНК-фрагмента в самореплицирующийся генетический аппарат (плазмиду или вирус), который используют для трансформации бактерий. Бактериальная клетка после трансформации способна воспроизводить этот фрагмент во многих миллионах идентичных копий. 5. Генетическая инженерия, позволяющая получать модифицированные версии генов и затем внедрять их в клетки или организмы. Сущность генетической инженерии сводится к целенаправленному конструированию генетических систем вне организма с последующим введением их в живой организм. При этом рекомбинантные ДНК становятся составной частью 35 генетического аппарата реципиентного организма и, кроме того, они привносят в него новые генетические и физиолого-биохимические свойства, полезные для человека. К числу таких свойств можно отнести синтез аминокислот и белков, гормонов, ферментов, витаминов и др. Один из важных этапов конструирования молекулы ДНК - лигирование (или сшивание) генов с помощью фермента ДНК-лигазы. Сшивание фрагментов ДНК, содержащих нужные гены, осуществляют двумя основными методами: а) по «липким» концам; б) с помощью искусственно достроенных «липких» концов. После того как рекомбинантная ДНК сшита, ее вводят в живые клетки. Но поскольку она не способна к самовоспроизведению, ее разрушают внутриклеточные нуклеазы. Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в ее геном и реплицироваться за его счет, либо быть способной к автономной репликации. Принято молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называть векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями: 1. Иметь субстратные участки для определенных эндонуклеаз рестрикции. 2. Иметь свойства репликона. 3. Содержать один или несколько маркерных генов, которые после проникновения вектора в клетку придают ей фенотип, свидетельствующий о присутствии вектора. В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам. Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т. д. В качестве векторов используют плазмиды, бактериофаги, вирусы. Векторные плазмиды и векторные вирусы со встроенными чужеродными генами часто называют гибридными (или химерными) плазмидами (или фагами). После конструирования рекомбинантных ДНК их с помощью трансформации вводят в реципиентный организм: бактериальную, грибную, растительную или животную клетку. Трансформация предусматривает предварительную обработку клеток соединениями, обусловливающими проникновение ДНК внутрь клеток с последующим их помещением в среду, в которой способны существовать только клетки, получившие векторную молекулу, например в среду с определенным антибиотиком. Процесс инфицирования клеток с помощью чужеродных ДНК, приводящий к образованию зрелого фагового потомства, назван трансфекцией. Эффективность функционирования бактериальных генов неодинакова, что обусловливает вариабельность концентрации отдельных белков в зависимости от их функций. Такие вариации белков, например у Е. соli, обусловлены системой контроля генной экспрессии, осуществляемой в основном на уровне транскрипции ДНК, и зависят от количества синтезируемой на данном гене мРНК и ак36 тивности фермента РНК-полимеразы. Порядок в чередовании нуклеотидных последовательностей в промоторном участке структурного гена определяет степень активности РНК-полимеразы и инициацию процесса транскрипции. Бактериальные гены, включенные в геном, как правило, экспрессируются достаточно легко, давая мРНК и белок в силу того, что в сигнальных последовательностях, управляющих процессами транскрипции и трансляции у различных прокариотических организмов, много общих черт. Что касается экспрессии генов эукариот в бактериях, то она происходит крайне редко, если не создавать специальные условия, поскольку регуляторные участки эукариот отличны от таковых у бактерий. Суммарная активность экспрессируемого гена возрастает с ростом числа копий рекомбинантной ДНК в расчете на клетку. Используя многокопийные плазмиды, можно получить сверхсинтез нужных белковых продуктов. Получены температурно - чувствительные мутантные плазмиды, способные накопить до 1 2 тыс. копий на клетку без нарушения жизненно важных функций бактерий. Обычно же используемые плазмидные векторы поддерживаются в клетке в количестве 20 - 50 копий. Получение бактериальных штаммов-сверхпродуцентов плазмидных генов одна из важнейших задач современной биотехнологии в экономическом, медицинском и социальном аспектах. В настоящее время разработаны системы клонирования в бактериях, дрожжах, грибах, растениях и млекопитающих. Особый интерес с экономической точки зрения представляют системы клонирования генов в грамположительных бактериях, многие из которых являются сверхпродуцентами важнейших химических соединений. Значительных успехов в биоиндустрии удалось достичь с клетками Васillus subtilis, стрептомицетами и Sассharomyces cerevisiae. Векторы для клонирования в таких системах представляют собой двойные репликоны, способные существовать и в Е. соli, и в той клетке хозяина, для которой они предназначены. В. subtilis - непатогенный почвенный микроорганизм. Клеточная стенка бактерии имеет простую структуру, позволяющую секретировать многие белки в культуральную жидкость. Стрептомицеты широко применяют в биотехнологии в качестве продуцентов антибиотиков. Конструирование векторов для клонирования в них началось с выделения плазмиды Scp2 из Streptomyces coelicolor. На основе этой плазмиды были сконструированы векторы, придающие стрептомицетам устойчивость к антибиотикам, например к метиленомицину А. Клонирование в дрожжах. Среди дрожжей наиболее полно изучен вид S.cerevisiae. У этого вида в гаплоидных клетках содержится 17 хромосом, в их составе идентифицировано несколько сотен генов. Большинство штаммов дрожжей содержат автономно реплицирующуюся кольцевую ДНК длиной 2мкм. Работа с дрожжами облегчается тем, что подобно бактериям они могут расти в жидкой среде и давать колонии на твердой среде, а также имеют сравнительно короткое время регенерации (несколько часов) вследствие малого размера генома. 37 Клетки подобно В. subtilis секретируют большое количество белка во внеклеточную среду, что используется также для секреции чужеродных белков, например интерферона человека. В настоящее время с помощью рекомбинатных ДНК получают такие препараты как инсулин, соматотропин, интерферон, вакцины, а также моноклональные антитела, тромболитики и антикоагулянты и др. Большие перспективы открываются в лечении наследственных заболеваний человека с использованием генотерапии. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Рекомбинантная ДНК и ее значение. 2. Векторы и требования к ним. 3. Способы создания векторных конструкций. 4. Целенаправленное конструирование генетических систем вне организма с целью введения их в живой организм. 5. Методы секвенирования рекомбинантных ДНК. 6.Способы введения рекомбинантных ДНК в реципиентный организм. 7. Системы клонирования генов в грамположительных бактериях. 8. Клонирование в дрожжах. 9. Использование рекомбинантной ДНК с целью создания медицинских препаратов. 10. Использование рекомбинантной ДНК в генодиагностике и генотерапии человека. 38 Занятие № 9 1. Тема: Получение антибиотиков. Антибиотики как природные антиметаболиты. Пенициллины, цефалоспорины, тетрациклины, аминогликозиды, противоопухолевые антибиотики 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить стандартные микробиологические методы для обнаружения и выделения микробов – продуцентов антибиотических веществ. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - новые подходы к получению антибиотиков; - механизмы антибактериального действия антибиотиков; - технологии биотехнологического производства антибиотиков. В итоге занятия обучающийся (аспирант) должен уметь: - применять современные методы и условия культивирования микроорганизмов; - продуцентов антибиотических веществ при лабораторном и промышленном культивировании. 4. Выполнить следующие задания: 1. Провести определение чувствительности исследуемой культуры S.aureus к антибиотикам серийных разведений. 2. Определить по демонстрационному посеву чувствительность микробов к антибиотикам диско-диффузионным методом. 5. Информационные материалы. Антибиотики - это вещества, в основном, природного происхождения и различной химической структуры, которые в малых концентрациях вызывают задержку размножения или гибель микробов и опухолевых клеток. Антибиотики действуют избирательно, специфически нарушая процессы жизнедеятельности только у определенных групп микробов (их можно считать продуктами и инструментами антагонизма). Антибиотики являются одними из представителей вторичных метаболитов живых клеток, которые представляют собой низкомолекулярные соединения (антибиотики, алкалоиды, пигменты и т.д.), образующиеся в клетках по завершении фазы роста. Метаболиты — это естественно возникающие промежуточные продукты обмена веществ клетки организма (аминокислоты, жирные кислоты, витамины, пурины, пиримидины и некоторые другие), которые постоянно вовлекаются в реакции метаболизма, участвуя в синтезе белков, нуклеиновых кислот, антибиотиков и других соединений, или превращаются в иные необходимые для организма продукты. Наряду с метаболитами существуют вещества, обладающие антиметаболитными свойствами (антиметаболиты), которые препятствуют вовлечению метаболитов в нормальный обмен клетки. Антибиотики конечные продукты обмена, никак не могут быть метаболитами. Скорее, наоборот, многие антибиотики - это своеобразные антиметаболиты. Итак, антибиотики — не промежуточные продук39 ты обмена веществ организмов (метаболиты), а конечные продукты обмена, накапливающиеся внутри клетки или выделяющиеся в окружающую среду. Антибиотики микробного происхождения (их большинство) образуются актиномицетами (тетрациклины, аминогликозиды, эритромицин, актиномицины), некоторыми бактериями (полимиксины), грибами (пенициллин, гризеофульвин). Первой по значению для современной лечебной практики является группа антибиотиков пенициллинов и цефалоспоринов, которая основана на использовании для модификации так называемых «ядер» молекул беталактамной структуры. Ими являются 6-АПК (6-аминопенициллановая кислота) и 7-АДЦК (7аминодезацетоксицефалоспорановая кислота). Пенициллины могут быть выделены из природных материалов биосинтетически или комбинацией методов биологического и химического синтеза. При промышленном производстве пенициллинов сначала получают аминопенициллановую кислоту из культуры плесневого гриба Penicillium chrysogenum или Penicillium notatum, а затем микробиологическим или химическим способом проводят ацилирование аминогруппы карбоновой кислотой или ее хлорангидридом. На основе 6-аминопенициллановой кислоты (6-АПК) синтезировано большое количество полусинтетических пенициллинов более широкого спектра действия (ампициллин), устойчивых к стафилококковой пенициллиназе (метилциллин, оксациллин, диклоксациллин, клосациллин, нафциллин), не разрушающихся в кислой среде желудка (фенетициллин, феноксиметилпенициллин, пропициллин, бициллин) и др. Цефалоспорины. Основной продуцент этого антибиотика - гриб Cepholosporium acremonium. Цефалоспорины, подобно пенициллинам, ингибируют транспептидазу белковой молекулы, участвующей в формировании структуры клеточной мембраны патогенных бактерий. Некоторые из них действуют как на грамположительные, так и на грамотрицательные бактерии. В настоящее время применяются 5 поколений антибиотиков-цефалоспоринов: I поколение - цефазолин, цефалексин; II поколение - цефуроксим, цефамандол; III поколение - цефотаксим, цефтриаксон, цефтазидим, цефиксим; IV поколение - цефипим, цефпиром; V поколение - цефтобипрол. Общими качествами, характерными для всех цефалоспоринов являются: широкий спектр антибактериального действия, бактерицидный эффект, высокая резистентность к β-лактамазам (причем, цефалоспорины I и II поколений резистентны к ферментам Staphylococcus, а препараты III и IV поколений имеют высокую устойчивость к β-лактамазам грамотрицательных микроорганизмов. Второй группой антибиотиков являются тетрациклины. Их продуцентами являются стрептомицеты. Тетрациклин можно получать из хлортетрациклина путем удаления из его молекул атома хлора. Однако тетрациклин продуцируют и некоторые актиномицеты. Некоторые тетрациклины относятся к ряду полусинтетических препаратов. К наиболее широко известным тетрациклиновым антибиотикам принадлежат тетрациклин, 6-диметилтетрациклин, 7-хлортет-рациклин, 7хлор-6-диметилхлортетрациклин, 7-бромтетрациклин, 5-окситетра-циклин, а так40 же миноциклин, метациклин и доксициклин, полученные в результате химической модификации молекулы окситетрациклина. в кислых условиях. Третьей группой антибиотиков являются аминогликозиды, также состоящие как из природных веществ, так и продуцентов их химической модификации. Аминогликозиды – содержат аминосахара в своей структуре. Большинство из них (канамицин, гентамицин и др.) продуцируются актиномицетами. Все антибиотики-аминогликозиды обладают широким спектром действия на различные патогенные бактерии. Выделяют аминогликозиды 1-го, 2-го и 3-го поколений. К аминогликозидам 1-го поколения относятся стрептомицин, неомицин, мономицин, канамицин. Внедрение в практику гентамицина (2-е поколение) связано с возникновением устойчивых штаммов микроорганизмов к аминогликозидам 1-го поколения и высокой активностью этого препарата по отношению к синегнойной палочке. Аминогликозиды 3-го поколения (тобрамицин, сисомицин, амикацин, дидезоксиканамицин В, нетилмицин и т.д.) созданы в то время, когда были раскрыты молекулярные механизмы резистентности, обнаружены и выделены специфические ферменты, инактивирующие данные антибиотики. Аминогликозиды 2-го и 3-го поколений отличаются более высокой антибактериальной активностью, более широким спектром антимикробного действия; они постепенно вытесняют препараты 1-го поколения из традиционных областей их применения. Четвертая группа представлена противоопухолевыми антибиотиками, являющихся продуктами разных видов почвенных грибов или их синтетическими производными. В настоящее время из противоопухолевых антибиотиков наибольшее практическое применение имеют антрациклины (антрахиноновые соединения), блеомицин, относящийся к флеомицинам, дактиномицин, являющийся актиномицином, и митомицин – своеобразный антибиотик с алкилирующим механизмом действия. Механизм цитотоксического действия противоопухолевых антибиотиков связан, главным образом, с ингибированием синтеза нуклеиновых кислот путем интеркаляции между парами азотистых оснований, нарушением вторичной спирализации ДНК за счет взаимодействия с топоизомеразой II, а также связыванием с липидами клеточных мембран, сопровождающимся изменением транспорта ионов и клеточных функций. Такой механизм обусловливает высокую антимитотическую активность при низкой избирательности действия. Применение их в комбинации с другими противоопухолевыми средствами позволяет уменьшить дозы и снизить частоту и выраженность токсических эффектов. Технологический процесс производства антибиотиков состоит из пяти стадий. На первой стадии осуществляется подготовка питательной среды и посевного материала (инокулята). Для каждого продуцента антибиотика и вновь полученного штамма разрабатывается своя оптимальная среда. Вторая стадия биосинтеза – основная биологическая стадия в процессе получения антибиотика, обеспечивающая для продуцента такие условия развития, которые бы способствовали максимальному уровню образования БАВ. Эффективность стадии биосинтеза определяется генетическими особенностями орга41 низма, составом питательной среды, режимом развития продуцента и зависит от времени максимального образования антибиотика, стоимости компонентов среды, пеногасителей, энергетических затрат, связанных с процессом развития организма-продуцента. В производстве антибиотиков используют методы периодического, непрерывного культивирования, а также методы, занимающие промежуточное положение между периодическим и непрерывным культивированием – полунепрерывный отъемно-доливной метод. Третья и четвертая стадии выделения и химической очистки включает ряд процессов: от обработки нативного раствора до сушки готового очищенного препарата. На этой стадии в зависимости от свойств антибиотика, его химического строения и места основного накопления применяют различные методы выделения и очистки. В качестве основных методов используют экстракцию, осаждение, сорбцию на ионообменных материалах, упаривание, сушку. Пятая стадия сушки – удаление из полученного препарата свободной и связанной воды. Поскольку большинство антибиотиков в той или иной степени термолабильны, для их высушивания необходимо применять методы, не приводящие к потере биологической активности и не изменяющие цвета препарата. Широкое распространение получила лиофильная сушка антибиотиков, которая проводится при сравнительно низких температурах (-8, -12°С). Готовый антибиотик подвергается тщательному биологическому и фармакологическому контролю. Количественное определение большинства антибиотиков проводят биологическими методами, основанными на сравнительной оценке угнетения роста тест-микроорганизма. Активность устанавливают диффузионным или турбидиметрическим методами. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Антибиотики. Характеристика. Классификация. 2. Антибиотики как природные антиметаболиты. 3. Механизм действия антибиотиков на микроорганизмы. 4. Продуценты некоторых антибиотиков 5. Способы получения антибиотиков. 6. Получение пенициллинов, цефалоспоринов. 7. Получение тетрациклинов. 8. Получение аминогликозидов. 9. Получение противоопухолевых антибиотиков. 10.Стадии технологического процесса производства антибиотиков. 42 Занятие №10 1. Тема. Получение витаминов. Микробиологическое производство витаминов для здравоохранения. Низкомолекулярные биорегуляторы – коферменты и витамины: НАД, НАДФ, ФМН, ФАД, липоевая кислота, АТБ, биотин, аскорбиновая кислота 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить закономерности протекания биохимических процессов, происходящих с участием витаминов и коферментов. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - биологическую роль витаминов и коферментов; - химическую структуру витаминов и коферментов; - технологии биотехнологического производства витаминов. В итоге занятия обучающийся (аспирант) должен уметь: - применять теоретические знания о получении витаминов на практике; - сформировать понимание сложности влияния витаминов на организм человека. 4. Выполнить следующие задания: 1. Определить количество витамина С в биологических объектах: капустный рассол, шиповник, драже поливитаминов, картофель. 2. Провести качественные реакции на витамины в продуктах питания. 5. Информационные материалы. Витамины необходимы любому организму: начиная с микроорганизмов и заканчивая макроорганизмами. Витаминами (от лат. vita — жизнь) называют низкомолекулярные биорегуляторы, которые необходимы в небольших количествах для нормальной жизнедеятельности человека и должны поступать с пищей, так как организм не может удовлетворить свою потребность в них за счет биосинтеза. Биосинтез ряда витаминов все же может протекать в организме человека, но только под влиянием внешних факторов, например ультрафиолетового облучения (витамины группы D), или из каких-то предшественников (провитаминов), получаемых с пищей. (например, витамин А синтезируется из каротинов). Известно, что высокой биологической активностью обладают, как правило, не сами витамины, а их производные – коферменты. Коферментные формы на основе различных витаминов участвуют в многочисленных ферментативных реакциях, обладают широким спектром действия и эффективно используются в медицинской практике. Витамины синтезируют в основном химическим путем или получают из природных источников. Однако эргостерин, рибофлавин (В2), витамин В12 и аскорбиновую кислоту (микроорганизмы используются как селективные окислители сорбита в сорбозу при производстве витамина С) получают микробиологическим путем. Для синтеза витаминов В1, В2, В6, В12 и аскорбиновой кислоты также используют кефирные грибки, а бифидобактерии – группы В, РР (никотиновая 43 кислота) и Н, однако пока эти микроорганизмы не используются как продуценты витаминов в промышленных масштабах. Изменяя условия среды, содержание отдельных витаминов можно увеличить. Количество витаминов в клетках, а также их выделение из последних можно изменить при помощи микроэлементов. В настоящее время известно более 30 витаминов, и основные направления исследований в этой области связаны с углубленным изучением биологической роли витаминов, разработкой биотехнологических способов их получения и применения в медицине. Витамин В2 (рибофлавин) представляет собой D-рибитильное производное гетероциклической системы изоаллоксазина; такие производные носят общее название — флавины; из природных источников выделено уже боле 20 биологически активных веществ этого типа. Первый флавиновый кофермент (флавинмононуклеотид, или FMN) был выделен из сердечной мышцы в 1932г. и тогда же получен из дрожжей первый флавопротеид, содержащий FMN в качестве простетической группы. Второй важнейший флавиновый кофермент — флавинадениндинуклеотид (FAD) выделен как кофактор оксидазы D-аминокислот в 1938г. Поздне был установлена структура еще двух флавиновых коферментов: 8α-(N-Lгистидил)-FAD и 8α-(N-L-цистеинил)-FAD. За счет окислительновосстановительного превращения флавинового кольца флавиновые коферменты осуществляют окислительно-восстановительные реакции в составе многих важнейших ферментных систем: оксидаз (в частности, оксидаз D- и L-аминокислот, моноаминооксидазы, регулирующей уровень катехоламинов в крови) и дегидрогеназ (часто с участием никотинамидадениндинуклеотида и убихинонов). Основными источниками рибофлавина и его коферментных форм являются молоко, овощи, печень, почки и дрожжи; дополнительно он поступает в организм также за счет деятельности кишечной микрофлоры. Витамин В5, чаще называемый витамином РР (от англ. Pellagra preventing factor — антипеллагрический фактор) или ниацином, химически представляет собой два вещества, обладающие одинаковой витаминной активностью: никотиновую (3-пиридинкарбоновую) кислоту (ниацин) и никотинамид (ниацинамид). Биохимическую роль витамин В5 играет в форме коферментов: котинамидадениндинуклеотида (NAD) и никотинамиддинуклеодатидфосфата (NADP). Эти коферменты входят в многочисленную группу оксидоредуктаз (дегидрогеназ), принимающих участие почти в 150 различных биохимических реакциях дегидрирования, окисления, N-алкилирования, изомеризации, в восстановлении нитрата до нитрита и далее до аммиака, фотосинтезе, дыхании, энергетическо обмене, анаэробном расщеплении углеводов и т. д. В ходе окислительно-восстановительных реакций NAD+ и NADP+ реагируют в составе ферментов с органическими субстратами, стереоспецифически (чаще с нижней стороны пиридинового кольца) отнимая от них гидрид-иони образуя NADH и NADPH; обратная реакция также протекает стереоспецифически. Здоровые люди не очень чувствительны к недостатку или даже отсутствию никотиновой кислоты или никотинамида в продуктах питания. Дело в том, что провитамином ниацина является триптофан, и именно 44 недостаток этой незаменимой аминокислоты в кукурузе или сорго являлся причиной заболевания пеллагрой там, где они становились основными продуктами питания. В организме человека триптофан превращается прямо в NAD через кинуренин, 3-гидроксикинуренин и1-амино-4-формилбутадиен-1,2-дикарбоновую кислоту; эффективность процесса, однако, невысока: 1мг ниацина получается из 60мг триптофана. Недостаток NAD и NADP может восполняться также за счет ферментативного синтеза из никотиновой кислоты, но не из никотинамида, поэтому истинным витамином следует считать никотиновую кислоту. Витамин Н (биотин, биос II) был выделен из яичного желтка и назван биосом II или биотином. Биохимическую роль биотин выполняет в виде кофермента N5-карбоксибиотина, который связывается через ε-аминогруппу лизина с рядом ферментов (метилмалонил-СоА-транскарбоксилазой, ацетил-, пропионил-, метилкротонил и пируваткарбоксилазами) в форме конъюгата (так называемого «активного карбоксила»), переносящего СО2 в обратимых реакциях карбоксилированиядекарбоксилирования и транскарбоксилирования при биосинтезе липидов, аминокислот, углеводов, нуклеиновых кислот и других биологически важных веществ. Недостаток биотина приводит к депигментации кожи и развитию специфического экзематозного дерматита, а также торможению роста и нервным расстройствам. Биотин необходим растениям, микроорганизмами вообще любым клеткам, а содержание его в клетках злокачественных опухолей всегда повышено. Потребность человека в витамине Н составляет 0,1—0,3мг/сут и легко удовлетворяется за счет биосинтеза в микрофлоре кишечника. Витамин С, известный также под названием аскорбиновой кислоты, представляет собой γ-лактон 2,3-дегидро-L-гулоновой кислоты. Он содержит группировку ≪редуктона≫ [-С(ОН) =С (ОН)-СО], способную легко окисляться с образованием дегидро-L-аскорбиновой кислоты, и имеет довольно необычную для углеводов L-конфигурацию хирального центра 5. Интересно отметить, что Dаскорбиновая кислота не только не обладает витаминными свойствами, но и является антивитамином С. L-Аскорбиновая кислота, будучи самым сильным восстановителем живого организма, участвует во многих биохимических процессах транспорта электронов, а образующаяся при этом дегидроаскорбиновая кислота легко восстанавливается обратно специальной редуктазой. Важными функциями аскорбиновой кислоты являются метаболическое расщепление тирозина и лизина и гидроксилирование остатков пролина в составе протоколлагена до остатков гидроксипролина, что необходимо для построения фибриллярного коллагена. Она обеспечивает также гидроксилирование допамина до важнейшего гормона и нейромедиатора норадреналина, участвует в обмене липидов и ряде других реакций. Витамин N (липоеваякислота, α-липоевая, или тиоктовая,), обнаруженный в 1951г. как фактор роста дрожжей, ряда других микроорганизмов и простейших, содержится также во многих растительных и животных организмах и в форме εлипоиллизина (связанного с белком) является коферментом мультиферментных комплексов - пируватдегидрогеназы, α-кетоглутаратдегидрогеназы и др., осуществляющих окислительное декарбоксилирование α-кетокислот и построение ацильных производных кофермента А. Липоевая кислота участвует также в тиол45 дисульфидных превращениях различных белков, окислительном фосфорилировании, преобразовании арахидоновой кислоты в простагландин Н и прочих важных биохимических реакциях. Благодаря этому она находит широкое применение в медицине для нормализации липидного обмена, лечения некоторых болезней печени (например, цирроза, болезни Боткина), сахарного диабета, атеросклероза, некоторых отравлений, а также в педиатрии. Кофермент Q (убихиноны) относится к витаминоподобным веществам. Эти витамины близки по структуре витаминам группы Е (в переводе «убихинон» означает «вездесущий хинон»). Они присутствуют в клеточных мембранах и принимают участие в окислительно-восстановительных процессах, сопровождающихся переносом электронов. Получение убихинонв – это биотехнология на основе каллусных культур риса или опухолевой ткани. Продуценты – бактерии, дрожжи и дрожжеподобные микроорганизмы. Сухая масса грибов рода Candida содержит смесь убихинонов. Это один из примеров, когда биотехнология совмещает в едином процессе получение убихинонов и эргостерина из микробных липидов. С химической точки зрения эти соединения являются производными 1,4бензохинона, содержащими изопреноидную боковую цепь. Кроме того, в хиноновом кольце присутствуют метоксигруппы, а по соседству с изопреноидной группировкой - метильная группа. В организме убихиноны могут легко и обратимо восстанавливаться в гидрохиноны. Химическая основа функционирования убихинонов в организме базируется на их способности легко и обратимо превращаться в восстановленные формы, что обусловливает их способность к переносу электронов. Применение убихинонов – при ишемической болезни сердца и при повышенных нагрузках. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Роль витаминов в жизни человека и в обмене веществ. 2. Витамины как низкомолекулярные биорегуляторы. 3. Коферменты как низкомолекулярные биорегуляторы. 4. Классификация витаминов и коферментов. 5. Отличие витаминов от витаминоподобных веществ. 6. Гиповитаминозы, авитаминозы, гипервитаминозы, причины их возникновения. 7. Химическая структура витаминов и коферментов. 8. Продуценты некоторых витаминов 9. Способы получения витаминов. 10.Номенклатура витаминов. 46 Занятие №11 1. Тема: Нанобиотехнология. Основные понятия, современное состояние исследований. Технологическая схема получения микро- и нананокапсул. Методы получения. Аппаратура. Перспективы применения 2. Продолжительность занятия – 5 часов 3. Цель занятия: Формирование системных знаний, умений и навыков по получению субстанций лекарственных нанопрепаратов, профилактических и диагностических средств битехнологическими методами синтеза и трансформации, а также комбинацией биологических и химических методов. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - источники и способы получения биотехнологических нанолекарственных веществ, их физические и химические свойства; - общие и специфические методы анализа биотехнологических нанолекарств в субстанциях и лекарственных формах; - основные методы, применяющиеся в нанотехнологических экспериментах (структурные, аналитические, препаративные); - теоретические основы микрокапсулирования, методы получения микрокапсул и нанокапсул. В итоге занятия обучающийся (аспирант) должен уметь: - пользоваться базовой терминологией, применяющейся в нанотехнологиях; - применять на практике базовые методы микрокапсулирования, получать микро- и нанокапсулы; - определять биологическую активность нанолекарств и нанодиагностикумов. 4. Выполнить следующие задания: 1. Получить микрокапсулы липазы и пепсина методом диспергирования жидкость в жидкости 2. Получить микрокапсулы витамина Е методом простой коацервации. 5. Информационные материалы Нанотехнология - это технология изучения нанометровых объектов и работы с объектами порядка нанометра (миллионная доля миллиметра), что сравнимо с размерами отдельных молекул, и атомов. Нанотехнология является логическим продолжением и развитием микротехнологии. Слово «нано» в переводе с греческого означает буквально «карлик». Нанометр - ничтожная величина, в сотни раз меньшая длины волны видимого света и сопоставимая с размерами атомов. Поэтому переход от "микро " к "нано " – не количественный, а качественный, означающий скачок от манипуляции с веществом к манипуляции отдельными атомами. Развитие нанотехнологий характеризуется следующими основными этапами: 47 - развитие пассивных наноструктур, т.е. материалов с неизменными стабильными свойствами и функциями, например композиты с нановолокнами или электронные схемы с углеродными нанотрубками-контактами – с 2000г.; - создание активных наноструктур, т.е. материалов с изменяющимися свойствами и функциями, например биоактивные молекулы или электронные схемы с нанотранзисторами – с 2005г.; - формирование сложных наносистем, например самособирающиеся электросхемы или регенерирующиеся имплантированные живые ткани – предполагаемое начало с 2010г.; - развитие сложных наносетей, например самособирающиеся сети нанокомпьютеров и нанороботов или адаптивные генетические терапевтические лекарства – предполагаемое начало с 2015г. В последние годы быстрыми темпами развивается наномедицина. Под этим термином понимают применение нанотехнологий в диагностике, мониторинге и лечении заболеваний. Выделяют 5 основных областей применения нанотехнологий в медицине: 1) доставка активных лекарственных веществ, 2) новые методы и средства лечения на нанометровом уровне, 3) диагностика in vivo, 4) диагностика in vitro, 5) медицинские имплантаты. Более 50% фармацевтических компаний-производителей, которые активно работают в области наномедицины, используют нанотехнологии для разработки систем доставки активных лекарственных веществ к органам и тканяммишеням. Одной из ведущих областей применения таких систем является онкология. Применение систем доставки направлено на уменьшение неблагоприятных побочных эффектов ЛС. Благодаря нанобиотехнологиям разработан новый способ лечения раковых опухолей. Суть метода в том, что наночастицы вводят в опухоль, а затем либо за счет воздействия магнитного поля, либо лазерного облучения их нагревают, при этом опухолевые клетки разрушаются. В 2003г. начались клинические исследования термотерапии опухолей мозга и рака предстательной железы. Нанометровые молекулы могут применяться непосредственно в качестве активных веществ. В частности, интересным классом молекул с этой точки зрения являются дендримеры. Эти разветвленные молекулы могут достигать размера мелких протеинов. По сравнению с классическими полимерными молекулами они обладают тем преимуществом, что можно контролировать их синтез с заданными свойствами, т.е. запрограммировать для определенного медицинского применения. Примером создания активного вещества на основе дендримера является препарат Vivigel – гель, способный защитить от ВИЧ-инфекции. Одним из новых принципов является размельчение активных лекарственных веществ до нанометровых размеров. Так пытаются решить проблему недостаточной растворимости ЛС. Новые возможности развития отечественной медицины связаны с реализацией междисциплинарных разработок в области нанотехнологий и лазерной физики. На базе ИОФ РАН им. Прохорова уже разработаны лазерные установки 48 для лечения хронического бронхита, хронической пневмонии, тяжелых форм туберкулеза легких и других заболеваний, а также средства диагностики раковых заболеваний. На базе Института эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН разработана технология создания нановакцин на основе молекулярного конструирования, одним из важнейших элементов которого станут частицы наноразмерного полисахарида, которые разрабатываются в Институте общей физики РАН им. А.М. Прохорова. Нанокапсула иначе коллоидосома (англ. nanocapsule) — наночастица, состоящая из полимерной, липидной или другой оболочки, окружающей ее внутреннюю полость или содержимое. Обычно нанокапсула представляет собой сферическую полую частицу, оболочка которой образована полимерами или фосфолипидами (в этом случае она называется липосомой или наносомой), а внутри находится низкомолекулярное вещество. Оболочка нанокапсул может быть изготовлена также из других материалов, например, гидроксиапатита или силиката кальция, а также определенным образом организованных молекул ДНК. Нанокапсулы должны быть химически стабильны, биоактивны, биосовместимы с организмом, защищать капсулированное вещество от нежелательного воздействия, например, растворения в жидкостях. Размеры нанокапсул обычно не выходят за пределы 100нм. Нанокапсулы обладают высокой проникающей способностью и могут проходить даже в такие «закрытые» зоны организма, как головной мозг. По размерам различают макро-, микро- и нанокапсулы. Первые имеют размеры 0,5-5,0мм и обычно используются по одиночке. Размеры микрокапсул колеблются от 1 до 1000 мкм, нанокапсул - от 50 до 200нм. В качестве оболочки макро- и микрокапсул обычно используют природные или синтетические полимеры, неорганические материалы и др. Микрокапсулированием достигаются: а) защита неустойчивых лекарственных препаратов от воздействия внешней среды (витамины, антибиотики, ферменты, вакцины, сыворотки и др.); б) маскировка вкуса горьких и тошнотворных лекарств; в) высвобождение лекарственных веществ в нужном участке желудочнокишечного тракта (кишечно-растворимые микрокапсулы); г) пролонгирование действия; д) совмещение в одной лекарственной форме несовместимых между собой веществ (использование разделительных покрытий); с) перевод жидкостей и газов в псевдотвердое состояние, т. е. в сыпучую массу, состоящую из микрокапсул с твердой оболочкой. Методы микрокапсулирования делятся на три основные группы: физические, физико-химические и химические. Физические методы микрокапсулирования многочисленны. К ним относятся методы дражирования, распыления, напыления в псевдосжиженном слое, диспергирования в несмешивающихся жидкостях, экструзионные методы, электростатический метод и др. 49 Основным физико-химическим методом является микрокапсулирование с использованием явления коацервации. Получение микрокапсул химическим методом основано на реакции полимеризации и поликонденсации на границе раздела фаз вода - масло. Нанокапсулы применяют для контролируемого введения инкапсулированных биологически активных веществ: лекарственных препаратов (в том числе нерастворимых в воде или нестабильных), пептидов и белков (имеющих функции гормонов и цитокинов), а также генетических конструкций, несущих гены ферментов, гормонов и цитокинов. Диапазон капсулированных веществ широк — от средств противоопухолевой терапии и морфогенетических белков костной ткани до средств косметологии. Для целевой доставки поверхность нанокапсул может быть модифицирована специфическими антигенами, рецепторами или лигандами. Липосомы являются одними из наиболее удобных нанокапсул. Перспективными также представляются подходы доставки нанокапсул внутри эритроцитов или бактерий. Технология включения лекарственных веществ в нанокапсулы позволяет использовать многие лекарственные соединения, доставка которых в органы и ткани была бы сильно затруднена из-за их нестабильности или нерастворимости в воде. В липосомах (наносомах) возможно капсулирование водных растворов лекарственных веществ, а полимерные нанокапсулы обычно используют для жирорастворимых соединений. Эта технология позволяет снизить токсичность и добиться желаемой фармакокинетики для лекарственных препаратов. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Предмет и задачи нанобиотехнологии. Основные понятия и определения наук о наносистемах и нанобиотехнологии. 2. История возникновения нанотехнологии. 3. Примеры нанообъектов и наносистем, их технические приложения. 4. Объекты и методы нанобиотехнологии. 5. Принципы и перспективы развития нанобиотехнологии. 6. Наноматериалы и их классификация. 7. Микрокапсулы. Цели микрокапсулирования. 8. Современные методы получения микрокапсул. 9. Что такое нанокапсулы? Отличие нанокапсул от микрокапсул. 10. Применение микро- и нанокапсул. 50 Занятие № 12 1. Тема: Нанобиотехнология. Наноносители, фулерены, наносомы. Микрокапсулирование. Характеристика методов получения микро- и нанокапсул 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить теоретические основы инкапсулирования биологически активных веществ. Сформировать у аспирантов систему знаний по методам получения биотехнологических нанопрепаратов. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - теоретические основы методов микрокапсулирования, получения нанокапсул и липосом; - инновационные пути создания нанолекарственных средств на основе использования данных геномики, протеомики и биоинформатики; - принципиальное значение нано-размерности как фактора, радикально меняющего физико-химические свойства. В итоге занятия обучающийся (аспирант) должен уметь: - пользоваться базовой терминологией, применяющейся в нанотехнологиях; - получать микро- и нанокапсулы различными методами; - освоить технологию получения липосом и методов их исследования; - определять биологическую активность нанолекарств и нанодиагностикумов. 4. Выполнить следующие задания: 1. Получить липосомы стрептомицина сульфата методом ручного встряхивания и «впрыскивания». 5. Информационные материалы Нанотранспортные системы (наноносители) можно охарактеризовать как тип коллоидных систем доставки лекарственных средств к тканям, клеткам и даже к вирусам, а также контролировать параметры высвобождения, пролонгируя его на несколько месяцев. Они представляют собой частицы размером менее 1мкм, образованные природными или синтетическими полимерами. «Пришивание» к поверхности наноносителя лиганда - молекулярного адреса - один из способов получения систем высвобождения лекарственного вещества нацеленного действия. К числу наноносителей лекарственных средств относятся полимерные нанокапсулы и наносферы. Наносферы представляют собой полимерные пористые матрицы. Лекарственное вещество может быть включено в структуру матрицы, а может быть адсорбировано или химически привито на ней. В нанокапсулах лекарственное вещество включено в ядро в виде раствора либо адсорбировано или химически привито на поверхности полимерной оболочки. Попадая в кровь при внутривенном введении, наноносители подвергаются опсонизации. На их поверхности происходит адсорбция белков плазмы. Опсони51 зацию предотвращают путем модифицирования поверхности наноносителей поверхностно-активными и другими веществами. Например, в результате адсорбции полиэтиленоксида (ПЭО) на поверхности наночастиц создается защитный слой, препятствующий контакту с белками. Опсонизированные наноносители подвергаются фагоцитозу и накапливаются в печени, селезенке, легких, лимфатических узлах. Для получения полимерных наноносителей используют синтетические и природные полимеры, в том числе полиаминокислоты, модифицированный поливиниловый спирт, полигидроксиэтилметакрилат, полицианоакрилат, а также пептиды, полисахариды, протеогликаны и др. Большой интерес представляет использование биодеградируемых полимеров, которые при попадании в физиологическую среду подвергаются деструкции в результате гидролитического разложения, ферментативного расщепления или жизнедеятельности микроорганизмов. Чаще всего для создания таких композиций используют биологически совместимую DL-полимолочную кислоту (ПМК) или сополимеры на ее основе (например, с гликолевой кислотой — ПЛГ). Они деградируют по сложноэфирным связям до естественных продуктов метаболизма — молочной и гликолевой кислот. Скорость разложения сополимеров программируется вариациями молекулярной массы, соотношением мономеров, кристалличностью и другими параметрами и может составлять от нескольких недель до года и более. Это обеспечивает депо лекарственного вещества при подкожном или внутримышечном введении лекарственной формы. К числу наноносителей относятся наносомы, представляющие собой фосфолипидные нанокапсулы. С помощью наносом возможна внутриклеточная доставка лекарственных средств, которые в традиционных лекарственных формах практически не могут преодолеть клеточный барьер. Биодеградация наносом в организме и высвобождение иммобилизованных в них лекарств могут продолжаться долго, в результате наряду с внутриклеточной доставкой обеспечивается пролонгированное действие. Токсические свойства наносомальных лекарственных препаратов резко снижаются, в связи с чем становится возможным эффективное использование многих высокотоксичных препаратов. Зарубежные и Российские специалисты в области нанотехнологий уделяют большое внимание углеродным нанотрубкам и фуллеренам. Фуллерен представляет собой замкнутую полую сферу, образованную чередованием гексагонов (6-членных углеродных колец) и пентагонов (5- членных углеродных колец). Известны получаемые в достаточно больших количествах С60, C70, C76 и другие. Наиболее устойчивую форму имеет фуллерен С60, сферическая полая структура которого состоит из 20 шестиугольников и 12 пятиугольников. Углеродные нанотрубки являются уникальными макромолекулярными системами. Их весьма малый нанометровый диаметр и большая микронная длина указывают на то, что они наиболее близки по своей структуре к идеальным одномерным системам. Они химически и термически стабильны, обладают превосход52 ной теплопроводностью, уникальными прочностными и механическими характеристиками. От фуллеренов нанотрубки отличаются сравнительно бόльшим объемом внутренней полости; молекулы устойчивых фуллеренов слишком малы, чтобы сдержать во внутренней полости больше трех-четырех атомов других элементов. Если каждый фуллерен представляет собой молекулу (которая может входить в состав молекулярных кристаллов), то углеродные нанотрубки нельзя рассматривать как отдельные молекулы (однослойные нанотрубки ближе к молекулам, многослойные – к углеродным волокнам), а сростки нанотрубок нельзя относить к обычным трехмерным кристаллам (отдельную нанотрубку принято рассматривать как одномерный, а сросток нанотрубки – как двумерный кристалл). Благодаря своим уникальным свойствам фуллерены и нанотрубки могут применяться во многих промышленных направлениях: создание новых материалов, устройства хранения, биотехнологии и др. Данные исследования сосредоточены на получении препаратов нового поколения, разработке способов доставки лекарственных средств, получении искусственных тканей организма, совершенствовании методов диагностики заболеваний и лабораторного тестирования препаратов. К парентеральным направленным системам доставки лекарственных средств нового поколения относят такие формы, как липосомы, микрокапсулы, микросферы, нанокапсулы и ниосомы. Микрокапсулы — это емкости, ограниченные полимерной оболочкой и содержащие лекарственное вещество; микросферы — матрицы с диспергированным лекарством. Диаметр их более 1мкм (в некоторых случаях достигает 200мкм и более). Микрокапсулы и микросферы изготавливают из синтетических или природных веществ. В них включают различные лекарственные средства и, особенно, цитостатики (метотрексат, митомицин С, 5-фторурацил, цисплатин), в том числе при селективной внутриартериальной химиоэмболизации у больных с карциномами мочевого пузыря, печени, почек, предстательной железы. Такие микроэмболы с цитостатиками обеспечивают высокую эффективность противоопухолевого лечения при меньших дозах лекарственных веществ, чем обычно применяемые в традиционных методах химиотерапии. Нанокапсулы — это частицы с преимущественным диаметром 25-800нм, изготавливаемые из полиалкил-2-цианакрилатов, изобутилцианакрилата, альбумина, желатина и др., с включенными или адсорбированными лекарственными веществами (например, диазепамом, доксорубицином, инсулином, метотрексатом, натрия салицилатом, простагландинами и пр.). Ниосомы — осмотически активные пузырьки, получаемые гидратированием смеси неионных ПАВ и холестерина, с включенными водорастворимыми лекарственными веществами. Диаметр ниосом колеблется от 300 до 900 нм. По своей «поведенческой активности» в организме ниосомы напоминают липосомы. Липосомы — концентрически замкнутые бислойные фосфолипидные мембраны, которые могут быть моноламеллярными (микро- и макровезикулярные, с диаметром 20-50нм и 200-1000нм соответственно) и мультиламеллярными, или 53 многослойными. Липосомы могут быть предназначены для внутрисосудистого, внутриполостного и наружного применения. Однако липосомы не проникают через гематоэнцефалический барьер и клубочковый аппарат почек и слабо — в сердечную и скелетные мышцы. В липосомы включают различные лекарственные вещества синтетического и природного происхождения (например, ферменты, антибиотики) и даже хромосомы. Методы получения микро- и нанокапсул можно условно разделить на три основные группы: 1. Физические методы микрокапсулирования основаны на способах формирования оболочек с помощью механических приемов. В эту группу методов входят нанесение покрытий в псевдоожиженном слое, экструзия с применением центрифуг или через формующие устройства типа «труба в трубе», конденсация паров (вакуумное напыление). 2. Физико-химические методы — коацервация, осаждение из водной среды пленкообразующего полимера путем добавления компонента, уменьшающего его растворимость, образование новой фазы при изменении температуры, упаривание легколетучего растворителя, отверждение расплавов в жидких средах, экстракционное замещение, высушивание распылением, физическая адсорбция. 3. Химические методы основаны на химических превращениях, приводящих к получению пленкообразующего материала, а именно — образование новой фазы путем сшивания полимеров, поликонденсация и полимеризация. Химическим превращениям могут подвергаться как высокомолекулярные вещества (олигомеры или полимеры), так и низкомолекулярные. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Основные понятия и определения наук о наносистемах и нанобиотехнологии. 2. Наноносители. Характеристика. Основные функции. 3. Наноносители: наносферы, наносомы. 4. Что можно отнести к числу наноносителей лекарственных средств? 5. Углеродные нанотрубки. Фуллерены. Принципиальные отличия. 6. Современные методы инкапсулирования. 7. Способы получения микро- и нанокапсул. 8. Что такое нанокапсулы? 9. Отличие нанокапсул от микрокапсул. 10. Применение микро- и нанокапсул. 54 Занятие № 13 1. Тема. Пробиотики в фармации. Препараты для лечения дисбактериоза. Общая схема процесса производства пробиотиков 2. Продолжительность занятия – 5 часов 3. Цель занятия: Изучить общие проблемы микроэкологии человека, основные причины дисбактериоза. Пробиотики в борьбе с дисбактериозом. 3.1. Целевые задачи: В итоге занятия обучающийся (аспирант) должен знать: - факторы, влияющие на состояние нормальной микрофлоры; - биообъекты, используемые при производстве нормофлоров; - препараты пробиотиков, используемые для лечения дисбактериоза. В итоге занятия обучающийся (аспирант) должен уметь: - готовить среды для учета молочнокислых бактерий и разливать их в чашки Петри; - осуществлять титрование культур молочнокислых бактерий. 4. Выполнить следующие задания: 1. Определить концентрацию жизнеспособных клеток лактобацилл и бифидобактерий. 2. Определить активную и титруемую кислотность лактобактерина. 5. Информационные материалы. Равновесие разнообразных видов микробов отдельных органов и систем, поддерживающее биохимическое, метаболическое и иммунологическое равновесие, нужное для сохранения здоровья человека, называют нормофлорой. Функции нормальной микрофлоры. Нормальная микрофлора рассматривается как самостоятельный экстракорпоральный орган с определенной анатомической структурой и следующими функциями: антагонистической (обеспечивает устойчивость соответствующих участков тела к заселению случайной, в том числе и патогенной, микрофлорой); иммуногенной (бактерии, постоянно поддерживают иммунную систему в должном состоянии своими антигенами); пищеварительной (нормальная микрофлора принимает участие в полостном пищеварении за счет своих ферментов); метаболической (нормофлора участвует в обмене белков, липидов, оксалатов, стероидных гормонов, холестерина за счет свих ферментов); витаминообразующей (в процессе метаболизма отдельные представители нормальной микрофлоры образуют витамины); детоксикационной (нормальная микрофлора обезвреживает образующиеся в организме токсические продукты обмена веществ или организмы, попавшие из внешней среды); регуляторной (нормальная микрофлора участвует в регуляции газового, водно-солевого обмена, поддержания рН среды); генетической (нормофлора является неограниченным банком генетического материала). 55 Дисбактериоз - это нарушение равновесия микрофлоры. При дисбактериозе нарушено соотношение полезных и условно-патогенных микроорганизмов, например, в кишечнике или в репродуктивных органах. Причинами дисбактериоза могут быть различные иммунодефициты (при СПИДе, раке крови, при лечении лучевой и химиотерапией, при системных заболеваниях). В этом случае иммунная система просто не способна контролировать численность патогенных микроорганизмов. Вторая причина дисбактериоза – продолжительное антибактериальное лечение. Третья причина состоит в том, что в кишечнике могут формироваться такие условия, в которых нормальная флора погибает. Лечение дисбактериоза в первую очередь должно быть направлено на ликвидацию причин, приведших к его развитию и устранение этих причин, используя пробиотики. Пробиотики - это живые микроорганизмы, которые при использовании в адекватных количествах оказывают положительный эффект на здоровье организма-хозяина. В клинической практике в зависимости от конкретных потребностей применяются различные виды микроорганизмов. В качестве пробиотиков обычно используются грамположительные кисломолочные бактерии (такие как Lactobacillus acidophilus, L.casei, L.lactis, L.plantarum, L.reuteri, L.rhamnosus, L.salivarius и L.johnsonii) и различные бифидобактерии (такие как Bifidobacterium animalis, B.infantis, B.lactis, B.longum и B.breve). В качестве пробиотиков на рынках позиционируются и другие микроорганизмы — непатогенные штаммы Escherichia coli или Enterococcu sspp., а также Saccharomyces boulardii (непатогенные дрожжи). Накопленные в настоящее время данные свидетельствуют, что пробиотики оказывают штамм-специфичные эффекты. Известно, что действие пробиотиков и продуктов питания с пробиотиками направлено на создание временного искусственного микробиоценоза в кишечнике, во время существования которого создаются условия для активизации собственной микрофлоры. Поэтому очень важно, чтобы пробиотик содержал в своем составе штаммы, обладающие высокой антагонистической активностью по отношению к условно-патогенным и патогенным микроорганизмам (продукция бактериоцинов), быстро размножался в кишечнике, т.е. имел хорошую скорость роста, и быстро закислял его содержимое. В типичных случаях дозировка варьирует в зависимости от используемого продукта, но обычная доза колеблется в пределах от 5 до 10 миллиардов КОЕ в день для детей и от 10 до 20 миллиардов КОЕ в день для взрослых. Существует несколько подгруп пробиотиков: монокомпонентные, содержащие живые бактерии, относящиеся к представителям нормальных симбионтов (бифидобактерии, лактобактерии, кишечные палочки, пропионовокислые бактерии и др.), или самоэлиминирующие антагонисты (Bacillus subtilis, Bacillus coagulans, B. licheniformis, Saccharomyces boulardii). К указанным препаратам относятся бифидумбактерин, лактобактерин, колибактерин, жидкий концентрат бифидобактерий, энтерол, бактисубтил, биоспорин, споробактерин, бактиспорин, биобактон, биофлор, нутралин; 56 поликомпонентные - состоящие из нескольких микроорганизмов: бифилонг (Bifidobacterium bifidum и В.longum), ацилакт (Lactobacillus acidophilus - 3 разных штамма 100 АШ, NK1, КЗ, Ш24), линекс (L. acidophilus, B.bifidum, Enterococcus faecalis), биоспорин (В. subtilis, B. licheniformis), бифиформ (В. longum, Enterососсus faecium), ацидофилюс (L .acidophilus, L. bulgaricum, Streptococcus thermophilus), бифидин (Bifidobacterium adolescentis и Escherichia coli), бифинорм (B. bifidum, B. adolescentis, B. longum); комбинированные - бифидумбактерин-форте, состоящий из В. bifidum, адсорбированных на активированном угле в виде микроколоний; кипацид, содержащий L. acidophilus и комплексный иммуноглобулин; бифилиз, включающий B.bifidum и лизоцим; аципол, содержащий L. Acidophilus и полисахарид кефирных грибков; рекомбинатные или генноинженерные - субалин, который представляет собой штамм В. subtilis, несущий клонированные гены, контролирующие синтез α-интерферона. Все бифидосодержащие продукты питания с пробиотиками можно разделить на три группы. В первую входят продукты, обогащенные бифидобактериями. К подобным продуктам относятся бифидокефир, антацидный бифилакт, бифидомолоко, бифидойогурт, бифидомороженое, бифидосметана. Вторая группа бифидосодержащих продуктов включает в себя продукты смешанного брожения, чаще всего сквашенные совместной культурой бифидобактерий и молочнокислых микроорганизмов. Это напитки «Угличский», «Вита». К третьей группе относятся продукты, сквашенные чистыми или смешанными культурами бифидобактерий, в производстве которых активизация роста достигается обогащением молока бифидогенными факторами различной природы. Кроме того, могут использоваться штаммы бифидобактерий адаптированные к молоку и способные расти в аэробных условиях. Среди таких продуктов - бифилин-М, кисломолочный бифидумбактерин. Общая схема технологического процесса производства пробиотиков: 1. Подготовка производственных помещений, оборудования, посуды, персонала, вентиляционной системы - проводят в соответствии с требованиями инструкций, регламентирующих условия работы со стерильными лекарственными средствами. 2. Подготовка и стерилизация сред (концентрированной, производственной и защитной среды высушивания). Предварительные работы включают качественный подбор необходимых для данной культуры веществ. 3. Оценка влияния отдельных компонентов на выход целевого продукта. 4. Нахождение оптимального соотношения составляющих и удешевление сред. 5. Выращивание маточных (до 6 пассажей) и производственных культур. Вначале выращивают маточную культуру из специального штамма при температуре 370°С, используя различные питательные среды. Производственную культуру выращивают методом глубинного культивирования в реакторах, установленных в боксах. Реакторы оснащены магнитной мешалкой и паровой рубашкой. 57 6. Розлив микробной суспензии в ампулы и флаконы проводят на аппаратах розлива и запайки ампул. Заполненные ампулы и флаконы поступают на сублимацию. 7. Сублимационная сушка. Ампулы помещают в морозильные камеры под углом 750°. Содержимое ампул замораживают при температуре -400°С, выдерживают при этой температуре 18-24ч, подвергая сублимации. 8. Укупорка. Ампулы с сухой микробной массой запаивают (флаконы укупоривают) с газовой защитой. 9. Маркировка, упаковка. Ампулы маркируют и упаковывают в пачки по 10штук. 10. Контроль качества готовой лекарственной формы. 6. Задание для текущего контроля Вопросы по теме занятия: 1. Нормальная микрофлора (нормофлора) человека и ее функции. 2. Значение микрофлоры на организм человека 3.Штаммы микроорганизмов, используемые для производства нормофлоров. 4. Требования, предъявляемые к штаммам микроорганизмов. 5. Факторы, влияющие на развитие дисбактериоза 6. Характеристика препаратов для лечения дисбактериоза. 7. Общая схема технологического процесса производства пробиотиков. 8. Частная технология препаратов пробиотиков. 9.Питательные среды, используемые для выращивания молочнокислых бактерий. 10. Параметры, контролируемые в процессе культивирования молочнокислых бактерий. 58 1. Задания для рубежного контроля Вопрос №1 Биотехнология – это дисциплина, которая: (a) использует биологические объекты для промышленного производства полезных для человека и животных веществ и продуктов (b) использует химические процессы для получения органических соединений (c) изучает химический состав биологических объектов (d) изучает особенности протекания биохимических процессов в живых клетках Вопрос №2 В роли биообъектов могут выступать: (a) растения, культивируемые в искусственных условиях (b) продукты жизнедеятельности микроорганизмов (c) клетки микро- и макроорганизмов и ферменты (d) выращиваемые в особых стерильных условиях животные-гнотобионты Вопрос №3 Под культурой клеток понимают: (a) популяцию про- или эукариотических клеток, выращиваемых в контролируемых условиях in vitro (b) группу эукариотических клеток, выполняющих определенную функцию (c) популяцию микроорганизмов, существующую на питательном субстрате (d) популяцию клеток в естественной среде, продуцирующих ценные БАВ Вопрос №4 При росте клеток на питательной среде в биотехнологии выделяют следующие последовательные стадии: (a) лог-фаза, идиофаза, стационарная фаза, фаза отмирания (b) лаг-фаза, трофофаза (c) лаг-фаза, фаза отмирания, лог-фаза (d) трофофаза, идиофаза Вопрос №5 Система GMP предъявляет требования к контролю качества лекарственных средств: (a) только на стадии непосредственно производства готовых продуктов (b) только на стадии переработки сырья (c) с начала переработки сырья до производства готовых продуктов (d) на стадиях фасовки и упаковки готовых продуктов 59 Вопрос №6 Особенностью асептики на биотехнологическом производстве является то, что это комплекс мер, направленных на: (a) предотвращение попадания в среду любых микроорганизмов (b) предотвращение попадания в среду только условно-патогенных и патогенных микроорганизмов (c) предотвращение попадания в среду посторонних микроорганизмов (d) предотвращение попадания в среду сапрофитных микроорганизмов Вопрос №7 Преимущество клеток микроорганизмов как биообъектов над клетками животных и растений заключается в: (a) наличии у них ферментных систем, необходимых для роста на искусственных питательных средах (b) повышенной чувствительности микроорганизмов к воздействию механических, физических и химических факторов (c) выраженной скорости протекания ферментативных реакций и нарастания клеточной массы в единицу времени (d) их способности продуцировать аналогичные БАВ, но в значительно больших количествах Вопрос №8 В качестве источника минерального азота в составе питательных сред используется: (a) зелёная патока (b) кукурузная мука (c) меласса (d) соли аммония Вопрос №9 По физическому состоянию питательные среды подразделяются на следующие группы: (a) жидкие, полужидкие, плотные, сыпучие (b) твёрдые, мягкие, газообразные (c) твёрдые, полутвёрдые, плотные (d) сыпучие, полусыпучие, мягкие, твёрдые Вопрос №10 Биореактор, используемый для наработки посевного материала, называется: (a) эрлифт (b) барботёр (c) инокулятор (d) ферментёр 60 Вопрос №11 Правила GLP регламентируют: (a) методы математической обработки данных (b) методы математической обработки данных (c) планирование поисковых работ (d) набор тестов при предклинических испытаниях Вопрос №12 Главный критерий отбора продуцента в качестве биообъекта: (a) быстрое накопление биомассы (b) секреция целевого продукта в культуральную жидкость (c) устойчивость к заражению посторонней микрофлорой (d) способность расти на дешевых питательных средах (e) способность синтезировать целевой продукт Вопрос №13 Ретроингибирование конечным продуктом при биосинтезе БАВ заключается в подавлении: (a) активности всех ферментов метаболической цепи (b) активности последнего фермента метаболической цепи (c) активности начального фермента метаболической цепи (d) трансляции (e) транскрипции Вопрос №14 Индукция фермента – это: (a) увеличение скорости синтеза фермента в ответ на появление индуктора (b) уменьшение скорости синтеза фермента в ответ на появление индуктора (c) уменьшение скорости разложения фермента в ответ на появление индуктора Вопрос №15 Трансляция ферментов синтеза метаболитов в клетке осуществляется если: (a) белок-репрессор связан индуктором (b) белок-репрессор соединен с оператором (c) белок-репрессор активирован корепрессором Вопрос №16 Преимуществами генно-инженерного инсулина являются (a) большая стабильность (b) меньшая аллергенность (c) высокая активность (d) меньшая токсичность 61 Вопрос №17 Преимущество РИА инсулина перед определением инсулина по падению концентрации глюкозы в крови животных: (a) ненужность дефицитных реагентов (b) продолжительность времени анализа (c) в отсутствии влияния на результаты анализа других белков (d) легкость освоения Вопрос №18 Ослабление ограничений на использование в промышленности микроорганизмов-рекомбинантов, продуцирующих гормоны человека, стало возможным благодаря: (a) совершенствованию методов изоляции генно-инженерных рекомбинантов от окружающей среды (b) повышению квалификации персонала, работающего с рекомбинантами (c) экспериментальному подтверждению обязательной потери чужеродных генов (d) установленной экспериментально слабой жизнеспособности рекомбинанта Вопрос №19 Прямой перенос чужеродной ДНК в протопласты возможен с помощью: (a) микроинъекции (b) трансформации (c) упаковки в липосомы (d) культивирования протопластов на соответствующих питательных средах Вопрос №20 Субстратами рестриктаз, используемых генным инженером, являются: (a) нуклеиновые кислоты (b) полисахариды (c) липиды (d) белки Вопрос №21 «Ген-маркер» необходим в генетической инженерии: (a) для отбора колоний, образуемых клетками, в которые проник вектор (b) для включения "рабочего гена" в вектор (c) для включения вектора в клетки хозяина (d) для повышения стабильности вектора 62 Вопрос №22 Понятие «липкие концы» применительно к генетической инженерии отражает: (a) взаимодействие нуклеиновых кислот и гистонов (b) комплементарность нуклеотидных последовательностей (c) реагирование друг с другом SH-групп с образованием дисульфидных связей (d) гидрофобное взаимодействие липидов Вопрос №23 Успехи генетической инженерии в области создания рекомбинантных белков больше, чем в создании рекомбинантных антибиотиков Это объясняется: (a) трудностью подбора клеток хозяев для биосинтеза антибиотиков (b) проблемами безопасности производственного процесса (c) более простой структурой белков (d) большим количеством структурных генов, включенных в биосинтез антибиотиков Вопрос №24 Ферменты лигазы используется в генетической инженерии поскольку: (a) катализируют включение вектора в хромосому клеток реципиентов (b) катализируют ковалентное связывание углеводно-фосфорной цепи ДНК гена с ДНК вектора (c) скрепляют вектор с оболочкой клетки реципиента (d) катализируют замыкание пептидных мостиков в пептидогликане клеточной стенки Вопрос №25 Вектор на основе плазмиды предпочтительней вектора на основе фаговой ДНК благодаря: (a) отсутствия лизиса клетки хозяина (b) меньшей токсичности (c) лизису клетки хозяина (d) большей частоты включения Вопрос №26 Для получения протопластов из бактериальных клеток используется: (a) папаин (b) трипсин (c) «улиточный фермент» (d) лизоцим 63 Вопрос №27 Для протопластирования наиболее подходят суспензионные культуры в: (a) стационарной фазе (b) фазе замедленного роста (c) логарифмической фазе (d) лаг-фазе Вопрос №28 Гибридизация протопластов возможна, если клетки исходных растений обладают: (a) видоспецифичностью (b) совместимость не имеет существенного значения (c) половой несовместимостью (d) половой совместимостью Вопрос №29 Прямой перенос чужеродной ДНК в протопласты возможен с помощью: (a) гибридом (b) трансформации (c) культивирования протопластов на соответствующих питательных средах (d) упаковки в липосомы Вопрос №30 Изолированный протопласт растительной клетки не содержит: (a) ядра (b) аппарата Гольджи (c) вакуолей (d) целлюлозной стенки Вопрос №31 Генетическая инженерия получила практическое применение после: (a) установления первичной структуры ДНК (b) завершения фундаментальных исследований по проекту «Геном человека» (c) открытие законов Менделя (d) открытия информационной РНК (e) формулирование молекулярной концепции гена Вопрос №32 Транскрипция – это: (a) введение последовательности оснований ДНК в компьютер для анализа (b) процесс копирования генетической информации с ДНК на РНК 64 (c) обмен генетической информацией между двумя хромосомами в паре хромосом (d) синоним бинарного деления Вопрос №33 Рестриктазы используются в технологии рекомбинантных ДНК, поскольку: (a) специфически расщепляют одноцепочечные участки нуклеиновых кислот (b) специфически расщепляют двухцепочечную ДНК по сайтам узнавания (c) катализируют синтез нуклеотидной цепи из отдельных нуклеотидов (d) катализируют ковалентное связывание углеводно-фосфорной цепи ДНК-гена и ДНК-вектора (e) катализируют синтез комплементарной ДНК на матрице РНК Вопрос №34 Природная роль лигаз: (a) интеграция генома ретровируса в виде ДНК в хромосомы клетки хозяина (b) защита бактериальных клеток от инфицирования фагами (c) воссоединение молекул ДНК бактерий после расщепления (d) ограничение скрещивания между различными бактериальными видами и штаммами (e) соединение молекул ДНК бактерий и бактериофага Вопрос №35 Последовательность нуклеотидов ДНК используется как исходный код для производства полимеров: (a) клеток (b) аминокислот (c) солей (d) сахаров Вопрос №36 Плазмиды – это: (a) небольшие молекулы ДНК вне бактериальной хромосомы, которые могут самостоятельно реплицироваться (b) слабые вирусы, которые могут войти в клетку, но не могут ее убить (c) белки, из которых строится бактериальная мембрана (d) вирулентные вирусы, быстро убивающие бактериальную клетку 65 Вопрос №37 Гибридомы – это: (a) генетически однородное потомство одной клетки (b) клетки, лишенные клеточной оболочки (c) клеточные линии, полученные от слияния нормальных лимфоцитов и миеломных клеток (d) клоновая культура, наследственная однородность которой поддерживается =отбором по специфическим признакам Вопрос №38 Моноклональные антитела получают в производстве: (a) фракционированием лимфоцитов (b) по гибридомной технологии (c) фракционированием антител организма (d) химико-ферментативным синтезом (e) очисткой антител методом аффинной хроматографии Вопрос №39 Трансгенный организм – это: (a) организм с неполовой репликацией (b) организм с необычным набором транспозонов в геноме (c) организм, созданный методами генетической инженерии и способный передавать новые гены своему потомству (d) организм, в популяции которого много генетических вариантов Вопрос №40 Функцией мРНК является: (a) обеспечивает правильный фолдинг белков (b) участвует в процессе обратной транскрипции в присутствии обратной транскриптазы (c) «редактирует» белки, обеспечивая правильную последовательность аминокислот (d) участвует в образовании тРНК, которая принимает участие в образовании белка 66 2. Задания для промежуточной аттестации 1. История возникновения, становления и развития биотехнологии как самостоятельной науки. 2. Объект и методы биотехнологии. Специфика использования биологического объекта. 3. Задачи современной биотехнологии, тенденции и перспективы ее развития. 4. Предмет и задачи генетической инженерии. История возникновения и развития методов работы с рекомбинантными ДНК. 5. Ферменты, используемые при создании рекомбинантных ДНК. Способы конструирования рекомбинантных ДНК. 6. Способы получения гена. 7. Прямые методы переноса чужеродной генетической информации в клетки про- и эукариот. 8. Векторные молекулы ДНК. Требования, предъявляемые к векторам для клонирования. Плазмидные векторы. 9. Векторы на основе бактериофагов. Гибридные векторы (космиды и фазмиды). 10. Идентификация клеток-реципиентов, несущих ген-мишень. Методы, основанные на идентификации признака, кодируемого геном. 11. Ферментные препараты медицинского назначения. 12. По лучение инсулина генно-инженерными методами. 13. Получение гормона роста (соматотропина) человека путем комбинации методов химического синтеза ДНК и ферментативного синтеза кДНК. 14. Характеристика интерферонов, их применение и получение генноинженерными методами. 15. Характеристика интерлейкинов, их применение и получение генноинженерными методами. 16. Биологические датчики. 17. Подходы к конструированию генно-инженерных вакцин. Вакцины первого, второго и третьего поколений. 18. Создание безопасных вакцин против вируса гепатита В. 19. Создание безопасных вакцин против вируса ящура. 20. Создание безопасных вакцин против вирусов полиомиелита, гриппа. 21. Подходы к конструированию вакцины против вируса иммунодефицита человека. 22. Задачи и проблемы генетической инженерии растений. Магистральные пути развития генетической инженерии растений. 23. Создание векторов для введения чужеродных генов в протопласты растений. Векторы на основе плазмид бактерий, заражающих растения в естественных условиях. 24. Создание векторов на основе ДНК-содержащих вирусов растений. Конструирование челночных векторов из прокариотическихплазмид и фрагментов хлоропластных или митохондриальных ДНК растений. 67 25. Биологическая фиксация азота. Генно-инженерные работы в области биологической фиксации азота. 26. Пути повышения эффективности фотосинтетических систем генноинженерными методами. 27. Выведение растений с увеличенным содержанием незаменимых аминокислот генно-инженерными методами. 28. Выведение растений устойчивых к неблагоприятным внешним факторам (рН почвы, ранние заморозки, засолению и т.д.) генно-инженерными методами. 29. Выведение растений устойчивых к гербицидам (глифосату) генноинженерными методами. 30. Генная инженерия человека. Основные направления и перспективы использования для терапии генетических заболеваний, для получения органов для трансплантации, для конструирования человека denovo. 31. Соматическая генная терапия как способ лечения, включающий генетические изменения клеток-мишеней. Векторные системы доставки и экспрессии терапевтических генов. 32. Трансгенные сельскохозяйственные животные. Принципиальные возможности генетической инженерии в животноводстве. Методы получения трансгенных животных. 33. Векторы, используемые в генетической инженерии животных (на основе литических вирусов, ретровирусов). 34.Генно-инженерные работы с геном гормона роста животных. Получение животных с ускоренным ростом и увеличенной массой. 35. Главные направления генно-инженерных работ со структурными белками молока. Получение фармакологических белков в молоке трансгенных животных. 36. Создание новых белков методами химической модификации белковой молекулы, сайт - направленного мутагенеза, молекулярной эволюции и переноса отдельных доменов. 37. Применение белковой инженерии. 38. Основная терминология и история развития клеточной инженерии растений и животных. 39. Виды культур клеток и питательные среды, используемые для культивирования. 40. Получение клеточных культур. 41. Методы культивирования клеток и тканей растений и животных. 42. Клонирование животных и растений. 43. Получение биологически-активных веществ из культивируемых клеток и тканей. 44. Использование клеточных культур для оздоровления и сохранения редких генофондов. 45. Получение моноклональных антител. 46. Практическое применение моноклональных антител. 68 47. Кинетика роста микроорганизмов в периодических и проточных процессах. 48. Классификация ферментационных процессов. 49. Количественные параметры ферментационных процессов. 50. Значение углекислого газа в ферментационных процессах. 51. Классификация биореакторов по функциям и типу. 52. Принципы масштабирования в биотехнологическом производстве. 53. Сырье и среды для биотехнологических производств. 54. Выделение продукта в биотехнологических производствах. 55. Общая характеристика спиртового брожения. Физиолого-биохимические основы брожения. 56. Общая морфофизиологическая характеристика дрожжей, используемых в промышленности. 57. Получение этилового спирта. 58. Общая характеристика пропионовокислого брожения. 59. Применение пропионовокислых бактерий. 60. Ацетонобутиловое брожение: биохимизм процесса брожения. 61.Среды и культуры бактерий, используемых в производстве ацетона и бутанола. 62.Общая характеристика полисахаридов микроорганизмов. 63. Биосинтез полисахаридов. 64. Получение полисахаридов в промышленности. 65. Практическое применение полисахаридов. 69 СПИСОК ЛИТЕРАТУРЫ Основная литература: 1. Биотехнология. Учебное пособие: В 8-и кн. /Под. Ред. Егорова Н.С., Самуилова В.Д.-М.: Высш. шк.-1987. 2. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение.-М.: Мир.-2002. 3. Егорова Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии.-М.: Академия.-2003. 4. Орехов С.Н. Фармацевтическая биотехнология. Руководство к практ. занятиям: учеб.пособие.- М.: ГЭОТАР-Медиа.- 2012. Дополнительная литература: 1. Прищеп Т.П., Чучалин В.С., Зайков К.Л и др. Основы фармацевтической биотехнологии: Учебное пособие.- Ростов н/Д.: Феникс; Томск: Изд. НТЛ, 2006. 2. Сазыкин Ю.О., Орехов С.Н., Чакалева И.И. Биотехнология.- М.: изд. центр «Академия», 2006. 3. Егоров Н.С. Основы учения об антибиотиках. Учебник.-М.: Изд-во МГУ, Наука.-2004. 70 Ответы на тесты для рубежного контроля [1] a [11] d [21] a [31] e [2] c [12] e [22] b [32] b [3] a [13] c [23] d [33] b [4] d [14] a [24] b [34] c [5] c [15] a [25] a [35] b [6] c [16] b [26] d [36] a [7] c [17] c [27] c [37] c [8] d [18] c [28] b [38] b [9] a [19] c [29] d [39] c [10] c [20] a [30] d [40] b 71 УЧЕБНОЕ ИЗДАНИЕ Д.В. Компанцев, Л.Н. Савченко, Т.Ф. Маринина, Т.Ю. Манджиголадзе, А.А. Чахирова МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОСВОЕНИЮ ДИСЦИПЛИНЫ «БИОТЕХНОЛОГИЯ (В ТОМ ЧИСЛЕ БИОНАНОТЕХНОЛОГИИ) » Образовательная программа «БИОТЕХНОЛОГИЯ (В ТОМ ЧИСЛЕ БИОНАНОТЕХНОЛОГИИ)» (подготовка научно-педагогических кадров) НАПРАВЛЕНИЕ ПОДГОТОВКИ 06.06.01 БИОЛОГИЧЕСКИЕ НАУКИ Технический редактор: Подписано в печать ________________ Формат 60×84/16, бумага писчая белая. Усл. печ. л. ___ Уч. изд.л. ____. Тираж _____ экз. Заказ №___________ Пятигорский медико-фармацевтический институт - филиал ГБОУ ВПО ВолгГМУ Минздрава Российской Федерации, 357532, г. Пятигорск, пр. Калинина, 11 72