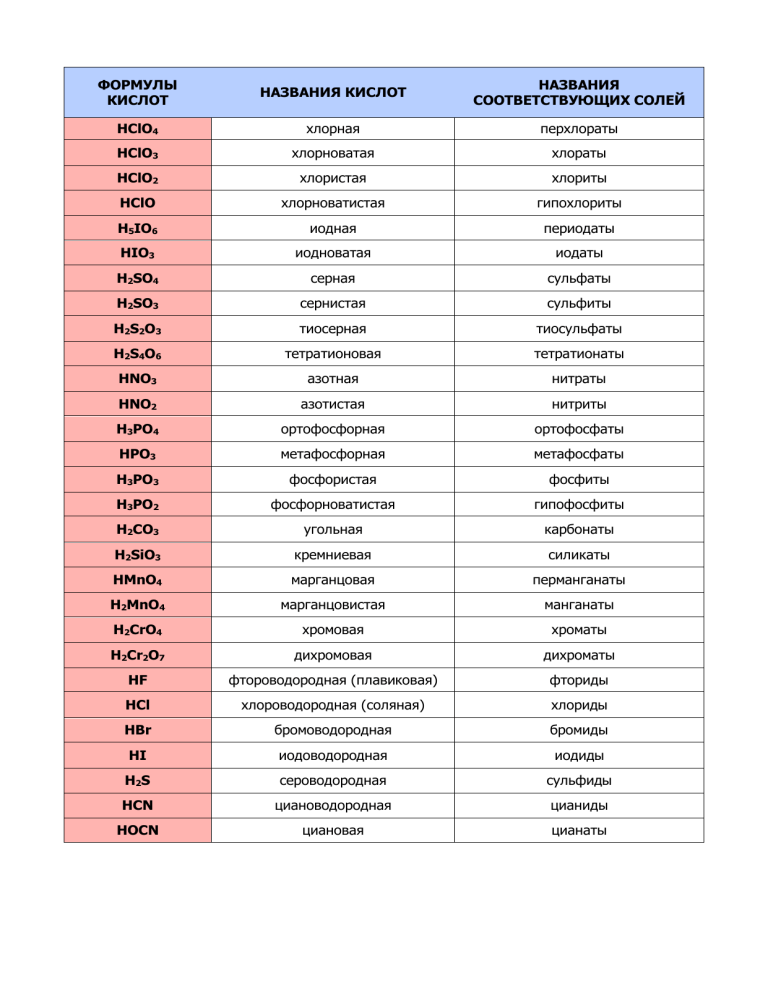
ФОРМУЛЫ КИСЛОТ НАЗВАНИЯ КИСЛОТ НАЗВАНИЯ СООТВЕТСТВУЮЩИХ СОЛЕЙ HClO4 хлорная перхлораты HClO3 хлорноватая хлораты HClO2 хлористая хлориты HClO хлорноватистая гипохлориты H5IO6 иодная периодаты HIO3 иодноватая иодаты H2SO4 серная сульфаты H2SO3 сернистая сульфиты H2S2O3 тиосерная тиосульфаты H2S4O6 тетратионовая тетратионаты HNO3 азотная нитраты HNO2 азотистая нитриты H3PO4 ортофосфорная ортофосфаты HPO3 метафосфорная метафосфаты H3PO3 фосфористая фосфиты H3PO2 фосфорноватистая гипофосфиты H2CO3 угольная карбонаты H2SiO3 кремниевая силикаты HMnO4 марганцовая перманганаты H2MnO4 марганцовистая манганаты H2CrO4 хромовая хроматы H2Cr2O7 дихромовая дихроматы HF фтороводородная (плавиковая) фториды HCl хлороводородная (соляная) хлориды HBr бромоводородная бромиды HI иодоводородная иодиды H2S сероводородная сульфиды HCN циановодородная цианиды HOCN циановая цианаты Взаимодействие металлов с кислотами окислителями MG, ЩЕЛОЧНЫЕ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ HNO3 (конц) N2O, NO, NO2 AL Пассивация при обычных условиях NO (при нагревании) HNO3 (разб.) H2SO4 (конц.) H2SO4 (разб.) N2, NH3, NH4NO3 H2S, S H2 FE, CR, NI, C O Пассивация при обычных условиях МЕТАЛЛЫ ДО ВОДОРОДА МЕТАЛЛЫ ПОСЛЕ ВОДОРОДА (CU И ДР) NO2 NO2 В зависимости от разбавления могут образовыват ься NO, N2, N2O, NH3, NH4NO3 NO S, H2S, SO2 SO2 H2 Нет реакции NO2 (при нагревании) N2O, NH4NO3 Основной NO, но в зависимости от разбавления могут образовываться N2, N2O, NH3, NH4NO3. Чем больше разбавлена кислота, тем ниже степень окисления азота Пассивация при обычных условиях Пассивация при обычных условиях При нагревании H2S При нагревании SO2 H2 H2









