Тема: Физические и химические свойства кислот
реклама

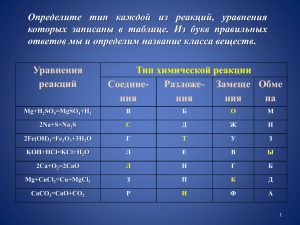
CO2 HCl H3PO4 CaCl2 Na2S HJ NO2 HNO3 NaCl MgO H2O H2SO4 H2Co3 NaOH P2O5 H2SiO2 Cu(OH)2 H2PO2 Выигрышный путь - кислоты HCl H2CO3 H3PO4 HJ H2 S • • • • • H2SO4 HBr HNO3 H3PO4 HCl • • • • • H2SO3 H3PO4 HF H2CO3 H 2S Физические свойства Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С «Дымит», так НNO3 (конц., дымящая) как пары ее образуют с влагой ω = 1, желтая НNO3 (разб., недымящая) ω = 0,6 бесцветная свет HNO3 ----------> воздуха мелкие капельки тумана 4NO2 ↑+ O2 ↑ + 2H2O Правила обращения с концентрированной азотной кислотой Работать в резиновых перчатках! Берегись ожога! При попадании кислоты на кожу место поражения быстро промыть большим количеством воды! 8 ! Правило разбавления кислот Н.Н.Бекетове Расшифруйте запись Б + D = MgSO4 + A 1 И 2 Н 3 Д 4 И 5 К 6 А 7 Т 8 9 О Р 1.УЧЕНЫЙ, ОТКРЫВШИЙ ВОДОРОД 2. ТИП РЕАКЦИИ ВЗАИМОДЕЙТВИЯ КИСЛОТ С МЕТАЛЛАМИ 3. ЛЕГКИЙ ГАЗ 4. ВЕЩЕСТВО ПОД ДЕЙСТВИЕМ, КОТОРОГО МЕТИЛОРАНЖ МЕНЯЕТ ЦВЕТ НА КРАСНЫЙ 5. СЛОЖНОЕ ВЕЩЕСТВО, СОСТОЯЩЕЕ ИЗ ДВУХ ЭЛЕМЕНТОВ, ОДИН ИЗ КОТОРЫХ – ОКСИГЕН. 6. СИЛЬНАЯ КИСЛОТА 7. КИСЛОТА, КОТОРАЯ ВХОДИТ В СОСТАВ « ЦАРСКОЙ ВОДКИ» 8. ВЕЩЕСТВО, КОТОРОЕ МОЖЕТ НАХОДИТЬСЯ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ 9. СОЕДИНЕНИЕ С ГИДРОГЕНОМ, ИМЕЮЩЕЕ НЕПРИЯТНЫЙ ЗАПАХ К А В Е З А М Е Н Д И ш Щ Е Н И Е В О Д О Р О Д К И С Л О Т О К С И Д Ы Я С У Л Ь Ф А Т Н А Н И Т Р А Т Н А Я О Д А Р О В В С Е О Д А О Р О Д