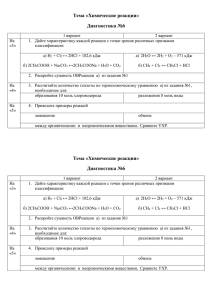
"Задачи на избыток" (учитель Гайдук Я.С. 20.12.2015)
реклама

Решение задач на избыток-недостаток 1. Вычисляем число молей реагирующих веществ: Y=m/M Y=V/Vm Y=mр-ра·w/M Y=N/Na Y=Vр-ра·p·w/M 2.Составляем уравнение химической реакции. 3.Устанавливаем мольное соотношение реагирующих веществ по условию задачи и сравниваем с мольным соотношением по уравнению (коэффициенты): Y 1(по условию) /Y 1(по уравн.) >,< Y 2(по условию) /Y 2(по уравн.) То число молей, которое больше, указывает,что данное вещество находится в избытке. Вычисления продукта реакции проводим по веществу, которое взято в недостатке. Пример: вычислить массу хлорида цинка, образовавшегося при взаимодействии 8,1 оксида цинка с раствором, содержащим 3,65г соляной кислоты. Дано: m (ZnO) = 8,1г m (HCl) = 3,65г ______________ m Zn Cl2 ? 1) Y( ZnO)=m/M Y= 8,1/81=0,1моль Y(HCl)= m/M Y= 3,65/36,5 = 0,1 моль 0,1 моль 0,1 моль Xмоль 2HCl + ZnO=ZnCl2 + H2O 2моль 1моль 1моль 2) 0,1/2<0,1/1 , следов. HCI в недост ., «Х» находим по HCI. 3) 0,1/2 = x/1, x= 0,05 моль Zn Cl2 или Y (HCI) =1/2 Y (Zn Cl2) = 0,05 моль 4) m( Zn Cl2) = YM m=0,05моль · 136г/моль = 6,8г Отв. m(Zn Cl2)=6,8 г Найти массу иодида серебра, образовавшегося при взаимодействии 45г раствора с массовой долей иодоводородной кислоты 40% с раствором, содержащим 34г нитрата серебра. Спасибо за внимание!