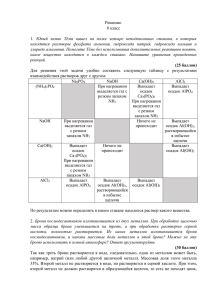
Fe 2+
реклама

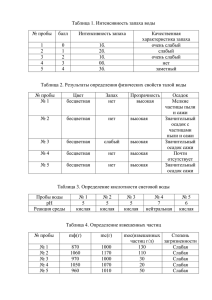
Тема урока: Качественные реакции в неорганической химии Учитель химии ГБОУ школа №589 Санкт-Петербурга Паерели Валентина Сергеевна 1 Цель: Обобщить знания о качественных реакциях и познакомиться с их практическим применением 2 Девиз: «Просто знать – ещё не всё, знания нужно уметь использовать» Гёте 3 Рабочий лист Дата ______ Ф. И. ученика ______________________________________ Тема урока: Качественные реакции в неорганической химии Задание Результаты работы 1. Среда нашего организма Вывод: 2. «Фейерверк» Элементы: 1. 2. «+» 3. 3. Определение катионного состава образца минерала щелочного металла Проблема: Гипотеза: Подтверждение гипотезы: Наблюдения: Вывод: 4. Определение железа в сплавах Проблема: Гипотеза: Подтверждение гипотезы: Наблюдения: Вывод: Итоговая оценка 4 Техника безопасности Нейтрализация кислот и щелочей: 1. С кожи растворы кислот и щелочей смываются сильной струёй воды 2. Кислота нейтрализуется 2%-ным раствором гидрокарбоната натрия. 3. Щелочь нейтрализуется 2%-ным раствором борной кислоты 5 В прошлое 6 7 8 9 10 11 12 Таблица: «Содержание рН некоторых органов, тканей и биожидкостей нашего организма» Органы, ткани, биожидкости Кислотно-щелочная среда рН Цвет индикатора Кожа 6,2 – 7,5 слабокислая ? Желудочный сок Печень 0,9 ? 6,4 – 7,4 кислая слабокислая Слюна 7,4 - 8,0 слабощелочная ? Плазма крови Лимфа 7,35 – 7,45 ? 7,4 нейтральная нейтральная Моча 4,8 – 7,5 кислая ? Желчь в протоках 7,4 – 8,5 слабощелочная ? ? ? ? Метилоранж Фенолфталеин 7,35 – 7,45 Лакмус Спинной мозг среда нейтральная 13 14 Классификация качественных реакций Определение ионов Кислотно-щелочные индикаторы Среда Индикатор нейтральная кислая щелочная Лакмус фиолетовая красная синяя Метилоранж оранжевая Фенолфталеин бесцветная Краснорозовая жёлтая бесцветная малиновая Окрашивание пламени ионами некоторых металлов Ионы металла Определ яемый ион Реактив, содержащий ион Ag+ Cl- Cu2+ OH- Синий осадок Fe2+ красная кровяная соль K3[Fe+3(CN)6] Синий осадок Fe3+ жёлтая кровяная соль K4[Fe+2(CN)6] NCS- Синий осадок NH4 OH- Запах аммиака Окраска пламени Результат реакции Творожистый осадок белого цвета кроваво-красный осадок Li+ Малиновый Ba2+ SO42- Молочный осадок белого цвета Na+ Жёлтый Ca2+ CO32- Белый осадок K+ Фиолетовый Zn2+ OH- Rb+ Тёмно-красный Белый осадок, при избытке OHрастворяется Cs+ Небесно-голубой Al3+ OH- Ca2+ Кирпичнокрасный Белый желеобразный осадок, при избытке OH- растворяется Cl- Ag+ Творожистый осадок белого цвета Br- Ag+ Желтоватый осадок I- Ag+ Жёлтый осадок Sr2+ Карминовокрасный Ba2+ Жёлто-зелёный Cu2+ Сине-зелёный NO3- H2SO4 (конц.) и Cu Pb2+ Бледно-голубой SO42- Ba2+ Выделение бурого газа 15 Молочный осадок белого цвета Качественная реакция на ионы железа (III) КNCS + К + NCS Тиацианат (роданид) калия 3+ Fe +3 NCS Fe(NCS)3 Красный 16 17 18 Fe + H2SO4 = FeSO4 + H2 +2 Fe SO +3 [Fe (CN) + K 4 3 Красная кровяная соль K ] 6 +3 +2 Fe [Fe (CN)6] Синий цвет 19 «Продолжи фразу» • Мне было интересно… • Мы сегодня разобрались…. • Я сегодня понял, что… • Мне было трудно… • Завтра я хочу на уроке… 20 Спасибо за внимание! 21