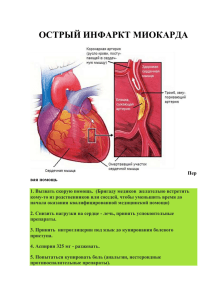
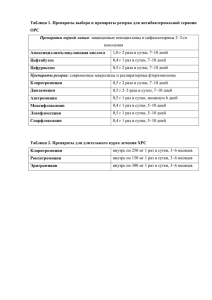
Новые требования к экспертизе материалов клинических
реклама

Количество заявок на КИ, поданных на экспертизу в 2014 году Количество заявок всего % в том числе отечественных производителей % I фаза КИ II фаза КИ III фаза КИ IV фаза КИ * Неинтервенционные КИ Исследование биоэквивалентности 5 2 14 1 6 13,2 5,3 36,8 2,6 15,8 5 2 12 - 100 100 85,7 - 10 26,3 9 90 ИТОГО 38 100 28 73,7 * Период ВСЕГО Заявки отечественных Международные производителей КИ БЭ КИН КИ БЭ КИН 2012 10 22 - 5 - 10 56 (из них 9 поправок) 2013 52 30 - 4 - 9 100 (из них 5 поправок) 2014 19 9 - 3 1 6 38 ИТОГО 81 61 - 12 1 25 194 Мониторинг побочных действий ЛС, ИМН и МТ В 2014 году в программе ПДЛС зарегистрировано 1666 картсообщений о побочных действиях лекарственных средств, изделий медицинского назначения и медицинской техники, из них: Количество карт-сообщений ПД ЛС в зависимости от страны-производителя: - 377 (23,7%) количество карт-сообщений о ПД ЛС отечественных производителей - 1096 (68,8%) количество карт-сообщений о ПД ЛС дальнего зарубежья (733 – Индийские производители и др. стран) - 120 (7,5%) количество карт-сообщений о ПД ЛС стран СНГ Отправлено карт-сообщений в центр ВОЗ по Международной программе мониторинга ПД ЛС- 16 Количество карт-сообщений по регионам Алматы Павлодар Тараз Астана Костанай Кызылорда Петропавловск Актобе Шымкент Кокшетау Уральск Караганда Усть-каменогорск 855 335 130 100 103 41 36 24 16 11 10 4 1 53,67% 21,02% 8,16% 6,08% 6,46% 2,49% 2,19% 1,50% 1,00% 0,66% 0,60% 0,25% 0,06% Количество карт-сообщений по анатомо-терапевтическохимической классификации (АТХ) По АТХ коду (фармакотерапевтической группе) побочные реакции выявлены на нижеперечисленные препараты: - на противомикробные препараты – 1293 (81,16%), в том числе противотуберкулезные препараты - 1068 (82,5%) и аминогликозидные антибактериальные препараты, применяемые для лечения туберкулеза - 83 (6,4%) - на препараты, влияющие на кроветворение и кровь – 35 (2,19%) - на противоопухолевые и иммуномодуляторы – 72 (4,51%) * Причины смерти в 40% случаев СПР связаны с основными заболеваниями пациентов: - миелодиспластический синдром - острый лейкоз - ревматоидный артрит - хронический вирусный гепатит С, осложненный циррозом печени В 50% случаев причинами смерти, возможно, являются подозреваемые лекарственные средства: - листенон (суксаметония хлорид) - новофер-Д (железа оксид декстран комплекс) - диклофенак (диклофенак) - бенлиста (белимумаб) - аркоксиа (эторикоксиб) Только в 10% случае невозможно оценить связь между СПР со смертельным исходом и применением препарата Бенлиста из-за не предоставления полной информации о данной побочной реакции представительством компании в РК * * Количество поступивших карт-сообщений об отсутствии эффективности ЛС, в том числе отечественных производителей – 39, на 13 препаратов проведен контроль качества, из них: 10 препаратов - соответствуют требованиям нормативного документа (НД) 3 препарата - не соответствуют НД * на 26 - не представлены серийные номера препаратов, в связи с отказом врачей, пациентов и ответственных лиц за фармаконадзор дать информацию для дальнейшего проведения оценки причинно-следственной связи * Запрещены (5) Приостановлено медицинские применения препаратов (7) Отозвано регистрационное удостоверение (1) Возобновление медицинского применения лекарственных средств (6) * * Разработка нормативно-правовых актов, регламентирующих проведение клинических исследований и мониторинга побочных действий (проекты приказов 744, 745, 647) - ответственность производителей/заявителей/спонсоров в вопросах обеспечения качества исследуемых образцов и организации/проведении КИ - понимание важности проведения мониторинга и аудита клинических исследований - ответственность исследователей при проведении КИ с участием несовершеннолетних, недееспособных лиц * Обновление Перечня доклинических и клинических баз, имеющих право проведения доклинических и клинических исследований * Обучение специалистов принципам надлежащей клинической практики в соответствие с требованиями ICH GCP и фармаконадзора * Отрегулировать работу локальных этических комиссий (возможно разработать Положение об этических комиссиях) * Обратить внимание страховых компаний на вопрос страхования здоровья и жизни субъектов исследования при проведении клинических исследований * Повышение участия медицинских работников в мониторинге побочных действий ЛС (не выполняется требование приказа МЗ РК №647 – предоставление годового статотчета медицинскими организации по ПД ЛС, ИМН и МТ) * Внедрение активного мониторинга ПД ЛС, ИМН и МТ (когортные исследования, пострегистрационные исследования безопасности ЛС) в сотрудничестве с медицинскими организациями * Понимание важности постмаркетингового мониторинга ПД ЛС (владельцы регистрационных удостоверений не сообщают о запретах, ограничениях в применении в других странах) * Проведение работы с населением по вопросам безопасности лекарственных средств * Повышение участия сотрудников кафедр клинической фармакологии медицинских ВУЗов республики в мониторинге ПД ЛС * Утверждение и регулярное обновление списка запрещенных лекарственных средств в РК по результатам мониторинга безопасности ЛС в РК и других странах