Документ 4940481
реклама

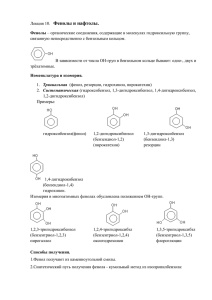
Фено́л (оксибензол, устар. карболовая кислота) C6H5OH — бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине. Мировое производство фенола на 2009 год составляет 8,3 млн тонн/год. По объёму производств фенол занимает 33е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ. Систематическое наименование Гидроксибензол, Карболовая кислота Традиционные названия Фенол Химическая формула C6H5OH Эмпирическая формула C6H6O Молярная масса 94,11 г/моль Большинство фенолов — бесцветные твердые вещества. Сам фенол плавится при t°=41°C. Фенол — антисептик, его водный раствор используется для дезинфекции и называется карболовой кислотой. Фенол не самый подходящий антисептик, так как вызывает ожоги кожи, а пары его токсичны. Многочисленными исследованиями было установлено, что некоторые замещенные фенолы являются более удобными антисептиками, чем сам фенол. Одно из наиболее употреби-тельных соединений — 2,4,6трихлорфенол. Фенол — один из важнейших продуктов нефтехимии. Реакции фенола можно разделить на реакции гидроксильной группы и реакции замещения в ароматическом кольце. 1. Диссоциация: С6Н5+Н2О = С6Н5O-+Н3O+ Фенол — слабая кислота (рК =10,0), более слабая, чем угольная, но более сильная, чем спирты (рК= 16,0). 2.Замещение гидроксильной группы на водород: С6Н5ОН+Zn=С6Н6+ZnO Влияние заместителей на кислотность фенола 4.Феноксид-анион стабилизирован делокализацией заряда по ароматическому кольцу При наличии в кольце электроноакцепторных групп электроны еще сильнее оттягиваются от атома кислорода, что приводит к дополнительной стабилизации аниона. Поэтому 4-хлор-фенол — более сильная кислота, чем фенол, а 2,4,6-тринитрофенол — очень сильная кислота cpK =0,42. Наоборот, электронодонорные заместители, такие, как -СН3, уменьшают кислотность фенолов Взаимодействие между электронами орбитали отрицательно заряженного атома кислорода и ароматического кольца в фенолят-анионе 5. Образование простых эфиров Реакция феноксид-аниона с галогеналканами известна под названием синтеза Вильямсона: 1. Фенол реагирует с электрофилами легче,чем бензол. Причина — взаимодействие неподеленной электронной пары атома кислорода и электронов ароматического кольца, в результате которого повышается электронная плотность. Заместители в бензольном кольце При введении в бензольное кольцо какого-либо заместителя вместо одного из атомов водорода реакционная способность получившегося соединения отличается от реакционной способности бензола. Если речь идет о взаимодействии с электрофильными частицами, такими, как катион нитрония NO+2, то заместители, подающие электроны в кольцо, ускоряют, а заместители, оттяги-вающие электроны, замедляют реакцию. Заместители, обладающие +I-эффектом, например группа СН3, подают электроны в кольцо. Такие заместители называются атакующими. Заместители, обладающие -I-эффектом, как группа —NO2, оттягивают электроны и дезактивируют кольцо, они называются дезактивирующими. 2. Галогенирование При действии на фенол бромной воды образуется осадок 2,4,6трибромфенола: 4. Окисление Фенолы легко окисляются даже под действием кислорода воздуха. При окислении сильными окислителями образуется хинон: 6. Сульфирование Концентрированная серная кислота сульфирует фенол при комнатной температуре. Получение фенола 1) Значительное количество фенола синтезируют из бензола и пропена (полученных крекингом нефти) через кумол (изопропилбензол), как показано ниже: 2) Сплавление бензолсульфоната натрия с гидроксидом натрия, а затем полученный феноксид натрия растворяют в подкисленной воде: Этот метод применяется только в промышленности. 4) В лаборатории фенолы получают из солей диазония: Температура плавления 40,8 °C Температура кипения 181,84 °C Температура вспышки 79 (в закрытом тигле); 85 (в открытом) °C Молярная теплоёмкость (ст. усл.) 2,35 Дж/(моль·К) Энтальпия образования (ст. усл.) -162,944 кДж/моль Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу (ПДК 5мг/м³, в водоёмах 0,001 мг/л). Попадая в организм, фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. При остром отравлении, сопровождающем попадание фенола на кожу или вдыхание его паров, наблюдается сильное жжение в местах, подвергшихся его непосредственному воздействию. Проявляются ожоги слизистых тканей; возникает сильная боль в области рта, в глотке, животе; тошнота, рвота, понос; резкая бледность, слабость, отек легких; возможны острые аллергические проявления; артериальное давление понижено; развивается сердечно-легочная недостаточность, возможны судороги; моча бурая, быстро темнеет на воздухе. Первая помощь – снять одежду (желательно сразу под душем), промыть пораженное место большим количеством воды. Прикрыть места ожогов фенолом чистой белой тканью. Если брызги фенола попали в глаза, необходимо обильно промывать их водой не менее 15 минут. Промыть желудок водой, внутрь дать активированный уголь. Спирт и вазелиновое масло противопоказаны. По данным на 2009 год мировое потребление фенола имеет следующую структуру: 44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол; 30 % фенола расходуется на производство фенолформальдегидных смол; 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона; остальные 14 % расходуются на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство. Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Список продуктов с высоким содержанием фенолов. Краткий список высокофенольных продуктов (из книги Карен Серусси), которые необходимо исключить, или хотя бы ограничить для предупреждения перегрузки, включает: пищевые красители, помидоры, яблоки, арахис, бананы, апельсины, какао, красный виноград, ярко окрашенные (красные)фрукты, и молоко. А это список Фейнгольда. Избегать всего – пищи, туалетные принадлежности, моющие средства, художественные принадлежности (краски), которые включают любой из следующих ингредиентов: синтетические/искусственные красители и вкусовые добавки, консерванты (BHA, BHT, TBHQ, производные от нефти), натуральные вкусовые добавки (могут содержать салицилаты), натуральные красители (могут содержать салицилаты), аспирин и продукты, содержащие аспирин или салициловую к-ту, салицилаты, , миндаль яблоки (в т.ч.. сидр и яблочный уксус), абрикосы, ягоды, черешня, чили перец, гвоздика, кофе, огурцы (в т.ч. маринованные), виноград (в т.ч. вино и виноградный уксус), нектарины, апельсины, паприка, персики, перцы, сливы (в т.ч. чернослив), мандарины, чай, помидоры. Другие источники, с которыми следует проявлять осторожность, это духи и одеколоны, нитриты и нитраты, глютамат натрия (MSG), сульфиты, бензоаты.