СТРОЕНИЕ АТОМА
реклама

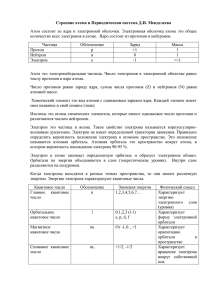
СТРОЕНИЕ АТОМА М ОДЕЛЬ Р ЕЗЕРФОРДА . Суть планетарной модели строения атома (Э.Резерфорд, 1911 г.) можно свести к следующим утверждениям: В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.). Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра. М ОДЕЛЬ Б ОРА В 1913 г. датский физик Н.Бор предложил свою теорию строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца. Однако к этому времени Дж.Франк и Г.Герц (1912 г.) доказали дискретность энергии электрона в атоме и это позволило Бору положить в основу новой теории два необычных предположения (постулата): 1 П ОСТУЛАТ Б ОРА Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам. Радиус орбиты r и скорость электрона v связаны квантовым соотношением Бора: mrv = nћ где m — масса электрона, n — номер орбиты, ћ — постоянная Планка (ћ = 1,05∙10-34 Дж∙с). 2 П ОСТУЛАТ Б ОРА При движении по стационарным орбитам электрон не излучает и не поглощает энергии. Таким образом, Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния, например с энергией Е1, в другое — с энергией Е2, что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия ∆E, величина которой определяется соотношением ∆E = E1 – E2 = hv, где v — частота излучения, h = 2p ћ = 6,62∙10-34 Дж∙с. К ВАНТОВАЯ МОДЕЛЬ СТРОЕНИЯ АТОМА . В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом. В ОСНОВЕ СОВРЕМЕННОЙ ТЕОРИИ СТРОЕНИЯ АТОМА ЛЕЖАТ СЛЕДУЮЩИЕ ОСНОВНЫЕ ПОЛОЖЕНИЯ : 1 Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля: λ=h/mv, где m — масса электрона. Э КСПЕРИМЕНТАЛЬНОЕ ПОДТВЕРЖДЕНИЕ ГИПОТЕЗЫ ДЕ Б РОЙЛЯ . 1927 г. - американские физики К. Девиссон и Л. Джермер: пучок электронов, рассеивающийся на кристалле никеля, дает отчетливую дифракционную картину, подобную той, которая возникает при рассеянии на кристалле коротковолнового рентгеновского излучения. В этих экспериментах кристалл играл роль естественной дифракционной решетки. 1928 г. английский физик Дж. П. Томсон: наблюдение дифракционной картины, возникающей при прохождении пучка электронов через тонкую поликристаллическую фольгу из золота. Д ИФРАКЦИЯ ЭЛЕКТРОНОВ Картина дифракции электронов на поликристаллическом образце при длительной экспозиции (a) и при короткой экспозиции (b). В случае (b) видны точки попадания отдельных электронов на фотопластинку. Э ЛЕКТРОННВЫЕ ВЛНЫ – ВОЛНЫ ВЕРОЯТНОСТИ Волновая функция ψ(x,y,z,t) ψ² - вероятность нахождения частицы в данной точке в данный Макс Борн момент времени В ОЛНЫ ВЕРОЯТНОСТИ Подлетая к экрану со щелями, частицы взаимодействуют с ним как волны де Бройля. Поведение частиц в пространстве между экраном со щелями и фотопластинкой описывается в квантовой физике с помощью Ψ(x,y,z,t)-функций. Квадрат модуля пси-функции определяет вероятность обнаружения частицы в том или ином месте. Таким образом, попадание частиц в различные точки фотопластинки есть вероятностный процесс. Волны вероятности – электрнные волны. В ОЛНОВЫЕ СВОЙСТВА МАКРОСКОПИЧЕСКИХ ТЕЛ . Впоследствии дифракционные явления были обнаружены также для нейтронов, протонов, атомных и молекулярных пучков. Экспериментальное доказательство наличия волновых свойств микрочастиц привело к выводу о том, что это универсальное явление природы, общее свойство материи. Следовательно, волновые свойства должны быть присущи и макроскопическим телам. Однако вследствие большой массы макроскопических тел их волновые свойства не могут быть обнаружены экспериментально. Например, пылинке массой 10–9 г, движущийся со скоростью 0,5 м/с соответствует волна де Бройля с длиной волны порядка 10-21 м, т. е. приблизительно на 11 порядков меньше размеров атомов. Такая длина волны лежит за пределами доступной наблюдению области. К ВАНТОВАЯ МЕХАНИКА Гипотеза де Бройля основывалась на соображениях симметрии свойств материи и не имела в то время опытного подтверждения. Но она явилась мощным революционным толчком к развитию новых представлений о природе материальных объектов. В течение нескольких лет целый ряд выдающихся физиков XX века – В. Гейзенберг, Э. Шредингер, П. Дирак, Н. Бор, М. Борн и другие – разработали теоретические основы новой науки, которая была названа квантовой механикой. Т ЕОРИЯ Ш РЕДИНГЕРА В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра. Общее у волновой модели Шредингера и планетарной модели Бора в том, что электроны в атоме существуют на определенных уровнях, подуровнях и орбиталях. В остальном эти модели не похожи друг на друга. В волновой модели орбиталь это пространство около ядра, в котором можно обнаружить заселивший ее электрон с вероятностью 95%. За пределами этого пространства вероятность встретить такой электрон меньше 5%. Полученные с помощью математического расчета такие "области вероятности" нахождения в электронном облаке s- и p-электронов показаны на рис П РИНЦИП НЕОПРЕДЕЛЕННОСТИ Г ЕЙЗЕНБЕРГА Почему вообще пришлось вводить такое понятие, как вероятность нахождения электрона в той или иной точке пространства около ядра? Немецкий физик Гейзенберг в 1927 году сформулировал принцип неопределенности, являющийся одним из важнейших физических принципов для описания движения микрочастиц. Этот принцип вытекает из фундаментального отличия микрочастиц от обычных физических тел. В чем же это отличие? В КЛАССИЧЕСКОЙ МЕХАНИКЕ предполагается, что человек может наблюдать явление, не нарушая его естественного хода. Например, можно наблюдать движение небесных тел в телескоп, и это никак не отразится на их движении. Астроном может произвести измерения и составить точное математическое описание движения объекта. Используя полученные формулы, можно предсказать, куда движется данный объект и где он будет находиться в любой момент времени. В МИКРОМИРЕ ДЕЛО ОБСТОИТ ИНАЧЕ . Например, исследуя движение электрона с помощью микроскопа (если бы такое было возможно), мы бы наблюдали отраженные от электрона волны света, энергия которых по величине сопоставима с энергией самих исследуемых частиц. Поэтому при выполнении измерений нами неизбежно вносились бы изменения в состояние электрона (местоположение, скорость, направление движения и т.д.). Значит, на основании наших измерений бессмысленно говорить о точном местоположении электрона в каждый момент времени. П РИНЦИП НЕОПРЕДЕЛЕННОСТИ Принцип неопределенности говорит о том, что не следует пытаться вычислить точную траекторию электрона вокруг ядра. Можно лишь указать вероятность нахождения электрона в том или ином участке пространства около ядра в любой момент времени. Эта вероятность поддается вычислению с помощью математических методов. ΔEΔt > h ΔpΔx > h Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение ∆x∙m∙∆v>h, где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости. П ОТНЦИАЛЬНЫЙ БАРЬЕР Прямоугольный потенциальный барьер и туннельный эффект: 1 – поток частиц, падающих на барьер, 2 – поток отражённых частиц, 3 – поток прошедших частиц. Э ЛЕКТРОН В КОРОБКЕ Возникают стоячие волны z λ= 2L/ n λ= h/mv y х E=mv²/2 E=(h²/8mL²)n² Э ЛЕКТРОННЫЕ ВОЛНЫ В АТОМЕ R= 1,0974*107 м-1 Т ЕОРИЯ БОРА n К ВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНОВ Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним. Пример: Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5). Под главным квантовым числом, равным ∞, подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома). Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей Образно говоря, если электронное облако атома сравнить с городом или улицей, где "живут" все электроны данного атома, то уровень можно сравнить с домом, подуровень - с квартирой, а орбиталь - с комнатой для электронов. Все орбитали какого-нибудь подуровня имеют одинаковую энергию. На s-подуровне всего одна "комната"-орбиталь. На p-подуровне 3 орбитали, на d-подуровне 5, а на f-подуровне - целых 7 орбиталей. В каждой "комнате"-орбитали могут "жить" один или два электрона. Запрещение электронам находиться более чем по двое на одной орбитали называют запретом Паули - по имени ученого, который выяснил эту важную особенность строения атома. Каждый электрон в атоме имеет свой "адрес", который записывается набором четырех чисел, называемых "квантовыми". l К ВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНОВ Значит, еще раз: в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l т.е. оно характеризует геометрическую форму орбитали. Это квантовое число может принимать целочисленные значения от 0 до n-1 (l = 0,1, ..., n - 1). Обычно численные значения l принято обозначать следующими буквенными символами: Значение l 01234 Буквенное обозначение spdfg К ВАНТОВЫЕ ЧИСЛА l ЭЛЕКТРОНОВ l=0 s- подуровень, s- орбиталь – орбиталь сфера l=1 p- подуровень, p- орбиталь – орбиталь гантель l=2 d- подуровень, d- орбиталь – орбиталь сложной формы f-подуровень, f-орбиталь – орбиталь еще более сложной формы S - орбиталь Три p – орбитали Пять d – орбиталей m К ВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНОВ Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве. Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве. Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1. Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2. Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне – пять и т. д. s К ВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНОВ Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения. Д ОМАШНЕЕ ЗАДАНИЕ