Элементы VIА группы:
реклама

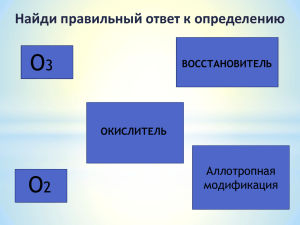
Химия. 9 класс Подгруппа кислорода Сера План урока 1. 2. 3. 4. 5. 6. 7. Сера в природе Строение атома серы Аллотропия серы Физические свойства Химические свойства Применение серы Биологическая роль серы Исторические сведения » Сера известна с глубокой древности и упоминается Гомером в «Одиссее» как лекарство от недугов. » В Древнем Египте серу использовали для приготовления красок, косметических средств. » В Древней Греции, сжигая серу, дезинфицировали помещение и вещи. » В Древнем Риме ее использовали для лечения кожных заболеваний. » В средние века сера была одним из «начал» у алхимиков, считалась необходимой составной частью «философского камня». Сера в природе ? Какие природные соединения, содержащие серу, вам известны? Сера в природе халькопирит CuFeS2 киноварь HgS пирит FeS2 галенит PbS самородная сера S гипс СаSO4.2H2O Работа в тетрадях Для серы укажите: 1. 2. 3. 4. Состав атомов Строение атомов Свойства атомов Возможные значения валентности и степени окисления Валентные состояния серы Валентность II, ст. окисления -2 3s 3p 3d ↓ ↑ Валентность IV, Ст. окисления +4 Валентность VI, Ст. окисления +6 SО2 Н 2S Н2SО4 Аллотропия серы сера кристаллическая моноклинная ромбическая пластическая Физические свойства Свойство Ромбическая сера Цвет Светло-желтый порошок Желтые иглы Темно-желтая масса Плотность, г/см3 2,07 1,96 Температура плавления, °С 112,8 119,3 - Температура кипения, °С Моноклинная сера Пластическая сера 444,6 Работа в тетрадях 5. Физические свойства серы Ф.С.: Тв., желтая, хрупкая, Н, Р в CS2, не смачивается водой, плохо проводит тепло и ток Химические свойства ? Какими окислительновосстановительными свойствами обладает сера? Химические свойства Сера – окислитель Сера – восстановитель ? При взаимодействии с какими веществами сера проявляет окислительные, а с какими – восстановительные свойства? Химические свойства Закончите уравнения реакций: Сера – окислитель Сера –восстановитель S+ S+ S+ S+ H2 = Na = Fe = Hg = S + O2 = S + F2 = Химические свойства Закончите уравнения реакций: Сера – окислитель Сера –восстановитель S + H2 = H2S S + 2 Na = Na2S S + Fe = FeS S + Hg = HgS S + O2 = SO2 S + 3 F2 = SF6 ? Почему сера в соединениях с металлами проявляет степень окисления –2, а в соединениях с кислородом и галогенами +4 и +6? Химические свойства Составьте уравнение реакции взаимодействия серы с бертолетовой солью, зная, что в результате ее образуется хлорид калия и сернистый газ. Рассмотрите эту реакцию как окислительно-восстановительную Применение серы 1. Производство серной кислоты 2. Получение резины 3. Получение гидросульфата кальция (для производства бумаги) 4. Производство пороха, пиротехники 5. Получение «сусального золота» – SnS2 6. В медицине для лечения кожных заболеваний 7. В сельском хозяйстве для борьбы с вредителями Биологическая роль серы » Сера участвует в ОВР в организмах растений и животных » Сера входит в состав белков и аминокислот » Особенно много серы в волосах, шерсти, рогах, копытах » Соединения серы обнаружены в хрящах, костях, в желчи http://school-collection.edu.ru http://ido.tsu.ru http://900igr.net http://www.terramarina.okis.ru