11. Механизмы реакций электрофильного ароматического замещения
реклама
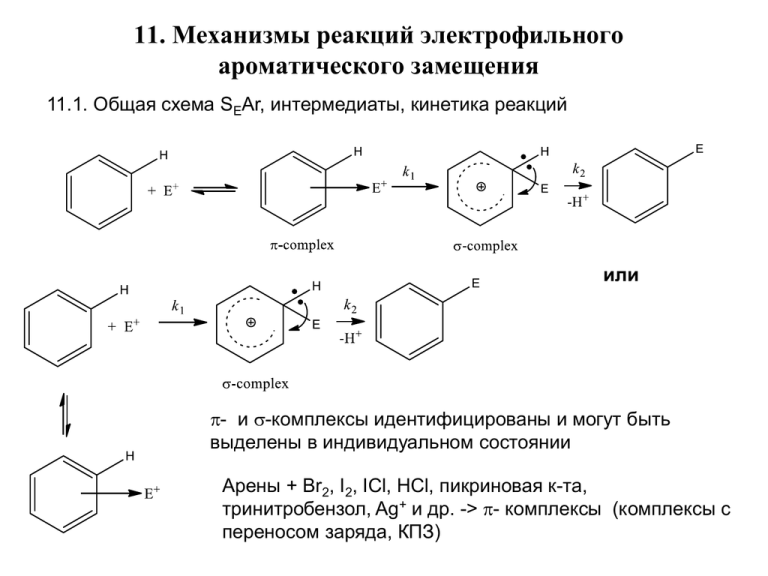
11. Механизмы реакций электрофильного ароматического замещения 11.1. Общая схема SEAr, интермедиаты, кинетика реакций или p- и s-комплексы идентифицированы и могут быть выделены в индивидуальном состоянии Арены + Br2, I2, ICl, HCl, пикриновая к-та, тринитробензол, Ag+ и др. -> p- комплексы (комплексы с переносом заряда, КПЗ) Доказательства механизма: Аренониевый ион J.Am.Chem.Soc., 1972,100,6299 Обычно КИЭ kH/kD для Ar-H и Ar-D ~ 1. Следовательно, расщепление связей C-H (C-D) не является лимитирующей стадией, т.к. k2 > k1. Наблюдаются и исключения. Например, при нитрозировании kH/kD = 8.5, ацилировании ~2, сульфировании ~3, и значения КИЭ зависят от конкретных условий (реагент, растворитель, температура). Объяснения: скорости стадий k2 и k1 сближаются, первая стадия обратима. В идеальных случаях v= [Ar-H] [E+], однако часто скорость реакции не зависит от [Ar-H], т.к. медленной стадией является образование электрофильной частицы. Например, HNO3 + 2 H2SO4 NO2+ + 2 HSO4- + H3O+. 11.2. Реакционная способность и ориентация в монозамещенных бензолах Общая схема изменения свободных энергий в ходе электрофильного замещения активированных и дезактивированных аренов Активирующие заместители активируют все положения кольца, но о- и пположения активированы сильнее, чем м-. Дезактивирующие заместители дезактивируют все положения, но м-положение дезактивировано меньше, чем о-и п-. На практике часто образуются все три изомера, но в закономерных соотношениях 1. R – активаторы и o-, p-ориентанты: NH2, NHR, NR2, NHCOR, OH, O-, OR, OCOR, SH, S-, SR, Alk, Ph, CH=CH2 (+M эффекты преобладают над –I эффектами) 2. R – дезактиваторы и m-ориентанты: NO2, CN, SO3H, CHO, COR, COOH, COOR, CONH2, CCl3, N+R3, S+R2, P+R3 (-М и –I эффекты) 3. R – дезактиваторы, но o-, p-ориентанты: F, Cl, Br, I (-I эффекты дезактивируют все s-комплексы, но o- и p- дезактивированы в меньшей мере за счет +М эффектов) Активирующая и дезактивирующая способности могут быть количественно оценены по значениям констант Гаммета sp, sm, sp+, J, R. 11.3. Факторы парциальных скоростей и селективность При нитрование нитробензола препаративно выделено 93% м-, 6% о- и 1% ризомеров динитробензола. Более точные данные об активности разных положений кольца получают из факторов парциальных скоростей: отношения скоростей реакций данного положения C6H5R к скорости той же реакции с бензолом. 2 орто-положения, 6 Н - положений 2 мета-положения, 6 Н - положений 1 пара-положение, 6 Н - положений нитрование хлорирование бромирование Ориентирующие эффекты зависят как от R в C6H5R, так и природы E+, а также условий реакции. Абсолютные значения скоростей SE реакций с толуолом: нитрование > хлорирование > бромирование. Отсюда – меньшая активность электрофильного агента приводит к большей селективности. 11.4. Соотношение орто- пара-замещенных аренов Нитрование алкилбензолов Увеличение размера R R CH3 CH2Me CHMe2 CMe3 o- % 58 45 30 16 p- % 37 49 62 73 fo/fp 0.78 0.46 0.24 0.11 Реакции с хлорбензолом Увеличение размера E+ Реакция хлорирование нитрование бромирование сульфирование o- % 39 30 11 16 p- % 55 70 87 73 fo/fp 0.35 0.21 0.06 0.11 Нитрование галоидбензолов Падение –I эффекта (действует сильнее на более близкое орто-положение) R F Cl Br I o- % 12 30 37 38 p- % 88 69 62 60 fo/fp 0.07 0.22 0.30 0.32 Сильно влияют и растворители, которые образуют комплексы с реагентом: при хлорировании толуола fo/fp могут изменяться от 0.75 до 0.34. Региоспецифичное пара-замещение может быть достигнуто, если арен комплексуется так, что только пара-позиция свободна. Хлорирование анизола в присутствии циклодекстрина дает соотношение р-/o- продуктов 21.6, а в отсутствие циклодекстрина 1.48. Циклодекстрины 11.5. Ипсо-замещение Проходят, если X+ - хорошие уходящие группы (s- or t-Alk+, Me3Si+, H2SO4) ArSO3H + H+ H2O ArSiMe3 + ICl Ar-H + H2SO4 Ar-I + Me3SiCl Известны ряды нуклеофугности для ипсо-замещения NO2+ < i-Pr+ ~ SO3 < t-Bu+ ~ ArN2+ < ArCH+OH < NO+ < CO2 Me+ < Cl+ < Br+ < D+ < RCO+ < H+ < Me3Si+ fXipso – фактор ипсо-замещения группы X fXipso = 0.18 для I, 0.08 для Br, 0.06 для Cl (в реакции нитрования) Это означает, что скорость ипсо-замещения иода составляет 0.18 от скорости нитрования одного положения бензола. Следовательно, галогены дезактивируют не только о-, м-, р-, но и ипсо-замещение в ароматическом ряду 11.6. Реагенты электрофильного замещения Электрофилы, способные замещать как активированные, так и дезактивированные кольца NO2+ HNO3 + H2SO4 Br2, Cl2, Br2---MXn, I2, «I+, Br+, Cl+» SO3 RSO2+ Brd+----Br----Md-Xn Br2 + MXn Br2 + 2H2O2 + 4H+ H2S2O7 RSO2Cl + AlCl3 2 BrO+H2 + 2 H2O H2SO4 + SO3 RSO2+ + AlCl4- Электрофилы, способные замещать только активированные кольца R3C+, R3CX----MXn, R3CHO + H+, CH2=CH2 + H+ RC+=O RCOX + MXn RC+=O + MXn+1 Электрофилы, способные замещать только сильно активированные кольца NO+ ArN2+ нитрозирование Азо-сочетание 11.6.1. Нитрование HNO3 + H2SO4 NO2+ + H3O+ + 2HSO4- NO2+ образуется и с другими сильными кислотами и может быть выделен HNO3 + HF + BF3 NO2+ BF4- (нитроний тетрафторборат, NO2F-BF3) Сходно получены и другие соли нитрония: NO2+ PF6- , NO2+ CF3SO3- (очень активные электрофилы) выделен в крист. форме, устойчив до -50оС N2O4 (O2N+ -NO2), N2O5, MeCONO2, AlkONO2 (можно использовать в орг. ра-телях – CCl4, AcOH, PhNO2 ) Очень активные субстраты могут нитроваться даже разбавленной азотной кислотой. В случае фенолов реакция нитрования частично проходит через стадию нитрозирования, т.к. в азотной кислоте содержится немного HNO2 HNO2 + 2 HNO3 NO+ + H3O+ + 2 NO3(либо азотистая кислота образуется при частичном окислении фенола азотной кислотой) 11.6.2. Галогенирование Cl2, Br2, I2 способны галогенировать только сильно активированные арены, например, феноляты, ароматические амины. зафиксирован спектрально J.Org.Chem. 1983, 48, 759 В остальных случаях используют четыре варианта галогенирования: 1. Hal2 + MXn (к-та Льюса) (кроме иода) 2. Hal2 (или MHal) + окислители 3. Гипогалогениты и N-галоидимиды: R-X-Hal (X = O, N, S): NBS, NIS, HOCl и т.п. 4. Br-Cl, I-Cl для бромирования и иодирования В первых двух случаях генерируются электрофильные частицы с электронодефицитными атомами галогенов V=k[ArH][Hal2][MXn] Окислители: H2O2, HNO3, HNO3/H2SO4, PhI(OAc)2, F2, KMnO4, O3, электролиз и др. В реальности Hal+ очень нестабильны и в свободном виде существовать не могут. Фактически они существуют в «гипогалогенитных» формах в зависимости от среды: HOCl, H2O+Cl, ROBr, I3+ (I+----I2) и т.п. Данные B3LYP/6-311* Изв. АН, сер.хим., 2006, 1280 Стабильность падает: I+ > Br+ > Cl+ Гипогалогениты и N-галоидимиды R-Xd-—Hald+ Интергалогенид: Cld- -Id+ Наивысшая активность в кислотных средах, поскольку R-XH+-Hal более сильный электрофил, чем RX-Hal, а RXH лучшая уходящая группа сравнительно с RXИзвестный порядок активности при галогенировании: хлорирование > бромирование > иодирование C6H6 + Cl2 C6H6 + ICl C6H5Cl + HCl; DG = -29.3, DG#= 39.9 kcal/mol C6H5I + HCl; DG = - 4.1, DG#= 53.5 kcal/mol J. Mol. Model. 2011, 17, 2759 11.6.3. Сульфирование Действующий электрофил SO3 (олеум или: 2H2SO4 SO3 + H3O+ + HSO4- Комплексы диоксан*SO3, пиридин*SO3 Особенность – выраженная обратимость и другая лимитирующая стадия k1 > k2 поэтому наблюдается КИЭ (kH/kD) >1 продукт кинетического контроля продукт термодинамического контроля 11.6.4. Алкилирование V= k[ArH] [Alk-X] [MXn] Реагенты: • Alk-Hal (Фридель-Крафтс) • Спирты • Олефины • Эпоксиды Активность алкилгалогенидов: AlkF > AlkCl > AlkBr > AlkI J.Org.Chem., 1964, 29, 2317 Активность кислот Льюиса (ряд условный, зависит от конкретной реакции и условий: AlBr3 > AlCl3 > GaCl3 > FeCl3 > SbCl5 > ZrCl4, SnCl4 > BCl3, BF3, SbCl3 Наблюдаются перегруппировки алкилирующих агентов и продуктов Me3CCH2Cl + AlCl3 + C6H6 C6H5CMe2CH2Me однако Me3CCH2Cl + FeCl3 + C6H6 C6H5CH2CMe3 Перегруппировки и полиалкилирование недостаток процессов алкилирования по ФриделюКрафтсу Более устойчивый изомер (продукт термодинамического контроля) Влияния строения аренов на реакционную способность в алкилировании подчиняется основным закономерностям реакций SEAr: Ph-Alk > C6H6 >> PhNO2. Однако, есть исключения: ArOH, ArOR и особенно ArNH2 показывают малую активность. Причина – координация к-т Льюиса с O и N-атомами. Алкены, спирты, эпоксиды Основные закономерности алкилирования здесь те же, что при алкилировании алкилгалогенидами 11.6.5. Ацилирование и формилирование RCOHal, (RCO)2O, RCOOH в присутствии к-т Льюиса или кетен CH=C=O V= k[ArH] [RCOCl] [AlCl3] Обычно в качестве ацилирующих агентов рассматривают комплекс A или ионную пару B В отличие от алкилирования необходимо использовать стехиометрические или большие количества к-т Льюиса, т.к. последняя связывается в комплекс с получающимися кетонами: R2C=O----AlCl3. Часто порядок активности в RCOHal: I > Br > Cl > F Порядок активности аренов, тот же, что и других р-циях SEAr, однако ArOH и ArNH2 ацилируются в первую очередь по гетероатомам. Эти продукты можно превратить в кетоны через перегруппировки Перегруппировка Фриса ацилий-катион + Формилирование по реакции Гаттермана-Коха Ph-H + CO + HCl + AlCl3 C=O + HCl + AlCl3 PhCHO O=CH+ AlCl4- Реакция равновесна, но сдвигается вправо за счет образования комплекса конечного альдегида с AlCl3: ArCH=O----AlCl3 11.6.6. Азосочетание Арендиазониевые соли R=OH, NH2, NR2 V = k [PhN2+] [PhNO-] КИЭ kH/kD > 1 оч. слабый электрофил, не реагирует с PhOMe, но электрофильность повышается, если есть электроноакцепторные группы. триазен бензтриазол 11.7. Полициклические конденсированные арены DE аром ккал/моль 150.5 255.2 < 150.2 x 2 = 300.4 Нафталин и антрацен содержат лишь один pэлектронный секстет, фенантрен – два, т.е. имеют пониженную степень 351.5 < 1502.2 x 3= 450.6 ароматичности. Отсюда выше реакционная способность и склонность к реакциям присоединения сравнительно с бензолом 387.0 < 150.2 x 3 = 450.6 Механизмы AdE–E, которые идут параллельно с обычным механизмом SEAr или преобладают Известно: J. Org. Chem. 1994, 59, 7335 Ж. Орг. Хим. 2001, 37, 1189 Объяснение авторов J. Org. Chem. 1994, 59, 7335: Однако Расчеты B3LYP/6-311G* Ж. Орг. Хим. 2008, 44, 681: Anthracene –ICl Anthracene.+ + ICl.- DGgas = 86.3, DG MeOH = 7.4 kcal/mol Phenanthrene–ICl Phenanthrene.+ + ICl.- DGgas = 97.8, DG MeOH = 18.5 kcal/mol DGgas = 7.2, DG MeOH = -10.5 kcal/mol 11.8. Механизм электрофильного замещения через перенос электрона (single-electron transfer SET) Kenner, J. Nature, 1945, 156,369 Weiss, J. Trans. Faraday Soc. 1946, 42, 116 Perrin, C.L. JACS, 1977, 99, 5516 Tanaka, M. Et al. J.Org.Chem. 2000,65,2972 Rosokha,S.A.; Kochi, J.K. J.Org.Chem., 2002, 67, 1727 De Queiroz, J.F. et al J.Org.Chem. 2006,71,6192 Полагают, что данный механизм может реализоваться параллельно с классическим SEAr механизмом для высокодонорных аренов (полиалкилбензолы, нафталины, антрацены и т.п.), имеющих низкие потенциалы ионизации 11.9. Электрофильное замещение в ароматических гетероциклах p-избыточные p-дефицитные p-амфотерные p-избыточные более активны сравнительно с бензолом к атаке электрофилами замещение преимущественно идет в a-положения или происходит полизамещение ka = 43.5 kb. Сравнительно с C6H5SiMe3 эти скорости выше в 5000 и 115 раз. Реакции SE могут идти со слабыми электрофилами и не в сильно кислотных средах, иначе полимеризация, осмоление возрастание активности: пиррол > фуран > тиофен Конденсированные пятичленные гетероциклы У индола (X=NH) и бензотиофена (X=S) реакции SE идут по положениям 3 (b) у бензофурана по положению 2 (a) (потеря ароматичности) Возможно: Пиридин (p- дефицитный гетероцикл) p=4n + 2 (неподеленная электронная пара атома азота не участвует в ароматическом сопряжении) Атом азота – электроноакцептор ! Пониженная электронная плотность на всех атомах углерода, особенно в положениях 2 и 4. Благодаря повышенной основности, в кислотных средах средах протонирование и пиридиниевый катион - дополнительная дезактивация пиридинового цикла в реакциях с электрофилами Низкая активность в SE реакциях: прямое нитрование, галогенирование идут с трудом, сульфирование – олеум, 230оС, 24 ч.






