Исследование класса «Оксиды» Подготовила: Москаленко Н.Н., учитель биологии и химии
реклама

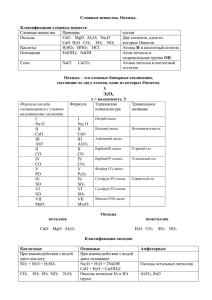
Исследование класса «Оксиды» Подготовила: Москаленко Н.Н., учитель биологии и химии 2008г План исследования класса «Оксиды» Определение Классификация Номенклатура Физические свойства Химические свойства Получение Применение Подумай, закончи строфу! С кислородом ходит парой, То металл, то неметалл он, Дружбу связями скрепит Всем известный класс - … Слайд – «ключ» Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Общая формула оксидов – RO. Относятся к оксидам: MgO, H2O, Na2O, CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3 Слайд – «ключ» Оксиды Оксиды металлов Оксиды неметаллов Классификация оксидов Оксиды основные Li2O + H2O = 2LiOH растворимое основание – гидроксид лития I,II,III СaO – оксид кальция CuO – оксид меди (II) кислотные P2O5 + 3H2O = 2H3PO4 ортофосфорная кислота Me V,VI,VII P2O5 – оксид фосфора (V) SO3 – оксид серы (VI) Запомни! Неметаллы, знай, мой друг, Строго все себя ведут: Коль в оксиды он подался – Так «кислотным» и назвался! Металл хотел запутать нас, Но я найду опору: Валентность меньше четырех – Оксид зову «основным». Ну а уж если повезло, Валентность пять и выше – Я буду помнить, всем назло, Оксид «кислотным» кличут. Номенклатура оксидов MgO – оксид магния, H2O – оксид водорода, Na2O – оксид натрия. Дайте названия оксидам CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3 Примеры названия оксидов, в которые входят элементы с переменной валентностью II CO – оксид углерода (II) IV CO2 – оксид углерода (IV) Физические свойства оксидов Широка натура у оксидов, Камнем вниз, а то рекой течет, А захочет – газ различных видов, И веществ создаст круговорот. Может черным быть, и белым, Может с запахом и без, Не оставит вас без дела: «Изучайте – мир чудес!» Слайд – «ключ» Широка натура у оксидов, Камнем вниз (CuO, CaO), а то рекой течет (H2O), А захочет – газ различных видов (CO2, SO2), И веществ создаст круговорот (CO2, H2O, SO3) . Может черным быть (CuO), и белым (CaO), Может с запахом (SO2) и без (CO2), Не оставит вас без дела: «Изучайте – мир чудес!» Химические свойства оксидов основных 1. 2. Основные оксиды взаимодействуют с кислотами, получаются соль и вода: CuO + H2SO4 = CuSO4 + H2O Оксиды активных металлов взаимодействуют с водой с образованием растворимых оснований - щелочей: LiO + H2O = 2LiOH кислотных 1. 2. Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода: СO2 + Ca(OH)2 = CaCO3 + H2O Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: P2O5 + 3H2O = 2H3PO4 3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли: CaO + H2O = CaCO3 4. Менее летучие кислотные оксиды вытесняют более летучие из их солей: CaCO3 + SiO2 = CaSiO3 + CO2 Общие способы получения оксидов Горение веществ Сложных: CH4 + 2O2 = CO2 + 2H2O Простых: C + O2 = CO2 Общие способы получения оксидов Разложение сложных веществ Нерастворимых оснований: Cu(OH)2 = CuO + H2O Кислот: H2SiO3 = SiO2 + H2O Солей: CaCO3 = CaO + CO2 Основные области применения оксидов В промышленности: Fe2O3 и Fe3O4 – производство чугуна и стали, СaO и SiO2 – производство строительных материалов, CO2 - в пищевой промышленности для производства газированных напитков, H2O – в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д. В быту: H2O – в питьевых и хозяйственных целях, SiO2 – входит в состав чистящих веществ, ZnO – входит в состав белой краски. В природных процессах: H2O и CO2 – обеспечивают осуществление процесса фотосинтеза, H2O – естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д. Домашнее задание по ТК составить устный рассказ «Общая характеристика класса «Оксиды». Письменное задание: предложить химические реакции, при помощи которых можно осуществить следующие превращение (выполнить две цепочки на выбор учащегося): а) K---K2O---KOH---K2CO3 б) S---S2O3---H2SO4---CaSO4 в) Al(OH)3---Al2O3 г) MgCO3---MgO---MgCO3